脾胃培源方治疗慢性萎缩性胃炎脾胃虚弱证患者疗效及对胃黏膜三叶因子2、核因子-κB表达的影响
2023-03-11裴蓓刘云宋标梅语郑艳敏李学军
裴蓓 ,刘云 ,宋标 ,梅语 ,郑艳敏 ,李学军
1.安徽中医药大学,安徽 合肥 230000;2.安徽中医药大学第二附属医院,安徽 合肥 230000;3.中国科学院合肥物质科学研究院,安徽 合肥 230000
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是因胃黏膜上皮反复遭受损害所导致的固有腺体减少,黏膜萎缩,可能伴有肠腺化生和假幽门腺化生的一种慢性胃部疾病,以病理诊断为“金标准”[1]。CAG发病率较高,随着病情进展有癌变可能。其中,肠上皮化生和/或异型增生被称为癌前病变,是慢性胃炎演变成胃癌的重要环节。因此,早期诊断和及时治疗是阻止CAG进展、降低胃癌发生率的关键。脾胃培源方是安徽省名中医李学军教授在首届全国名老中医马骏教授的指导下,结合多年临床实践总结的经验方,是安徽中医药大学第二附属医院特色院内制剂之一。前期研究表明,脾胃培源方具有良好的防治CAG作用[2-3]。本研究采用脾胃培源方治疗CAG脾胃虚弱证,观察其临床疗效,并探讨其作用机制。现报道如下。
1 资料与方法
1.1 一般资料
选择2019年6月-2021年6月安徽中医药大学第二附属医院CAG脾胃虚弱证患者132例,采用随机数字表法分为治疗组65例和对照组67例。治疗过程中因患者自行退出,治疗组脱落3例、对照组脱落5例。对照组62例,其中男32例、女30例,平均年龄(59.31±7.88)岁;治疗组62例,其中男29例、女33例,平均年龄(60.15±8.06)岁。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经安徽中医药大学第二附属医院医学伦理委员会批准(2019zj20)。
1.2 西医诊断标准
依据《慢性萎缩性胃炎中西医结合诊疗共识意见(2017年)》[1],并经内镜检查及病理确诊。
1.3 中医辨证标准
参照《慢性萎缩性胃炎中医诊疗共识意见(2009,深圳)》[4]制定脾胃虚弱证辨证标准。主症:胃脘胀满或隐痛,胃部喜按或喜暖;次症:食少纳呆,大便稀溏,倦怠乏力,气短懒言,食后脘闷;舌脉:舌质淡,脉细弱。主症必备并具次症2项以上即可明确辨证。
1.4 病例筛选标准
1.4.1 纳入标准
①年龄18~70岁;②符合上述西医诊断标准及中医辨证标准;③近期未使用抑酸药、抗生素等相关药物治疗;④自愿参加本研究,并签署知情同意书。
1.4.2 排除标准
①合并消化性溃疡、恶性肿瘤或病理诊断疑有恶变者;②合并严重心、肺、造血系统等原发性疾病者;③法律规定的残疾者(盲、聋、哑、智力障碍、精神障碍);④妊娠期、哺乳期妇女。
1.4.3 脱落标准
①治疗过程中出现严重不良反应者;②自行退出或未完成整个疗程者。
1.4.4 剔除标准
①基本资料不全者;②未按治疗方案用药者。
1.5 治疗方法
治疗组予脾胃培源方颗粒(含白术20 g、炙黄芪18 g、石斛15 g、白芍10 g、香附10 g、刘寄奴6 g,安徽中医药大学第二附属医院制剂室制备,批号1071341),每日1剂,开水400 mL溶解,分早晚2次温服。对照组予叶酸片(常州制药厂有限公司,批号21041511,5 mg/片),每次1片,每日3次,口服。2组均连续治疗24周。嘱患者治疗期间节饮食、畅情志、戒烟酒、忌生冷。
1.6 观察指标
1.6.1 中医症状评分
根据《中药新药临床研究指导原则(试行)》[5]和《脾胃病症状量化标准专家共识意见(2017)》[6],于治疗前后对2组患者进行中医症状评分,按症状的无、轻、中、重度分为4个等级,主症(胃脘胀满、胃脘痛)分别计0、2、4、6分,次症(大便不爽、食少纳呆、神疲乏力、气短懒言)分别计0、1、2、3分。评分越高表明症状越重。
1.6.2 胃镜及病理评分
于治疗前后对2组进行胃镜及病理评分。参照《中国慢性胃炎共识意见精简版(2017年,上海)》[7]和《慢性胃炎的内镜分型分级标准及治疗的试行意见》[8],将胃镜所见的黏膜色泽、黏膜隆起、血管透见度和黏膜质地按无、轻、中、重度,分别计0、1、2、3分。病理评分:萎缩、肠上皮化生作为主要病理表现,慢性炎症和活动性作为次要病理表现,按无、轻、中、重度,分别计0、1、2、3分。通过胃镜观察并记录患者治疗前后同一部位的胃镜病理表现。
1.6.3 实验室指标检测
于治疗前后采用ELISA检测2组患者血清胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、胃泌素-17(G-17)及胃黏膜三叶因子2(TFF2)、核因子-κB(NF-κB)水平。严格按照试剂盒(PGⅠ、PGⅡ、G-17,芬兰Biohit公司,批号分别为14PA1805、12PB1805、16GC1812;TFF2、NF-κB,武汉华联科公司,批号分别为181118、181120)说明书进行操作。
1.6.4 安全性评价
观察2组患者研究过程中可能出现的不良反应,并于治疗前后检测2组患者肝功能(天冬氨酸氨基转移酶、丙氨酸氨基转移酶)、肾功能(血肌酐、尿素氮、血尿酸)及血常规、尿常规、粪常规。
1.7 疗效标准
参照《中药新药临床研究指导原则(试行)》[5]制定疗效标准。治愈:临床症状、体征消失,胃镜复查黏膜慢性炎症明显好转,病理组织学证实腺体萎缩、肠上皮化生、异型增生恢复正常或消失。显效:临床主要症状、体征消失,胃镜复查黏膜慢性炎症好转,病理组织学证实腺体萎缩、肠上皮化生、异型增生恢复正常或减轻2个级度。有效:临床主要症状、体征明显减轻,胃镜复查黏膜病变范围缩小1/2以上,病理组织学证实慢性炎症减轻1个级度,腺体萎缩、肠上皮化生、异型增生减轻。无效:未达到上述标准或恶化者。总有效率(%)=(治愈例数+显效例数+有效例数)÷总例数×100%。
1.8 统计学方法
2 结果
2.1 2组临床疗效比较
治疗组总有效率为88.71%(55/62),对照组为72.58%(45/62),治疗组疗效明显优于对照组(P<0.05)。见表1。

表1 2组CAG脾胃虚弱证患者临床疗效比较[例(%)]
2.2 2组治疗前后中医症状评分比较
与本组治疗前比较,2组治疗后各项中医症状评分均下降(P<0.05);2组治疗后比较,治疗组中医症状评分(除大便不爽评分外)均低于对照组(P<0.05)。见表2。
表2 2组CAG脾胃虚弱证患者治疗前后中医症状评分比较(±s,分)
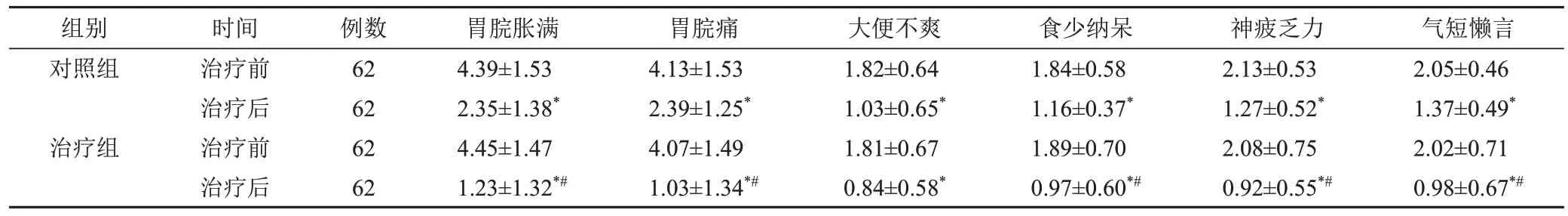
表2 2组CAG脾胃虚弱证患者治疗前后中医症状评分比较(±s,分)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
组别对照组治疗组时间治疗前治疗后治疗前治疗后例数62 62 62 62胃脘胀满4.39±1.53 2.35±1.38*4.45±1.47 1.23±1.32*#胃脘痛4.13±1.53 2.39±1.25*4.07±1.49 1.03±1.34*#大便不爽1.82±0.64 1.03±0.65*1.81±0.67 0.84±0.58*食少纳呆1.84±0.58 1.16±0.37*1.89±0.70 0.97±0.60*#神疲乏力2.13±0.53 1.27±0.52*2.08±0.75 0.92±0.55*#气短懒言2.05±0.46 1.37±0.49*2.02±0.71 0.98±0.67*#
2.3 2组治疗前后胃镜评分比较
与本组治疗前比较,2组治疗后各项胃镜评分均下降(P<0.05);2组治疗后比较,治疗组胃镜黏膜色泽评分、黏膜质地评分均低于对照组(P<0.05)。见表3。
表3 2组CAG脾胃虚弱证患者治疗前后胃镜评分比较(±s,分)
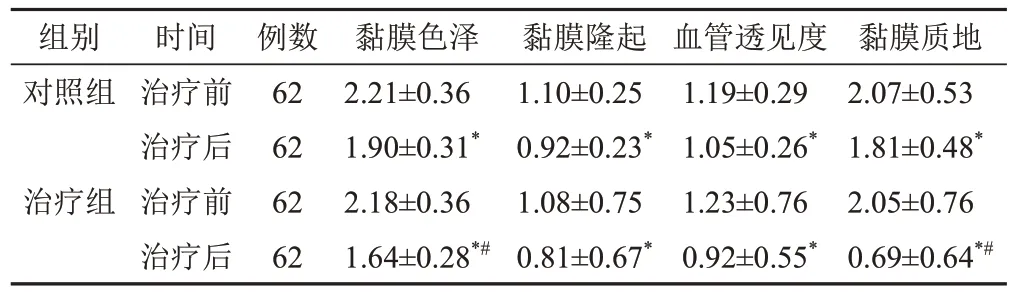
表3 2组CAG脾胃虚弱证患者治疗前后胃镜评分比较(±s,分)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
组别对照组治疗组时间治疗前治疗后治疗前治疗后例数62 62 62 62黏膜色泽2.21±0.36 1.90±0.31*2.18±0.36 1.64±0.28*#黏膜隆起1.10±0.25 0.92±0.23*1.08±0.75 0.81±0.67*血管透见度1.19±0.29 1.05±0.26*1.23±0.76 0.92±0.55*黏膜质地2.07±0.53 1.81±0.48*2.05±0.76 0.69±0.64*#
2.4 2组治疗前后病理评分比较
与本组治疗前比较,2组各项病理评分均明显下降(P<0.05);2组治疗后比较,治疗组各项病理评分均低于对照组(P<0.05)。见表4。
表4 2组CAG脾胃虚弱证患者治疗前后病理评分比较(±s,分)
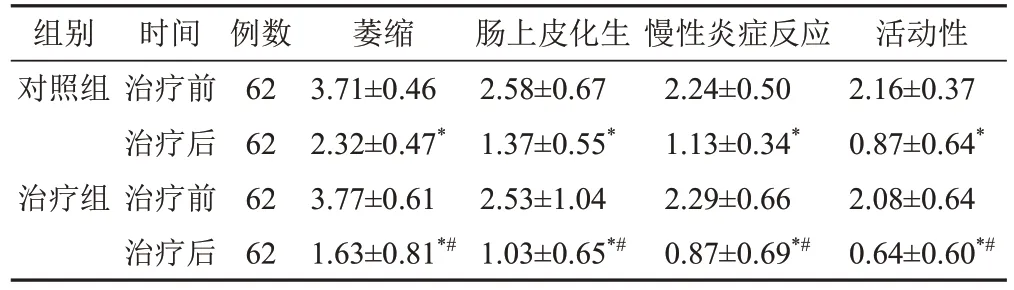
表4 2组CAG脾胃虚弱证患者治疗前后病理评分比较(±s,分)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
组别对照组治疗组时间治疗前治疗后治疗前治疗后例数62 62 62 62萎缩3.71±0.46 2.32±0.47*3.77±0.61 1.63±0.81*#肠上皮化生2.58±0.67 1.37±0.55*2.53±1.04 1.03±0.65*#慢性炎症反应2.24±0.50 1.13±0.34*2.29±0.66 0.87±0.69*#活动性2.16±0.37 0.87±0.64*2.08±0.64 0.64±0.60*#
2.5 2组治疗前后血清胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ及胃泌素-17水平比较
与本组治疗前比较,2组治疗后血清PGⅠ、PGⅡ、G-17水平明显升高(P<0.05);2组治疗后比较,治疗组上述指标改善优于对照组(P<0.05)。见表5。
表5 2组CAG脾胃虚弱证患者治疗前后血清PGⅠ、PGⅡ、G-17水平比较(±s)
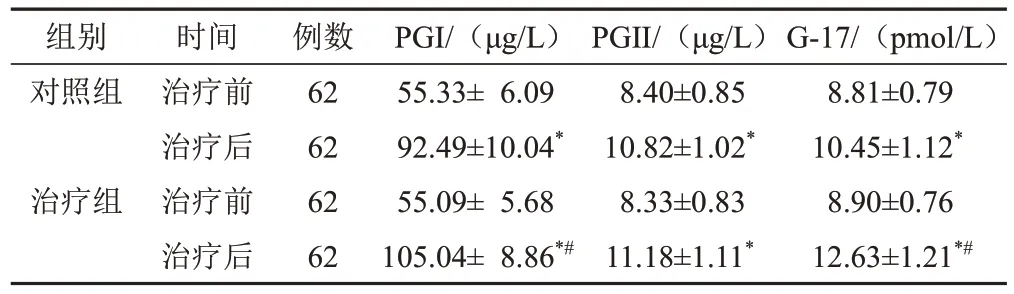
表5 2组CAG脾胃虚弱证患者治疗前后血清PGⅠ、PGⅡ、G-17水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
组别对照组治疗组时间治疗前治疗后治疗前治疗后例数62 62 62 62 PGI/(μg/L)55.33± 6.09 92.49±10.04*55.09± 5.68 105.04± 8.86*#PGⅡ/(μg/L)8.40±0.85 10.82±1.02*8.33±0.83 11.18±1.11*G-17/(pmol/L)8.81±0.79 10.45±1.12*8.90±0.76 12.63±1.21*#
2.6 2组治疗前后胃黏膜三叶因子2、核因子-κB水平比较
与本组治疗前比较,2组治疗后胃黏膜TFF2、NF-κB水平均降低(P<0.05);2组治疗后比较,治疗组胃黏膜TFF2、NF-κB水平均低于对照组(P<0.05)。见表6。
表6 2组CAG脾胃虚弱证患者治疗前后胃黏膜TFF2、NF-κB水平比较(±s,μg/L)
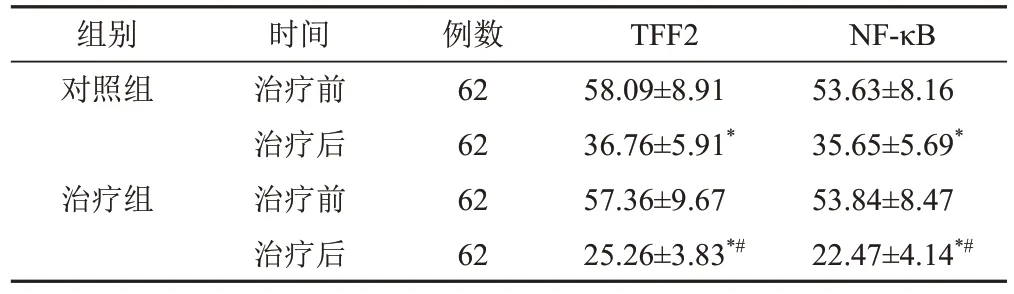
表6 2组CAG脾胃虚弱证患者治疗前后胃黏膜TFF2、NF-κB水平比较(±s,μg/L)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05
组别对照组治疗组时间治疗前治疗后治疗前治疗后例数62 62 62 62 TFF2 58.09±8.91 36.76±5.91*57.36±9.67 25.26±3.83*#NF-κB 53.63±8.16 35.65±5.69*53.84±8.47 22.47±4.14*#
2.7 2组不良反应比较
2组治疗过程中均未见明显不良反应,治疗后肝、肾功能及血常规、尿常规、粪常规均未见明显异常。
3 讨论
CAG与幽门螺杆菌感染、精神心理、饮食、遗传、药物等因素相关,在多种因素长期作用下,损伤胃黏膜,进而导致黏膜萎缩、肠上皮化生等病变[9]。根据CAG反复发作的非特异性消化不良的症状,可将其归属于中医学“痞满”“胃痛”“嘈杂”“吐酸”等范畴。目前西医治疗CAG以对症治疗为主,缺乏特效药物,且难以从根本上缓解症状,改善胃黏膜的病变[10]。研究表明,中医药在改善症状、延缓病情进展等方面具有独特优势[11-12],不仅可改善临床症状,在修复胃黏膜、延缓甚至逆转CAG、抑制癌基因表达等方面也有显著疗效[13]。
中医学认为,本病病位主要在胃,与脾、肾关系密切。其发生发展与外邪侵袭、饮食不节、情志失调、脾胃素虚等因素有关,在多种因素长期影响下,脾胃虚弱,纳运失司,导致气血生化乏源,气机升降失调,气滞、血瘀、痰湿等病理因素出现,进一步妨碍脾胃气机,本虚和邪实夹杂,日久脏腑功能失常,逐渐诱发并加重本病。CAG主要分为肝胃气滞证、肝胃郁热证、脾胃虚弱证、脾胃湿热证、胃阴不足证、胃络瘀血证6种证型[1],由于病情缠绵,多虚实夹杂,但总以脾胃虚弱证为基础。脾胃培源方中炙黄芪、白术合用,以温中健脾、补中益气;白芍、香附养血柔肝、和胃止痛;石斛益气养阴;刘寄奴为引经药,入脾经,健脾醒脾、破血通经。全方健脾与温中并行,攻补兼施,共奏益气健脾、温中和胃、理气活血之功。该方对阻止疾病进展、预防胃癌发生均具有良好效果[2-3]。本研究表明,脾胃培源方可有效改善患者的临床症状及胃黏膜的病理变化,提高其生活质量。
胃蛋白酶原(PG)是胃黏膜主细胞分泌的一种胃蛋白酶前体,在胃中可转化为活性胃蛋白酶。根据其生物特性可分成PGⅠ、PGⅡ2个亚型。PGⅠ主要由胃底腺的主细胞分泌,PGⅡ由整个胃和十二指肠的细胞分泌[14]。当胃黏膜萎缩时,胃体腺和胃底腺的数量减少,主细胞减少,导致胃黏膜功能受损,PGⅠ水平明显下降,而PGⅡ水平保持稳定或略有升高[15-16]。G-17由胃G细胞分泌,可刺激盐酸、胆汁和胰液分泌,G-17水平受饮食习惯、胃病灶部位、药物、G细胞数量等多种因素影响,是反映胃窦分泌功能的敏感指标[17-18]。研究表明,CAG组和慢性胃炎组的PGⅠ、G-17水平较其他组均降低,且随着胃黏膜萎缩程度加重,PGⅠ、G-17水平逐渐降低[19-20]。可见,PGⅠ、PGⅡ、G-17水平可反映胃黏膜萎缩程度[21]。
TFF2是已知的3种哺乳动物三叶肽之一[22]。三叶肽是由胃肠道黏膜分泌的小分子蛋白酶抗性蛋白,具有重要的细胞保护和恢复作用。在慢性浅表性胃炎和慢性萎缩性胃炎中,TFF2均呈高表达[23]。研究发现,TFF2不仅可通过促进胃黏膜糖蛋白的分泌发挥黏膜保护作用,还可通过促进黏膜上皮细胞向黏膜损伤部位移行发挥修复作用[24-25]。作为一种细胞保护因子,TFF2蛋白因胃黏膜损伤而被诱导[23]。NF-κB为多向调控的蛋白质因子,在正常胃黏膜、慢性萎缩性胃炎、胃癌中均为阳性表达,且逐渐增强[26]。NF-κB活化水平与炎症程度呈正相关,能够诱导IL-6、TNF-α等炎症因子的生成,影响胃黏膜上皮细胞的分裂、增殖,促进CAG向肠上皮化生、异型增生甚至胃癌转变[27]。
综上所述,脾胃培源方能够有效缓解CAG患者的临床症状,改善胃黏膜的病理变化,调节血清PG水平,延缓疾病进展。其作用机制可能与调节血清TFF2、NF-κB水平有关。但本研究样本量有限,有待今后进一步扩大样本量,进行多中心临床验证,并通过开展分子实验研究,探究其具体的药理成分及作用机制。
