早期胃癌伴淋巴结转移患者远期预后的影响因素分析
2023-03-11宋立强梁文全刘贵宾
宋立强,崔 昊,梁文全,刘贵宾,曹 博,黄 俊,袁 震,卫 勃
(1.解放军总医院第一医学中心普通外科医学部 全军普通外科研究所,北京,100853;2.南开大学医学院)
胃癌作为常见的消化系统恶性肿瘤,在中国发病率仅次于肺癌、结直肠癌,位居第三,死亡率也位居第三[1]。根据中国胃肠联盟数据统计结果显示,我国胃癌患者的肿瘤分期主要以进展期为主,占全部胃癌患者的80.3%[2]。随着我国人民生活水平的提高、胃镜筛查技术的推广普及,我国早期胃癌的检出率正不断增加[3]。通常情况下,早期胃癌预后较好,手术后5年总体生存率可超过90%,但早期胃癌患者出现淋巴结转移时,预后相对较差[4]。既往大样本研究结果显示,早期胃癌淋巴结转移率为9.8%~16.7%[5-7]。虽然早期淋巴结转移率较低,但有数据表明,淋巴结转移是影响早期胃癌患者远期预后的独立危险因素[8],且淋巴结转移数量与患者的远期预后呈正相关[9]。因此,本研究旨在探讨影响早期胃癌伴有淋巴结转移患者远期预后的独立危险因素,并筛选淋巴结转移数量对预后影响的优化分类方法。
1 资料与方法
1.1 临床资料 本研究为单中心回顾性研究,选取2005年2月至2021年12月在解放军总医院第一医学中心普通外科医学部行胃癌根治术,术后病理为早期胃癌伴有淋巴结转移的348例患者,依据第八版美国癌症联合委员会指南N分期标准[10]分为T1N1组与T1N2+组,其中T1N1组140例,T1N2+组208例。观察指标包括性别、年龄、肿瘤部位、切除范围、肿瘤大小、脉管癌栓、神经侵犯及肿瘤分化程度。本研究已获医院伦理委员会审批(伦理审批号:S2021-533-01)。
1.2 纳入与排除标准 纳入标准:(1)根据第八版美国癌症联合委员会与国际抗癌联盟对胃癌TNM分期的最新标准[10],定义术后病理T分期为T1期(肿瘤侵犯黏膜层或黏膜下层)且伴有淋巴结转移的早期胃癌患者;(2)临床病理资料完整。排除标准:(1)进展期胃癌、残胃癌或既往行胃部分切除术;(2)行新辅助治疗后病理T分期为T1期;(3)其他胃肠道肿瘤,如胃肠间质瘤、淋巴瘤。
1.3 统计学处理 应用SPSS 26.0、R语言3.4.1软件进行统计分析。采用χ2检验确定分类变量的差异。以患者的总体生存作为结局,进行Cox回归分析,将单因素分析中P<0.1的因素纳入多因素分析,以探讨早期胃癌伴有淋巴结转移患者远期预后的独立危险因素。根据Kaplan-Meier法绘制生存曲线,应用log-rank检验评估远期生存间的统计学差异。依据不同淋巴结转移数量设定截断值,应用log-rank检验比较χ2值,以评估早期胃癌伴有淋巴结转移患者的生存差异[9],并通过X-tile软件验证可反映预后差异的最佳淋巴结转移数量截断点[11]。双边P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床病理特征及远期预后的比较 相比T1N1组,T1N2+组神经侵犯(20.7% vs.11.4%,P=0.024)、脉管癌栓(32.2% vs.21.4%,P=0.028)的比例及肿瘤长径>3 cm的比例(65.4% vs.43.6%,P<0.001)更高,差异有统计学意义。两组患者性别、年龄、肿瘤部位、切除范围、肿瘤分化程度差异无统计学意义(P>0.05)。见表1。

表1 两组患者的临床病理特征(n)
T1N1组失访率为3%,T1N2+组为5%,中位随访时间52个月,末次随访时间2022年3月。T1N1组患者的3年总体生存率为83.9%,T1N2+组为61.9%(log-rankχ2=15.533,P<0.0001),生存曲线见图1。

图1 两组患者生存曲线图(组1:T1N1;组2:T1N2+)
2.2 早期胃癌伴淋巴结转移患者预后的独立危险因素 将总体生存作为结局进行Cox回归分析,单因素分析结果显示,患者年龄、N分期、肿瘤大小、脉管癌栓与早期胃癌伴淋巴结转移患者的远期预后相关(P<0.05)。性别、肿瘤部位、切除范围、神经侵犯等与患者远期预后无关(P>0.05)。将单因素分析中P<0.1的因素纳入到多因素分析中,结果显示年龄≥60岁、肿瘤>3 cm、肿瘤N分期较晚是影响患者远期预后的独立危险因素。见表2。

表2 早期胃癌淋巴结转移患者的单因素、多因素分析结果
2.3 评估淋巴结转移数量对预后影响的优化分类方法 根据淋巴结转移数量设定截断值,并通过log-rank检验比较患者的生存差异,结果显示,淋巴结转移数量截断值设定为6时,log-rank检验χ2数值最大(对应3年总体生存率:77.5% vs. 56.0%,log-rankχ2=23.109,P<0.001)。此外,我们使用X-tile验证淋巴结转移数量为6可作为区分早期胃癌淋巴结转移患者远期预后的最佳截值点,可作为反映预后差异的有效分类指标。见表3、图2、图3。生存曲线见图4。

表3 淋巴结转移数量切点分析
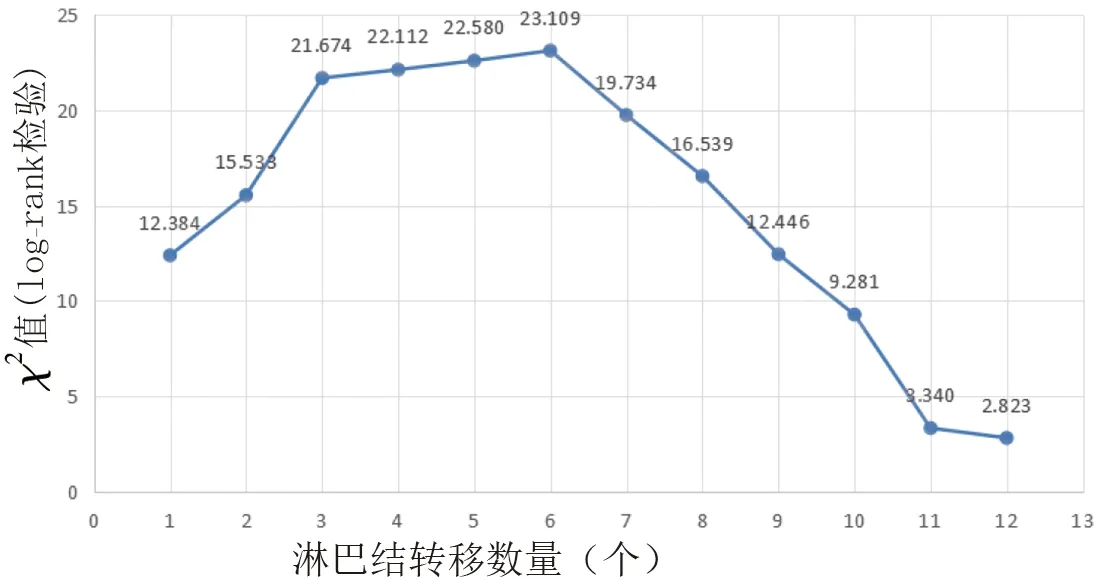
图2 早期胃癌伴有淋巴结转移患者切点生存的χ2值趋势曲线

图3 通过X-tile软件分析远期预后差异的淋巴结转移个数最佳截断值

图4 按照淋巴结转移数等于6为切点的生存曲线(group 1:淋巴结转移总数≤6组;group 2:淋巴结转移总数>6组)
3 讨 论
胃癌是发病率高、病死率高、预后较差的恶性肿瘤,病理分期是影响患者远期生存的重要因素[12]。目前对于早期胃癌的定义主要为癌灶仅限于黏膜层或黏膜下层的胃癌,而不论有无淋巴结转移[13]。淋巴结转移数量在肿瘤N分期中具有重要作用,随着淋巴结转移数量的增多,患者的远期预后会更差。因此,探讨早期胃癌伴有淋巴结转移患者远期预后的危险因素,同时基于淋巴结转移数量筛选可区分患者不良预后的优化分类指标,有助于指导临床医生合理选择综合治疗模式,提升早期胃癌患者整体治疗效果。
高龄是影响胃癌根治术后远期预后的独立危险因素[14]。但对于早期胃癌,年龄是否也是患者预后的独立危险因素仍有待进一步验证。李亮冲等[15]表示,年龄>75岁是影响老年早期胃癌预后的独立危险因素。谢怡等[16]的研究也表明,高龄胃癌患者由于手术风险高、合并基础疾病较多、免疫及器官功能较差等多因素影响远期预后相对较差。以上两项研究均证实了年龄在早期胃癌患者的预后方面具有重要作用。本研究结果也发现,年龄≥60岁是早期胃癌伴有淋巴结转移患者远期预后的独立危险因素。因此,对于此类患者,术后仍需进行规范化综合治疗,以改善患者的远期生存。
肿瘤大小能否成为早期胃癌的独立预后因素尚存有分歧[17-18]。Kunisaki等[19]的研究将肿瘤长径(3 cm、6 cm)设为截断点,将早期胃癌患者分为三组,结果显示,3组间术后5年疾病特异性生存率差异无统计学意义。陆俊等采用受试者工作特征曲线确定的最佳截点进行预后分析,发现肿瘤大小是早期胃癌患者预后的独立相关因素[20]。本研究结果显示,肿瘤>3 cm是早期胃癌伴有淋巴结转移患者预后的独立危险因素,与既往研究结果相似。因此,我们建议对于此类患者应高度重视预后较差的相关风险,可适度强化围手术期治疗模式。
淋巴结转移数量是影响胃癌远期预后的关键因素[21]。自国际抗癌联盟/美国癌症联合委员会第五版胃癌TNM分期方案发布后,淋巴结转移数量开始作为N分期的重要参数[22]。第八版美国癌症联合委员会胃癌TNM分期中,将N3a、N3b进行独立分期,T1N3bM0由ⅡB期上升为ⅢB期,这也体现出淋巴结转移数量在胃癌分期中的重要作用[23-24]。本研究发现,T1N1组患者的3年总体生存率为83.9%,T1N2+组为61.9%,差异有统计学意义(P<0.0001)。此外,我们发现,较高的pN分期是影响早期胃癌伴有淋巴结转移患者远期预后的独立危险因素。通过进一步log-rank检验得出,当设定淋巴结转移数量截断值为6时,log-rank检验χ2值最大,此结果也经X-tile软件进行验证,表明淋巴结转移≤6个与>6个两组早期胃癌患者的总体生存差异最大,可作为反映早期胃癌淋巴结转移患者预后的有效分类指标。值得一提的是,在第八版美国癌症联合委员会指南中对于pN2期与pN3a期淋巴结转移数量的界定同样为6枚淋巴结,但对于pT1N3a患者的病理分期相较第7版美国癌症联合委员会指南并未进行调整。因此,笔者认为对于早期胃癌淋巴结转移患者,pT1N3a相较pT1N2可能具有更加不良的远期预后,有待于大样本研究以优化基于淋巴结转移数量的肿瘤分期模式。
本研究存在以下不足:(1)本研究为单中心回顾性研究,存在一定偏倚,有待多中心、前瞻性、大样本研究以提供高级别循证医学证据;(2)患者时间跨度较大,不同时期接受胃切除手术的淋巴结清扫范围存在差异。随着胃癌手术的标准化、规范化,有助于减少此类偏倚。
综上,本研究发现对于早期胃癌淋巴结转移的患者,年龄≥60岁、肿瘤大小>3 cm、肿瘤N分期较晚是影响其远期预后的独立危险因素。设定淋巴结转移数量截断值为6可作为区分早期胃癌淋巴结转移患者预后差异的有效分类指标。
利益冲突 所有作者均声明不存在利益冲突。
