Siewert Ⅱ型食管胃结合部腺癌的外科治疗现状
2023-03-11黄亚迪闫治波孙丹平梁贻泽曹伟波赵汝东于文滨
黄亚迪,魏 猛,闫治波,孙丹平,钟 鑫,刘 鹏,梁贻泽,曹伟波,赵汝东,于文滨
(1.山东大学齐鲁医院胃肠外科,山东 济南,250012;2.威海市立二院普通外科;3.阳信县中医医院普通外科)
胃癌作为消化系统最常见的恶性肿瘤之一,因其发病率高、预后差等,一直是研究的重点与热点。胃癌在全球恶性肿瘤发病率中位居第五,每年有100多万新发病例、76万死亡病例,严重威胁人们的身体健康[1]。其中包括Siewert Ⅱ型食管胃结合部腺癌(adenocarcinoma of the esophagogastric junction,AEG)在内的胃上部癌近年发病率正在不断升高[2]。AEG是指肿瘤中心位于食管胃交界(esophagogastric junction,EGJ)上、下5 cm内且累及EGJ的腺癌,由于位置特殊,且发病率在世界范围内逐年上升,引起了人们的广泛关注。美国国立综合癌症网络胃癌治疗指南建议[3],累及EGJ的腺癌均应进行Siewert肿瘤类型评估。SiewertⅠ型是食管下段腺癌,肿瘤中心位于解剖EGJ上方1~5 cm内;Siewert Ⅱ型是贲门癌,肿瘤中心位于EGJ上方1 cm至下方2 cm范围内;SiewertⅢ型是贲门下癌,肿瘤中心位于EGJ下方2~5 cm,浸润EGJ及以下部位、食管下端。目前针对Siewert Ⅰ型及Siewert Ⅲ型AEG的临床治疗已基本达成共识[4],但Siewert Ⅱ型AEG由于其解剖部位及生物学行为的特殊性,在手术入路、淋巴结清扫、切除范围及消化道重建方式方面仍然备受争议[5-6]。目前,尽管化学治疗、靶向治疗、经内镜下黏膜切除术、内镜下黏膜剥离术等可作为胃癌治疗的选项,但以外科治疗为主的综合治疗仍是胃癌治疗的首选。本文以胃肠外科医生视角,从胃切除范围、淋巴结清扫及消化道重建三个方面阐述Siewert Ⅱ型AEG肿瘤的治疗现状。
1 胃切除范围
对于早期Siewert Ⅱ型AEG,有经消化内镜及外科手术两种治疗方式,而进展期Siewert Ⅱ型AEG只能通过外科手术达到根治目的。2019版的《Siewert Ⅱ型食管胃结合部腺癌腔镜手术治疗中国专家共识》[7]建议,腹腔镜治疗Siewert Ⅱ型AEG的手术指征为:(1)T分期≤cT3;(2)食管侵犯长度≤2 cm;(3)肿瘤直径≤4 cm。对于大多数cT2或分期更高的AEG,中国临床肿瘤学会胃癌治疗指南[8]建议进行新辅助化疗+胃切除术+辅助化疗的综合治疗。日本胃癌治疗指南[4]指出,在针对肿瘤进行胃切除术时,为达到根治性治疗效果,应确保有足够的切缘。对于T1期肿瘤,应获得2 cm的大体切除边缘。对于T2或更深的肿瘤,如果为扩张型生长,建议近缘至少3 cm;浸润型生长则建议近缘至少5 cm。对于侵犯食管的肿瘤,切缘不一定要>5cm,但为了保证R0切除,最好将切线进行冰冻切片检查。目前,Siewert Ⅱ型AEG的治疗仍存在争议,现将不同分期的Siewert Ⅱ型AEG的治疗方式综述如下。
1.1 早期胃癌 美国国立综合癌症网络胃癌治疗指南[3]建议,早期胃癌的诊断最好通过内镜下病理结果进行明确。对于无绝对手术禁忌的早期胃癌患者,一般建议行内镜下黏膜切除术、内镜下黏膜剥离术或外科手术进行治疗。对于病灶直径≤2 cm且组织病理学显示高或中高分化、未穿透浅表黏膜下层、未显示淋巴血管浸润且具有清晰的侧切缘、深切缘时,内镜下黏膜切除术或内镜下黏膜剥离术可达到根治性切除。日本胃癌治疗指南[4]也建议,对于病灶直径≤2 cm且不伴溃疡的分化型腺癌行内镜下黏膜切除术或内镜下黏膜剥离术。而对于临床诊断为T1a,且病灶直径≤2 cm的不伴溃疡的未分化型黏膜内癌,是内镜下黏膜剥离术的扩大指征[8]。而对于低分化、有淋巴血管浸润证据、浸润至黏膜下层深部、侧切缘或深切缘阳性,或淋巴结转移的胃癌,美国国立综合癌症网络胃癌治疗指南[3]认为,内镜下黏膜切除术或内镜下黏膜剥离术无法做到根治,应通过外科手术治疗。对于早期Siewert Ⅱ型AEG的手术切除范围,目前社会各界已基本达成共识,推荐行根治性近端胃大部切除术进行治疗[4]。
1.2 进展期胃癌 对于具备手术指征的进展期胃癌,目前的首选治疗方案仍是以手术治疗为主的综合治疗,其手术方式有近端胃大部切除术、全胃切除术两种,手术可通过开腹、腹腔镜、机器人辅助三种方式进行。目前,腹腔镜技术已趋于成熟,大量研究表明,与开腹手术相比,腹腔镜技术具有术中视野清晰、淋巴结清扫彻底、术后康复快、术后并发症少等优势,具有逐渐取代开腹手术成为胃癌手术主流的趋势[9]。但开腹手术对患者心肺功能影响较小,适应证更加广泛,仍是临床上不可摒弃的技术之一。机器人辅助技术作为新兴技术,在胃癌手术治疗方面的应用处于探索阶段,仍需要大量多中心的前瞻性临床研究去对比与腹腔镜技术、开腹手术技术的优劣。
1.2.1 近端胃切除术 就Siewert Ⅱ型AEG而言,关于手术切除范围的争议仍然激烈[10],至今未制定出明确统一的标准来规范治疗。根据日本胃癌治疗指南[4]的建议,早期胃上部癌淋巴结转移率较低,对于能保留一半以上远端胃的近端cT1N0型肿瘤,可行近端胃大部切除术;而针对进展期胃癌,由于分期较晚,恶性程度较高,仍推荐行全胃切除术,以达到根治目的。Goto等[11]研究了AEG的淋巴结清扫获益指数后认为,Siewert Ⅱ型AEG可选择行近端胃切除术。综合患者术后恢复、生存期、生活质量等多种因素考虑,目前我国胃癌治疗指南[8]的胃癌手术切除原则是:基于肿瘤位置选择胃切除的范围,确保有足够的手术切缘。这给了临床医生更大的选择空间,也使得术者可综合考虑肿瘤位置及其侵袭性、食管与残胃状态、患者与家属意愿后选择合适的手术切除范围。此外,日本学者Mine等[12]的一项研究收集并分析了在7个临床中心进行的进展期Siewert Ⅱ型AEG患者术后的淋巴结受累情况,发现肿瘤远端至EGJ的距离小于3 cm时,胃大弯及幽门区的淋巴结转移率为2.2%;肿瘤远端距EGJ大于5 cm时,患者胃大弯及幽门区淋巴结的转移率有了明显升高(20%);因此,肿瘤远端到EGJ的距离也是患者行近端胃切除的一个重要因素。这意味着对于进展期胃癌,肿瘤距EGJ在3 cm内,且术中有足够的手术切缘,可行近端胃切除,从而保留部分残胃功能,减少术后并发症的发生。目前,虽然关于Siewert Ⅱ型AEG的最佳手术切除范围仍在讨论中,但近端胃切除术的疗效已得到临床医生的认可,并逐渐得到普及。针对胃癌术后各种影响患者生活质量的并发症,不少学者改良了术中消化道重建方式,并对其安全性、可行性及改善患者生活质量的能力进行了验证。
1.2.2 全胃切除术 由于大多数胃癌患者就诊时已处于进展期,肿瘤体积较大,侵及范围较深,不满足近端胃切除的要求,必须行全胃切除术以达到根治效果。全胃切除术的切除范围包括贲门及幽门在内的全胃,全胃切除后通过近端空肠与食管进行吻合来重建消化道。相较近端胃大部切除术,全胃切除术淋巴结清扫更加彻底,杜绝了残胃肿瘤复发的风险,由于全胃切除术后患者无胃酸分泌,反流性食管炎发生率较低,术后生活质量有一定提高。但同时由于舍弃了胃本身具有的储备及分泌功能,改变了消化道的连续性,使得消化道中盐酸及内因子等物质缺乏,食物的消化吸收受到一定影响,术后营养不足,体重减轻,倾倒综合征等并发症时有发生,给患者与术者带来了极大的困扰[10]。目前,针对全胃切除术后的消化道重建方式,也有较多选择。
2 淋巴结清扫
淋巴结转移是胃癌预后与治疗的重要指标,彻底的淋巴结清扫对于肿瘤根治具有重要意义。第7版的国际抗癌联盟/美国癌症联合委员会TNM分期系统[13]建议,清扫淋巴结数量多于16枚。只有当清扫出的淋巴结数量大于16枚时,针对淋巴结转移的病理分期才对肿瘤的分期及患者的术后生存具有更加明确的指导意义。淋巴结清扫不仅对于进展期肿瘤的术后治疗具有一定的指导意义,在早期胃癌的治疗中也发挥作用。虽然对于某些早期胃癌可通过内镜下黏膜切除术或内镜下黏膜剥离术进行治疗,但早期胃癌仍存在一定的淋巴结转移率。韩国的一项大型研究发现[14],早期胃癌的淋巴结转移率为17.1%,而淋巴结的转移与肿瘤的浸润深度、分化类型及肿瘤大小有一定关系。Wang等[15]的研究表明,对于淋巴结转移数量为0、1~2、3~6及>6枚的早期胃癌患者而言,五年生存率分别为94.9%、88.5%、64.3%、41.8%。此外,对于无淋巴结转移或切除不少于15枚淋巴结的患者而言,其7年复发风险有所降低。因此,对于早期胃癌,行淋巴结清扫术不失为个体化的策略。
2.1 胃周淋巴结转移规律及清扫范围 关于胃周淋巴结清扫范围的讨论通常与胃切除的范围有一定相关性,在全胃切除与近端胃切除的研究中,一个限制胃切除手术能否达到根治性切除的关键性因素就是淋巴结清扫范围。Siewert Ⅱ型AEG位于EGJ,肿瘤兼具食管癌与胃癌的生物学特性,淋巴结清扫需考虑腹腔与纵隔两处,是以有关淋巴结清扫范围的研究也在如火如荼地进行。一项关于近端胃切除与全胃切除预后的研究[16]得出以下结论,胃癌浸润越深,淋巴结转移率越高,虽然近端胃次全切除术与全胃切除术后的长期结果并无明显差异,但近端胃手术后长期生活质量优于全胃切除术。该研究认为,在胃上部三分之一的癌症中,仅累及黏膜或黏膜下层的癌症,甚至累及固有肌层的癌症,其淋巴结转移率均较低。然而,累及浆膜下的癌症淋巴结转移的发生率显著增加。Feith等[17]的研究发现,在Siewert Ⅱ型AEG中,贲门左(67%)、贲门右(63%)、胃小弯(66%)、胃左动脉、脾动脉与腹主动脉(25%)是主要的淋巴结转移部位,其他部位的淋巴结转移很少发生。日本的一项大型研究表明[18],胃癌中,4sa、4sb、4d、5、6号淋巴结的转移率均低于1%,与肿瘤部位、pT分期无关,超过90%的转移淋巴结被证实局限于胃近端、食管裂孔、食管远端及胰腺上区。但该研究还发现,对于第7、8、9、10组淋巴结而言,当肿瘤分期为pT3/4时,淋巴结转移率较pT1/2分期有所升高。日本胃癌治疗指南[4]推荐近端胃切除时的淋巴结清扫范围为NO.1、2、3a、4sa、4sb、7、8a、9、11p。我国胃癌治疗指南[8]也有类似推荐。因此对于近端胃切除而言,无需清扫远端胃周围淋巴结(NO.5、6)。
2.2 纵隔淋巴结清扫范围及手术入路
2.2.1 纵隔淋巴结清扫范围 Siewert Ⅱ型AEG的淋巴结清扫范围目前尚未在国际上达成共识。根据日本胃癌治疗指南[4],对于食管胃交界性肿瘤行近端胃切除术的患者,D1+淋巴结清扫范围应包括NO.1、2、3a、4sa、4sb、7、8a、9、11p及110。行全胃切除术的食管胃交界性肿瘤的D1+淋巴结清扫范围应包括NO.1~7、8a、9、11p、110,达到D2切除,则应继续清扫第11d、12a、19、20、111组淋巴结。此外,由于目前很难做到NO.19、20及NO.110、111、112之间的精确区分,因此,下纵隔淋巴结通常与食管裂孔周围的淋巴结被一起切除。对于Siewert Ⅱ型AEG,美国国立综合癌症网络食管癌及食管胃结合部肿瘤指南[3]建议,淋巴结清扫数量不低于16枚,未对淋巴结清扫范围进行界定。
研究表明,纵隔淋巴结的转移主要与肿瘤侵犯食管的范围及肿瘤浸润深度有关[19]。Feith的一项基于1 602例患者的大型临床研究表明[17],Siewert Ⅱ型AEG在中纵隔及上纵隔的淋巴转移极少见,而下纵隔淋巴结的转移率也仅有12%。与该研究类似,2015年发表的一项多中心的回顾性研究发现[20],Siewert Ⅱ型AEG其上、中、下纵隔淋巴结转移率分别为4%、7%与11%,并且认为EGJ至原发灶近缘的距离可能是Siewert Ⅱ型AEG患者纵隔淋巴结转移或复发的一个重要指标。只有当EGJ到原发灶近缘的距离大于3 cm时,经胸腔入路彻底的纵隔淋巴结清扫术可能对治疗提供正面影响。而对于普外科医生遇到的Siewert Ⅱ型AEG而言,能经腹腔直接进行根治性近端胃大部切除或全胃切除术而无需行胸腹联合手术进行消化道重建的患者,其病变向上侵及食管的范围多小于3 cm。一项大型研究证实[21],只有当肿瘤对食管的侵犯长度大于2 cm时,第110组淋巴结才被列为强烈推荐的清扫范围。故而我们认为,如非必要,不将彻底清扫全部的纵隔淋巴结作为AEG的首选手术策略。
2.2.2 纵隔淋巴结清扫的手术入路 对于Siewert Ⅱ型AEG,目前临床医生常采用经胸食管胃切除术或经腹食管裂孔食管胃切除术[3],淋巴结清扫路径也是通过经胸或经腹食管裂孔两种途径。经胸淋巴结清扫术相较经腹食管裂孔径路而言,具有视野清晰、淋巴结清扫彻底的优势,但术后肺部并发症发生率也有所提高。由于纵隔淋巴结大部分位于膈上,只有NO.111组淋巴结位于膈下;因此对于纵隔淋巴结的清扫,经腹食管裂孔入路在不打开膈肌的情况下腹腔镜下难以清扫所有的纵隔淋巴结,可能造成淋巴结清扫不彻底,增加术后转移或复发的风险。荷兰的团队通过一项随机对照试验[22]比较了经胸入路与经腹食管裂孔径路治疗AEG的疗效,发现尽管经胸入路彻底清扫纵隔淋巴结的患者5年长期存活率有所改善,但其早期发病率升高,给患者带来的经济压力也更大;而经腹食管裂孔径路治疗的患者在获得更好的短期收益的同时长期存活率却相应降低。此外,两组患者在中位数总体、无病与质量调整后的存活率方面并无明显差异。也有研究表明[23],对于AEG,通过经腹食管裂孔径路清扫淋巴结具有创伤小、出血量少、对心肺功能影响小的优点。Sasako等[24]的一项大型研究表明,对于AEG,与经腹食管裂孔径路相比,经胸入路并不能给患者带来更高的生存获益。日本胃癌治疗指南[4]及Siewert Ⅱ型食管胃结合部腺癌腔镜手术治疗中国专家共识[7]均推荐食管受累距离小于3 cm的Siewert Ⅱ型AEG,首选经腹食管裂孔径路清扫下纵隔淋巴结。
3 消化道重建方式
3.1 近端胃切除术后消化道重建方式 近端胃切除术后最简便的消化道重建方式是单纯食管-残胃吻合,然而食管与残胃直接吻合后,由于失去了贲门、食管下括约肌等生理抗反流屏障的功能,术后发生反流性食管炎的频率较高,严重影响患者的术后生活质量[25]。为此,临床医生在行近端胃切除术时多会选择改良抗反流术式,以期改善患者术后生活质量,降低术后复发的风险。根据《完全腹腔镜胃癌手术消化道重建专家共识及手术操作指南(2018版)》[26],近端胃切除术后消化道重建应尽可能满足以下要求:(1)在保证肿瘤根治切除的前提下,根据切除胃的范围选择安全、方便的重建方式,操作简便,易于推广;(2)确保吻合口血运佳、张力低、肠襻通,并尽量减少吻合口数量;(3)保持消化道的连续性,兼顾食物储存功能与预防反流性食管炎的功能;(4)尽量保证术后内镜检查的可行性(包括残胃、十二指肠与胆道的检查)。消化道重建的改良术式按照抗反流原理基本上可分为三类:(1)食管胃吻合口的改良,其大多复刻生理抗反流屏障的功能,如双肌瓣吻合、胃底折叠术、食管胃侧壁吻合等;(2)延长反流距离,这一类吻合通常会改变消化道的连续性或生理形态,如管状胃吻合、双通道吻合、间质空肠及间质空肠储袋吻合等;(3)促进胃排空,如幽门成形术等。各类消化道重建方式见图1。
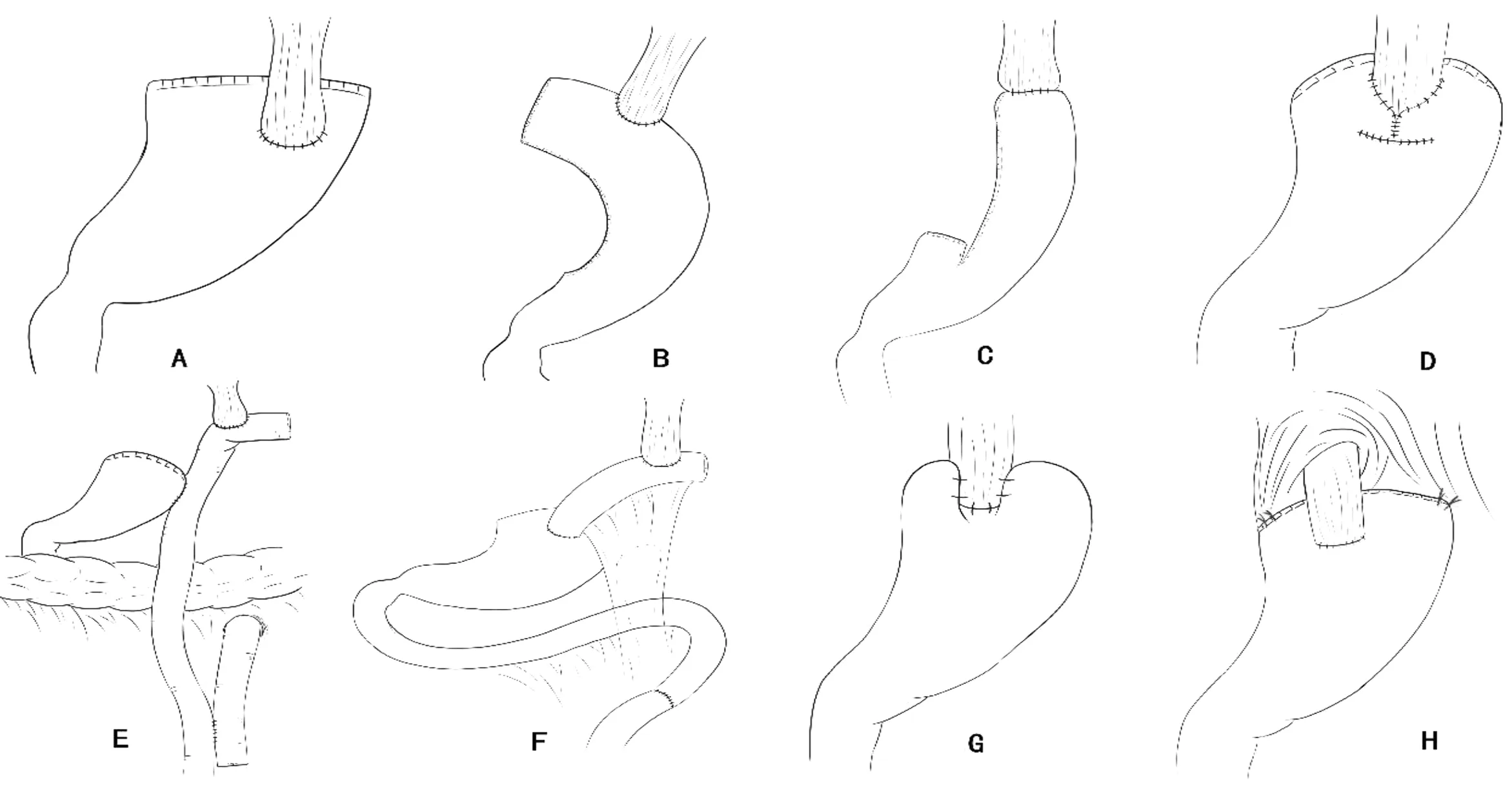
图1 近端胃切除术后消化道重建方式(A:传统食管胃吻合;B:管状胃吻合;C:管状胃-giraffe吻合;D:双肌瓣吻合;E:双通道吻合;F:间质空肠吻合;G:胃底折叠术;H:食管胃侧壁吻合)
3.1.1 管状胃吻合 管状胃吻合的技术要点在于自幽门上方5 cm处向上将远端胃切割成长15~20 cm、宽3~5 cm的管状,管状胃也因此得名。管状胃吻合切除了大部分小弯侧胃壁,减少了胃酸的分泌,同时也延长了反流路径,相较单纯食管-残胃吻合,其抗反流效果明显,患者术后生活质量得到显著提高[25]。因其制作简单,学习难度低,不延长手术时间,也被临床医生广泛接受。但在应用过程中,人们发现由于管状胃在制作过程中产生了较多的切缘,且食管胃吻合口与管状胃切缘距离较近,使得管状胃吻合术后吻合口狭窄的发生率较高,许多患者需要寻求内镜下球囊扩张以恢复饮食。此外,管状胃吻合的抗反流效果仅有68%,与其他抗反流术式相比优势并不明显[27]。我国学者针对该术式进行改良,改造出了“giraffe吻合”[28],重建了小胃底及His角结构,抗反流效果也得到了验证,然而该改良术式的安全性、可行性仍待进一步研究。
3.1.2 双肌瓣吻合 双肌瓣吻合是指由残胃的浆肌层包裹食管下段,通过胃壁的张力给食管残胃吻合口提供闭合的压力,形成一个类似“食管下括约肌”的结构,使残胃内容物无法反流至食管内。该吻合方式最早由Kamikawa报道,因此又被称为Kamikawa术式。该术式抗反流效果显著,Muraoka等[29]的研究证明,进行双肌瓣吻合的24例患者均未出现反流症状,此外,他们通过术后的胃镜检查发现,吻合口处的外观与天然贲门类似,也侧面说明了双肌瓣吻合形成了人工抗反流屏障,抗反流效果可靠。由于双肌瓣吻合是腔镜下手工吻合,对操作者的经验、技术及医疗器械的质量要求较高,延长了消化道重建时间,且术后吻合口狭窄的发生率有所升高。一项研究表明[30],术后30%的患者会出现程度不一的进食梗阻感,10%的患者需行内镜下球囊扩张。为简化手术方式,缩短手术时间,有学者提出“拱桥式吻合”[31],通过辅助切口在体外进行肌瓣重建,形成一个类似拱桥的结构,进一步在腔镜下完成食管残胃的手工吻合。该学者的研究证明,“拱桥式吻合”可有效缩短手术时间,提高手术效率,且不影响术后抗反流效果。然而该改良术式目前研究较少,有待大样本多中心的前瞻性临床研究进一步探索。
3.1.3 双通道吻合 双通道吻合是日本胃癌治疗指南推荐的三种消化道重建方式之一[4]。该术式重建“胃通道”及“肠通道”,给予食物两种选择,既保留了残胃的储备与分泌功能,又保证了消化道的通畅,减少了食物潴留的发生,同时,由于残胃与食管之间的空肠段,使得反流距离得以延长,抗反流效果显著,更加适于残胃较小、行食管胃吻合有一定难度的患者。但双通道吻合打破了消化道的连续性,给术后胃镜检查增加了难度。Sakuramoto等[32]的研究发现,行双通道吻合后,无一例患者出现反流症状,仅25%的患者出现了内镜下轻度反流性食管炎。由于该术式吻合口较多,使得手术时间相对延长,且术后发生吻合口漏的风险相应提高。一项研究表明[33],近端胃切除术后双通道吻合能缩短手术时间,预防反流,改善患者术后营养状态。关于双通道,还有一些学者担心一段时间后,残胃通道的食物分流量减少,更多的食物倾向于通过空肠通道进行消化吸收,使得双通道变成单通道,失去该消化道重建术式的发明初衷。因此,我们认为即使食物不通过残胃,残胃依旧保留着消化与分泌功能,其分泌的胃酸、内因子等物质通过十二指肠到达空肠,促进食物的消化吸收,改善患者营养状态。就这方面而言,双通道与全胃切除术后的Roux-en-Y吻合有本质区别。
3.1.4 间质空肠/间质空肠储袋吻合 间质空肠及间质空肠储袋吻合也是一个较为传统的消化道重建方式,已被多个研究中心报道。间质空肠直接将食管与空肠进行吻合,并将残胃旷置,仅保留残胃的分泌功能,使食物通过食管-空肠通道进行消化吸收。一项研究证明[27],虽然间质空肠吻合的消化道重建相对复杂,花费时间较长,但其抗反流效果较好,且术后营养状况更好,这得益于残胃完整的分泌功能得以保留。间质空肠储袋与间质空肠类似,其效果常与间质空肠一起评价,具体手术方式的选择依旧依靠临床医生根据术中情况决定。
3.1.5 胃底折叠术 胃底折叠术不是临床常用术式,因其对残胃血供要求高,且必须在残胃足够大的前提下进行。该术式将残胃上端向内折叠,包埋一段食管,通过胃壁的张力形成一个类似食管下括约肌的结构,从而拮抗反流。虽然与单纯食管-残胃吻合相比,胃底折叠术确实能有效拮抗胃酸反流,但文献报道[32],其抗反流效果不如双通道可观稳定,且对残胃的大小有一定要求,故而临床上关于近端胃根治性切除术后使用胃底折叠术重建消化道的应用不多。值得一提的是,胃底折叠术是反流性食管炎质子泵抑制剂治疗无效患者的首选标准术式[34]。
3.1.6 食管胃侧壁吻合 食管胃侧壁吻合是指将残胃固定在左右膈肌脚上进行食管-残胃吻合的方式,相当于重建了胃底结构,给胃酸反流提供了一个缓冲区,一定程度上可防止反流的发生,根据Yamashita等[35]的研究,食管胃侧壁吻合将食管壁左侧与胃壁前壁吻合后再使食管壁右侧与胃壁贴紧,将食管变平,这使得保存下来的食管胃吻合口在正常状态下是紧闭的状态,从而构成了瓣膜状的抗反流机制。该研究证实,仅7%(1/14)的患者术后出现了内镜证实的反流性食管炎。然而由于该研究病例数较少,且临床上很少采用此种术式进行消化道重建,是以其安全性、可行性仍有待评估。
3.1.7 其他吻合方式 如保留迷走神经术、幽门成形术、保留食管下括约肌的近端胃切除术等,由于应用较少,相关研究较少,且有的消化道重建方式通常与其他吻合方式联合应用,在此不做赘述。
3.2 全胃切除术后消化道重建方式 全胃切除术是日本胃癌治疗指南中进展期Siewert Ⅱ型AEG的标准手术方式[4]。全胃切除使得胃周围淋巴结的清扫更加彻底,降低了胃癌复发与转移的风险。由于胃被整个切除,杜绝了胃癌复发进展成残胃癌的隐患。但其消化道重建方式仍存在一定争议,主要表现在十二指肠旷置与加做空肠储袋两方面。不少学者为了模拟正常消化道的生理状态,提高手术效率,改善患者术后生活质量,进行了不同消化道重建方式的尝试(图2),现总结如下。
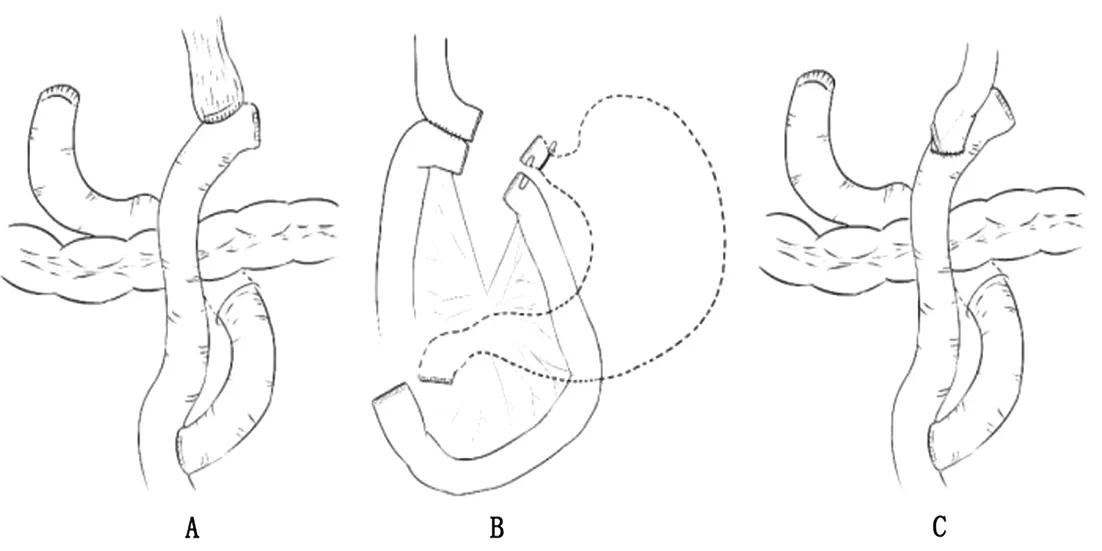
图2 全胃切除术后消化道重建方式(A:Roux-en-Y吻合;B:π吻合;C:overlap吻合)
3.2.1 Roux-en-Y吻合 Roux-en-Y吻合是全胃切除术后最常见的消化道重建方式,也是《完全腹腔镜胃癌消化道重建专家共识及手术操作指南》[26]中推荐的全胃切除术后消化道重建方式。An等的研究证实[10],Roux-en-Y吻合术后吻合口狭窄与反流性食管炎的发生率分别为6.9%与1.8%,与同期进行的近端胃切除术相比,其营养状况未明显降低。Roux-en-Y吻合过程中需离断空肠,进行食管空肠吻合及空肠空肠吻合,破坏了消化道的连续性,也破坏了肠神经功能的传导,容易导致肠道生理功能及运动功能紊乱,从而引起倾倒综合征、Roux-en-Y滞留综合征等术后长期并发症。Uncut Roux-en-Y吻合可减少这种并发症的发生。与Roux-en-Y吻合不同,Uncut Roux-en-Y吻合在保持肠管连续性的同时,保证了十二指肠功能的充分利用,同时给空肠增加了一段储备功能,使消化道更接近术前状态,利于患者术后恢复[36]。研究表明[37],Uncut Roux-en-Y吻合较Roux-en-Y吻合操作简便,术后恢复快,并发症发生率低,且对患者早期术后营养状况的维持具有更好的作用。
3.2.2 π吻合 π吻合是近年新兴的消化道重建方式之一,其技术要点在于先行食管空肠吻合后再关闭食管空肠共同开口,同时离断胃。π吻合在离断胃前先行食管空肠吻合,利用胃的牵拉作用提供张力,降低了食管空肠吻合的难度,同时减少了直线切割闭合器的应用。研究证实[38],π吻合操作简便,能有效缩短手术时间,减轻了患者的经济负担,且不增加术后并发症发生率。在了解π吻合的优势时,我们也发现,在消化道重建过程中无法判断肿瘤具体位置,离断胃后有上切缘阳性的可能,因此该术式不适于术前评估肿瘤侵犯位置较高的肿瘤,尤其是AEG。由于π吻合提出时间不长,临床上其研究不如传统消化道重建方式多,具体临床疗效有待前瞻性的多中心临床研究验证。
3.2.3 Overlap吻合 2010年,Inaba提出了Overlap这一消化道重建方式,并报道了满意的早期术后结果。为验证该术式,Kitagami等进行了一项病例数为100的临床研究[39],发现Overlap吻合所需中位吻合时间为32 min,手术时间短,且术后患者恢复迅速,无一例发生吻合口相关并发症,证实了Overlap吻合是安全、可行且能使患者受益的术式。与π吻合不同,Overlap吻合离断胃后进行吻合,术中视野不受限制,操作空间大,利于缩短手术时间,且吻合后食管及空肠蠕动方向一致,利于食物的传递。但由于食管缺少了胃的牵拉作用,容易回缩至胸腔,因此需要在食管断端额外固定两根牵拉线牵引食管,以保证手术的顺利进行。
综上所述,在保证肿瘤根治的前提下,对于Siewert Ⅱ型AEG,一般建议术中根据肿瘤位置及浸润深度选择淋巴结清扫范围,在尽可能缩短手术时间的同时减少术后并发症的发生与术后复发的可能。目前,全胃切除、近端胃切除术及其相对应的消化道重建方式仍存在较多争议,且各有利弊,最佳术式仍在不断探索研究中。因此,术中应根据患者一般状况及食管、残胃状态选择合适的消化道重建方式,使患者得到最佳获益。
