新疆某医院侵袭性念珠菌感染的菌种分布、药物敏感性及耐药基因初步分析
2023-03-09张松迪王晓东艾柯代玉苏甫哈地利亚哈斯木帕丽达阿布利孜
张松迪 王晓东 艾柯代·玉苏甫 哈地利亚·哈斯木 帕丽达·阿布利孜
(新疆医科大学第一附属医院皮肤科,乌鲁木齐 830011)
随着糖皮质激素、抗生素、介入性操作技术的广泛应用以及老龄化、免疫受损人群数量增多,侵袭性真菌感染的发病率呈明显上升趋势。侵袭性念珠菌病是最常见的侵袭性真菌感染,死亡率达50%左右,已成为危重症患者面临的巨大威胁[1]。由于日渐广泛的预防性和经验性应用抗真菌药,菌株的耐药现象日趋严峻,特别是多重耐药“超级真菌”耳念珠菌的出现已引起了全世界范围的密切关注[2]。由于侵袭性念珠菌病的流行病学和耐药情况存在地域差异,本文将调查分析本院侵袭性念珠菌感染分离菌株的流行分布情况以及耐药特点,并在此基础上探讨真菌耐药的分子机制,以期为当地侵袭性真菌病的临床诊治提供科学依据。
1 材料与方法
1.1 标本来源
收集2022年6月—2023年6月新疆医科大学第一附属医院确诊为侵袭性真菌病住院患者的无菌体液、分泌物、支气管肺泡灌洗液、痰液等标本中的菌株,共计125株。剔除同一患者同一部位重复送检的同种菌株以及首次培养阳性前一周内接受抗真菌治疗患者的分离菌株。
1.2 设备与试剂
Sensititer YeastOne YO10真菌药敏板(Thermo Fisher公司);Ezup柱式真菌基因组 DNA 抽提试剂盒和聚合酶链反应试剂盒购自上海生工生物工程有限公司;PCR引物的合成及产物双向测序委托上海生工生物工程有限公司。PCR仪(美国ABI公司)、高速离心机(湖南湘仪实验仪器开发有限公司)、凝胶成像仪(上海复日科技有限公司)、电泳仪(北京六一仪器厂)。
1.3 方法
菌种培养及鉴定 所有标本接种于显色培养基(法国科玛嘉)上并置于35 ℃培养箱中培养1~2 d,观察菌落形态及颜色进行形态学鉴定,并对菌株核糖体DNA内转录间区( internal transcribed space,ITS)测序进行分子生物学鉴定。
抗真菌药体外敏感性检测 按照 Sensititer YeastOne YO10真菌药敏板说明书进行操作,测定菌株对药敏板上所包被的9种抗真菌药(氟康唑、伏立康唑、伊曲康唑、泊沙康唑、卡泊芬净、阿尼芬净、米卡芬净、两性霉素B、5-氟胞嘧啶)的最低抑菌浓度(minimal inhibit concentration,MIC)。药敏结果依据美国临床和实验室标准化协会最新文件[3]的临床折点(clinical breakpoints,CBPs)判读,没有临床折点的参考流行病学界值(epidermiological cutoff values,ECVs)[4]来判读。选择近平滑念珠菌ATCC 22019、克柔念珠菌ATCC6258为质控菌株。
目的基因的提取、扩增和测序 按照Ezup 柱式真菌基因组 DNA 抽提试剂盒说明书对分离出的33株唑类耐药念珠菌提取基因组DNA。依据GenBank数据库中念珠菌ERG11基因序列(genBank accession no.NC_032093.1(白念珠菌);M23673.1 (热带念珠菌);L40389.1 (光滑念珠菌);AF531428.1(克柔念珠菌);NW_023503279.1(近平滑念珠菌)和NC_005967.2(光滑念珠菌)的PDR1基因设计引物来测序,引物序列见表1。

表1 PCR引物

(续表)
PCR反应总体系为25 μL:上下游引物各1 μL,dNTP(mix)1 μL,Taq酶0.2 μL,PCR缓冲液2.5 μL,ddH2O 18.3 μL。PCR产物经1%凝胶电泳观察结果。PCR反应参数:①预变性:94 ℃ 5 min; ②扩增:94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸60 s,共35次循环扩增;③终延伸:72 ℃ 8 min;于4 ℃下保存。由上海生工生物工程有限公司对纯化后的PCR产物采用Sanger法行双向测序。利用SnapGene4.1.8软件将扩增的产物基因序列与GenBank数据库提供的基因序列进行比对以确定基因突变位点。
1.4 统计学分析
用SPSS 22和Origin2018软件进行统计学分析和作图。计数资料以频数或构成比表示,采用χ2检验或Fisher精确检验分析数据;P<0.05认为差异有统计学意义。
2 结 果
2.1 菌种鉴定及分布情况
送检样本经形态学和分子生物学鉴定后,共鉴定111株酵母菌,包括两株少见酵母菌Wickerhamomycesonychis和Magnusiomycescapitatus以及109株念珠菌,其中最常见的是白念珠菌(56/111,50.45%),然后依次为光滑念珠菌(20/111,18.02%)、热带念珠菌(17/111,15.32%)和克柔念珠菌(8/111,7.21%),见图1、2。菌株的体液标本来源主要来自于痰液(87,78.38%)、尿液(17,15.32%)、支气管肺泡灌洗液(4,3.6%)。除了粪便和咽拭子之外,其他的体液标本中最常分离的前几位菌种依次为白念珠菌、光滑念珠菌、热带念珠菌、克柔念珠菌,见表2。分离的菌株主要来自13个科室,主要分布于呼吸科(41.44%)、重症监护病房(ICU)(30.63%)和感染科(9.01%),见表3。
2.2 体外抗真菌药物敏感性实验结果
本研究仅对有CBPs和ECV以及例数≥3的菌株进行分析。多数念珠菌对两性霉素B及5-氟胞嘧啶(5-fluorocytosine,5-FC)高度敏感(见表4)。三种棘白菌素类药物对常见念珠菌均表现出良好的体外抗真菌活性,其中白念珠菌、克柔念珠菌、近平滑念珠菌和葡萄牙念珠菌对所有的棘白菌素类药物均敏感。热带念珠菌对阿尼芬净和米卡芬净的敏感率为100%(5.88%的菌株对卡泊芬净表现为中介)。光滑念珠菌对阿尼芬净、米卡芬净、卡泊芬净的敏感率分别为90%、90%和85%。此外,发现1株光滑念珠菌同时对3种棘白菌素类药物耐药(见表4)。
念珠菌对氟康唑、伊曲康唑、伏立康唑、泊沙康唑的耐药率分别是7.1%、7.1%、3.6%、10.7%;光滑念珠菌对伏立康唑和泊沙康唑耐药率较高(70%和45%),明显高于氟康唑和伊曲康唑(5%);热带念珠菌对泊沙康唑的耐药率最高(64.71%),对氟康唑、伊曲康唑、伏立康唑的耐药率分别为23.53%、11.76%和17.65%。克柔念珠菌对唑类药物的耐药率为12.5%(氟康唑除外)。葡萄牙念珠菌对所有唑类药物均敏感,近平滑念珠菌对泊沙康唑和伊曲康唑100%敏感,对氟康唑和伏立康唑的耐药率分别是33.33%和0(对伏立康唑有33.3%表现为中介),见表5。本研究中共发现33株念珠菌(6株白念珠菌、14株光滑念珠菌、11株热带念珠菌、1株克柔念珠菌和1株近平滑念珠菌)为唑类耐药/非野生株。
2.3 目的基因测序结果
对33株唑类耐药或非野生型念珠菌菌株所提取的目的基因进行PCR扩增均获得了大小与DNA Marker位置相符并且无非特异性产物的条带。将上述菌株的ERG11和PDR1基因测序结果分别进行blast比对,将起始密码子ATG中的A计作1来确定突变位点。

图1 菌种鉴定情况:A.念珠菌钙荧光白染色镜下形态(×400),①~④:白念珠菌、光滑念珠菌、热带念珠菌、克柔念珠菌;B.念珠菌科玛嘉显色培养基鉴定,a~d分别为克柔念珠菌、光滑念珠菌、白念珠菌、热带念珠菌;C.部分念珠菌ITS区基因PCR扩增琼脂糖凝胶电泳图
ERG11基因测序结果显示6株白念珠菌共发现两处错义突变(E266D 和(V488I);在11株热带念珠菌中仅有1株发生错义突变(Y132F和S154F),还有8株发生同义突变,另外2株未发生突变;14株光滑念珠菌中有两株发生错义突变,分别为K108N和T293I,其余菌株均发生同义突变;而在克柔念珠菌和近平滑念珠菌中未发现错义突变。14株光滑念珠菌中PDR1基因共发现7处错义突变(D243N、S76P、V91I、L98S、T143P、F948S、K425R),见表6。

图2 菌株分布情况
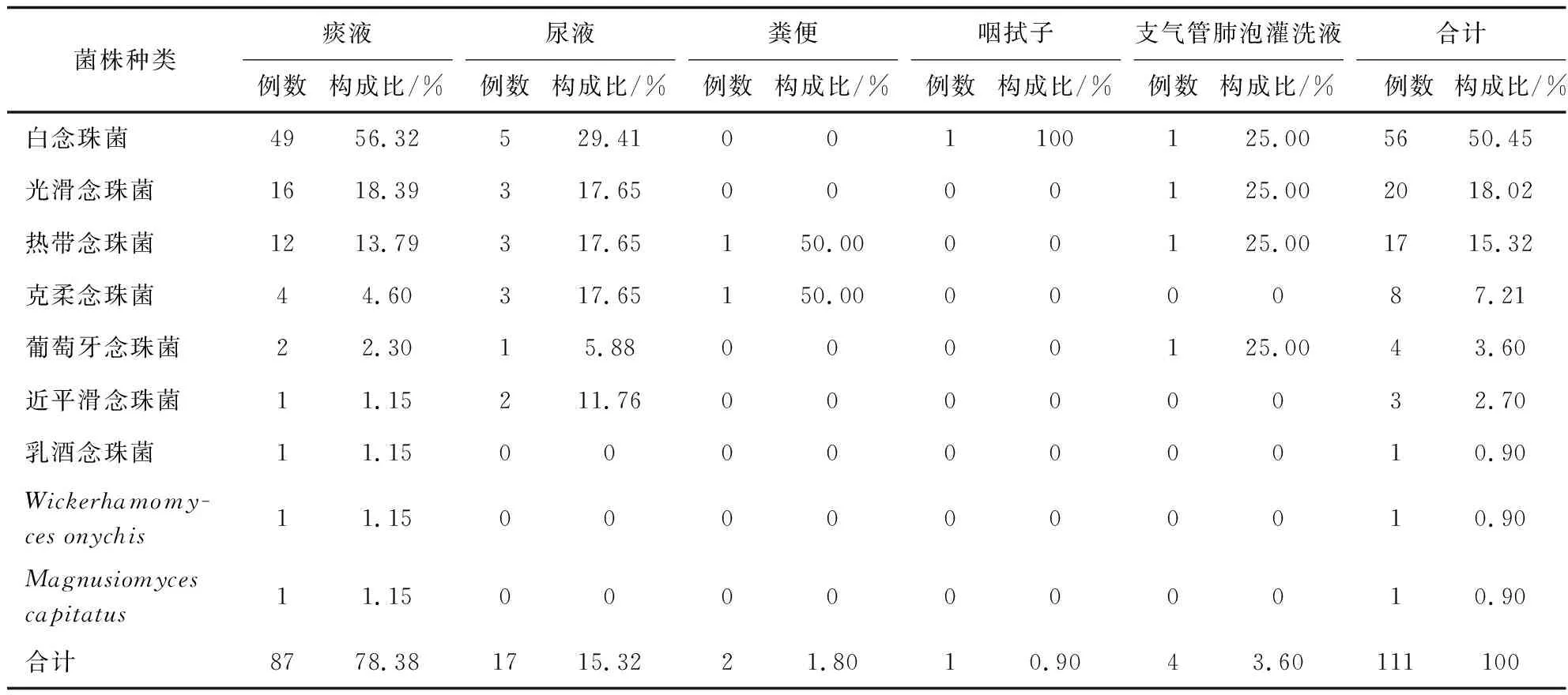
表2 菌株标本类型分布
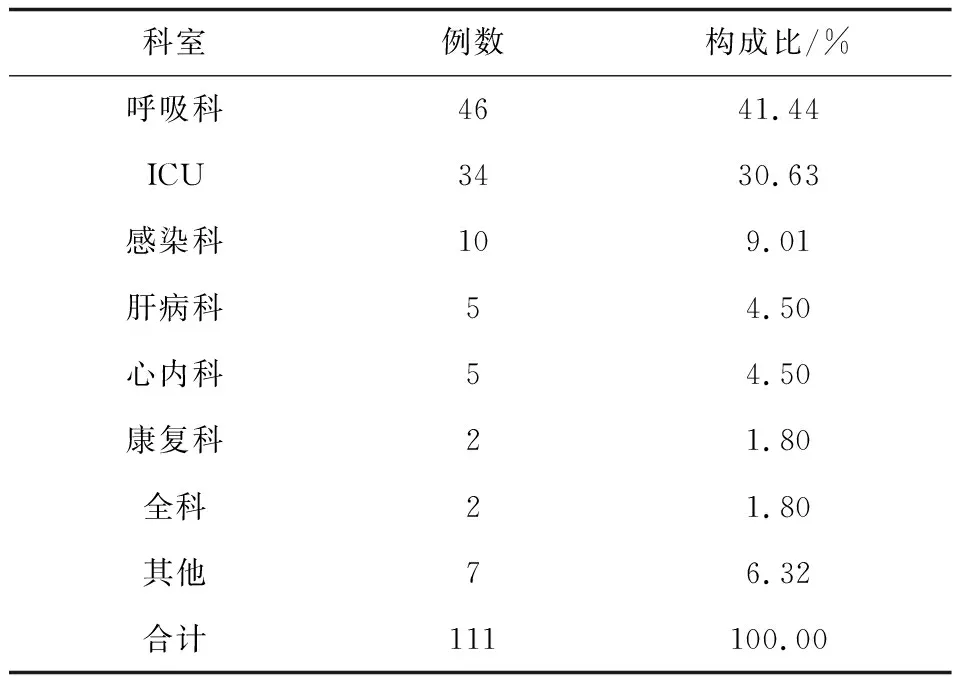
表3 菌株科室分布
3 讨 论
近年来侵袭性念珠菌病的发病率逐渐上升,但治疗侵袭性真菌感染的药物种类有限,耐药菌株的出现常引起治疗失败而给临床带来了极大挑战[5]。随着抗真菌药物的广泛应用,侵袭性念珠菌病的致病菌种分布有一定变异和地区差异,非白念珠菌感染比例逐渐增高,在某些地区甚至已经超过了白念珠菌[6]。本研究收集的侵袭性念珠菌病菌种以白念珠菌为主,与我国两项大型多中心研究[7-8]结果一致。非白念珠菌以光滑念珠菌和热带念珠菌的分离率最高,与国外部分研究报道[9-10]一致。我国一些单中心研究[11-14]显示非白念珠菌的优势菌种是光滑念珠菌,但在一些大样本的多中心研究[15-17]中最常分离的非白念珠菌是近平滑念珠菌,可见致病菌种的分布存在一定的地域差异,可能与菌株分离标本的来源及种类、不同的患病人群以及抗真菌药物的选择应用等多种因素有关,这提示我们有必要对当地侵袭性念珠菌的流行病学进行动态监测。
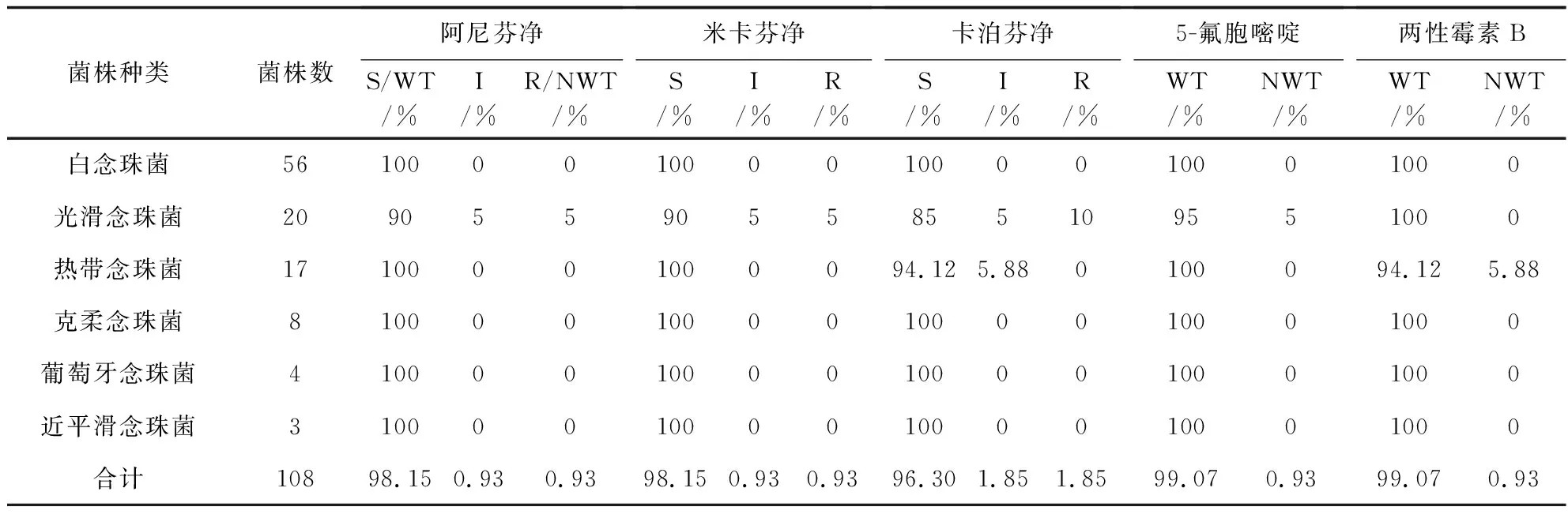
表4 常见念珠菌对棘白菌素、5-氟胞嘧啶和两性霉素B的体外药敏结果
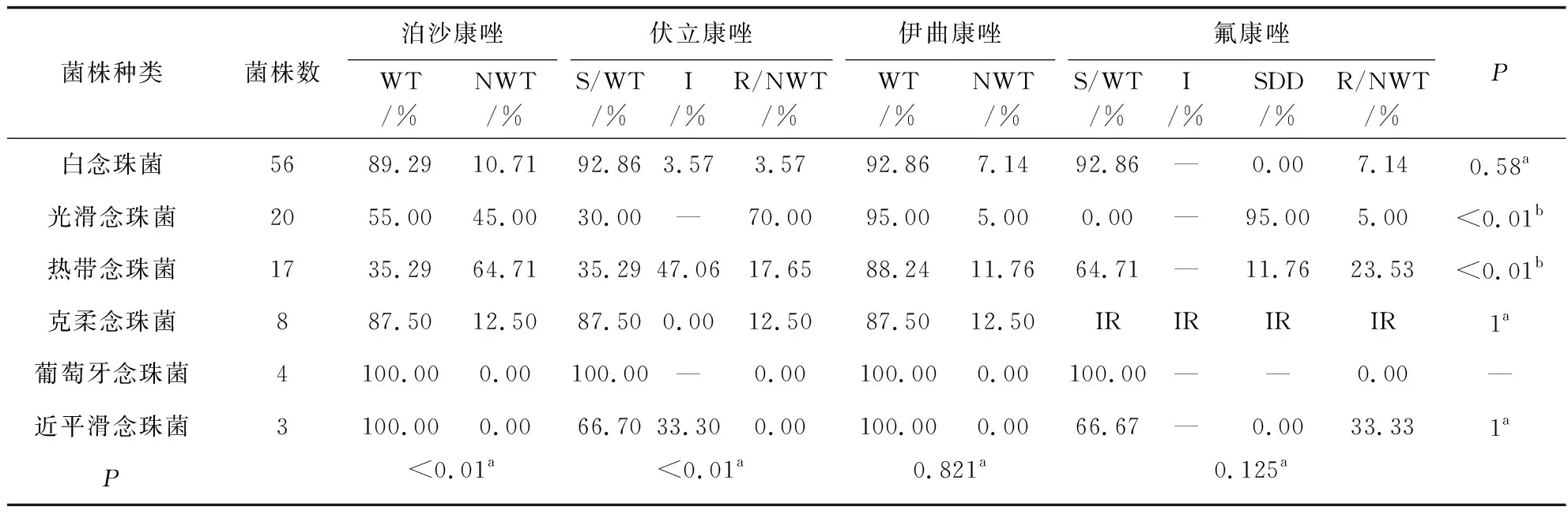
表5 常见念珠菌对唑类的体外药敏结果
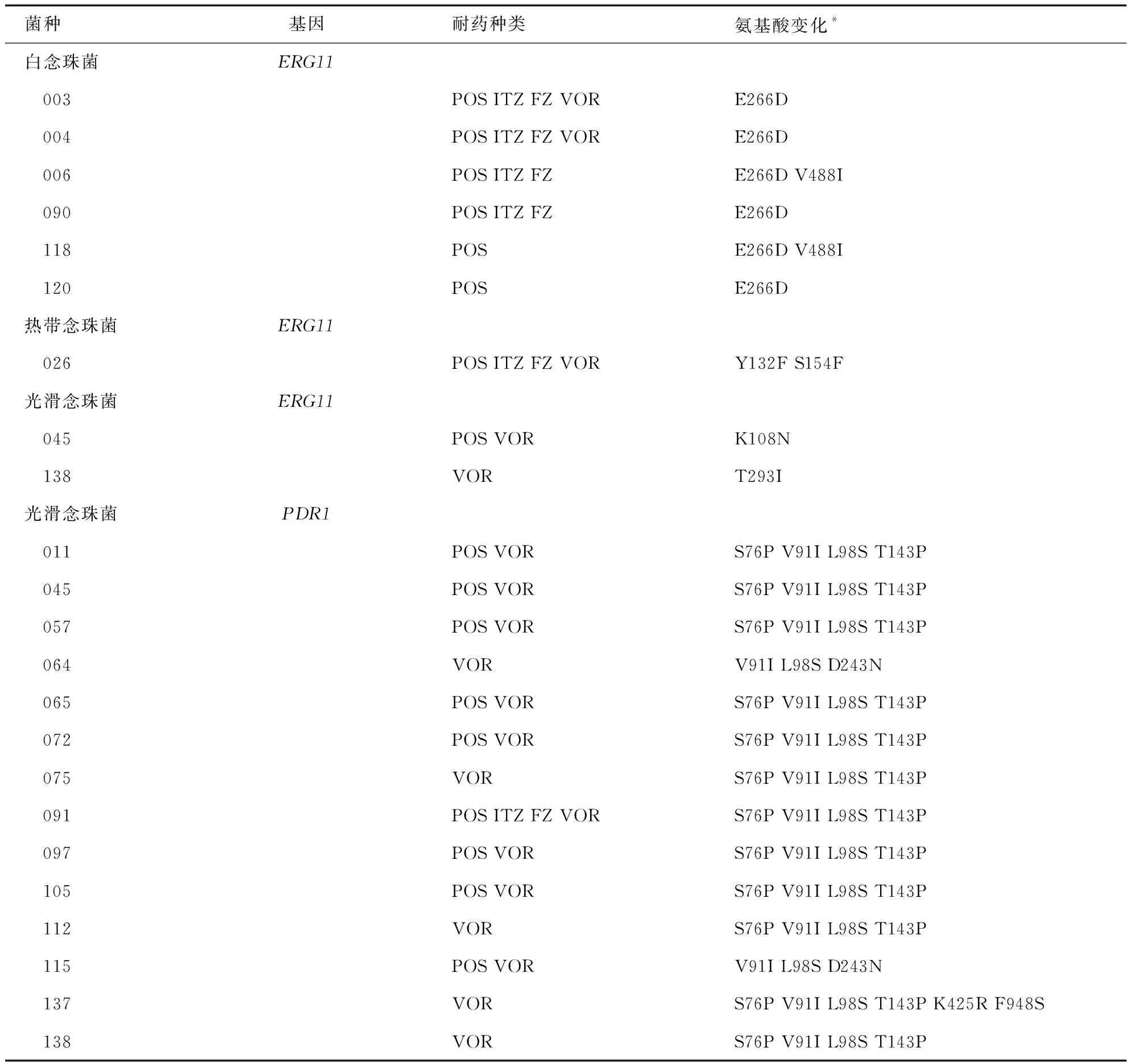
表6 唑类耐药/非野生型念珠菌中相关基因突变
从菌株分布科室来看,本研究收集的菌株主要分布于呼吸科、ICU和感染科,这可能因为这些科室患者病情相对复杂和危重,广谱抗生素的应用率较高以及侵入性操作技术和侵袭性生命支持的应用相对较多,导致机体微生态紊乱、菌群失调、免疫屏障破坏进而增加了条件致病菌感染的机率。在临床工作中我们应对这些科室重点关注、早期识别易感的高危人群,完善相应的防治措施。
本研究体外抗真菌药物敏感性实验数据显示念珠菌整体对两性霉素B和5-FC高度敏感,对唑类药物表现出不同程度的耐药。白念珠菌对唑类药物较为敏感(敏感率89.29%~92.86%),非白念珠菌对唑类药物的敏感性相对较低,如光滑念珠菌对伏立康唑、热带念珠菌对泊沙康唑的耐药率高达64.7%和70%,这与目前国内外研究[18-19]报道的耐药流行趋势相一致,与其他种类的念珠菌相比,光滑念珠菌和热带念珠菌对唑类药物具有天然的异质耐药性,更易发生唑类耐药。棘白菌素类药物因其对唑类耐药念珠菌具有良好的抗菌活性和独特的抗菌机制在临床上应用逐渐增多,目前棘白菌素类药物被推荐作为治疗侵袭性念珠菌病的一线治疗药物[20-21],值得关注的是近年来棘白菌素类药物的耐药现象正在逐渐增多,可能是随着药物的广泛应用而带来的选择性压力有关,耐药现象在光滑念珠菌中尤为显著。国内外学者均报道了光滑念珠菌对棘白菌素类药物的耐药现象[9,22],美国的一项研究发现[23]光滑念珠菌对棘白菌素耐药率超过了10%。本研究结果(见表4)显示,棘白菌素类药物对多数念珠菌具有良好的抗菌活性,但光滑念珠菌对棘白菌素的耐药率达5%~10%。虽然棘白菌素类药物在我国普及稍晚,其耐药现象在临床上并不常见,但发生光滑念珠菌感染时我们仍需密切关注药敏情况并注意用药选择。
唑类抗真菌药因经济、相对安全有效在临床上应用最为广泛,念珠菌对唑类药物的耐药现象也最为常见,探索其耐药机理有助于推进侵袭性念珠菌病的治疗方案的选择和改善患者预后。ERG11基因[24-25]编码真菌细胞膜麦角甾醇合成途径关键酶羊毛甾醇14α-去甲基化酶,该酶是唑类药物的作用靶点,ERG11基因突变可导致靶酶构象改变、影响药物和靶酶的结合而导致耐药。念珠菌的唑类耐药机制常与ERG11基因突变有关[24],然而光滑念珠菌对唑类耐药机制主要与锌簇转录因子编码基因PDR1突变有关,PDR1基因突变可上调外排泵编码基因CDR1、CDR2及SNQ2而导致唑类耐药[26-27]。本研究共收集33株唑类耐药/非野生型念珠菌,这些菌株的ERG11基因测序结果示白念珠菌共发现16处突变位点,其中3处发生错义突变(D116E、E266D和V488I)。这些错义突变虽然常见于唑类耐药株中,但已有研究[28]发现这些突变与耐药无关,这也证实了菌株中还存在其他的耐药机制;耐药热带念珠菌ERG11基因共发现7处突变位点,其中2处发生Y132F和S154F错义突变,这两个位点位于基因突变热点区域内,已经研究[29-30]证实可导致唑类耐药;光滑念珠菌ERG11基因中发现了两处错义突变(K108N和T293I),目前ERG11基因突变尚未被报道作为一种重要的机制参与光滑念珠菌唑类耐药,关于此机制的研究报道数量有限,本研究中新发现的变异位点是否与耐药相关还有待进一步验证。另外,本研究在14株耐药光滑念珠菌中均检测到PDR1错义突变,其中S76P、V91I 、L98S、 T143P、D243N突变经证实可导致外排泵编码基因CDR1或CDR2的表达上调而发生唑类耐药[31-32];K425R、F948S为新发现的突变,新的变异位点还需进一步研究来证实是否与耐药相关。
综上所述,我院侵袭性念珠菌病的主要致病菌是白念珠菌,侵袭性念珠菌病致病菌种对棘白菌素类药物、两性霉素B、5-FC较为敏感,非白念珠菌特别是热带念珠菌和光滑念珠菌的唑类耐药率较高,我们需谨慎合理地选择抗菌药物、及时行动态药敏监测及对致病菌种进行流行病学特征分析。本研究在唑类耐药/非野生型的白念珠菌、光滑念珠菌和热带念珠菌的ERG11基因和PDR1基因发现了可介导唑类耐药的错义突变,由于念珠菌耐药机制错综复杂,本研究中未发生突变、存在同义突变以及经证实发生的突变与耐药无关的耐药株中是否还存在其他的耐药机制仍需深入和持续性的研究来明确。未来应继续收集更多的样本,对可能与耐药相关的错义突变运用软件对ERG11蛋白质同源分子建模分析预测突变位点的功能,还可构建耐药突变位点异位表达的菌株来检测耐药表型以进一步证实基因突变位点与耐药的关系,并对PDR1调控的下游基因转录水平进行分析以验证PDR1基因突变对耐药的影响。此外,可进一步结合样本的临床特征、危险因素、预后结局等来进行综合分析,为我院侵袭性念珠菌病的诊治提供更详尽的科学依据。
