桑葚幼果的落果与正常果的果柄转录组分析
2023-03-09陈春兵刘练练查幸福
邓 璇,陈春兵,邓 静,刘练练,李 娟,查幸福
(西南大学 家蚕基因组生物学国家重点实验室,重庆 400700)
桑Morus是一种重要的木本植物,具有28条染色体[1],不仅可以作为家蚕的重要食物,还具有一定的经济、药用及生态价值。但是桑葚在成熟的过程中易脱落,使得桑葚变软变黑,影响其产业价值,因此,如何采用有效的手段对桑葚脱落进行调控十分重要。
果实脱落是植物正常发育过程中的一种常见现象,但是,在一定程度上会限制果树的产量。果实脱落主要受环境因素、酶、生理代谢共同调控[2],其中,环境因素主要包括生物胁迫(如病虫害[3])和非生物胁迫(温度胁迫[4]、水分胁迫[5]、光胁迫[6]等);生理代谢则包括一些激素代谢(如脱落酸[7]、乙烯[8]等植物激素)和糖代谢[9];由于纤维素和果胶是植物细胞壁的主要组成成分,因此纤维素酶、果胶酶、多聚半乳糖醛酸酶[10]等与果实脱落相关[11]。
目前,桑葚脱落的分子机制还未见报道。本研究以白桑Morus alba为供试材料,对其进行转录组测序分析,探究桑葚在脱落过程中的生化成分代谢的分子机制,旨在为进一步了解桑葚果实脱落的分子机制提供参考。
1 材料与方法
1.1 材料
2021年4月在西南大学家蚕基因组生物学国家重点实验室桑树资源种质基地,选取无病害、健康状况较好的白桑幼果果柄。以落果果柄 (YD) 为实验组,取6个果柄为1份,设3个生物学重复,标记为YD1、YD2、YD3。正常果果柄 (YN) 为对照组,同样取6个果柄为1份,设3个生物学重复,标记为YN1、YN2、YN3。取材后立即在液氮中速冻并储存于−80 ℃冰箱保存。
1.2 冷冻切片的制作
将正常果和脱落果果柄组织清洗后用质量分数为4%的多聚甲醛过夜固定,用包埋剂包埋材料。待包埋剂彻底凝固后进行冷冻切片。切片厚度为5 μm,将切片后的材料吸附于阳离子载玻片上,室温干燥30 min后,用磷酸缓冲盐溶液(PBS)洗涤样品,去除包埋剂后置于显微镜下观察。
1.3 RNA 提取
采用TRIzol法提取落果果柄和正常果果柄的总RNA,用分光光度计检测RNA样品的浓度和纯度,以保证是否可以进行下一步测序分析。
1.4 转录组测序与分析
样品由华大基因进行测序及分析,利用华大智造测序平台BGISEQ测序,所得的原始数据为raw reads。过滤掉低质量、接头污染以及未知碱基N含量过高的reads,过滤后的数据称为clean reads。将clean reads比对到参考基因组上,再进行后续分析。
1.5 测序原始数据的公开
将测序所得原始数据提交到美国国家生物技术信息中心(NCBI)的SRA数据库中,检索号为:PRJNA811258。
1.6 差异表达基因的筛选和富集分析
使用DEseq2方法检测样品之间的差异表达基因(DEG)[12]。根据基因本体论数据库(GO)和京都基因与基金组百科全书(KEGG)注释结果以及官方分类,将差异基因进行功能分类,同时使用R软件中的phyper函数进行富集分析。详细说明见Wiki网站https://en.wikipedia.org/wiki/Hypergeometric_distribution。校正后的P≤0.05为显著富集。
1.7 实时荧光定量 PCR (RT-qPCR)验证
将桑葚幼果的落果果柄与正常果果柄RNA用 PrimesciptTMRT reagent kit with gDNA Eraser(Takara)反转录,在 primer premier 5.0 软件设计定量引物 (表 1),内参基因为 Actin,利用 NovoStart®SYBR qPCR SuperMix Plus(novoprotein) 试剂盒进行荧光定量 PCR。反应程序为:95 ℃ 30 s,95 ℃ 3 s,60 ℃ 30 s,共 40 个循环。用 2−ΔΔCt算法处理数据,利用 GraphPad Prism 8.0.2 软件作图。

表1 转录组数据 RT-qPCR 验证引物序列Table 1 Primer sequences used in RT-qPCR validation of transcriptome data
2 结果与分析
2.1 果柄离区切片观察
桑果是带果柄脱落,为了研究桑树正常果柄和脱落果柄的差异,对其进行冷冻切片并观察显微结构。从图1可知:正常幼果果柄与枝干相连的区域内细胞规则,形态一致,而脱落幼果果柄与枝干相连处细胞小且致密。

图1 落果与正常果果柄纵切面显微结构图Figure 1 Longitudinal section microscopic structures of abscised and normal surviving young fruit peduncles
2.2 转录组测序结果质量分析
基于BGISEQ对桑葚幼果的落果与正常果果柄离区进行转录组测序,6个样品获得262.92 Mb的原始序列。原始测序数据经一系列质量控制后,每个样本获得超过6.3 Gb的高质量纯净测序数据量,每项碱基质量大于20的碱基数量占总碱基数量的比例 (Q20) 均大于96%,每项碱基质量大于30的碱基数量占总碱基数量的比例 (Q30) 均大于91%。将每个样本的高质量纯净序列与测序并组装的桑树基因组序列进行比对,比对率均高于59%(表2),表明本研究转录组测序数据质量较高,可用于后续的分析。
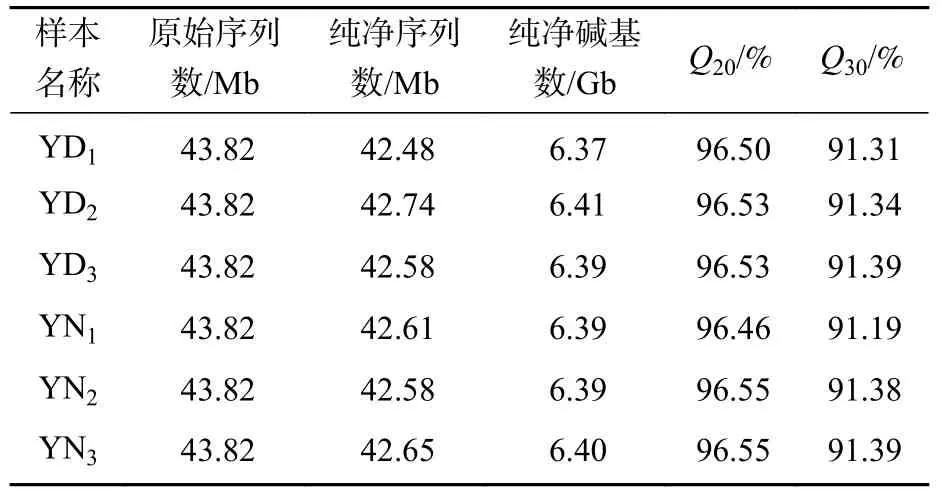
表2 测序数据统计Table 2 Statistics of sequencing data
2.3 落果与正常果果柄的差异表达基因
用每2个样品之间的Pearson相关系数以反映样本间基因表达的相关性(图2)。结果发现:Pearson相关系数为0.69~1.00,说明各样本间重复性和相关性较好。

图2 落果与正常果果柄的相关性热图Figure 2 Correlation heatmap of abscised and normal surviving young fruit peduncles
在桑葚幼果果柄组织中,共鉴定到25 293个基因(图3A)。其中,共表达的基因有23 203个,占91.7%。正常果果柄特有基因为1 164个,占4.6%,落果果柄组特有基因为926个,占3.7%。由此可见,落果果柄基因较正常果果柄基因少。根据差异筛选标准,在2组中共筛选到10 481个差异表达基因(图3B),其中,5 239个差异表达基因上调表达,5 242个差异表达基因下调表达。

图3 落果与正常果果柄的表达基因和差异表达基因Figure 3 Expressed genes and differentially expressed genes of abscised and normal surviving young fruit peduncles
2.4 差异表达基因的 GO 富集分析
本研究对差异表达基因进行GO功能富集分析,共发现37个显著性GO条目。生物过程共富集到7 064个基因,显著富集到19个条目,涉及生物调节、细胞过程、代谢过程、对刺激的反应等,其中富集到生物过程中最多的差异表达基因为细胞过程和代谢过程基因;细胞组分共富集到6 857个基因,显著富集到6个条目,涉及细胞解剖实体、细胞内、其他有机部分、含蛋白质复合物、病毒粒子等,富集到细胞组分最多的差异表达基因为细胞解剖实体和细胞内基因;分子功能共富集到9 842个基因,显著富集到12个条目,涉及催化活性、转运蛋白活性、转录调节活性、分子功能调节剂等,富集到分子功能最多的差异表达基因为催化活性和结合基因(图 4)。

图4 落果与正常果果柄的差异表达基因GO分类柱状图Figure 4 Histogram of GO classification of differentially expressed genes of abscised and normal surviving young fruit peduncles
GO富集分析结果显示:大多数差异基因集中在催化活性、膜的组成成分、氧化还原酶活性、膜的内在成分,分别为 4 623、2 774、777、1 781 个基因(图5)。其中,具催化活性的基因最多,说明在桑葚的落果过程中可能有很多重要的酶参与,从而发生一系列的催化反应。
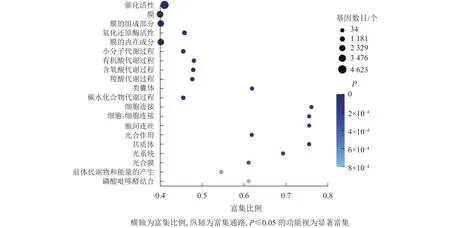
图5 落果与正常果果柄的差异表达基因GO富集气泡图Figure 5 GO enrichment bubble chart of differentially expressed genes of abscised and normal surviving young fruit peduncles
2.5 差异表达基因的KEGG代谢通路富集分析
在本研究中,细胞过程富集的基因为380个,富集到1个条目,为运输和分解代谢;环境信息处理共富集到653个基因,富集到2个条目,为膜运输和信号转导;遗传信息处理共富集到1 558个基因,包含4个条目,为折叠分类和降解、复制和修复、转录、翻译;代谢通路富集到5 315个基因,包含11个条目,为氨基酸代谢、其他次生代谢物的生物合成、碳水化合物代谢、能量代谢等;有机系统共富集到427个基因,含1个条目(图6)。分析发现:代谢通路富集的基因最多,说明桑葚在脱落过程中代谢反应尤为明显。

图6 落果与正常果果柄的差异表达基因KEGG分类柱状图Figure 6 Histogram of KEGG classification of differentially expressed genes of abscised and normal surviving young fruit peduncles
KEGG通路富集分析结果显示:大多数差异表达基因集中在MAPK信号通路、黄酮类生物合成、柠檬酸循环、植物激素信号转导、氨基酸的生物合成通路,分别含293、102、55、318、251个基因(图7)。其中,植物激素信号转导途径的差异表达基因数量最多,说明在桑葚果实脱落过程中植物激素起到了十分重要的作用。

图7 落果与正常果果柄的差异表达基因的KEGG富集气泡图Figure 7 KEGG enrichment bubble diagram of differentially expressed genes of abscised and normal surviving young fruit peduncles
在桑树的代谢通路中,植物激素信号转导途径的差异表达基因数量最多,为318个基因,其中,落果果柄中有51.9% (156个)的差异表达基因的表达量高于正常果果柄(图8A);在黄酮类生物合成途径中,有102个差异基因富集,其中有73.5% (75个)的差异基因在落果果柄中表达量高(图8B);在氨基酸生物合成通路中,共有251个差异表达基因富集,其中有59.8% (150个)的差异表达基因在落果果柄中表达量更高(图8C);在柠檬酸循环中,有55个差异表达基因富集,其中有74.5% (41个)的差异表达基因在落果果柄中表达量更高(图8D)。不难发现,落果果柄有超过一半的差异表达基因表达量高于正常果果柄。说明植物激素、黄酮类等次生代谢物以及柠檬酸等物质在桑葚脱落过程中发挥了重要的作用。

图8 落果与正常果果柄的代谢途径的差异表达基因热图Figure 8 Heat map of differentially expressed genes in metabolic pathways of abscised and normal surviving carpopodium
2.6 转录组测序数据的 RT-qPCR 验证
由于植物激素对于落花落果以及保花保果都具有十分重要的作用,于是在植物激素信号转导途径中筛选4 个差异十分显著的基因,分别为GH3.6 (XM_010096892.1)、bHLH78 (XM_010102492.2)、SAUR15 (XM_010113436.1)、PHO1 (XM_024169608.1)。将这4个基因的每千个碱基转录每百万映射读取的碎片值(FPKM)绘制直方图,GH3.6在落果组中的表达水平是正常果组的20多倍,bHLH78在落果组中的表达水平约为正常果组20倍,PHO1(磷转运蛋白)在落果组中的表达水平是正常果组的30多倍,SAUR15在落果组中的表达水平是正常果组的100多倍(图9A)。由此推测,这4个基因均参与了桑葚的果实脱落。为了验证转录组数据的准确性,对这4个基因进行RT-qPCR验证,结果发现:4个差异表达基因的荧光定量相对表达量的变化趋势与转录组表达趋势一致,说明该转录组数据可靠(图9B)。

图9 4 个差异表达基因的 RT-qPCR 验证Figure 9 RT-qPCR validation of four differentially expressed genes
3 讨论
近年来,为了提高果树产量,越来越多果实脱落的相关研究被报道,如番茄Lycopersicon esculentum[13]、荔枝Litchi chinensis[14]、扁桃Amygdalus communis[15]等。桑树作为一种具有重要经济价值的植物,其生理落果引起学者们的关注。2021年,有研究者对不同种类的长果桑Morus macroura的生理落果进行研究,发现高浓度的脱落酸(ABA)和乙烯(ETH)能够促进落果,而高浓度的赤霉素(GA3)和生长素(IAA)抑制落果[16]。但是,关于桑树果实脱落的分子机制还尚不清楚。
植物激素是植物生长发育过程中十分重要的物质,参与植物的落花落果,与落花落果常见的相关植物激素有IAA、GA3、细胞分裂素、ETH、ABA[17]。
IAA主要是促进植物的生长发育,抑制果实的脱落,如果生长素在运输途径中受到阻碍则会导致植物果实的脱落[18−19]。GH3.6是吲哚乙酸酰胺合成酶的基因,能够催化IAA氨基化,使生长素失活[20],这与本研究的结论一致。Small auxin-up RNA(SAUR) 基因是一类生长素早期响应基因,SAUR15能够调控植物的生长发育并参与环境胁迫响应[21]。在本研究中,SAUR15的表达水平在落果组高于正常果组100多倍,说明SAUR15基因可能参与桑葚果实脱落;ABA主要是促进果实脱落[7],这是由于ABA能够增加纤维素酶的活性进而促进果实脱落[22]。有学者通过研究无核荔枝ABA合成关键酶LcNCED与生理落果的关系,验证了ABA对于落果的作用[14];GA主要是通过作用于IAA影响果实脱落[23];ETH主要促进果实的成熟、衰老、脱落,这在多种植物中被报道,如番茄[13]等;细胞分裂素能够促进坐果,延迟果实的脱落[24]。
此外,在对落果的研究中还发现了大量的基因和转录因子的调控,如JOINTLESS[25]、LATERAL SUPPRESSOR(LS)[26]、MACROCALYX[27]主要调控离区的形成,MYB[28]、WRKY[29]、bHLH[30]、bZIP[31]等转录因子能参与植物的器官脱落。bHLH78属于bHLH转录因子,参与植物生长和代谢[32],调节花青素的生物合成[33]。本研究中,bHLH78的表达水平在落果组较高,说明其可能参与桑葚的脱落。此外,还有一些重要的酶及蛋白调控植物的器官脱落,如纤维素酶、果胶酶、多聚半乳糖醛酸酶、扩展蛋白等[34]。在本研究中,磷转运蛋白(PHO1)在落果果柄组的表达水平是正常果柄组的30多倍。此前研究表明:ABA调控依赖于PHO1的表达[35],说明PHO1基因可能参与桑葚的脱落。
4 结论
本研究GO富集分析结果显示:有4 623个基因具有催化活性,说明在果实脱落过程中,有多种重要的酶发挥催化效应;KEGG通路富集分析结果显示:大多数差异表达基因集中在黄酮类生物合成、柠檬酸循环、植物激素信号转导、氨基酸的生物合成等通路中,说明在果实脱落过程中,植物激素、糖类、次生代谢物质等发挥了重要的作用,从而调控果实的脱落。本研究筛选了4个显著的差异表达基因,均在桑葚脱落过程中参与反应,可为今后进一步研究桑树的果实脱落提供参考。
