龙葵UNUSUAL FLORAL ORGANS类SnUFO2基因C端序列的保守性对花发育的影响
2023-03-09周佳圆努尔阿斯娅伊马木崔敏龙朴春兰
周佳圆,钟 玉,努尔阿斯娅·伊马木,崔敏龙,朴春兰
(1.浙江农林大学 园艺科学学院,浙江 杭州 311300;2.乌什县农业农村局,新疆 阿克苏 843006)
花发育是植物完成生命周期的关键过程。植物从营养生长到生殖生长的转变是对环境因素和遗传因素的双重响应,为了确保子代的正常繁殖,高等植物必须在最适的环境条件下开花[1]。花发育分为成花诱导、成花启动及花器官发育共3个阶段[1]。植物通过外界环境和内源激素变化感受到开花信号,刺激茎顶端分生组织 (shoot apical meristem,SAM)转变为花序分生组织 (inflorescence meristem,IM),随后花序分生组织在花分生组织特征基因 (floral meristem identity gene)和花器官特征基因 (floral organ identity gene)的作用下形成一朵完整的花[2]。F-box蛋白是植物中最大的蛋白质超家族之一,N端存在F-box结构域,该结构域由40~60个氨基酸残基组成,能和Skp1、Cullinl (CUL1)/Cdc53和Rbxl/Rocl/Hrtl结合形成Skp1-Cullin1-F-box (SCF)复合体参与泛素化过程;C端为底物结合区域,存在不同的结构域,包括Kelch、LRR、FBD结构域等,F-box蛋白的C端决定了底物识别的特异性,根据结合底物的不同,F-box蛋白发挥不同的作用[3−5]。可见,F-box蛋白形成的SCF复合体能参与植物生命周期的各个方面,如种子萌发、花发育、自交不亲和性、生物胁迫和非生物胁迫以及光形态建成等[3, 6]。
UNUSUAL FLORAL ORGANS(UFO)基因是与花发育相关的F-box基因,是重要的花分生组织特征基因和花器官特征基因,依赖于LEAFY(LFY)基因发挥作用,并与LFY基因共同促进ABC模型中B类基因的表达,从而调控花瓣和雄蕊的发育[7−12]。除了LFY基因,UFO还能与ASK1结合形成 SCFUFO复合体对花瓣和雄蕊发育造成影响,ufo和ask1突变体都表现为花瓣和雄蕊发育不良[11]。在拟南芥Arabidopsis thaliana中UFO基因C末端区域是花瓣发育所必需的,而在百脉根Lotus japonicus和豌豆Pisum sativum中,UFO同源基因PROLIFERATING FLORAL ORGANS(PFO)和STAMINA PISTILLOIDA(STP)基因C端序列的缺失不仅对花瓣发育有影响,还对花分生组织确定性造成影响,形成次生花序[13−15]。
龙葵Solanum nigrum是茄科Solanaceae茄属Solanum的1年生草本植物,花序结构为聚伞花序[16]。目前对茄科的研究集中在番茄S.lycopersicum等经济作物上,在其他茄科植物中关于花发育的研究较为欠缺。龙葵生长周期短、植株矮小、遗传转化效率高且便于实验室栽培,是理想的研究材料。通过对龙葵花发育的研究可以丰富茄科植物花发育的研究内容,探讨UFO基因在不同物种的调控机制,为UFO基因在茄科花发育的调控方面提供理论支持。
1 材料与方法
1.1 材料
以野生型植株及其转基因植株为材料,在室温25 ℃及光周期16 h/8 h的条件下栽培,备用。
1.2 方法
1.2.1 基因序列获得 根据龙葵转录组数据筛选出SnUFO2基因序列,设计上下游引物并利用在线网站NEBcutter (http://tools.neb.com/NEBcutter/index.php3)添加酶切位点BamHⅠ和SacⅠ以及保护碱基(表1)。引物序列送杭州有康生物科技有限公司合成。
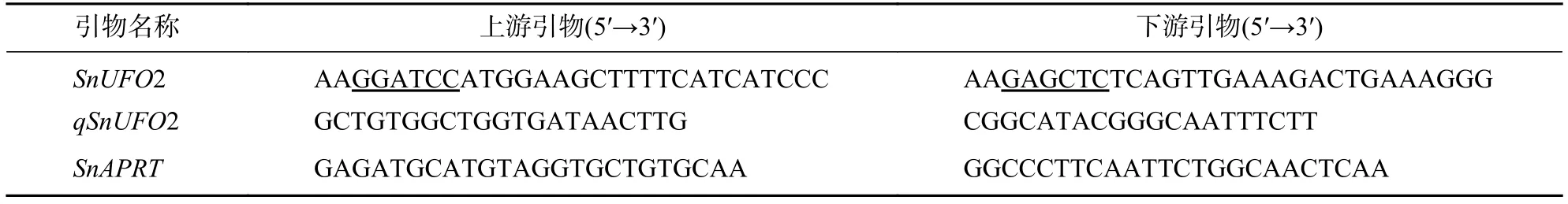
表 1 基因克隆及RT-qPCR引物列表Table 1 Gene cloning and RT-qPCR primer list
利用RNA提取试剂盒(普洛麦格生物产品有限公司,上海)提取盛花期野生型龙葵植株相同生长时期花苞的 RNA,使用EasyScript®First-Strand cDNA Synthesis SuperMix 反转录试剂盒 (全式金生物技术有限公司,北京)获得cDNA,以其为模板克隆SnUFO2基因。PCR反应程序:97 ℃预变性3 min;95 ℃变性 40 s,60 ℃ 退火 40 s,72 ℃ 延伸 1 min,35 个循环;72 ℃ 总延伸 10 min。PCR 产物进行琼脂糖凝胶电泳检测片段大小,并纯化回收目的片段。目的片段连接到pEASY Blunt simple (全式金生物技术有限公司,北京)载体后,转入大肠埃希菌Escherichia coliDH5α 感受态中(唯地生物技术有限公司,上海)。通过菌落PCR筛选阳性单菌落,摇菌送杭州擎科生物有限公司测序。测序返回数据拼接后与转录组测序序列进行比对,获得2条目的基因序列。
1.2.2 生物信息学分析 通过在线网站 Pfam (http://pfam.xfam.org/)蛋白质家族数据库进行结构域分析。将克隆得到的2条SnUFO2序列在美国国家生物信息中心(NCBI)上通过Blastx进行同源基因检索。利用MEGA7[17]进行氨基酸序列比对和系统进化树构建。进化树构建采用邻接法,Bootstrap检验1 000次。将筛选到的不同物种中UFO基因和龙葵中2条SnUFO2序列输入在线网站MEME Suite(https://meme-suite.org/meme/),选择合适的Motif数量后导出结果,并用TBtools[18]软件美化。
1.2.3 组织特异表达分析 于野生型龙葵植株盛花期取样,分别采集植株不同部位,包括根、茎、叶和花苞并提取RNA,以反转录后的cDNA为模板,进行实时荧光定量PCR反应。内参基因为龙葵的APRT基因,SnAPRT和SnUFO2*定量引物如表 1所示。根据RT-qPCR试剂盒TransStart®Tip Green qPCR SuperMix(全式金生物技术有限公司,北京)说明书设置反应体系:cDNA 1 μL,上下游引物(10 μmol·L−1)各 0.2 μL,2×TransStart®Tip Green qPCR SuperMix 5 μL,双蒸水补足至 10 μL。反应条件:95℃ 预变性 30 s;95 ℃ 变性 5 s,60 ℃ 退火 15 s,72 ℃ 延伸 10 s,共反应 45 个循环。数据计算方法采用2−∆∆Ct法计算相对表达量。
1.2.4 表达载体构建 利用BamHⅠ和SacⅠ(赛默飞世尔科技公司,上海)将目的片段和 pBI121 载体进行双酶切,纯化回收后在16 ℃下过夜连接,并转入大肠埃希菌感受态。菌落经PCR验证后,提取阳性重组质粒,通过单双酶切验证超表达载体。
1.2.5 转基因植株分子检测及形态学分析 SDS法提取转化苗基因组DNA,以野生型龙葵为对照,通过PCR检测阳性转基因植株。通过尼康相机(COOLPIX P7100)拍照记录转基因植株和花序表型变化,Leica体视显微镜(M165FC)拍照记录转基因植株花表型变化。
1.2.6 组织学染色分析 采用海氏铁矾-苏木精染色法[19],在野生型与转基因植株盛花期取 2.5 mm 左右的花苞置于FAA固定液中固定,依次经50%、60%、70%、80%、90%、95%、100%体积分数的乙醇脱水,再依次经体积梯度比1∶2、1∶1、2∶1的二甲苯无水乙醇混合液和纯二甲苯透明后,浸蜡3 d,使石蜡缓慢进入材料中,将材料包埋至蜡块中。使用Leica转轮式切片机(RM2235)切片,用苏木精染色后封片。
2 结果与分析
2.1 基因克隆与生物信息学分析
以野生型龙葵盛花期花苞的cDNA为模板,克隆得到2条SnUFO2序列,都含有F-box结构域。一条序列与转录组测序结果一致,为龙葵中SnUFO2基因,编码456个氨基酸;另一条序列为短截版的SnUFO2基因,该基因在1 294~1 295 bp处有1个碱基G的插入,导致翻译提前终止,编码433个氨基酸,记为SnUFO2*。将SnUFO2*基因、全长SnUFO2基因和不同物种中UFO的同源基因构建系统进化树。SnUFO2*、SnUFO2基因和番茄、辣椒Capsicum annuum和矮牵牛Petunia × hybrida中的UFO基因在同一进化分支,同源关系较近,而与水稻Oryza sativa,拟南芥中的UFO基因同源关系较远(图1A)。
利用MEME软件对SnUFO2*和SnUFO2蛋白进行Motif预测发现,这些蛋白相似性极高,预测到高度相似的Motif可能行使UFO蛋白最保守的功能(图1B)。SnUFO2*与其他UFO蛋白相比,Motif 8的缺失可能导致该基因的功能与其他物种中UFO基因的功能存在差异。通过氨基酸序列比对发现:SnUFO2*C末端比SnUFO2基因少了23个氨基酸,这段序列在茄科物种中高度保守,可能影响龙葵正常的花发育进程(图2)。

图1 SnUFO2*系统发育树分析及 Motif分析Figure 1 SnUFO2* phylogenetic tree analysis and Motif analysis

图2 龙葵 SnUFO2*氨基酸序列比对Figure 2 Amino acid sequence alignment of S.nigrum SnUFO2*
2.2 龙葵SnUFO2*基因的组织特性表达
UFO基因是重要的花器官特征基因,在花发育初期发挥作用。为了探究SnUFO2*基因在龙葵营养器官及生殖器官中的表达水平,提取盛花期的根、茎、叶和花苞进行RT-qPCR分析。以龙葵APRT为内参基因,RT-qPCR结果表明:SnUFO2*在根、茎、叶中的表达量低,在花苞中相对表达量较高,推测SnUFO2*基因可能主要参与花器官发育(图3)。
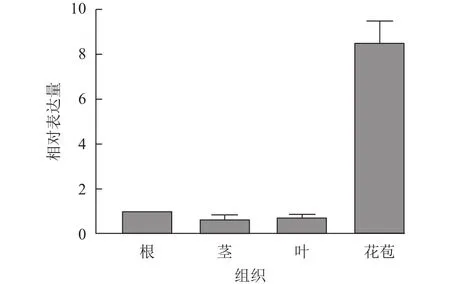
图3 野生型龙葵中 SnUFO2*不同组织部位表达量分析Figure 3 Expression analysis of SnUFO2* in different tissues of wildtype S.nigrum
2.3 龙葵转基因植株表型分析
为探究龙葵C末端缺失的SnUFO2*基因对龙葵花发育的影响,构建了SnUFO2*的表达载体,将其转入龙葵植株中,经含有卡那霉素抗性的培养基筛选后,获得40个T0代独立抗性株系,经PCR鉴定共获得31个转基因阳性株系。选择表型明显的不同株系转基因植株进行分析,转基因植株的根、茎和叶等未观察到明显变化(图4A),而花器官发育异常:野生型龙葵花盛开后,花瓣呈白色,花瓣基部相连,雄蕊紧靠雌蕊生长于花中心(图4C);弱表型转基因SnUFO2-30株系的花部分花瓣中部形成绿色条纹状组织,偶尔形成萼片状花瓣,花瓣基部裂口变大,雄蕊花药未紧靠雌蕊,杂乱分布于四周(图4B和C);强表型SnUFO2-10株系的花瓣完全萼片化,这类花最终不能形成正常的果实和种子(图4A~C)。

图4 35S::SnUFO2* 转基因植株表型图Figure 4 Phenotypic map of 35S::SnUFO2* transgenic plants
2.4 龙葵花苞组织学染色观察
为了进一步确定转基因植株花内部结构及其细胞变化,通过对野生型和SnUFO2-10转基因植株的花苞进行石蜡切片表明:野生型株系的花苞由外到内依次存在萼片、花瓣、雄蕊和雌蕊;SnUFO2-10株系花苞生成萼片状花瓣,雄蕊缺失,心皮发育异常,没有花柱和柱头产生,偶尔在发育中的心皮两侧观察到胚珠的产生(图5)。

图5 野生型及 35S::SnUFO2*转基因株系花苞石蜡切片Figure 5 Paraffin sections of flower buds of wild-type and 35S::SnUFO2 * transgenic lines
3 讨论与结论
本研究克隆了1条短截版的SnUFO2基因,探究C端序列的完整性对龙葵花发育的影响。生物信息学分析发现:SnUFO2*基因属于F-box基因家族,且C末端缺失的序列可能具有保守的功能。F-box蛋白家族通常以SCF复合体的形式参与植物各项生命活动。过往研究认为F-box蛋白的N端与SKP1类基因结合,形成SCF复合体,而C端与靶蛋白结合,通过泛素链引导至26S蛋白酶体从而降解结合蛋白[3]。基于C端序列在F-box基因中的重要作用推测,SnUFO2* C末端23个保守的氨基酸缺失可能会影响泛素化过程。
UFO及其同源基因已被证明在植物花发育过程中发挥作用[7−15]。通过RT-qPCR分析发现:SnUFO2*基因在龙葵的根、茎和叶中表达水平较低,而在花苞中表达量较高,推测该基因和其他UFO基因一样在花发育过程中发挥作用。于是构建SnUFO2*超表达载体并将其转入龙葵中。在矮牵牛中过表达DOUBLE TOP(DOT)基因会导致植株矮化,形成一朵单花[20]。然而形态学观察发现:35S::SnUFO2*转基因植株未出现矮化表型,根、茎和叶也无明显变化,但是花器官发生明显变化,萼片内侧的花瓣、雄蕊和雌蕊都被萼片状的器官代替。这与C末端缺失的UFO基因突变体表型相似,在拟南芥ufo-2突变体中,UFO基因翻译提前终止,编码262个氨基酸,产生了强烈的表型变化:生成萼片状花瓣、花丝及心皮状结构[21]。在豌豆突变体,stp-4中,STP基因只编码了252个氨基酸,导致豌豆花缺少花瓣和雄蕊,且有次生花产生[15]。黄瓜Cucumis sativus ufo突变体中,其花瓣的位置产生了叶状器官,雄蕊发育不正常[22]。以上研究表明:UFO基因的C末端对该基因的功能具有重要作用,虽然不同C末端缺失突变体表型不完全相同,但这可能与该基因短截的位点不同有关,也可能与物种特性有关。
花发育是一个受多基因调控的复杂生理过程,需要相关花分生组织特征基因和花器官特征基因的共同作用。SnUFO2-10花苞的石蜡切片结果显示:在4轮花器官形成过程中,除最外轮萼片部分形成正常外,花瓣萼片化,花分生组织不确定导致内轮不断产生增殖的萼片状器官。缺少C末端的ufo突变体的共同特征为花瓣和雄蕊的缺失或是畸形发育,例如拟南芥ufo-2花瓣萼片化及雄蕊数量减少,豌豆stp突变体表现为花瓣向萼片转化[15, 21]。其次是心皮发育异常或花分生组织的不确定性,例如金鱼草fimbriata620 (fim620)突变体产生的侧生花及花的萼片数目不确定和百脉根pfo突变体产生的不断增殖的萼片状器官[14, 23]。这些表型的出现与花器官特征基因中的B类和C类基因有关,因此推测UFO基因C端序列的缺失对该基因的功能造成影响,从而直接或间接影响B类和C类基因的正常表达。过往研究表明:SCFUFO可能促进LFY基因的转录活性,且UFO基因能与LFY共同促进B、C类基因的表达[11−12, 20−21]。我们认为:SnUFO2*可能通过SCF复合体的形式,影响LFY基因的表达进而促进相关花同源异型基因的表达,然而SnUFO2*基因C末端序列的缺失影响了SCF复合体的功能,从而影响4轮花器官的正常发育。转基因植株形成的萼片状花与lfy突变体表型相似,间接证明了这种猜想[11]。
综上所述,不仅是UFO基因的F-box结构域对其功能具有重要作用,C端序列的完整性对基因功能也极其重要。之后的研究中,观察全长SnUFO2转基因植株表型的变化,尤其是花器官发育变化,对深入探究UFO基因的功能是必要的。
