蜜环菌β-1,6-葡聚糖通过调节人源巨噬细胞极化发挥抑制结肠癌作用
2023-03-09沈丹阳王源宁周义发程海荣
任 爱,沈丹阳,王源宁,陈 磊,孙 琳,周义发,程海荣
(东北师范大学 生命科学学院,长春 130024)
目前, 结直肠癌已成为世界第三大常见癌症,平均每年新增病例约200万[1].治疗结肠癌的方法主要有手术、放疗、化疗和免疫疗法.其中免疫疗法因其高效、副作用低等优势已引起人们广泛关注[2].巨噬细胞在免疫系统中发挥重要作用,既作为固有免疫应答细胞,又作为免疫调节细胞,可诱导、抑制或调节适应性免疫反应,参与器官发育、宿主防御、急慢性炎症、感染和代谢等各种生理病理过程[3].肿瘤组织中浸润大量的巨噬细胞,称为肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs).巨噬细胞具有较强的可塑性,有两种常见亚型: 1) M1型巨噬细胞即经典激活巨噬细胞,具有较强的抗原提呈能力,可促进炎症反应、产生大量促炎因子,如TNF-α,IL-6和IL-1β等,上调M1型巨噬细胞标志物表达如CD80,CD86,iNOS等[4];2) M2型巨噬细胞, 是选择性活化巨噬细胞,能抑制炎症反应,促进血管生成[5],可产生大量的抑炎因子,如TGF-β,IL-4,IL-10等,以及上调M2型巨噬细胞标志物表达,如Arg-1,Ym-1,Fizz-1和CCL18等.在肿瘤微环境中,TAMs主要表现为M2型.研究表明,M2和M1 的比值与肿瘤的愈后呈明显相关性.因此,诱导M2型巨噬细胞向M1型极化对抑制肿瘤生长具有重要意义.
多糖具有调节免疫[6]、抗肿瘤[7]、抗病毒[8]、抗炎[9]和抗氧化[10]等多种生物活性.多糖可促进促肿瘤生长的M2型巨噬细胞向抑制肿瘤生长的M1型巨噬细胞极化.其中,酵母β-葡聚糖可促进TAMs转化为M1型巨噬细胞,并已应用于神经母细胞瘤患者的Ⅰ期临床试验中[11];姬松茸多糖可提高M2型巨噬细胞中TNF-α,NOS2,IL-12和IL-6的表达,即向M1表型转化[12];猪苓多糖可显著增加炎症相关因子的表达,将M2型巨噬细胞转化为M1型巨噬细胞[13].
蜜环菌(Amillariellamellea)属担子菌门伞菌目泡头菌科,是一种在我国分布广泛的食用菌.文献[14]从蜜环菌子实体中通过乙醇分级醇沉分离得到一种β-1,6-葡聚糖并命名为 AAMP-A70,其分子量为5 600.研究表明,AAMP-A70能够上调小鼠单核巨噬细胞RAW264.7中NO,ROS,IL-1β,TNF-α和IL-6的表达,同时也可将小鼠单核巨噬细胞RAW264.7从M2型转化为M1型, 进而抑制结肠癌细胞HCT116的增殖[15].在此基础上,本文采用人源单核巨噬细胞THP-1研究AAMP-A70对M2型巨噬细胞极化的影响,并分析该极化作用对人源结肠癌细胞DLD-1增殖和凋亡的影响.研究结果可丰富β-1,6-葡聚糖诱导巨噬细胞极化的研究,同时为β-1,6-葡聚糖作为抗肿瘤药物的开发提供理论基础.
1 材料与方法
1.1 材 料
1.1.1 实验材料
人源单核细胞THP-1和人源结肠癌细胞DLD-1均购于美国模式培养物集存库(ATCC).蜜环菌均一级分AAMP-A70,参考文献[13]制备.
1.1.2 主要试剂
DMEM高糖培养基和RPMI-1640培养基购于美国Gibco公司;IL-4,IL-13和IFN-γ购于美国MCE公司;脂多糖(LPS)和佛波酯(PMA)购于美国Sigma公司;PARP,Pro-casepase-3和Cleaved-Casepase-3抗体购于美国Cell Signaling Technology公司;胎牛血清购于浙江天杭生物科技股份有限公司;ELISA试剂盒购于武汉博士德生物工程有限公司;胰酶、二甲亚砜(DMSO)和结晶紫购于北京索莱宝科技有限公司;TRNzol试剂和反转录试剂盒购于天根生化科技(北京)有限公司;磺胺和萘胺购于天津光复精细化工研究所.
1.1.3 主要实验仪器
多功能酶标仪(SPARK 10M型,瑞士Tecan公司); NanoDrop微量分光光度计(ND-ONE-W型,美国Thermo Fisher Scientific公司); 实时荧光定量PCR仪(聚合酶链式反应,qRT-PCR, LightCycler480Ⅱ型,瑞士Roche公司);电泳仪(JY600E型,北京君意东方电泳设备有限公司);垂直电泳槽(VE-180型)、转移电泳槽(VE-186型)和化学发光分析系统(4600型)均购于上海天能科技有限公司.
1.2 方 法
1.2.1 巨噬细胞极化实验
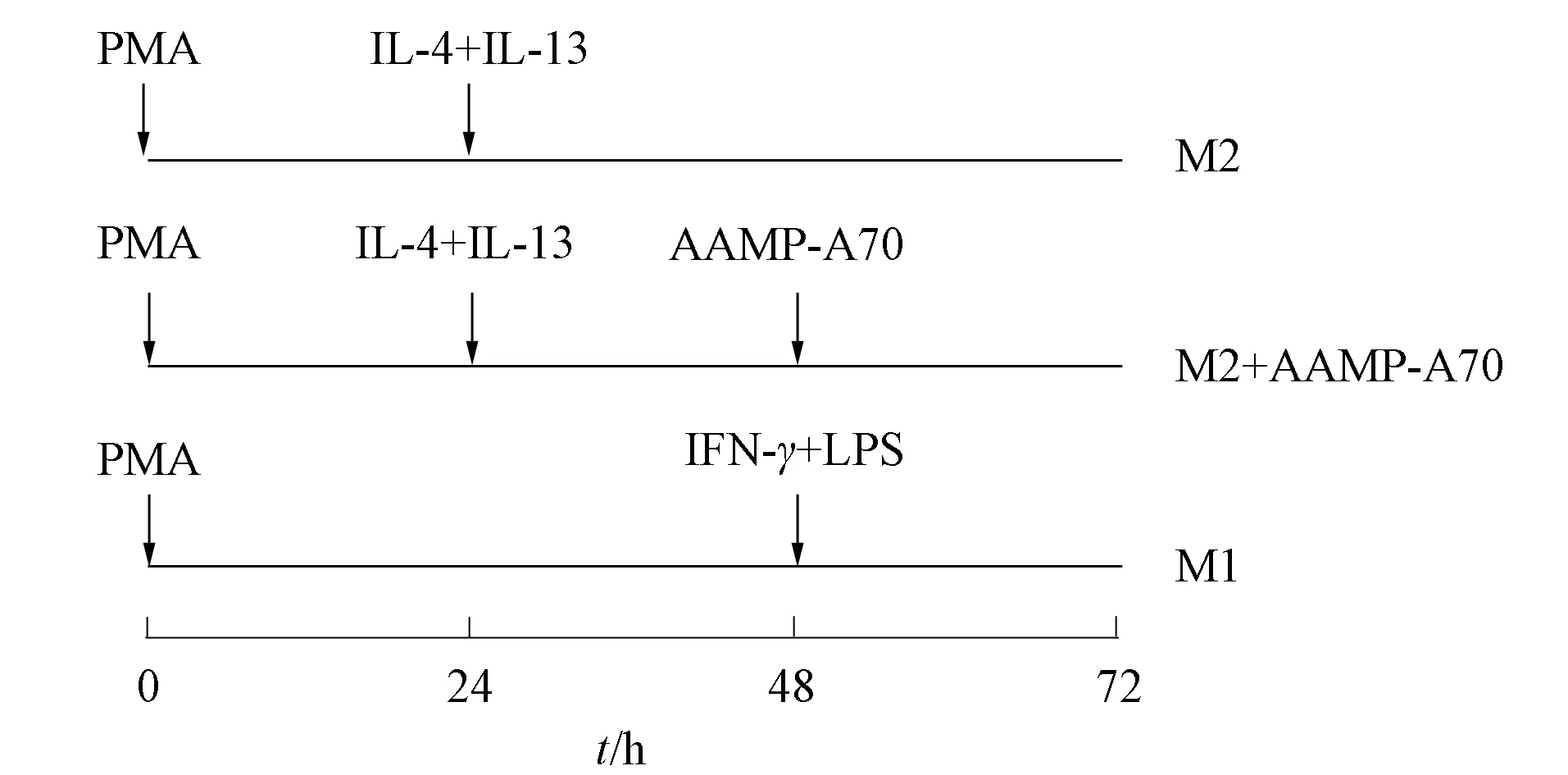
图1 THP-1细胞诱导为M1和M2型巨噬细胞及 AAMP-A70处理M2型巨噬细胞示意图Fig.1 Schematic diagram of induction of THP-1 cells into M1 and M2-like macrophages and AAMP-A70 treatment of M2-like macrophages
THP-1按1.6×106个/孔铺于6孔板中,采用100 ng/mL PMA处理THP-1细胞24 h即可将其诱导为M0型巨噬细胞.向该M0型巨噬细胞中加入20 ng/mL的 IL-4和IL-13再诱导24 h,即可诱导为M2型巨噬细胞.在THP-1细胞培养基中加入100 ng/mL PMA孵育 48 h后,再加入20 ng/mL的IFN-γ和100 ng/mL 的LPS,即可诱导为M1型巨噬细胞.AAMP-A70处理组(M2+AAMP-A70组)在将THP-1细胞诱导为M2型巨噬细胞24 h后,加入200 μg/mL AAMP-A70,继续培养24 h,其示意图如图1所示.
1.2.2 酶联免疫吸附(ELISA)实验
取细胞上清液按1∶100(体积比,下同)稀释后按100 μL/孔加入酶标板中,于37 ℃孵育90 min后,弃去液体;每孔加入 100 μL稀释后的抗体,37 ℃孵育60 min后,弃去液体;用洗涤液洗涤5次,每次1 min.每孔加入 100 μL 稀释后的ABC抗体,37 ℃孵育30 min后,弃去液体,用洗涤液洗涤5次,每次1 min.每孔加入90 μL的3,3′,5,5′-四甲基联苯胺(TMB)显色液,充分显色后,加入100 μL终止液.采用酶标仪在 450 nm 处检测各孔吸光值,TNF-α及VEGF相对释放量=(AM1组,M2组或M2+AAMP-A70组/AM1组)×100%.
1.2.3 实时荧光定量PCR(qRT-PCR)
向每组细胞中加入1 mL TRNzol试剂提取mRNA,采用反转录试剂盒对mRNA进行反转录,使用NanoDrop分光光度计测定cDNA浓度和纯度.根据qRT-PCR试剂盒的说明书进行实时定量PCR扩增.反应程序为: 95 ℃,5 min;反应40个循环,每个循环为95 ℃,10 s;58 ℃,10 s;72 ℃,10 s.引物由生工生物工程(上海) 股份有限公司合成,合成引物序列如下:
TNF-α,Forward: 5′-TGGAGCTGGCCGAGGAG-3′,
Reverse: 5′-AGCAGGCAGAAGAGCGTGG-3′;
Arg-1,Forward: 5′-TGGACAGACTAGGAATTGGCA-3′,
Reverse: 5′-CCAGTCCGTCAACATCAAAACT-3′;
IL-1β,Forward: 5′-AATCTGTACCTGTCCTGCGTGTT-3′,
Reverse: 5′-TGGGTAATTTTTGGGATCTACACTCT-3′;
TGF-β,Forward: 5′-CCCTGGACACCAACTATTGC-3′,
Reverse: 5′-GCAGAAGTTGGCATGGTAGC-3′;
CCR7,Forward: 5′-AGTCTTCCAGCTGCCCTACA-3′,
Reverse: 5′-TCGTAGGCGATGTTGAGTTG-3′.
1.2.4 结晶紫染色实验
采用1.2.1的方法给药后,取诱导后的M2组、M2+AAMP-A70组和M1组THP-1细胞,弃去培养基,加入无血清培养基继续培养24 h.收集细胞培养上清液,并加入胎牛血清调整至终体积分数为5%.将体积分数为75%的培养上清液(conditioned medium,CM)加至DLD-1细胞中,于细胞培养箱中培养72 h后,弃培养上清液,每孔加入500 μL无水甲醇,于室温中静置5 min后,再加入500 μL结晶紫试剂,于室温中染色5 min.弃染色液后流水冲洗,去除多余染色液,室温晾干后拍照.
1.2.5 MTT实验
将DLD-1细胞按1×104个/孔铺于96孔板中.按1.2.4方法收集的各组上清液以不同浓度加至DLD-1中培养72 h后,弃去上清液.每组加入0.5 mg/mL MTT溶液100 μL,于37 ℃孵育4 h后,每组加入含0.04 mol/L HCl的质量分数为20%的十二烷基硫酸钠(SDS)溶液50 μL,于37 ℃培养箱中培养12 h后,采用酶标仪于570 nm处测各孔吸光值.
1.2.6 Western-blot实验
提取各上清液处理后的DLD-1细胞中的总蛋白,并进行蛋白定量.采用质量分数为12%丙烯酰胺凝胶分离蛋白样品,先将蛋白转至聚偏二氟乙烯(PVDF)膜上,再用脱脂牛奶封闭后,采用磷酸盐缓冲液(PBST)洗涤.加入按1∶1 000稀释的一抗工作液,置于4 ℃摇床中孵育过夜.洗涤后加入按1∶5 000稀释的二抗工作液,室温孵育1 h,采用PBST洗涤.将增强型化学发光剂(ECL)均匀滴于PVDF膜上,采用化学发光仪检测凋亡相关蛋白的表达.
1.2.7 统计学分析
所有实验数据用SPSS 19.0软件进行统计学分析,结果均以平均值±标准差的形式(SD)表示.两组数据的显著性用t检验进行比较.当p<0.05时,表示差异显著,表明该结果具有统计学意义.*表示p<0.05,**表示p<0.01,***表示p<0.001.
2 结果与讨论
2.1 AAMP-A70对M2型人源巨噬细胞极化的影响
2.1.1 AAMP-A70对M2型人源巨噬细胞TNF-α和VEGF释放量的影响
M1型巨噬细胞高表达促炎因子(如TNF-α和IL-6等),产生的VEGF量较低;而M2型巨噬细胞则相反.研究表明,当AAMP-A70质量浓度为200 μg/mL时,其诱导RAW264.7小鼠单核巨噬细胞活化的能力较强[14-15].因此,本文采用200 μg/mL 的AAMP-A70处理THP-1细胞诱导的M2型巨噬细胞,并采用ELISA方法检测TNF-α和VEGF的相对含量.结果表明,M2型巨噬细胞TNF-α分泌量较低,VEGF分泌量较高,即已诱导出M2型巨噬细胞.采用AAMP-A70处理M2型巨噬细胞后,TNF-α分泌量显著增加(p<0.001),VEGF含量显著降低,表明AAMP-A70可促进M2型巨噬细胞向M1型极化,如图2所示.
2.1.2 AAMP-A70对M2型人源巨噬细胞特异性标志蛋白mRNA表达的影响
研究表明, M1型巨噬细胞高表达TNF-α,IL-1β和CCR7的mRNA,低表达Arg-1和TGF-β的mRNA,M2型巨噬细胞相反.本文采用qRT-PCR方法在转录水平上检测AAMP-A70对M2型人源巨噬细胞特异性标志蛋白的mRNA表达的影响,结果如图3所示.由图3可见,M2型巨噬细胞低表达TNF-α,IL-1β和CCR7的mRNA,高表达Arg-1和TGF-β的mRNA.AAMP-A70处理的M2型巨噬细胞具有 M1型巨噬细胞的特征,即TNF-α,IL-1β和CCR7的mRNA表达量显著增加,Arg-1和TGF-β的mRNA表达量显著降低.因此AAMP-A70可显著促进M2型巨噬细胞向M1型极化.
2.2 AAMP-A70通过促进M2型巨噬细胞向M1型极化抑制结肠癌细胞的增殖
研究表明,AAMP-A70对人结肠癌细胞DLD-1、人结肠癌细胞HCT116及小鼠结肠癌细胞CT26的增殖均无直接抑制作用.本文采用结晶紫染色实验和MTT实验检测AAMP-A70促进M2型巨噬细胞向M1型极化是否能够抑制结肠癌细胞的增殖.通过镜下观察和结晶紫染色,结果分别如图4和图5所示.由图4和图5可见,M1型巨噬细胞培养液可显著抑制DLD-1细胞的增殖,M2型巨噬细胞培养液处理组的DLD-1细胞无明显变化,AAMP-A70处理的M2型巨噬细胞培养液的DLD-1细胞增殖明显减少.
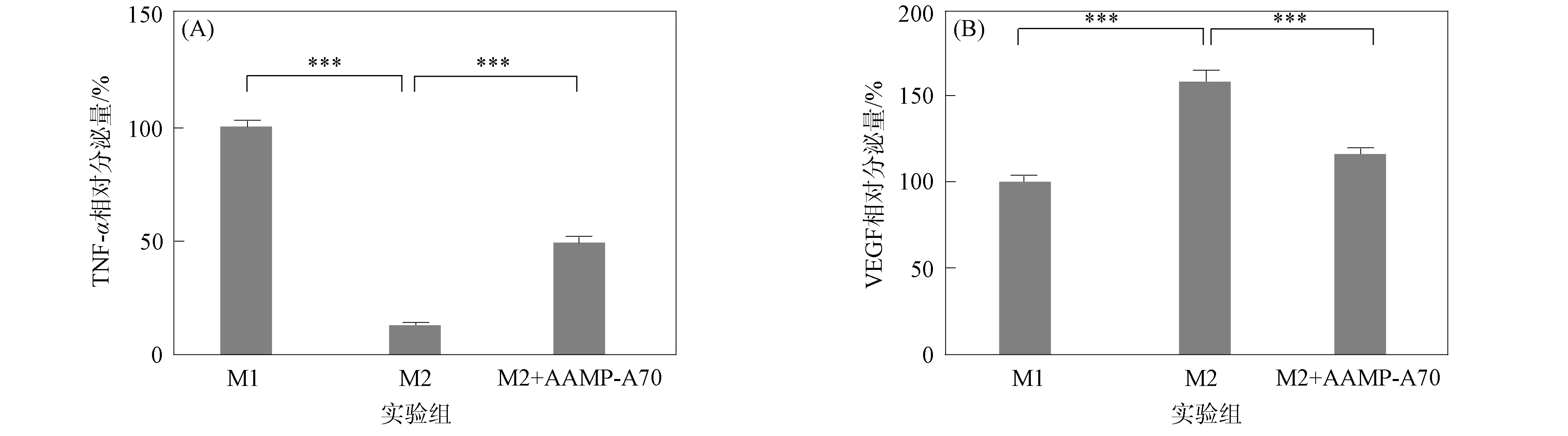
***表示p<0.001.图2 AAMP-A70对M2型人源巨噬细胞TNF-α(A)和VEGF(B)释放量的影响Fig.2 Effects of AAMP-A70 on TNF-α (A) and VEGF (B) production released by human M2-like macrophages

**表示p<0.01; ***表示p<0.001.图3 AAMP-A70对M2型人源巨噬细胞极化相关特异性标志蛋白mRNA表达的影响Fig.3 Effects of AAMP-A70 on expression of polarization related specific marker protein mRNA of M2 human macrophages
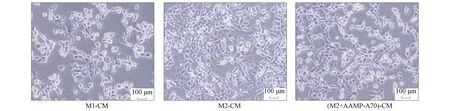
图4 DLD-1细胞形态Fig.4 DLD-1 cell morphology
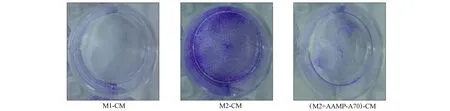
图5 结晶紫染色实验结果Fig.5 Experimental results of crystal violent staining
采用MTT实验检测各组不同浓度的巨噬细胞培养液对DLD-1细胞增殖的影响,结果如图6所示.由图6可见,不同体积分数的M1型巨噬细胞培养液均可显著抑制DLD-1细胞的增殖(p<0.001),不同体积分数的M2型巨噬细胞培养液对DLD-1细胞的增殖均无影响(p>0.05),AAMP-A70处理的M2型巨噬细胞培养液随浓度的增加对DLD-1细胞增殖的抑制作用逐渐增强.因此AAMP-A70可通过促进M2型巨噬细胞向M1型极化,从而抑制结肠癌细胞DLD-1的增殖.
2.3 AAMP-A70通过促进M2型巨噬细胞向M1型极化促进结肠癌细胞的凋亡
将M1,M2和M2+AAMP-A70组巨噬细胞培养上清液与结肠癌细胞DLD-1共培养72 h后,提取细胞总蛋白,并采用Western-blot实验检测凋亡相关蛋白PARP和Caspase-3的表达情况,结果如图7所示.由图7可见: M1型巨噬细胞培养液可显著促进凋亡相关蛋白PARP和Caspase-3水解,即cleaved-PARP和 cleaved-Caspase-3表达;M2型巨噬细胞培养液处理DLD-1对凋亡相关蛋白无明显影响;AAMP-A70处理M2型巨噬细胞的培养液可显著上调PARP和Caspase-3水解.因此AAMP-A70可通过促进M2型巨噬细胞向M1型转化诱导DLD-1发生明显细胞凋亡.
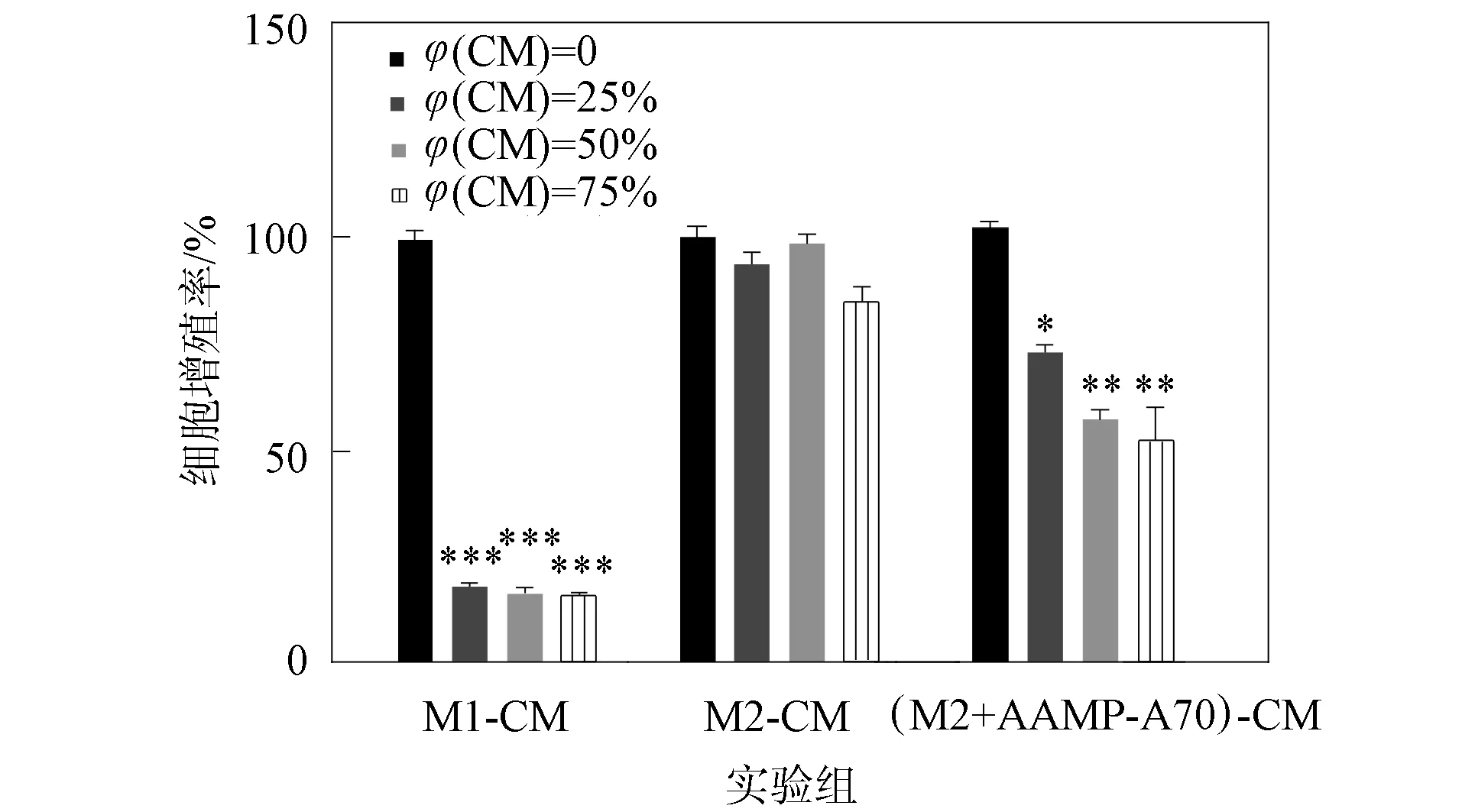
*表示p<0.05; **表示p<0.01; ***表示p<0.001.图6 MTT实验结果Fig.6 Experimental results of MTT
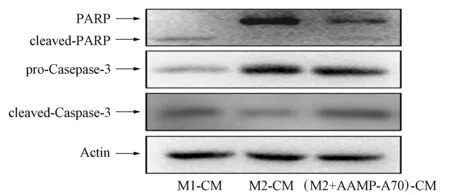
图7 AAMP-A70处理的M2型巨噬细胞 培养液对结肠癌细胞DLD-1凋亡 相关蛋白表达的影响Fig.7 Effect of M2-like macrophage culture medium treated with AAMP-A70 on expressions of apoptotic- related proteins DLD-1 in colon cancer cells
综上所述,AAMP-A70可促进由THP-1诱导的M2型巨噬细胞高表达M1型特异性标志分子TNF-α,IL-1β和CCR7,并抑制M2型特异性标志分子Arg-1,VEGF和TGF-β的表达,表明AAMP-A70可抑制M2型巨噬细胞向M1极化.此外,AAMP-A70可通过促进巨噬细胞极化抑制结肠癌细胞DLD-1的增殖,诱导其凋亡.
