真皮干细胞SKPs对银屑病样小鼠模型治疗作用分析
2023-03-09陈小凤许凤丽熊霞钟建桥
陈小凤,许凤丽,熊霞,钟建桥
银屑病是一种慢性、复发性、炎症性疾病,严重影响患者身心健康[1-2]。目前该病确切病因病机尚未完全阐明,但研究认为免疫炎症和氧化应激在银屑病的发病中起着重要促进作用[3-4]。现今针对银屑病的治疗药物很多,但因其不良反应多、长期疗效不确切、费用昂贵等而受限制[5]。皮肤源性前体细胞(skin-derived precursors,SKPs)是真皮来源的干细胞,具有抗炎、抗氧化、促进创伤组织修复等作用,已用于炎症性、创伤性、氧化应激相关疾病等多种疾病的治疗[6-7],但关于其在银屑病方面的研究至今尚未见报道。故为探索SKPs对银屑病的治疗作用,本实验通过构建银屑病样动物模型,经SKPs干预后,观察其相关指标的变化,进一步为SKPs治疗银屑病提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 BALB/c雄性无毛小鼠购自成都达硕实验动物有限公司[许可证编号:SCXK(川)2015-030],为4周大小,体重约16~18 g。饲养于西南医科大学城北动物实验中心SPF级实验室,使用消毒垫料、酸化水及无菌饲料,室内温度为18 ℃~24 ℃、湿度为40%~70%,采光为12 h明暗交替。本研究已通过西南医科大学实验动物伦理委员会的批准(批准号:20220704-005)。
1.1.2实验细胞 SKPs取材于新生1~3 d的BALB/c雄性乳鼠真皮(购自成都达硕实验动物有限公司)。
1.1.3主要试剂 咪喹莫特乳膏(imiquimod,IMQ)(四川明欣药业有限责任公司);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、过氧化氢酶(catalase,CAT)试剂盒(南京建成科技有限公司);ROS、IL-17、IL-23试剂盒(北京安迪华泰科技有限公司)。
1.2实验方法
1.2.1SKPs体外分离培养与鉴定 参照课题组前期的实验方法[8-9],取新生1~3 d的BALB/c乳鼠,用碘伏浸泡处死乳鼠,75%酒精反复脱碘、消毒、PBS冲洗后,取背部皮肤去除皮下脂肪、血管,用眼科剪将皮肤剪成0.5 cm2大小,加入0.25%的胰酶(美国Gibco Life Technologies),放入37 ℃、5% CO2孵箱中消化30 min后,分离表皮和真皮,弃表皮。将真皮反复剪碎、吹打、静置,吸取上清液过滤、离心后弃去上清液,加入含20 ng/mL表皮生长因子(epidermal growth factor,EGF)、40 ng/mL成纤维细胞生长因子(fibroblast growth factor,FGF)、2% B27的无血清培养基重悬细胞,然后置于37 ℃、5% CO2的培养箱中培养。定期观察细胞生长情况并换液,直至细胞生长成熟以备用。本实验组在前期研究中已对该细胞进行鉴定[7],已证实为SKPs。
1.2.2银屑病样鼠模型的构建与分组 于小鼠背部皮肤涂抹5%的IMQ乳膏62.5 mg/d,面积约3 cm×4 cm,1次/d,连续涂抹6 d,以构建银屑病样小鼠模型。同时以凡士林为对照,方法同上述。小鼠皮肤出现银屑病典型皮损和病理改变,则提示造模成功。将20只小鼠随机分成4组(每组5只),即模型组(仅外用IMQ)、治疗组(外用IMQ+皮内注射SKPs)、对照组(外用IMQ+皮内注射培养基)和凡士林组(仅外用凡士林)。
1.2.3SKPs干预银屑病样鼠模型 按上述模型构建方法对前三组即模型组、治疗组和对照组小鼠背部皮肤外涂IMQ乳膏,凡士林组外涂凡士林乳膏。在涂抹IMQ第1天,将1.2.1部分培养的SKPs用Hanks液重悬制成浓度1×104个/100 μL的细胞悬液,取100 μL SKPs悬液分6点皮内注射(即背部皮肤的中央部位注射1点,周围皮肤分别均匀注射5点)到治疗组小鼠背部皮肤(仅第1天注射),随后再连续涂抹IMQ 5 d;对照组在首次涂抹IMQ后,将100 μL Hanks液同前方法注射到小鼠背部皮肤,然后继续涂抹IMQ 5 d。模型组和凡士林组仅分别涂抹IMQ或凡士林共6 d。肉眼观察皮损变化,采用银屑病面积与严重指数(psoriasis area and severity index,PASI)对皮损评分;第7天,称重后处死小鼠,分离小鼠脾脏称重后计算脾脏体重指数(splenic index,SI);收集小鼠血液及背部皮肤进行相关实验室指标检测。
1.2.4PASI评分与SI计算 肉眼观察小鼠背部皮肤红斑、鳞屑、浸润情况,行PASI评分,分别为0~4分(0分=无;1分=轻度;2分=中度;3分=重度;4分=极重度)。每天观察并拍照,将三者得分相加为PASI总分(0~12分),各组小鼠皮损积分取平均值。处死小鼠前称其体重,处死后取脾脏观察脾脏大小并称重,计算SI,SI=脾脏重量(mg)/小鼠体重(g)。
1.2.5病理组织学检测 取小鼠背部皮肤行苏木精-伊红(hematoxylin-eosin,HE)染色。即将各组皮肤组织置于4%多聚甲醛溶液中固定后,放于循环机中脱水、浸蜡12 h,然后进行石蜡包埋、切片、HE染色、中性树脂封片,最后置于显微镜下观察各组皮肤病理组织学变化。
1.2.6炎症及氧化应激相关指标检测 实验结束后取各组小鼠全血分离获得血清。采用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测血清中SOD、GSH、MDA、ROS、CAT、IL-17、IL-23等炎症因子和相关氧化应激指标的蛋白表达水平。具体操作步骤按说明书进行,最后在酶标仪不同波长处读出吸光度OD值,参照标准曲线计算出待测指标值。
1.2.7实时荧光定量核酸扩增检测系统(real-time quantitative PCR detecting system,qPCR) 将各组小鼠背部皮肤组织分别研碎,采用Trizol提取皮肤组织总RNA,经反转录酶体系将总RNA反转录成cDNA。然后将制备好的cDNA在扩增体系下进行PCR扩增,检测基因MAPK、NF-κB、SOD、GSH、iNOS、ROS、CAT、IL-17、IL-23的引物序列见表1。以GAPDH基因作内参,应用F=2-△△Ct进行相对定量分析。

表1 各基因引物序列Tab.1 The primer sequences of the genes
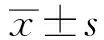
2 结果
2.1SKPs的形态及特征 原代培养的SKPs在培养基中呈悬浮生长,外观表现为椭圆形或圆形、大小不一的克隆样细胞球,其边缘明亮,而中央略暗(图1)。

×100;×400图1 SKPs原代培养Fig.1 Primary culture of SKPs
2.2SKPs改善银屑病样鼠外观和降低PASI评分 模型组小鼠背部皮肤浸润明显,可见红斑、斑块及大量厚层鳞屑,随着造模时间延长,皮损逐渐加重,PASI评分逐渐升高,于第7天达高峰,总分为11分(图2a,图3);但经SKPs干预后,治疗组随着时间延长,皮损较模型组及对照组明显减轻,仅见片状红斑和少许鳞屑,轻度浸润,PASI评分总分为5分(图2b,图3);对照组皮肤表现与模型组相似,PASI评分总分为10.8分(图2c,图3);凡士林干预后其皮肤外观同正常小鼠,皮肤光滑,无红斑、鳞屑、浸润等,PASI评分为0分(图2d,图3)。
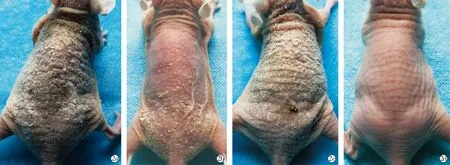
Model group;Treatment group;Control group;Vaseline group图2 各组小鼠皮肤外观表现Fig.2 Skin appearance of mice in different groups
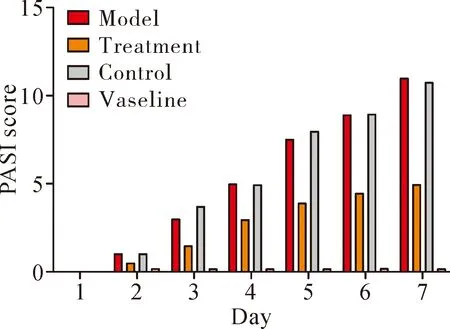
图3 随着时间的变化各组小鼠皮肤的PASI评分Fig.3 The PASI score of mice in different groups along with time variation
2.3SKPs减轻组织病理学表现 模型组小鼠经IMQ干预后其皮肤在病理上表现为角化过度、角化不全、角质层、棘层明显增厚,颗粒层变薄或减少、表皮突下移,真皮可见大量炎症细胞浸润(图4a)。但经SKPs移植后,治疗组镜下表皮仅轻度角化过度,未见角化不全,角质层及棘层厚度明显减少,颗粒层细胞增多,真皮层仅见少许炎症细胞浸润(图4b);对照组病理组织学表现与模型组相似(图4c);凡士林组则表现为皮肤组织结构清晰、层次分明,角质层和棘层无增厚,颗粒层无减少,真皮层未见明显炎症细胞浸润(图4d)。
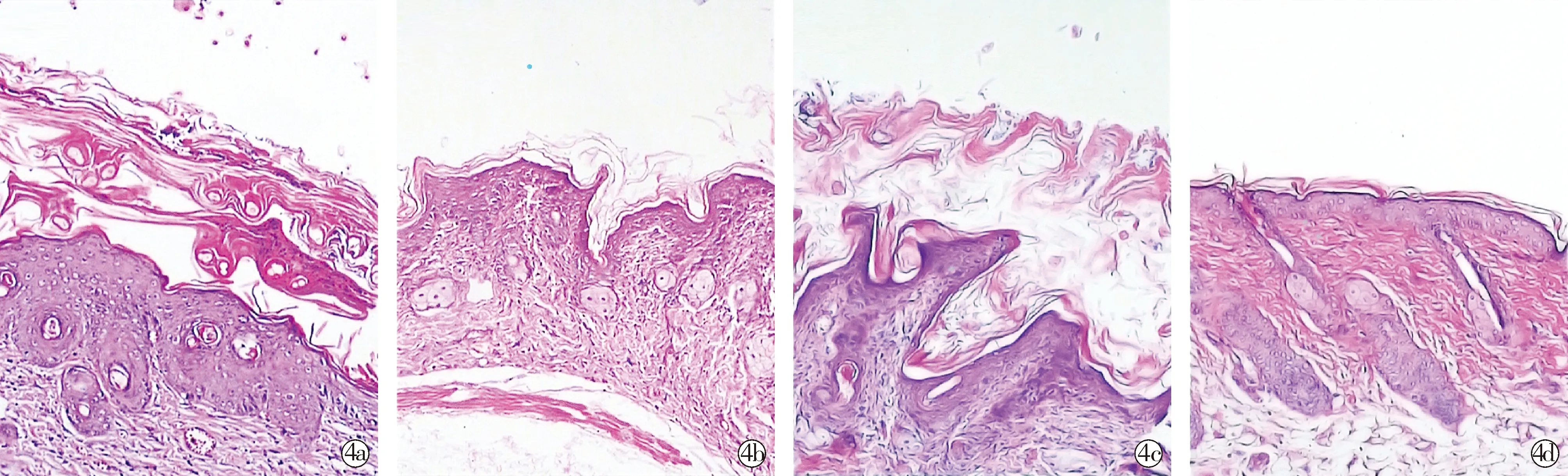
Model group;Treatment group;Control group;Vaseline group图4 各组小鼠组织病理学表现 (HE×100)Fig.4 Histopathological manifestations of mice in each group (HE×100)
2.4SKPs减轻脾脏肿大和降低SI 模型组脾脏增大明显,SI较凡士林组明显升高(P<0.05);而经SKPs注射后,其脾脏缩小,SI较模型组及对照组显著降低(P<0.05);对照组脾脏大小与模型组相似,SI与模型组比较差异无统计学意义(P>0.05);而凡士林组脾脏无增大(图5)。
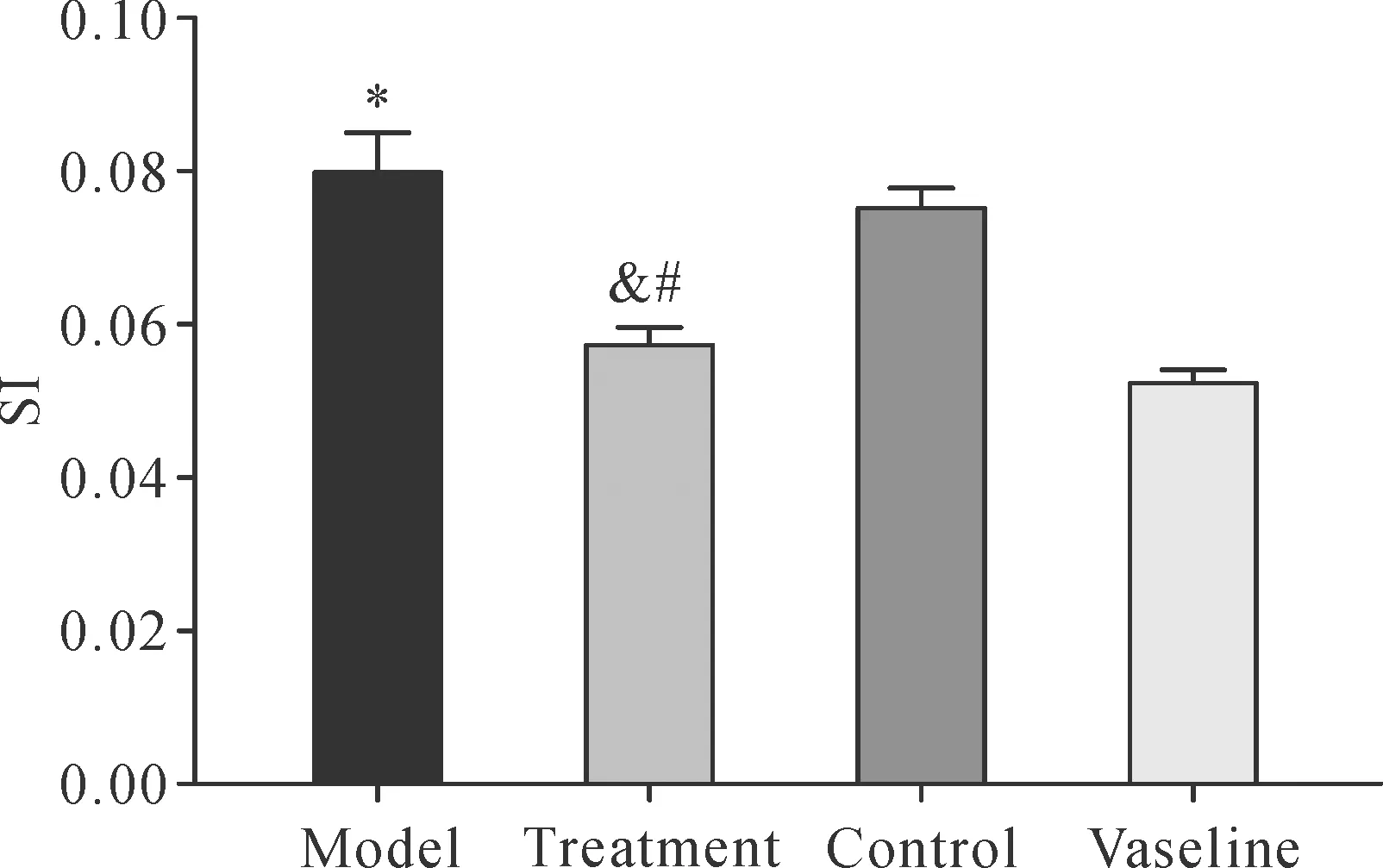
Note:Compared with the vaseline group,*P<0.05;compared with the model group,&P<0.05;compared with the control group,#P<0.05.图5 各组SI变化Fig.5 Alterations of SI in different groups
2.5SKPs调节炎症及氧化应激相关指标水平 经IMQ涂抹后,模型组血清中MDA、ROS及炎症因子IL-17、IL-23水平均较凡士林组升高,而SOD、GSH和CAT等抗氧化物水平下降(P<0.05);但经SKPs注射后,治疗组血清中MDA、ROS、IL-17、IL-23表达水平显著下调,SOD、GSH、CAT表达水平显著升高,较模型组和对照组差异有统计学意义(P<0.05);而对照组与模型组比较差异无统计学意义(P>0.05),见图6。
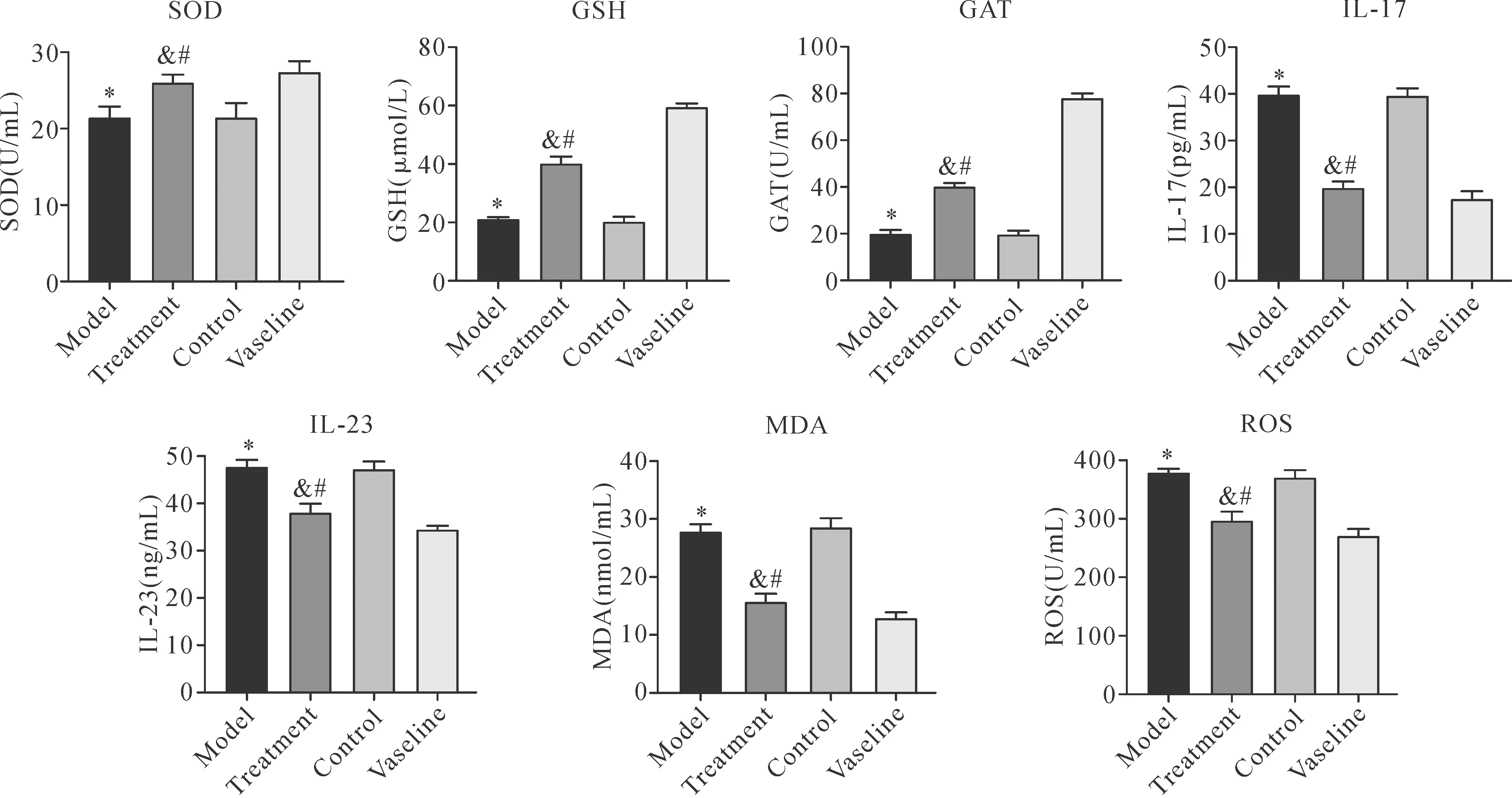
Note:Compared with the vaseline group,*P<0.05;compared with the model group,&P<0.05;compared with the control group,#P<0.05.图6 各组炎症因子及氧化应激相关指标的蛋白表达水平Fig.6 Protein expression levels of inflammatory/oxidative stress-related indicators in different groups
2.6SKPs调节炎症及氧化应激相关指标的基因表达 模型组表达MAPK、NF-κB、iNOS、ROS、IL-17、
IL-23的mRNA水平较凡士林组明显升高,而SOD、GSH、CAT的mRNA水平较凡士林组下降(P<0.05)。但经SKPs干预后,治疗组MAPK、NF-κB、iNOS、ROS、IL-17、IL-23的mRNA表达水平明显降低,SOD、GSH、CAT的mRNA水平显著升高,与模型组和对照组比较差异有统计学意义(P<0.05)。然而,对照组与模型组比较差异无统计学意义(P>0.05),见图7。

Note:Compared with the vaseline group,*P<0.05;compared with the model group,&P<0.05;compared with the control group,#P<0.05Inflammatory related genes;Oxidative stress-related genes图7 各组炎症因子及氧化应激相关指标的基因表达Fig.7 Relative expression of inflammatory/oxidative stress-related genes in different groups
3 讨论
银屑病是一种慢性、炎症性疾病,可能与遗传、免疫、环境、感染等因素相关[10]。而免疫炎症和氧化应激在银屑病的发病中起着关键促进作用。研究表明,炎症相关因子IL-17、IL-23和TNF-α等在银屑病中明显升高[11];同时iNOS和ROS等氧化物生成增多,而抗氧化物质如SOD、GSH等活性下调,激发氧化应激,进一步激活MAPK、NF-κB等信号通路,产生一系列炎症因子如IL-17、IL-23和TNF-α等,进而促进角质形成细胞过度增殖及真皮炎症细胞浸润,最终导致银屑病的发生发展[12-13]。近年来干细胞因具有抗炎、抗氧化、促进组织修复等作用而日益备受关注。而真皮干细胞SKPs通过上调抗氧化物活性和下调氧化产物的表达,从而在多种疾病中发挥抗炎、抗氧化的作用[14-15]。
因此,本研究为观察SKPs对银屑病的疗效,首先进行了银屑病样动物模型的构建。目前关于银屑病动物模型的构建方法较多,其中IMQ直接诱导法是十分常用的造模方法,已广泛用于银屑病的临床前研究[16-17],故本实验采用了局部涂抹IMQ建立银屑病样小鼠模型。笔者发现,经IMQ干预后小鼠背部皮肤出现典型的厚层鳞屑覆盖的红斑/斑块;PASI评分逐渐增加,于第7天达高峰;组织病理学出现角化过度/角化不全、棘层明显增厚、颗粒层变薄或减少,真皮炎症细胞浸润等。其小鼠皮肤外观和病理表现类似人银屑病表现。同时随着IMQ的干预,SI、炎症因子及氧化物水平升高,而抗氧化物活性降低,表明IMQ的应用不仅促使银屑病样症状出现,而且能引起炎症反应和氧化发生,这些变化与既往文献报道的一致[18-19]。因此,证实了本研究已成功构建出银屑病样小鼠模型,并处于炎症和氧化应激状态,与银屑病的发病机制吻合。
在成功建立银屑病样模型鼠的基础上,笔者予以了SKPs进行干预。结果发现,经SKPs局部移植可明显减轻银屑病样症状和组织病理学改变、降低PASI评分,而对照组Hanks液则无此作用;表明SKPs对银屑病样鼠具有较好的治疗效果。同时SKPs可显著降低银屑病样模型鼠的炎症因子IL-17、IL-23和氧化物MDA、ROS的蛋白基因水平,促进抗氧化物SOD、GSH等表达。提示SKPs治疗实验性银屑病可能是通过抑制炎症和拮抗氧化应激而作用,这尤其与SKPs抗炎和抗氧化的活性密切相关。该结果与课题组前期研究以及其他学者报道相符[15,20]。他们通过实验发现SKPs能显著上调光损伤模型鼠SOD、GSH等表达,降低ROS、MDA等水平;抑制炎症环境中IL-17分泌型T细胞的生成和促进调节性T细胞活化,进而起到抗氧化、抗炎、调节免疫的作用。
在初步证实了SKPs通过抗炎、抗氧化而对银屑病具有治疗作用,但机制又是如何呢?既往研究表明,银屑病中多条信号通路异常激活,主要涉及MAPK和NF-κB等;MAPK和NF-κB信号的激活促进了银屑病角质形成细胞过度增殖和异常分化以及炎症细胞浸润和细胞因子(IL-17、TNF-α等)的分泌,进而加速了银屑病的发生与发展[21-22]。因此,为进一步探讨SKPs抗银屑病的可能机制,笔者又对MAPK、NF-κB等基因进行检测。结果显示,IMQ外涂后模型组中MAPK、NF-κB及iNOS、ROS、IL-17、IL-23的mRNA水平升高,而SOD、GSH、CAT基因水平下降;但经SKPs干预后,MAPK、NF-κB及iNOS、ROS、IL-17、IL-23基因表达下调,SOD、GSH、CAT基因水平上调,而对照组较模型组无明显变化。说明SKPs可从基因水平调节炎症及氧化应激指标的转录和表达,从而发挥其抗炎、抗氧化能力,最终实现抗实验性银屑病的作用。这可能与SKPs抑制MAPK、NF-κB两条关键途径及其下游信号,进而抗炎和抗氧化应激有关。
综上所述,本研究通过IMQ构建银屑病样鼠模型,予以SKPs进行干预,从皮肤外观、组织病理、SI、炎症与氧化应激相关指标的蛋白和基因水平上初步探索了SKPs对实验性银屑病的治疗作用,这为银屑病的治疗提供了新的方向,但其具体治疗机制有待在将来的体外实验中进一步阐明。
