6-姜酚健康效应机制及其口服增效递送体系开发的研究进展
2023-03-09田文妮宋明月吕慕雯
田文妮,宋明月,2,吕慕雯,2,王 群,2,曹 庸,2,肖 杰,2,*
(1.华南农业大学食品学院,广东 广州 510642;2.广东省功能食品活性物重点实验室,广东 广州 510642)
6-姜酚又名6-姜辣素,是从生姜中提取的一种酚类物质(图1)。其由一个芳香环与侧链烷基组成,是生姜辣味物质姜酚的主要活性成分,同时其生物活性也最强。6-姜酚室温下为淡黄色油状液体,难溶于水(小于200 μg/L),但易溶于甲醇、乙醇等有机溶剂[1-3]。自1984年来,国内外学者对6-姜酚的健康功效和作用机制做了深入研究,证实6-姜酚具有抗肿瘤[4]、抗氧化[5]、降血糖[6]、降血脂[7]、降血压[8]、保护心脑血管[9]、改善肝损伤[10-11]和治疗消化道疾病(如结肠炎)等健康效应[12-14]。

图1 6-姜酚的分子结构Fig.1 Structure of 6-gingerol
然而,6-姜酚水溶性低、易在胃肠道环境中降解失活、分散性差、代谢速度快等问题都限制了其经口摄入后的健康效应。因此,开发口服增效递送体系,通过智能化设计递送体系以调控6-姜酚在上、下消化道的分布、吸收效率和体内生物转化过程,从而提高6-姜酚的生物可及性、生物利用度和生物功效,是探究6-姜酚健康增效作用及机制的重要基础。本文以6-姜酚的体内生物转化途径为关键对象,对近年来6-姜酚的健康效应和作用机制及其口服增效递送体系开发的研究进行综析,旨在为今后开发高效的食品功能口服增效递送体系提供参考。
1 6-姜酚的健康效应及作用机制的研究进展
6-姜酚具有显著的抗癌活性。胚胎癌症干细胞(cancer stem cells,CSCs)可以分化为任何类型的癌细胞,而6-姜酚可通过调控磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)介导的磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases,PI3K)/丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,AKT)/p53信号通路抑制程序性细胞死亡蛋白-1(programmed cell death 1 ligand 1,PD-L1)的表达,抑制CSCs的铁代谢途径,进而诱导CSCs中活性氧生成、线粒体膜电位破坏和DNA损伤反应,促进CSCs细胞周期阻滞和凋亡,从而发挥抗癌作用[15]。2021年,Zhang Haibo等采用流式细胞技术揭示了6-姜酚通过诱导苷活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)活化和抑制AKT/mTOR信号通路抑制口腔癌细胞生长的分子机制[16]。
此外,6-姜酚具有抗氧化和抗炎活性。脂多糖和硫酸葡聚糖钠(dextran sulfate sodium salt,DSS)能够诱导机体炎症和氧化应激反应的发生,6-姜酚不仅可预防脂多糖诱导的小鼠肠道屏障损伤和肝损伤,还可以治疗DSS诱导的结肠炎[17]。其潜在机制包括:1)6-姜酚通过调控核因子κB(nuclear factor kappa-B,NF-κB)信号通路上调ZO-1和Claudin-1蛋白的表达以恢复肠道屏障[18],从而显著逆转脂多糖诱导的小鼠回肠炎症反应[10];2)6-姜酚通过下调Bax和细胞色素c基因表达,抑制Caspase-3通路,减轻肠源性脂多糖诱导的回肠细胞凋亡;3)6-姜酚通过调控NF-κB、Wnt/β-catenin等通路发挥抗炎作用,通过调控核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)/血红素氧合酶1(heme oxygenase-1,HO-1)信号通路、降低活性氧(reactive oxygen species,ROS)水平来发挥抗氧化活性,从而预防DSS诱导的溃疡性结肠炎[19-20]。也有研究表明,6-姜酚还可减轻脂多糖诱导的大鼠海马和大脑皮质组织损伤,其保护作用是通过逆转神经行为缺陷、氧化应激、炎症和淀粉样变过程介导的[21]。
6-姜酚也被发现在糖脂代谢中发挥重要作用。研究表明,6-姜酚对糖尿病大鼠空腹血糖水平、高脂血症、丙二醛和炎症标志物水平、NF-κB蛋白表达及肾脏抗氧化酶水平均有显著恢复作用[6]。也有研究证实,6-姜酚通过增强小鼠骨骼肌细胞中AMPK的磷酸化以促进葡萄糖转运体(glucose transporter,GLUT)4易位,从而降低2型糖尿病小鼠的血糖水平[22]。Ahn等揭示了6-姜酚通过抑制肝细胞核因子4α、激活氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)信号通路,从而改善高脂饲料饲喂小鼠肝脏中的脂肪积累和氧化变性[23]。
此外,6-姜酚具有促进睡眠和改善因睡眠剥夺引起的代谢紊乱作用。剥夺睡眠会干扰许多重要的生理活动,包括与代谢过程相关的基因表达、对压力和炎症的免疫应答、昼夜节律生物钟周期、细胞增殖调节和各类信号通路。因此,睡眠不足与糖尿病、心脑血管疾病等风险的增加有关。研究发现,6-姜酚(灌胃70 mg/kgmb)可抑制小鼠自发性运动活动,延长戊巴比妥诱导的睡眠时间,改善由于睡眠剥夺诱导的氧化应激和炎症反应、心肌细胞损伤、血脑屏障暂时性破坏[24-25]。
6-姜酚在心脑血管疾病的防控中发挥着举足轻重的作用。Lee等的研究表明6-姜酚通过介导过PPAR信号改善人脐静脉血管内皮细胞、人胚胎肾细胞以及分化的小鼠前脂肪细胞(3T3-L1细胞)中与高血压发展正相关的生物标志物(如血管细胞黏附蛋白1(vascular cell adhesion protein 1,VCAM1)、肿瘤坏死因子(tumor necrosis factor α,TNFα))的表达[8]。除了高血压,心肌缺血/再灌注损伤也会对心肌组织造成严重损伤,是死亡率高的疾病之一[26],6-姜酚可通过瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)/FAS关联因子1(FAS-associated factor 1,FAF1)复合物介导的自噬抑制NLRP3炎症小体和细胞凋亡,减轻脑缺血再灌注损伤[27],也可通过调节lncRNA H19/miR-143/ATG7信号转轴介导的自噬,对心肌缺血再灌注损伤起到防护作用[28]。凋亡是诱发心血管细胞损伤的重要原因之一,动脉粥样硬化的致病因素是通过激活血管内皮细胞发生凋亡,而6-姜酚可通过激活人脐静脉血管内皮细胞PI3KAKT-eNOS通路发挥抑制高糖诱导的血管内皮细胞凋亡和损伤作用[9]。
6-姜酚的健康效应研究汇总如表1所示。

表1 6-姜酚的健康效应及其功效发挥的主要限制性因素Table 1 Health effects of 6-gingerol and major factors limiting its health effects
2 6-姜酚的体内生物转化途径
口服吸收发生在机体消化道,消化道是从口腔延伸到肛门的系统,是食物与肠道微生物群和宿主机体相互作用最大的场所。以盲肠为分界点,消化道可以被划分为上消化道(依次包括口腔、胃、十二指肠、空肠、回肠)和下消化道(盲肠、升结肠、横结肠、降结肠、直肠)。上消化道是食物消化的主要场所,其中小肠是吸收营养物质的主要部位;而下消化道中则发生大量以肠道微生物酶介导的消化过程。6-姜酚的体内生物转化途径包括6-姜酚在胃肠道吸收、在体循环中分布、代谢和排泄的过程(图2),上、下消化道pH值环境、转运时间、分泌物和消化酶系、肠道微生物群落结果的差异决定了6-姜酚经上、下消化道吸收后不同的生物转化途径,这是其在机体内发挥相应健康效应的基础。
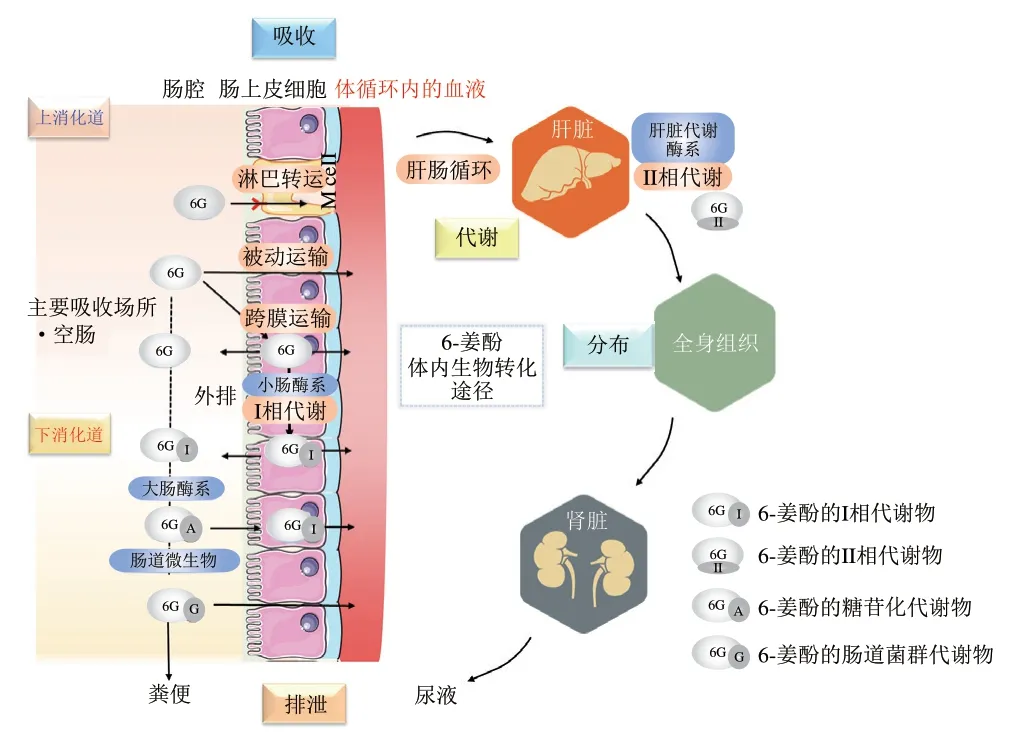
图2 口服6-姜酚在体内的生物转化途径Fig.2 Biotransformation pathway of oral 6-gingerol in the body
2.1 6-姜酚的胃肠道稳定性和吸收特性
6-姜酚经口摄入后在靶标部位发挥健康效应的前提是由胃肠道吸收进入到血液中,其中进入血液循环系统所占比例被称为“口服生物利用度”,其可通过药代动力学分析评估[37]。影响6-姜酚生物利用度的因素可分为三大类:生物可及性、肠道通透性和代谢转化率[38]。具体来说,6-姜酚经口摄入后在胃和小肠环境中不稳定,易被氧化酶代谢发生氧化反应,这与6-姜酚的β-羟基酮结构(C3羰基和C5羟基)有关[39]。此外,尽管6-姜酚水溶性低,但其对脂质具有高度亲和力,因而具有良好的小肠透过性。6-姜酚的主要吸收部位为空肠[40],90%以上的6-姜酚在空肠黏膜层与葡萄糖醛酸结合并在钠依赖的葡萄糖转运体协助下被吸收进入血液循环[41];剩余少部分进入大肠,经过结肠微生物及其相应酶系的羟基化和谷胱甘肽氧化还原反应等作用,被进一步代谢降解,其代谢产物可经过肠壁重吸收进入体循环或随粪便排出体外。6-姜酚进入肠道细胞后可通过多药耐药相关蛋白(motility related protein 1,Mrp1)转运到循环系统,或通过活性外排蛋白载体、P-糖蛋白、乳腺癌耐药蛋白及其代谢产物转运回腔内。这里特别指出,P-糖蛋白是位于肠上皮细胞膜上的跨膜糖蛋白,具有能量依赖性的“分子泵”功能,可使肠细胞内活性物泵出细胞外,降低活性物生物利用度。小肠黏膜是生物转化的主要部位之一,在小肠上皮细胞作用下,部分6-姜酚发生生物转化,这被成为小肠的“首过效应”,是限制6-姜酚生物利用度的因素之一。因此,6-姜酚在内皮层的转运效率也是影响其生物功效的关键控制点。值得注意的是,6-姜酚可通过抑制P-糖蛋白的活性提高其在内皮层的转运和吸收效率,从而提高其在血液循环中的浓度[42]。
2.2 6-姜酚的组织分布
6-姜酚的在体循环中的组织分布备受科学界关注[43]。研究发现在大鼠静脉注射6-姜酚(3 mg/mL)后在体内迅速被消除(t1/2=7.23 min),全身清除率为16.8 mL/(min·kgmb)[44]。用6-姜酚(240 mg/kgmb)灌胃雄性SD大鼠后,其在血液中被迅速吸收并快速消除(t1/2=1.77 h),其生物利用度低极可能与首过效应相关[45]。此外,研究表明6-姜酚经口服后被迅速吸收代谢并在组织中积累和均匀分布,这可能与其亲脂性有关[46]。
研究发现,大鼠灌胃30 mg/kgmb或120 mg/kgmb6-姜酚后12 h内各组织器官(包括大脑、心脏、肝脏、脾、肺、肾脏等)均未检测出游离的6-姜酚,但灌胃120 mg/kgmb6-姜酚大鼠血流量丰富的肝、脾、肾、肺等组织中可检测到6-姜酚葡萄糖苷酸[47]。这是由于6-姜酚在体内吸收过程中发生大量的首过代谢,迅速转化为6-姜酚葡萄糖苷酸,葡萄糖醛酸基团的引入增大了6-姜酚的极性,因此,器官的血流量是影响6-姜酚葡萄糖苷酸组织分布的关键因素[48]。Gundala等证实6-姜酚在小肠重吸收后由肝门静脉回流入肝,6-姜酚的葡萄糖醛酸苷可通过肝肠循环返回血液循环[49]。
2.3 6-姜酚的代谢
口服6-姜酚的代谢转化发生在上消化道小肠上皮细胞中或肠道微生物群富集的下消化道[50]。一旦由胃肠道吸收,6-姜酚将经历在肠道细胞中的I期代谢,随后通过循环系统进入肝脏进行II期代谢。参与I/II期的生物转化酶包括细胞色素P-450(cytochrome P-450,CYP-450)酶、UDP-葡萄糖醛酸基转移酶、谷胱甘肽S-转移酶、磺基转移酶等。对于微生物转化,6-姜酚的常见代谢途径包括解偶联、C环裂解、脱羧、还原、脱羟基和脱甲基等[51]。
2.3.1 上消化道宿主代谢
经上消化道吸收后的宿主代谢是产生6-姜酚I/II期代谢物的重要途径。口服6-姜酚在上消化道的代谢转化途径如图3所示。6-姜酚(50 mg/kgmb)经口摄入后在小肠和肝胆处酚侧链发生葡萄糖醛酸化、羟基化、ω-1氧化和β-氧化,产生(S)-6-姜酚-40-O-β-葡萄糖苷和9-羟基6-姜酚[50-52]。6-姜酚具有7 种代谢产物[52],包括3 个I期代谢产物(6-姜烯酚、脱氢6-姜酚、羟基化6-姜酚)和4 个II期代谢产物(6-姜酚的葡糖苷、6-姜烯酚的葡糖苷、脱氢6-姜酚的葡糖苷、羟基化6-姜酚的葡糖苷),其I相代谢物丰度较II相代谢物低。值得注意的是,口服酚类化合物,尤其是极性较低的化合物,通常在肠道黏膜和/或肝脏发生羟基化和/或葡萄糖醛酸苷和/或硫酸盐偶联[53-54]。然而,口服6-姜酚后胆汁和尿液中均未检测到其硫酸盐代谢物,这可能是6-姜酚是一种葡萄糖醛酸化的高亲和力底物,不易发生硫酸盐化作用[55-56]。在大鼠和人的肝微粒体中,6-姜酚可以在芳香族和脂肪族的羟基上被葡萄糖醛酸化,且葡萄糖醛酸化的位置取决于尿苷二磷酸葡萄糖基转移酶亚型,在大鼠肝微粒体中主要代谢酶为CYP3A,6-姜酚代谢产物为6-姜烯酚和脱氢6-姜酚,而在人类肝微粒体中其主要代谢物为羟基化6-姜酚[57]。

图3 口服6-姜酚在上消化道的代谢转化途径Fig.3 Metabolic transformation pathways of oral 6-gingerol in the upper digestive tract
2.3.2 下消化道肠道微生物代谢
口服6-姜酚经上、下消化道的代谢转化过程如图4所示。下消化道肠道微生物群代谢对6-姜酚健康效应具有重要影响。未被上消化道吸收的6-姜酚进入大肠在肠道菌群作用下产生结肠代谢产物。此外,结肠还接收肠肝循环外排的I/II相代谢产物,通过粪便微生物酶如β-葡萄糖苷酶、α-鼠李糖苷酶等进行解聚,释放出苷元。口服6-姜酚(50 mg/kgmb)后,检测出胆汁中的主要代谢物(48%)为(S)-6-姜酚-4’-O-β-葡萄糖苷。(S)-6-姜酚-4’-O-β-葡萄糖苷、香草酸、阿魏酸、(S)-(+)-4-羟基-6-氧化-8-(4-羟基-3-甲氧基苯基)辛酸、4-(4-羟基-3-甲氧基苯基)丁酸和9-羟基-6-姜酚的排泄持续到48 h[52]。研究表明,6-姜酚经过I相代谢产生6-姜烯酚,其在结肠微生物菌群的生物转化下产生6-姜烯酚的半胱氨酸缀合代谢物和谷胱甘肽缀合代谢物,这两种缀合物比6-姜烯酚具有更显著的抗炎功效[58]。6-姜烯酚经口摄入后2 h出现在结肠组织中,结肠组织中6-姜烯酚的半胱氨酸缀合代谢物含量非常高(Cmax=2 μg/g),在结肠中能以1 μg/g的含量保持3.3 h[59]。

图4 口服6-姜酚经上、下消化道的代谢转化过程Fig.4 Metabolic transformation of oral 6-gingerol in the upper and lower digestive tract
2.4 6-姜酚的排泄
6-姜酚经口摄入后,在体内生物转化后通过尿液或粪便排出体外。研究表明,6-姜酚的葡萄糖醛酸化代谢物高分子质量和高极性的特性促进了6-姜酚在胆汁中的排泄,其在大鼠尿液和粪便中的平均回收率约为5.36%[59]。Nakazawa等在大鼠胆汁、尿液和肝脏中分别发现1、6、2 种代谢产物,约48%的代谢产物通过胆汁排泄,约16%代谢产物通过尿液排泄,其中肠道菌群及肝药酶在生物转化过程中起关键作用[52]。
3 增强6-姜酚健康效应的口服靶向递送体系
由于6-姜酚是一种疏水酚类化合物,其快速代谢导致生物利用度低,因此,其在靶组织和循环系统中的浓度远低于其体外治疗浓度。虽然6-姜酚具有显著的临床疗效,但由于其在人体药代动力学实验中无法达到可检测的血药浓度,因此未能实现临床研究。基于此,设计递送体系以提高6-姜酚的生物利用度、生物可及性、生物功效和靶向能力成为研究人员近年来的研究热点[37,60-61]。近年来增强6-姜酚生物功效和健康效应的口服递送系统汇总如表2所示。

表2 增强6-姜酚生物功效和健康效应的递送系统Table 2 Delivery systems for enhancing biological efficacy and health effects of 6-gingerol
3.1 基于增强6-姜酚在上消化道吸收以强化其健康效应的递送体系
针对6-姜酚口服吸收和机体内生物转化特性所设计的递送体系,主要以聚合物胶束、纳米颗粒、纳米脂质载体、前脂质体、纳米纤维和多糖磷脂复合物为代表。Zhen Lijun等采用溶剂注射法制备的聚合物胶束使6-姜酚的生物利用度提高了3 倍,其归因于聚合物胶束的纳米尺寸(73 nm)有助于提高6-姜酚在胃肠道中的分散性和在小肠处的吸收和转运效率,提高了6-姜酚穿过肠上皮细胞进入血液循环系统[3]。Wei Qiuyu等采用高压均质法制备的纳米脂质载体具有消化缓释特性和高效的经淋巴循环转运吸收特性,能够提升其经淋巴转运进入血液循环系统的效率,从而使6-姜酚的生物利用度提高4 倍[2]。Thanaporn等采用静电纺丝技术制备的负载6-姜酚纳米纤维,提高了6-姜酚在胃肠道中的稳定性和分散性,相比6-姜酚,其具有更强的抗氧化活性[62]。Manatunga等采用共沉淀法设计和制备了新型pH敏感型复合纳米颗粒,其具有良好的包封特性(93.03%)和响应性缓释特性,在pH值为5.3时能够响应性释放6-姜酚,可作为食品功能因子控释和靶向载体应用于肿瘤等疾病的防治[64]。Wang Qilong等采用薄膜分散法制备的前脂质体提高了6-姜酚在水中的分散性、口服生物利用度和抑制乳腺癌和肝癌细胞增殖的作用,其增效作用可能归因于前脂质体良好的包封特性和膜亲和能力,从而提高6-姜酚在小肠的转运吸收效率[65]。Singh等采用反溶剂沉淀法制备了壳聚糖磷脂复合物,基于其高负载率(8.26%)和纳米尺寸(254 nm),与游离姜酚相比,其具有持续缓释特性,提高了姜酚的生物利用度,从而增强了其体外抗氧化、抗菌和抗炎活性等健康效应[66]。
6-姜酚在上、下消化道的生物转化过程对其体内健康效应的发挥具有重大影响[67],除上述旨在增强6-姜酚小肠内吸收生物利用度的递送体系设计策略外,旨在增强其结肠酶系介导的健康效应的下消化道定向吸收增强型递送体系也开始受到研究者的重视。
3.2 基于增强6-姜酚在下消化道吸收以强化其健康效应的递送体系
6-姜酚具有缓解溃疡性结肠炎的作用,但其首过代谢效应和结肠靶向能力差等问题限制了其口服健康效应。Zhang Mingzhen等构建了纳米颗粒以提高生姜活性成分的口服结肠靶向性,该纳米颗粒提高了6-姜酚经结肠上皮细胞及巨噬细胞的吸收效率,基于高效的靶向细胞识别和吸收效率,其具有更强的肠道屏障损伤修复能力和缓解急性结肠炎的健康效应[63]。此外,基于6-姜酚的结肠代谢物6-姜烯酚半胱氨酸结合物和6-姜烯酚谷胱甘肽结合物比其上消化道代谢产物6-姜烯酚具有更强的抗炎能力,因此,设计智能化递送体系提高6-姜酚活性代谢物的生物功效和体内健康效应是一个值得研究的方向。Yang Chunhua等设计的纳米脂质载体能够有效地将6-姜烯酚、6-姜烯酚半胱氨酸结合物和6-姜烯酚谷胱甘肽结合物递送到结肠,减少其在肾或肝中蓄积[58]。在结肠中,相比6-姜烯酚,纳米脂质载体显著提高了6-姜烯酚的生物利用度和结肠分布比例;相比6-姜烯酚纳米脂质载体,半胱氨酸结合物和6-姜烯酚谷胱甘肽结合物纳米脂质载体通过增强其抗炎活性和修复肠道黏膜损伤作用对溃疡性结肠炎小鼠具有更强的治疗作用。因此,通过调控6-姜酚的吸收代谢途径是实现6-姜酚改善结肠炎的精准调控策略之一。
目前基于增强6-姜酚生物功效和健康效应的递送系统被广泛开发[68-70],其增强功效的机制主要包括:1)通过门静脉-淋巴调控机制促进6-姜酚进入血液循环;2)通过调控6-姜酚的吸收代谢途径以增强其生物效价;3)通过消化道时滞性释放调控达到健康效应最大化;4)通过靶向吸收增强实现精准干预。基于以上增效作用调控理论,目前主要的功效提升策略的设计原理包括:1)控制性制备纳米尺寸、高负载率和包封率的运载体以增强6-姜酚的生物功效;2)设计具备消化响应性、缓释性、时滞性的运载体以增强6-姜酚健康效应;3)基于提高淋巴转运效率的运载体设计以增强6-姜酚的生物效价;4)设计具备靶部位特异性识别能力的运载体,实现6-姜酚健康增效作用精准调控。
4 结语
6-姜酚在细胞、动物和临床研究中都展现出一系列的健康效应,但其口服生物利用度有限,主要在上消化道吸收,且在体内清除迅速。近年来,肠道微生物群和体内生物转化对6-姜酚生物活性的影响日益受到关注,通过设计口服增效运载体系、结肠靶向递送体系来提高6-姜酚的健康效应是一个有趣但未得到充分讨论的领域。本文从6-姜酚在体内的吸收、分布、代谢和排泄等方面探讨了其生物转化途径。为了提高6-姜酚的口服生物利用度和结肠靶向能力,研究者们设计了许多载体,如纳米颗粒、纳米颗粒、纳米脂质载体,今后应进一步加强6-姜酚结肠靶向型递送体系的研发,开发微胶囊、多层级核壳微/纳米体系、多腔室乳液凝胶等具有胃肠耐受性、能被结肠微生物酶降解的递送体系,以克服口服递送的障碍,从而发挥其靶向结肠的健康效应。整体上,在6-姜酚膳食健康干预研究中具有有潜力的研究方向包括:1)深入研究6-姜酚与肠道菌群的复杂动态互作过程与其体内生物活性的相关性,以揭示6-姜酚发挥生物学活性的系统性机制;2)通过设计靶向递送体系调控6-姜酚在上、下消化道的吸收分布以明晰6-姜酚健康效应的增效作用和机制等。
