苦荞蛋白源肽AFYRW对脂多糖诱导的人脐静脉内皮细胞损伤的影响
2023-03-09张礼林王筑婷莫晓川许庆忠李红梅
肖 怡,左 婕,邓 艳,张礼林,王筑婷,莫晓川,许庆忠,李红梅*
(贵州医科大学基础医学院,生物化学与分子生物学教研室,贵州 贵阳 550025)
心脑血管疾病是全球性疾病死亡的主要原因之一,其发病率在中国呈逐年上升趋势[1]。动脉粥样硬化(atherosclerosis,AS)是导致心脑血管疾病的主要原因。血管炎症在AS的发生发展中起重要作用。血管内皮的炎症反应可上调多种细胞黏附分子的表达,包括血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)、细胞内黏附分子-1(intracellular adhesion molecule-1,ICAM-1)和E-选择素,同时会导致多种促炎细胞因子的大量释放,如白细胞介素(interleukin,IL)-6、IL-8和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)。黏附分子和促炎细胞因子的增多会促进白细胞黏附,增加血管通透性[2]。脂多糖(lipopolysaccharide,LPS)作为革兰氏阴性菌细胞壁外壁的组成成分,能够诱导全身性炎症和败血症,被广泛用于诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤,是诱导细胞损伤的经典模型[3]。LPS诱导内皮细胞炎性损伤的相关机制较多,其中通过激活核因子κB(nuclear factor κB,NF-κB)下游信号通路,放大炎症反应,被认为是最经典的机制之一[4]。因此,研究内皮细胞炎性损伤的作用机制,改善内皮细胞的功能,是防止心血管疾病发展的有效措施。
目前,从各种食源性动植物中寻找具有抑菌、抗氧化等多种重要生理功能的活性肽已成为研究的一个热点。生物活性肽一般是由2~20 个氨基酸构成的短肽,分子质量大多在3 kDa以下,对生物机体的生命代谢活动有益或具有一定生物活性。生物活性肽常常隐藏于蛋白质一级结构序列中的一些特定区域内,必须释放它们才能发挥作用[5]。已报道的生物活性肽具有多种生理功能,包括抗氧化、抗高血压、抗病毒、抗肿瘤和抗菌等[6]。
苦荞学名鞑靼荞麦,别名万年荞、野兰荞、荞叶七,隶属于蓼科(Polygonaceae)荞麦属(Fagopyrum),与何首乌、大黄等同属蓼科,是我国药食同源文化的典型体现。据《本草纲目》记载,苦荞麦有益气力、利耳目、降气、宽肠、健胃等功效,能治疗痢疾,咳嗽、水肿、喘息、烧伤等疾病。苦荞营养丰富,富含蛋白质、维生素、膳食纤维、黄酮类化合物和多种微量矿物质元素等营养物质[7]。贵州威宁地区广泛种植苦荞,课题组前期采用碱性蛋白酶酶解苦荞清蛋白,经多种色谱分离及质谱鉴定,得到一种新的具有抗氧化作用的活性五肽AFYRW(Ala-Phe-Tyr-Arg-Trp),分子质量为741.85 Da,其对羟自由基和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基的半数清除浓度(half maximal inhibitory concentration,IC50)分别为0.65 mmol/L和0.64 mmol/L。此外,AFYRW还具有较强的还原力和抑制脂质过氧化的作用[8]。本研究以HUVECs为研究对象,建立LPS诱导的内皮细胞损伤模型,观察AFYRW对LPS诱导的内皮细胞炎性损伤的保护作用,为苦荞的深加工及苦荞活性肽的开发提供基础实验依据。
1 材料与方法
1.1 材料与试剂
肽AFYRW(纯度≥98%)由上海淘普生物科技有限公司合成。HUVECs、内皮细胞培养基(endothelial cell medium,ECM) 美国Sciencell研究实验室;BCA蛋白定量试剂盒、LPS、蛋白磷酸酶抑制剂、牛血清白蛋白、2’,7’-二-(2-羧乙基)-5(6)-羧基荧光素乙酰甲酯(2’,7’-bis-(2-carboxyethyl)-5-(and-6)-carboxyfluorescein acetoxymethyl ester,BCECF-AM) 北京索莱宝科技有限公司;细胞增殖及细胞毒性检测试剂盒 大连美仑生物技术有限公司;p65、p-p65 抗体 美国Cell Signaling Technology公司;内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、诱导型一氧化氮合酶(inducible nitricoxide synthase,iNOS)、ICAM-1、VCAM-1、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体 武汉三鹰生物技术有限公司;NO试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
iMark多功能酶标仪 伯乐生命医学产品(上海)有限公司;TS100荧光倒置显微镜 日本Nikon公司;BB150二氧化碳培养箱 赛默飞世尔科技(中国)有限公司;H1650R台式高速冷冻离心机 德国Hermle公司;TGL-16B台式离心机 上海安亭科学仪器厂;SLIK-O3000-S数显圆周摇床 美国赛洛捷克公司:DYY-6C型稳压稳流电泳仪、Western blot制胶器及电转移装置 北京六一仪器厂;Tanon-4600SF凝胶成像系统上海天能公司。
1.3 方法
1.3.1 AFYRW的高效液相色谱和质谱鉴定
AFYRW经上海淘普生物科技有限公司合成,并采用高效液相色谱(high performance liquid chromatography,HPLC)和电喷雾离子化质谱(electrospray ionization mass spectrometry,ESI-MS)进行纯度和成分分析。检测条件为:色谱柱为kromasil C18-5(4.6 mm×150 mm),流动相A:乙腈(含0.1%的三氟乙酸),流动相B:水(含0.1%的三氟乙酸),采用梯度洗脱,上样质量浓度为1 mg/mL,上样体积为20 μL,流速1.0 mL/min,检测波长214 nm。
1.3.2 细胞培养
细胞复苏:HUVECs用ECM培养基培养(含5%胎牛血清、1%内皮生长因子、100 U/mL青霉素、100 U/mL链霉素)。将液氮罐中的冻存细胞取出,快速将其放入37 ℃水中反复摇晃约1 min,再将细胞从冻存管吸出转移到装有预热培养基的新的培养瓶中,不用离心,摇晃均匀于培养箱中培养,次日换液及传代培养。
细胞传代:当细胞生长密度达80%~90%时,吸弃培养基,加入缓冲液清洗2 次,加入1 mL 0.25%胰蛋白酶消化1 min。倒置显微镜下观察到细胞成块脱落时,立即加入培养基终止消化。轻轻吹打培养瓶收集细胞,细胞悬液1 000 r/min离心5 min,弃上清液,加入1 mL培养基重悬细胞,根据需求加入不同的培养瓶。
细胞计数:细胞重悬后吸取10 μL从盖玻片边缘加入,使细胞悬液全部充满计数室。首先计算周边4 个中方格内的细胞总数,再取平均数,根据实际需要对细胞悬液进行二次稀释。
细胞分组和药物干预:细胞状态良好时即可分组,分为4 组:1)对照组;2)模型组:质量浓度0.125 μg/mL LPS;3)低剂量组(AFY5组):质量浓度0.125 μg/mL LPS+质量浓度5 μg/mL AFYRW;4)高剂量组(AFY50组):质量浓度0.125 μg/mL LPS+质量浓度50 μg/mL AFYRW。AFYRW干预保护24 h后,再用LPS作用1.5 h建立炎症模型。
1.3.3 CCK8检测细胞生存活力
以每孔4×103个的数量接种于96 孔板中,混匀后每孔加入100 μL细胞悬液,每组设置4 个平行复孔。等待细胞贴壁生长至融合状态,分组给药干预24 h后加入LPS作用1.5 h。造模结束后每孔加入10%的CCK8溶液,加液过程勿产生气泡,混匀后放回培养箱中继续培养0.5 h,450 nm波长处测定各孔吸光度。空白孔只含CCK8溶液,实验重复3 次。细胞存活率按式(1)计算。
1.3.4 Western blot检测相关蛋白的表达
冰上裂解提取细胞总蛋白,BCA法进行蛋白浓度测定。根据蛋白分子质量制备合适浓度的胶。10 μg总蛋白上样、电泳,当溴酚蓝电泳至胶边缘时终止。制作转膜体系,转膜时间2 h。用5%牛血清封闭2 h。按一定比例稀释抗体,一抗过夜孵育,TBST洗膜3 次,每次10 min。二抗室温孵育2 h,TBST洗膜3 次,每次10 min。化学发光试剂显色后凝胶成像系统拍照。收集图像后用Image J软件分析各条带灰度值。
1.3.5 NO含量的检测
调整HUVEC细胞密度为4×105个/mL,接种于6 孔培养板,于37 ℃、5% CO2培养箱中培养24 h,分别加入终质量浓度为5、50 μg/mL的AFYRW孵育24 h后,加入终质量浓度为0.125 μg/mL的LPS继续孵育1.5 h,弃去LPS刺激的培养液后,用缓冲液清洗2 次,胰酶消化后收集细胞1 000 r/min离心5 min,超声破碎制备细胞悬液,BCA定量蛋白浓度,根据试剂盒说明书进行测定,空白孔为双蒸水和显色液,标准品为20 μmol/L亚硝酸钠,取上清液于酶标仪550 nm波长处测定各孔OD值,根据公式(2)计算NO含量。
式中:A标准为标准孔吸光度;c标准为标准品浓度;ρpr为细胞匀浆蛋白质量浓度/(g/L)。
1.3.6 单核细胞黏附实验
细胞接种于24 孔板中等待贴壁,分为4 组:1)对照组;2)模型组:3)低剂量组(AFY10组):质量浓度0.125 μg/mL LPS+质量浓度10 μg/mL AFYRW;4)高剂量组(AFY50组):质量浓度0.125 μg/mL LPS+质量浓度50 μg/mL AFYRW。干预结束后将THP-1细胞1 000 r/min离心3 min,1640培养基重悬细胞后用计数板计数,使用BCECF-AM(5 μmol/L)标记重悬的THP-1细胞,混匀后培养箱中培养30 min,培养结束后用0.01 mol/L pH 7.2~7.4磷酸盐缓冲液(phosphate buffered saline,PBS),清洗3 遍,洗掉多余的BCECF-AM。加入到HUVECs中共同培养1 h,注意避光,PBS冲洗未黏附的细胞,倒置荧光显微镜下拍照。
1.4 数据处理与分析
所有实验均重复3 次。各组实验数据以平均值±标准差表示,采用SPSS 19.0软件进行统计分析,采用方差齐性检验和单因素方差分析对数据进行比较,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 AFYRW的HPLC和质谱鉴定结果
经HPLC测定,AFRYW的纯度为95%(图1A)。经ESI-MS测定其分子质量为741.85 Da(图1B)。

图1 合成AFYRW的HPLC(A)和质谱(B)图Fig.1 High performance liquid chromatogram (A) and mass spectrum (B) of synthetic AFYRW
2.2 AFYRW对LPS诱导的HUVECs细胞活力的影响
如图2所示,与对照组相比,质量浓度0.125 μg/mL LPS 作用内皮细胞1.5 h 后,细胞存活率显著降低(P<0.05);与模型组相较,不同质量浓度的AFYRW预处理24 h,再加入LPS刺激1.5 h,细胞活力均显著提高(P<0.05),AFY50组尤为显著。以上结果说明AFYRW能降低LPS诱导的细胞死亡。

图2 AFYRW对LPS诱导的HUVECs细胞活力的变化影响Fig.2 Effect of AFYRW on cell viability of HUVECs induced by LPS
2.3 AFYRW对LPS诱导的HUVECs细胞中NO含量的影响
由于NO在内皮功能障碍中起着重要作用,因此检测了AFYRW对LPS诱导的HUVECs中NO水平的影响,结果如图3所示。与对照组相比,LPS刺激后,NO含量显著增多(P<0.05);与模型组相比,低质量浓度AFYRW预处理24 h后NO含量明显降低,高质量浓度AFYRW可显著抑制NO的生成(P<0.05)。由于iNOS和eNOS对NO生成的调节的影响,因此检测了LPS及AFYRW+LPS作用下HUVECs中iNOS和eNOS的相对表达量。如图4所示,与对照组相比,LPS刺激下,HUVECs的iNOS相对表达量显著增加(P<0.05)、eNOS相对表达量无显著变化(P>0.05),从而导致NO生成过量。结果表明AFYRW可通过降低NO的生成进而减轻细胞损伤。
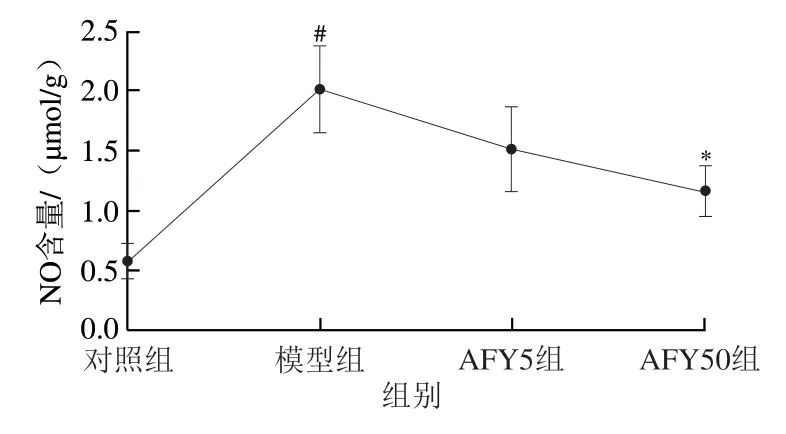
图3 AFYRW对LPS刺激下HUVECs的NO含量的影响Fig.3 Effect of AFYRW on the content of NO in HUVECs under LPS stimulation

图4 AFYRW对LPS刺激下HUVECs的iNOS、eNOS蛋白相对表达量的变化影响Fig.4 Effect of AFYRW on iNOS and eNOS protein expression under LPS stimulation
2.4 AFYRW对LPS刺激下单核细胞黏附的影响
单核细胞黏附、聚集在内皮上是动脉硬化发生早期的表现。单核-内皮黏附实验被用来观察ARYRW是否能抑制LPS刺激下单核细胞的黏附。如图5、6所示,与对照组相比,LPS刺激能明显诱导单核细胞THP-1黏附到HUVECs;加入AFYRW的实验组中荧光标记的THP-1细胞明显低于LPS组,并且AFYRW质量浓度越高,标记的THP-1细胞数量越少。结果表明AFYRW能够抑制LPS诱导单核细胞THP-1对HUVECs细胞的黏附。
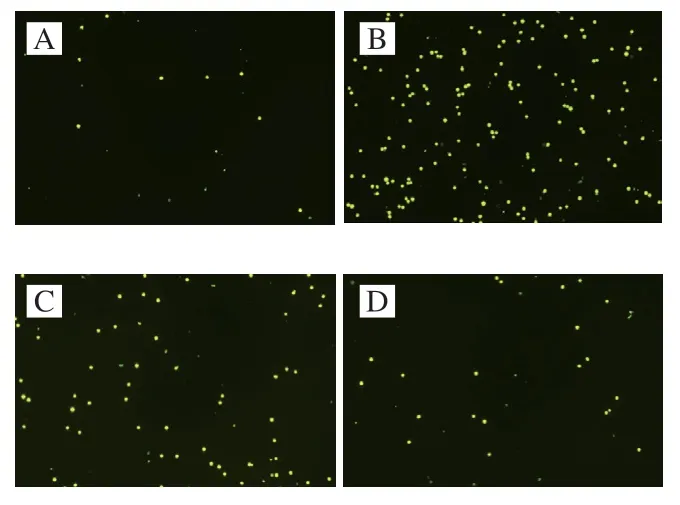
图5 单核细胞对内皮细胞的黏附性检测结果(10×)Fig.5 Determination of monocyte adhesion to endothelial cells (10×)
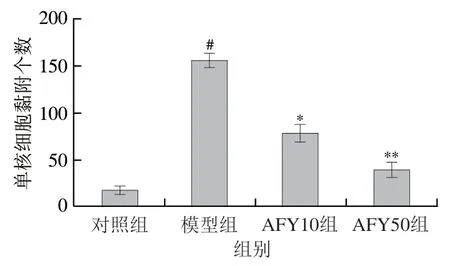
图6 单核细胞对内皮细胞的黏附性检测结果Fig.6 Determination of monocyte adhesion to endothelial cells
2.5 AFYRW对LPS刺激下HUVECS黏附分子和炎症因子表达的影响
血管内皮细胞损伤后,可分泌多种黏附分子和促炎细胞因子,趋化单核细胞黏附于血管内皮。与对照组比较,LPS刺激后,细胞中的VCAM-1、ICAM-1、IL-6、TNF-α蛋白的相对表达量显著增加(P<0.05),说明LPS诱导了HUVECs的炎性损伤;与模型组比较,低、高质量浓度的AFYRW均可降低VCAM-1、ICAM-1、IL-6、TNF-α蛋白的相对表达量,高剂量组效果尤其极显著或显著(P<0.01、P<0.05),炎症有所缓解(图7)。说明AFYRW可减轻LPS诱导HUVECs的炎性损伤。NF-κB信号通路在LPS诱导的HUVECs的黏附分子及炎症因子表达中起着关键作用。与对照组比较,LPS的刺激使p-p65蛋白相对表达量显著增加(P<0.05);与模型组相比,低剂量AFYRW可显著降低该蛋白表达(P<0.05),高剂量AFYRW可极显著降低p-p65的表达(P<0.01)(图8),说明AFYRW可通过抑制NF-κB信号减轻黏附分子及炎症因子的表达,从而减缓LPS诱导的炎症反应。
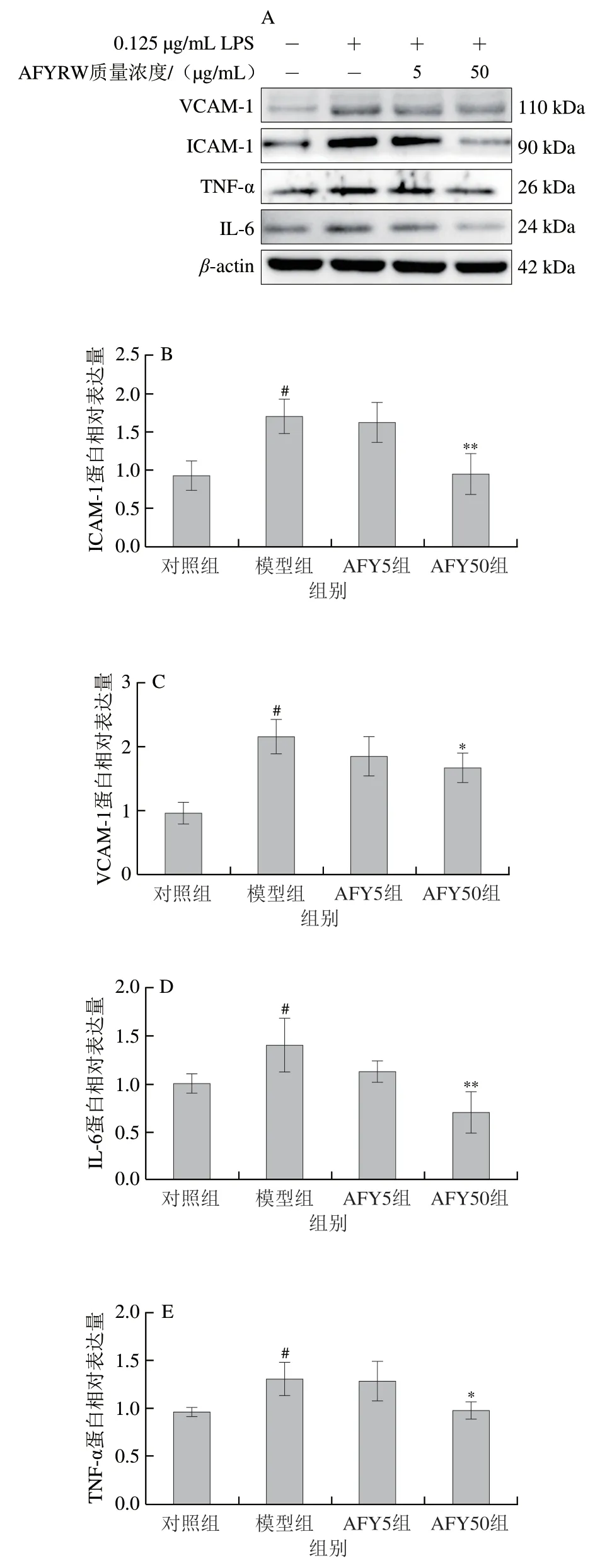
图7 AFYRW对LPS刺激下ICAM-1、VCAM-1、IL-6和TNF-α表达的影响Fig.7 Effect of AFYRW on the protein expression of ICAM-1,VCAM-1,IL-6 and TNF-α in HUVECs under LPS stimulation

图8 AFYRW对LPS刺激下p-p65表达的影响Fig.8 Effect of AFYRW on the protein expression of p-p65 under LPS stimulation
3 讨论
饮食因素在维持正常免疫系统功能方面发挥着至关重要的基础和核心作用[9]。生物活性肽作为蛋白质分解的产物,不仅能像蛋白质一样改善机体的营养状况,还具有更强的抗氧化和调节免疫的作用[10]。研究认为生物活性肽的免疫效应与肽序列中的氨基酸的物理化学特性有关,如带有正电荷的精氨酸的生物活性肽可结合并激活免疫细胞的趋化因子受体,色氨酸可被免疫细胞表面的阿片受体识别[11]。来源于苦荞蛋白的抗氧化肽AFYRW序列中含有精氨酸和色氨酸,同时考虑氧化应激与炎症之间的关系,因此,本实验主要研究AFYRW对LPS诱导的血管内皮细胞的炎症反应的改善作用。
慢性血管炎症和随后单核细胞与内皮细胞的黏附是AS发生和发展的基本环节[12]。因此,抑制炎症反应和单核细胞与内皮细胞的黏附可能是预防AS的有效策略[13]。血管内皮细胞损伤后,可分泌VCAM-1和ICAM-1等多种黏附分子,这些物质可趋化单核细胞及T淋巴细胞黏附于血管内皮。动脉硬化早期,白细胞黏附、聚集是一个重要环节,正常的血管内皮不与白细胞发生黏附,但在血管硬化部位白细胞黏附于内膜表面,并穿透内皮细胞间连接进入到内膜,内皮细胞表面表达的VCAM-1和ICAM-1可促进白细胞和血管内皮细胞黏附,加速白细胞向血管内皮游走,并促进平滑肌细胞增殖[14-17]。在促炎细胞因子中,IL-6是AS发展过程中的关键炎症分子[18],IL-6激活内皮细胞参与白细胞募集并诱导IL-8、MCP-1和黏附分子的释放,因此,抑制IL-6可以预防炎症的发展[19-22]。在本研究中,用AFYRW干预后,可显著抑制LPS诱导HUVECs上的黏附分子VCAM-1和ICAM-1、炎症因子IL-6和TNF-α的表达,并减少LPS诱导的THP-1细胞与HUVECs的黏附。以上结果表明AFYRW对血管炎症具有有益的作用。
NO是血管稳态的关键调节因子,NOS催化L-精氨酸产生NO。NO促进动脉血管扩张,抑制血小板聚集、单核细胞黏附至血管内皮上,并抑制平滑肌细胞的增殖。大量研究表明,内皮细胞中NO生成的增加可抑制NF-κB活性并减轻AS[23]。在内皮细胞中,NO通过eNOS催化生成,因此,促进eNOS活化可能是控制AS的有效途径。然而,研究报道iNOS催化产生的过量NO会对血管功能产生有害的影响[24]。iNOS是炎症标志物,在炎症和免疫刺激下,iNOS被活化,催化NO过多产生,使机体发生氧胁迫,引起细胞损伤[25],如过多的NO会引起血管扩张,使血流减慢[26]。在炎症早期NO可推动炎症细胞迁移,推动炎症进程。因此,NO可间接反映血管内皮细胞的受损程度[27]。在本研究中,发现用LPS处理HUVECs后,NO含量明显升高;AFYRW干预后,NO含量显著降低,并呈剂量依赖性。通过Western blot检测eNOS和iNOS的蛋白表达情况,发现eNOS在各组中的表达量没有明显变化,而在LPS处理后,iNOS表达明显增高,经过AFYRW干预后,与模型组相比,iNOS相对表达量显著下调,说明AFYRW可逆转LPS诱导的iNOS表达,减少NO的生成,从而减轻细胞损伤。
NF-κB几乎存在于所有炎症介质蛋白质基因的启动子和增强子部位上,NF-κB信号激活可通过调节包括细胞因子、趋化因子和黏附分子在内的各种炎症介质的表达,在机体免疫中尤为重要[28]。通常情况下,NF-κB以二聚体的形式存在,与抑制蛋白-κB(inhibitors of κB,IκB)结合,存在于胞质中。在刺激因子作用下(如LPS),IκB复合物先发生磷酸化,随后泛素化降解,NF-κB p65的核定位序列暴露,活化的NF-κB p65可以进入细胞核并与特定的DNA区域结合,促进靶基因的序列表达,如VCAM-1,从而参与细胞各病理生理过程[26],并诱导相关因子的表达,其中包括iNOS,从而增强炎症反应[29-30]。因此,若能有效地抑制NF-κB的活性,可能有助于阻断AS的发生发展[31-32]。本研究发现LPS作用内皮细胞后,细胞内NF-κB p65磷酸化水平明显升高,表明LPS可能促进p65磷酸化,激活NF-κB转移进入细胞核,产生炎症反应,AFYRW干预后,p65磷酸化水平明显下调,减轻炎症反应。
综上所述,苦荞活性肽AFYRW 对LPS 诱导的HUVECs的炎性损伤具有早期预防作用,其作用机制可能与抑制NF-κB的活性有关。
