药用植物黄芩的生物学研究进展及展望
2023-03-07郑敏敏柳洁赵清
郑敏敏 柳洁 赵清
(1.上海辰山植物园 中国科学院分子植物科学卓越创新中心辰山科学研究中心 上海市资源植物功能基因组学重点实验室,上海 201602;2.中国科学院大学,北京 100049)
黄芩(Scutellaria baicalensisGeorgi)为唇形科黄芩属多年生草本植物,具披针或线性披针形叶,根茎肉质,花紫色或蓝色(图1),原产于中国、俄罗斯东部、蒙古、朝鲜、日本等地[1-2]。植物黄芩的干燥根即是传统中药里的“黄芩”,在中国具有悠久的药用历史,最早记载“黄芩”药用的书籍是汉代的《神农本草经》,主治肺和肝脏的疾病[3]。东汉时期,张仲景的《伤寒杂病论》中也记载了含有“黄芩”的多个复方汤剂(表1),用于治疗风寒、头疼、发热、腹泻等疾病[4]。明代的医学著作《本草纲目》中也记载“黄芩”具有清热燥湿、泻火解毒、消炎、止血安胎以及健脾胃等作用,可用于治疗腹泻、腹痛、出血、炎症和呼吸道感染等疾病[5-6]。

图1 黄芩植株、黄芩的根和黄芩药材Fig. 1 S. baicalensis plant, S. baicalensis root and S. baicalensis as medicinal material

表1 《伤寒杂病论》里含有黄芩的复方汤剂Table 1 Compound decoctions in “Treatise on Febrile and Miscellaneous Diseases” containing S. baicalensis
1 黄芩的化学成分
随着提取和分离技术的发展,迄今为止,已从黄芩植物中分离出132 种化合物,这些化合物大多从根中分离得到。根据结构划分,化合物主要类型包括类黄酮化合物、苯乙醇苷、固醇类、萜类、酰胺以及酚类化合物,其中黄酮及其苷类化合物占绝大部分。132 种化合物中游离的类黄酮化合物有56种,包括42 种黄酮、3 种黄酮醇、9 种黄烷酮、1种查耳酮和1 种双黄酮,其中黄芩素、汉黄芩素的含量最高(图2-a,2-c);黄酮苷类有44 种,其中黄芩苷的含量最高,其次为汉黄芩苷(图2-b,2-d);此外,还含有8 种苯乙醇苷、3 种固醇、1 种二萜、5 种酰胺、9 种酚类化合物以及6 种多糖[7-8]。
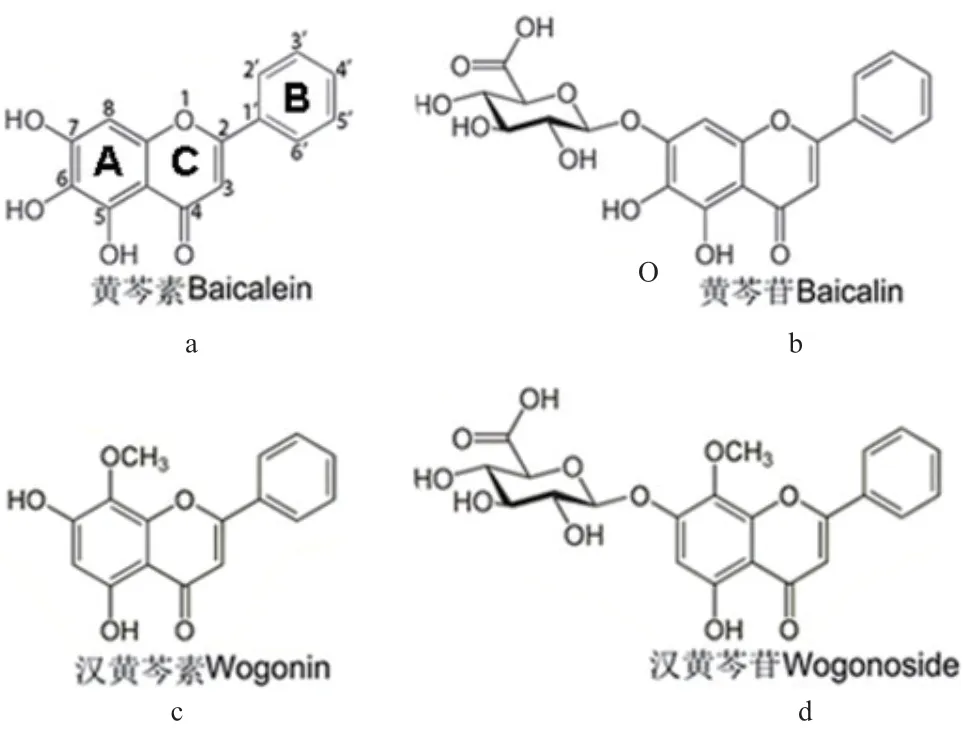
图2 黄芩中主要活性黄酮的结构Fig. 2 Structures of main active flavones in S. baicalensis
黄芩中的黄酮化合物结构特殊,除常见的C-5和C-7 位被取代基取代以外,C-6 和C-8 位上也会被羟基取代,或C-8 位被甲氧基取代,这在其他植物中是很少见的。此外,黄芩植物中黄酮苷化合物的糖苷类型可分为O-葡萄糖苷、O-葡萄糖醛酸苷以及C-葡萄糖苷,大部分O-葡萄糖苷在7-OH 或2′-OH 上糖基化,作为糖基,葡萄糖醛酸苷不像葡萄糖苷普遍,但在黄芩中,至少存在17 种葡萄糖醛酸苷,且普遍在7-OH 上糖基化,少数在8-OH 和2′-OH 上[8]。
近几十年来,大量临床和药理研究表明,黄酮化合物是黄芩的主要生物活性物质,尤其是根部的
2 黄芩中的药用活性物质及药理研究
黄芩素、汉黄芩素及其苷类,具有抗肿瘤、抗病毒、抗炎、抗氧化、护肝及神经保护等药理活性[6]。
2.1 抗肿瘤活性
黄芩素、汉黄芩素及其苷类具有良好的抗肿瘤活性,对乳腺癌、结直肠癌、肝癌、肺癌等多种癌症都具有抑制效果,其主要机制是通过阻断癌细胞的增殖,抑制癌细胞转移、激活癌细胞衰老凋亡或者诱导机体自噬[9-12]。肿瘤的发生、扩散和对治疗产生的抗性与抗凋亡蛋白 Bcl-2、Bcl-x(L)、Bcl-w和 Mcl-1 的过度表达密切相关。Polier 等[13]将可抑制Bcl-2、Bcl-x(L)和 Bcl-w 的抑制剂ABT-263 与汉黄芩素、黄芩素、白杨素等活性黄酮共同处理 T细胞白血病异种移植小鼠,发现这些活性黄酮可以通过下调 Mcl-1 来增强ABT-263 诱导细胞凋亡表达,并且汉黄芩素对正常增殖的T 细胞和血小板没有毒性。黄芩素能通过剂量依赖性调节甲状腺癌细胞的NF-kB 信号改变Bax/Bcl-2 比率,介导细胞凋亡蛋白浓度增加导致癌细胞发生自噬,还可以降低有丝分裂蛋白Cyclin B1 的浓度抑制甲状腺癌细胞的有丝分裂细胞周期,从而抑制癌细胞增殖[14]。汉黄芩素主要通过信号通路如丝氨酸-苏氨酸激酶 Akt 和AMP活化蛋白激酶(AMPK)通路、p53 依赖性/非依赖性细胞凋亡、端粒酶活性的抑制、转录因子(NF-κB和AP)的抑制、活性氧(ROS)以及ER 应激介导的细胞凋亡和自噬来诱导癌细胞的凋亡和抑制癌细胞增殖[15-16]。此外,黄芩素和汉黄芩素与成熟的化疗药物如水飞蓟素、顺铂、10-羟基喜树碱(HCPT)、多西他赛(多烯紫杉醇)联合使用,可以明显提高抗癌效果,还能降低癌细胞的耐药性以及对正常细胞的毒性[17-22]。黄芩素还可以与靶向治疗乳腺癌的溶瘤麻疹病毒(oncolytic measles virus, MV)联用,先利用MV 感染乳腺癌细胞,再联合黄芩素治疗,可以提高诱导癌细胞的凋亡的比率[23]。
2.2 抗病毒活性
黄芩素、汉黄芩素及其苷类能够有效地抑制病毒的复制,具有抗病毒活性。新型冠状病毒(SARSCoV-2)于2019年末开始在全球肆虐,在寻找有效药物治疗新型冠状病毒病的过程中,发现中医药中的“三药三方”,即金花清感颗粒、连花清瘟颗粒和胶囊、血必净注射液、清肺排毒汤、化湿败毒方、宣肺败毒方在此次疫情中控制COVID-19 的临床疗效显著[24-25]。吉米丽汗·司马依等[26]研究表明,金花清感颗粒的山柰酚、黄芩素和千层纸黄素A 等活性成分可能通过与ACE2 结合作用于PTGS2、BCL2和CASP3 等靶点调节多条信号通路,从而发挥对COVID-19 的治疗作用。Xia 等[27]分析了连花清瘟胶囊中10 种活性成分,构建了由65 个靶基因组成的与COVID -19 相关的靶基因集,筛选出了9 个中心基因,将参与肺损伤、肺纤维化和病毒感染的最重要基因Akt1与连花清瘟胶囊6 种活性成分(β-胡萝卜素、山柰酚、木犀草素、柚皮素、槲皮素和汉黄芩素)进行分子对接,发现6 种活性成分均可进入Akt1 的活性口袋,连花清瘟胶囊主要通过调节免疫反应、细胞凋亡和抵御病毒感染等机制发挥作用。孙逊等[28]和刘畅等[29]基于网络药理学和分子对接法,对化湿败毒方的主要活性成分进行筛选,构建成分-疾病靶点网络,并与新型冠状病毒的3CL 水解酶(3CLpro, Mpro)、血管紧张素转化酶Ⅱ(ACE2)进行分子对接,结果表明与Mpro 结合最好的是黄芩素。Zhao 等[30]研究表明清肺排毒汤中4 种活性物质(黄芩苷、甘草酸、橙皮苷和金丝桃苷)和细胞的7 个靶点(AKT1、TNF-α、IL6、PTGS2、HMOX1、IL10 和 TP53)是与清肺排毒汤疗效相关的关键分子。此外,对于其他一些病毒如艾滋病病毒(HIV)[31]、呼吸道合胞病毒(RSV)[32]、能引起新生儿畸形的寨卡病毒(ZIKV)[33]、登革热病毒[34-35]、导致失能性关节炎的基孔肯雅病毒(CHIKV)[36]等病毒,黄芩素和黄芩苷也表现出了良好的抗病毒活性。
2.3 抗炎
炎症可能引起细胞因子风暴,导致器官的损伤和衰竭[37]。研究表明,黄芩主要活性成分黄芩素、汉黄芩素及其苷类具有抗氧化和抗炎的功效,已经在多种疾病中得到验证,包括肝炎[38]、心血管疾病[39]、肺部疾病[40]、过敏性气道炎[41]、神经炎症及神经退行性疾病[42-43]以及肠道疾病[44]。黄芩素、汉黄芩素及其苷类能够直接作用于淋巴细胞、巨噬细胞、肥大细胞、树突状细胞、单核细胞、中性粒细胞等免疫细胞,抑制其产生炎症细胞因子 IL-1β、IL-6、IL-8 和 TNF-α,以及其他炎症介质,如一氧化氮(NO)、前列腺素(PGs)、白三烯(LTs)和活性氧(ROS)作用于免疫细胞,抑制其产生炎症因子及其他炎症介质。分子机制主要是通过toll 样受体的下调、Nrf2 和 PPAR 信号通路的激活以及核硫氧还蛋白系统和炎症相关通路(如 MAPK、Akt、NFκB 和 JAK-STAT)的抑制[37,45]。Huang 等[38]研究发现,黄芩苷能通过上调 TUG1 的表达,从而抑制p38MAPK 和 JNK 通路,减轻由脂多糖(LPS)刺激的正常肝脏L-02 和THLE2 细胞凋亡和炎症反应。
3 黄芩的生物技术研究
黄芩中的黄酮化合物药用价值高,因此解析这些活性黄酮的生物合成途径并阐明其调控机制,将为黄芩的育种或用合成生物学技术异源生产这些活性物质提供理论指导。
3.1 黄芩的组织培养
目前,黄芩的组织培养研究主要集中在愈伤组织的诱导、愈伤组织的分化与再生、细胞悬浮培养以及多倍体诱导[46]。如刘建霞等[47]以黄芩幼苗的茎段为材料,研究了不同的激素浓度配比对黄芩外植体诱导愈伤组织、再生芽和根的影响,发现黄芩茎段在MS+6-BA 1.0 mg/L+NAA 0.5 mg/L 的培养基中愈伤组织的诱导效果最佳;在MS+6-BA 0.5 mg/L+NAA 0.5 mg/L 的培养基中黄芩茎段的再生芽的分化效果最好;在1/2 MS+NAA 0.4 mg/L 的培养基中,黄芩茎段再生根的分化效果最好[47]。由于悬浮培养细胞具有次生代谢产物含量高和抗氧化活性较强的特点,韩淑兰[48]建立了黄芩细胞悬浮培养体系,并对黄芩苷等次生代谢产物含量进行测定,发现黄芩苷等次生代谢产物在悬浮培养20 d 时获得了最高的产量78.31 mg/g 干重。李富雄等[49]利用秋水仙素诱导了黄芩的同源四倍体。于辉等[50]测定了四倍体黄芩和二倍体黄芩中的黄芩苷和汉黄芩苷的含量,结果表明四倍体黄芩中黄芩苷和汉黄芩苷含量显著高于二倍体,由二倍体的12.83%、3.35%增为20.69%、6.23%,分别提高了61.26%和85.97%。
作者研究团队也成功建立了黄芩再生体系,将新鲜健康叶片灭菌后置于配比为MS + 3% sucrose+ 2.0 mg/L 6-BA + 0.2 mg/L IAA 的愈伤诱导培养基中,暗培养5 周,可观察到有愈伤组织长出;将得到的愈伤组织置于配比为MS + 3% sucrose + 0.1 mg/L 6-BA+0.5 mg/L PP333 的不定芽诱导培养基中,光照时间为16 h/24 h,光培养60 d 后,可以得到不定芽;将不定芽从愈伤组织上切下,置于配比为MS + 2%sucrose + 0.17 g/L K2HPO4+ 0.5 mg/L PP333 的生根培养基中,光照时间16 h/24 h,光培养30 d 后,可以长出白色的根,得到完整的黄芩再生植株(图3)。

图3 黄芩的再生植株Fig. 3 Regenerated plants of S. baicalensis
3.2 黄芩的毛状根培养系统
由于发根农杆菌的Ri 质粒诱导的毛状根具有生长迅速、激素自养、生长条件简单、次生代谢产物含量高且稳定、分化程度高和不易变异等特点,毛状根培养系统在药用植物代谢途径的解析、生产高价值的次生代谢产物以及生产重组蛋白等方面得到广泛应用[51-52]。黄芩中,利用毛状根系统进行代谢工程的相关研究已有许多报道,如通过利用毛状根系统进行基因工程改造,将次生代谢产物合成相关基因或调控的转录因子引入毛状根来调节次生代谢产物的产生。Kim 等[53]使用发根农杆菌介导的毛状根系统分别过表达肉桂酸4-羟化酶(cinnamate 4-hydroxylase,C4H)和4-香豆酰辅酶A连接酶(4-coumaroyl: CoA-ligase,4CL)基因,通过HPLC 检测黄芩苷、黄芩素和汉黄芩素含量发现,与对照组相比,过表达SbC4H的毛状根中,黄芩苷的含量从39.9 mg/g 增加到44.1 mg/g 干重,增加了1.2-1.4 倍,黄芩素和汉黄芩素分别从27.1 mg/g 增加到62.2 mg/g,4.7 mg/g 增加到10.8 mg/g 干重,分别增加了1.4-3.2 倍和1.6-3.4 倍;在过表达Sb4CL的毛状根中黄芩素是对照组的2.4 倍,汉黄芩素是对照组1.5-2.5 倍。Park 等[54]通过毛状根体系建立了黄芩的查耳酮异构酶(chalcone isomerase,CHI)基因过表达和SbCHIRNAi 沉默的转基因毛状根系,通过HPLC 对黄芩素、黄芩苷和汉黄芩素的含量进行测定,结果表明,SbCHI过表达毛状根的黄芩素、黄芩苷和汉黄芩素分别是对照组的1.8-2.5 倍、2.4-3.4倍和1.2-3 倍,SbCHIRNAi 毛状根系的黄芩素、黄芩苷和汉黄芩素相比对照组分别减少了13%-80%、4.6%-50%和22%-85%。Park 等[55]通过在毛状根培养物中过表达玉米的转录因子Lc(ZmLc)和拟南芥的转录因子PAP1(AtPAP1)可以增强黄芩苷、黄芩素和汉黄芩素的含量。
毛状根系统还可以用于表征新基因、新转录调控因子的功能以及解析未知的代谢途径。2016、2018 和2019年,Zhao 等[56-58]找到了可能参与根特异黄酮(黄芩素、汉黄芩素)合成途径中相关酶的候选基因,通过农杆菌介导的转化分别得到这些基因的RNAi 沉默的转基因毛状根,结果表明根特异黄酮的含量会随着这些基因表达量的减少而下降,验证了II 型黄酮合成酶(flavone synthase II, FNSII-2)、肉桂酰辅酶A 连接酶(cinnamate CoA ligase, CLL-7)、黄酮6 位羟化酶(flavone 6-hydroxylase,F6H)、黄酮8位羟化酶(flavone 8-hydroxylase,F8H)和8 位甲氧基转移酶(8-O-methyl transferase,PFOMT5)的确参与根特异黄酮合成途径中4′-脱氧黄酮的合成,解析了黄芩素、汉黄芩素的合成途径。
作者研究团队曾比较过不同组织来源的外植体对发根诱导效率的影响。用发根农杆菌A4 去侵染黄芩不同的外植体(子叶、叶片和下胚轴)(图4-a-c),结果发现只有子叶和叶片能够产生毛状根(图4-d 和e),且叶片诱导而来的毛状根比子叶诱导而来的毛状根粗壮,更适合后续毛状根研究。此外,作者研究团队还发现将红色荧光蛋白基因(red fluorescent protein gene,dsRed)转入黄芩毛状根,用激发光照射后,红色荧光十分明显(图4-f 和g),非常适合作为黄芩发状根中的报告基因,用于筛选转基因阳性毛状根。

图4 不同黄芩外植体诱导的毛状根及转入红色荧光蛋白的毛状根Fig. 4 Hairy roots induced by different S. baicalensis explants and hairy roots transferred with dsRed(red fluorescent protein gene)
4 黄芩的组学研究
黄芩是一种非常重要的药用植物,然而与其相关的基因组、转录组信息较少,限制了对其进行生物学研究。2016年,黄芩的花和毛状根的转录组已有发表[57],相关的转录组数据已上传NCBI 的SRA(Sequence Read Archive)数据库(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA300475)。随着三代测序技术发展,利用Illumina 和PacBio 测序策略和HIC 技术,黄芩染色体水平的高质量全基因组序列已有报道[56],数据已上传至国家基因组科学数据中 心(National Genomics Data Center)(https://bigd.big.ac.cn/gwh/Assembly/10400/show)。这是唇形科中第一个完成染色体水平全基因组测序的植物,研究者还从黄芩的花、花蕾、叶、茎、根以及JA 处理的根中提取样品进行了RNA-seq(https://www.ncbi.nlm.nih.gov/sra/SRX4549232),辅助基因组注释,共注释了28 930 个基因,在阐明黄芩的黄芩素和汉黄芩素的合成途径以及相关酶基因的发现及基因组进化方面取得了很大的进展。此外,还有研究报道了黄芩和半枝莲的染色体水平基因组(https://ngdc.cncb.ac.cn/gsa/browse/CRA001730),并证实了半枝莲和黄芩的分化时间为13.28 Mya,通过比较基因组发现二者染色体端粒比例相似,半枝莲的染色体的重排和扩张可能是近期长末端重复序列的插入导致,为黄芩和半枝莲的育种、进化、化学多样性和基因组编辑研究提供重要见解[59]。黄芩的代谢组信息也已有报道[60]。
5 黄芩代谢生物学
5.1 黄芩中黄酮合成途径的解析
研究表明,黄芩中存在地上部分和地下部分两条黄酮合成途径。地上部分(茎、叶和花)主要合成野黄芩素和野黄芩苷,为经典的黄酮合成途径,普遍存在于高等植物中;地下部分(根)主要合成黄芩素、汉黄芩素、黄芩苷和汉黄芩苷,地下部分的黄酮合成途径目前只在黄芩中发现,是黄芩特有的,也称根特异黄酮(root-specific flavones, RSF)合成途径[56-58](图5)。
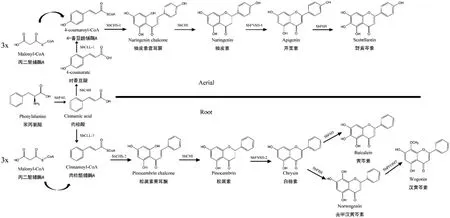
图5 黄芩的地上地下两条黄酮合成途径Fig. 5 Two flavonoid biosynthetic synthesis pathways of S. baicalensis in aerial and root parts
经典黄酮途径从莽草酸途径生成的苯丙氨酸开始,苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)催化下形成肉桂酸(cinnamic acid)[61];肉桂酸在肉桂酸羟化酶(C4H)作用下生成对香豆酸(p-coumaric acid)[62];对香豆酸经过4-香豆酰辅酶A 连接酶(4CL)催化生成香豆酰辅酶A(p-coumaroyl CoA)[63];香豆酰辅酶A 和丙二酰辅酶 A 在查耳酮合成酶(chalcone synthase, CHS)作用下生成柚皮素查耳酮(naringenin chalcone);柚皮素查耳酮在查耳酮异构酶(CHI)催化下生成柚皮素(naringenin)[64];柚皮素在黄酮合成酶(flavone synthase II, SbFNSII-1)的催化下生成芹菜素;芹菜素在黄酮6 位羟化酶(SbF6H)的作用下生成野黄芩素[57-58,65]。
根特异黄酮合成途径同样起始于苯丙氨酸,在SbPAL 作用下生成肉桂酸。随后,肉桂酸在肉桂酸辅酶A 连接酶(SbCLL-7)催化下形成肉桂酰辅酶 A(cinnamoyl CoA);肉桂酰辅酶A 在松属素查耳酮合成酶(pinocembrin-chalcone synthase, SbCHS-2)作用下生成松属素查耳酮(pinocembrin chalcone);松属素查耳酮在 CHI 的作用下产生松属素(pinocembrin);松属素在黄酮合成酶(SbFNS II-2)催化下生成白杨素(chrysin);白杨素在黄酮 6 位羟化酶或黄酮 8 位羟化酶(SbF8H)作用下分别生成黄芩素(baicalein)或去甲汉黄芩素(norwogonin);去甲汉黄芩素最终在8 位氧甲基转移酶(SbOMT)作用下生成汉黄芩素[56-58]。黄芩素和汉黄芩素在黄酮类7-O-葡萄糖醛酸基转移酶(UBGAT)的催化下生成黄芩苷和汉黄芩苷[66]。
5.2 黄芩中黄酮合成途径的调控
代谢途径不仅受内部基因的调控,还受外部因素影响。环境因子(光质、温度和水分)和诱导子(生物诱导子和非生物诱导子)同样能调控黄芩中活性黄酮的积累[65]。有研究表明,光照和黑暗两个条件下对黄芩悬浮细胞进行培养发现,光照显著促进了黄芩苷和黄芩素的积累,可能是通过诱导PAL、黄芩素-7-O-葡萄糖醛酸基转移酶(UBGAT)基因的表达,或通过内源激素进行调控[67-68]。不同光源(红色、蓝色、白色)对黄芩幼苗的根、茎和叶进行照射后发现,白光处理的黄芩幼苗根部的黄芩苷、黄芩素和汉黄芩素含量最高[69]。另有研究表明,黑暗条件有利于黄芩发状根的生长和黄芩苷的积累[70]。不同温度培养对黄芩愈伤组织中黄芩苷含量也有显著影响,在一定范围内黄芩苷的含量随着温度增加而增加,20℃培养时黄芩苷含量最高,高温35℃或较低温度(低于15℃)都对黄芩苷的合成产生了一定的抑制,可能是影响了黄芩苷合成途径中关键酶的活性[71]。此外,短期、轻中度干旱胁迫能够不同程度增强PAL、C4H、4CL 和CHS 酶活性,促进黄芩苷积累,长期、重度干旱胁迫会抑制这4 种酶的活性,导致黄芩苷的合成受到抑制[72]。
诱导子常被用来促进次生代谢产物的积累,如曲霉和米曲霉等真菌诱导子能提高黄芩毛状根中黄芩苷的含量[73]。茉莉酸甲酯(methyl jasmonate,MeJA)能够通过上调黄酮合成途径相关基因从而促进黄芩悬浮细胞、愈伤组织和发根中黄芩苷的积累[57,62,74-75]。在黄芩愈伤组织培养基中加入一定浓度的水杨酸会抑制愈伤组织生长,但能促进黄芩苷的积累[76]。添加外源植物激素如6-苄氨基嘌呤(N-(phenylmethyl)-9H-purin-6-amine, 6-BA)和萘乙酸(1-naphthylacetic acid, NAA)培养黄芩愈伤组织,也能够提高黄芩苷含量。稀土元素如镧(La),能够以茉莉酸(jasmonic acid, JA)为信号分子诱导黄芩幼苗积累黄芩苷[77]。高浓度砷抑制黄芩植物黄芩苷和汉黄芩苷的生成,但促进了黄芩素、汉黄芩素和千层纸素A 的生成[78]。
5.3 黄芩中黄酮合成途径的进化
进化分析表明,黄芩的根特异黄酮合成途径是从地上部分的经典黄酮合成途径进化而来,该途径进化在黄芩属和鼠尾草属(Salvia)的分化后形成(<32.7 Mya),该途径中只有SbCHI基因仅有一个基因座,且在地上部分和地下部分黄酮合成途径中功能相同,其他关键酶基因分别经历点突变(SbCLL-7)、串联增殖以及新功能化(SbCHS-2、SbFNSII-2、SbF8H和SbPFOMT)、片段复制(SbFNSII-2)和反转录复制(SbF6H)进化而来[79]。
PAL 催化苯丙氨酸脱氨基生成反式肉桂酸和氨,是连接初级代谢和次级代谢之间的关键酶之一[61]。Xu 等[62]使用 cDNA 末端快速扩增(RACE)技术从黄芩中克隆了3 个编码苯丙氨酸解氨酶亚型(SbPAL1、SbPAL2和SbPAL3)的全长 cDNA。黄芩和半枝莲的比较基因组分析显示,黄芩中的PAL基因数(5 个)与半枝莲的PAL(4 个)相比要多,说明这些基因的特异性扩增可能是在黄芩和半枝莲物种形成后通过串联复制发生的(<13.28 Mya)[59]。
CLL 是4CL 的异构体。基于根RNA-seq 数据库,Zhao 等[56]从黄芩中鉴定并克隆了5 个CLL基因的全长cDNA(SbCLL-1、SbCLL-5、SbCLL-6、SbCLL-7,SbCLL-8);纯化的重组蛋白SbCLL-1 和SbCLL-5 可以催化肉桂酸、4-香豆酸和咖啡酸与CoA 反应,而SbCLL-7 只能以肉桂酸为底物添加CoA;比较基因组分析表明,SbCLL-1和SbCLL-7在唇形科其他物种(丹参、一串红和芝麻)中具有同源性,但丹参、一串红和芝麻中的CLL-7对肉桂酸、4-香豆酸或咖啡酸没有活性,表明SbCLL-7对肉桂酸的特异性活性在黄芩近缘种的同源基因中没有共享,说明黄芩中的CLL基因的点突变可能发生在黄芩、丹参和一串红分化后(<32.7 Mya)。
Zhao 等[57]还从黄芩中鉴定并克隆了两个CHS基因的全长cDNA(SbCHS-1和SbCHS-2)。SbCHS-1在花中特异性表达,可能与经典黄酮和花青素的生物合成有关;SbCHS-2在根中高度表达,编码一种催化松属素查耳酮生成的酶。基于基因组分析,SbCHS-2的基因组区域发生了串联复制事件,导致SbCHS-2产生了5 个相邻的基因拷贝(SbCHS2.1-SbCHS2.6)。SbCHS-1和SbCHS-2的新功能化是随着鼠尾草属和黄芩属(~32.7 Mya)的分化而发生的,原始CHS基因在黄芩中复制,一个拷贝(SbCHS-1)移向假3 号染色体,另一个拷贝(SbCHS-2L)保留在假9 号染色体(约19 Mya)上,并在12 Mya 左右复制(SbCHS2.3)。然后通过串联复制扩增,产生其他SbCHS-2基因,并且可能在最后一个Mya内新功能化[56]。总之,黄芩的SbCHS-2经历了几轮扩增,在物种分化之前出现的重复(SbCHS2L和SbCHS2.3),以及在物种水平分化后出现串联复制(CHS-2.1、CHS-2.2、CHS-2.4、CHS-2.5和CHS-2.6)。比较基因组表明,在半枝莲中,CHS-2的复制程度没有黄芩中那么大[59],这证实了CHS-2的大部分复制是近期内发生的[56],可能是黄芩作为中药被人为筛选后引起的。
黄芩中,两种不同类型的FNS 酶(FNSI 和FNSII)通过引入C2 和C3 位的双键来实现黄烷酮到黄酮的转化。FNSI 属于酮戊二酸依赖的双加氧酶(2-oxoglutarate-dependent dioxygenase, 2OGD)超家族,最早在伞形科植物中发现[80],FNSII 是一种广泛分布于被子植物中的细胞色素P450(CYP450)单加氧酶[81]。一般来说,FNSI 和FNSII 催化具有4′-OH基团黄烷酮类,如柚皮素、圣草酚和甘草素转化为相应的黄酮[82]。Zhao 等[57]首次报道了黄芩中具有新功能的FNSII(SbFNSII-2),该FNSII 是专门合成4′-脱氧黄酮所必需的,此外,黄芩的地上部分还存在FNSII 亚型(SbFNSII-1),能将柚皮素转化为芹菜素。基因组分析表明,有两个SbFNSII-1位点是唇形科分化后(<42.7 Mya)发生片段复制的一部分,然而,黄芩基因组中仅存在一个SbFNSII-2位点,表明SbFNSII-2是由SbFNSII-1串联复制产生,并且是在鼠尾草属和黄芩属分化(<32.7 Mya)之后发生的新功能化[56]。黄芩和半枝莲比较基因组分析表明,在黄芩与半枝莲共线区域可以检测到FNSII-2的一个直系同源基因,以及FNSII-1和FNSII-2的串联复制[59]。这表明黄芩属中FNS-II复制早于物种分化,黄芩属中4 ′-脱氧黄酮化合物的进化十分保守[79]。
黄芩中的两个CYP450 家族成员负责黄酮化合物6 位和8 位的羟基化(分别是SbF6H 和SbF8H),SbF6H(CYP82D1.1)可以利用4′-羟基黄酮化合物和4′-脱氧黄酮化合物(分别为芹菜素和松属素)在地上部分和根中分别产生野黄芩素和黄芩素[58]。黄芩的5 号染色体上只有一个SbF6H位点,该位点可能来源于1 号染色体上CYP82D基因的复制和逆转录转座作用,而SbF8H则来源于1 号染色体上串联复制和新功能化[56]。
黄 芩 中 两 类OMTs(O-methyltransferases) 参与根特异性4′-脱氧黄酮化合物的生物合成。II 型OMT 依赖于Mg2+,也被称为苯丙素类和类黄酮OMT(PFOMTs),据报道,它们能将甲基转移到类黄酮的芳香环的羟基上[79]。在黄芩根中,SbPFOMT 2 和5可以有效地O-甲基化黄酮化合物的C6、C8 和C3 位,分别生成单甲氧基黄酮化合物如千层纸素、汉黄芩素、韧黄芩素Ⅱ和金圣草素[56,60]。此外,在黄芩中发现了3 条有功能的I 型OMTs(flavonoid OMTs,SbFOMTs)可 以 修 饰4′- 脱 氧 黄 酮,SbFOMT3 和SbFOMT6 是7-OMT,前者可将黄芩素转化为7-甲氧基黄芩素;后者可同时修饰黄芩素和去甲汉黄芩素底物;SbFOMT5 能使黄芩素C5、C6 和C7 上的羟基甲基化;SbPFOMT5 与SbFOMT6 组合或SbPFOMT5加SbFOMT5 组合可在酵母中分别产生黄芩黄酮I 和韧黄芩素I[60]。此外,SbPFOMT5 最近在1 号染色体上也经历了串联复制和新功能化[56]。
6 黄芩的合成生物学
随着合成生物学的发展,通过大肠杆菌、酵母等微生物合成植物天然产物成为一种高效、绿色和经济的方法[83]。已有研究报道在大肠杆菌、酵母和烟草中表达黄酮合成关键基因,重建黄酮生物合成途径,提高活性黄酮的产量。Zhao 等[58]曾在烟草中瞬时表达黄芩中的SbCLL-7、SbCHS-2、SbCHI、SbFNSII-2、SbF6H,得到了黄芩苷和野黄芩素。Li等[84]在大肠杆菌转入来自不同物种的黄酮合成关键基因,圆红酵母(Rhodotorula toruloides)的PAL、欧 芹(Petroselinum crispum) 的4CL和FNS I、 矮牵 牛(Petunia hybrida) 的CHS、 苜 蓿(Medicago sativa)的CHI以及黄芩截短的F6H,在大肠杆菌中重构了黄芩素和野黄芩素的生物合成途径,在以0.5 mg/L 的丙苯氨酸和酪氨酸为前体48 h 发酵后,得到了8.5 mg/L 的黄芩素和47.1 mg/L 的野黄芩素;经过优化丙二酰辅酶 A 的利用率后,黄芩素和野黄芩素的摇瓶产量达到了23.6 mg/L 和106.5 mg/L[84]。之后,还开发了顺序自组装酶反应器,利用大肠杆菌中蛋白质-肽相互作用将RtPAL 和Pc4CL 进行自组装,有效地减少了中间体的积累,大大的提高黄芩素和野黄芩素的产量,黄芩素的摇瓶产量从21.6 mg/L 提高到143.5 mg/L,提高了6.6 倍;野黄芩素的摇瓶产量从84.3 mg/L 提高到120.4 mg/L,提高了1.4 倍;通过发酵罐分批补料,黄芩素和野黄芩素的产量能达到271 mg/L 和288.9 mg/L;此外,还在大肠杆菌中首次实现了从葡萄糖到黄芩素的从头合成,通过分批补料发酵,黄芩素的产量能达到214.1 mg/L[85]。Qian 等[86]在毕赤酵母中分别引入黄芩根中4′-脱氧黄酮合成中的多个催化酶:PAL、CLL-1、CHS-2、CHI、FNSII-1、F6H、F8H、OMT5,结果发现其产物除了黄芩素、去甲汉黄芩素和汉黄芩素外,首次得到了千层纸素A、6-甲氧基汉黄芩素、6-甲氧基去甲汉黄芩素,表明SbF8H 和SbPFOMT5 具有多种催化作用;此外,他们在毕赤酵母中引入完整的黄芩素的生物合成途径,并以乙醇为碳源,实现了黄芩素的从头合成;为了提高黄芩素和千层纸素的产量,他们进一步将黄芩素生物合成途径分成5个模块,还构建了一系列的乙醇诱导转录信号放大装置(ESADs)和组成性转录信号放大装置(CSADs)来驱动和平衡模块,显著减少了副产物和中间产物的积累,黄芩素和千层纸素A 的产量达到报道过的最高水平401.9 mg/L 和339.5 mg/L。
7 总结与展望
黄芩作为传统的药用植物,已有数千年的使用历史,在现代医学中,黄芩仍拥有着巨大的开发潜力,如黄芩素能够很好地结合新型冠状病毒的3CLpro 靶点,阻止引起全球大流行的新冠病毒的复制[24]。此外,黄芩素和汉黄芩素等还具有良好的抗肿瘤、抗炎、神经保护等作用。目前,黄芩中根特异黄酮的生物合成途径已经完整解析,全基因组序列和转录组数据已发表,这些工作不仅为黄芩后续的研究提供了参考,也为开发利用其他药用植物提供了借鉴。到目前为止,黄芩黄酮骨架结构合成途径及A 环上的修饰机制已经研究清楚,但其B 环修饰反应还需进一步研究。如韧黄芩素I、黄芩黄酮I、甘肃黄芩素I、侧花黄芩素I,这些黄酮在B 环的2′、3′、5′和6′位置发生羟基化,该羟基化的酶尚未鉴定,且其中部分黄酮(韧黄芩素I 和黄芩黄酮I)在诱导癌细胞的细胞凋亡方面具有比黄芩素更强的细胞毒性[60],其生物合成途径及临床研究非常值得探索。
除黄芩外,黄芩属中还有许多其他入药的植物,如半枝莲(Scutellaria barbata)在韩国和朝鲜常被用来治疗咽喉肿痛、水肿和痔疮和蛇咬伤以及一些癌症;侧花黄芩(Scutellaria lateriflora)在北美被用来治疗癫痫、焦虑等神经疾病;韩信草(Scutellaria indica)在中国、韩国和印度被用来解毒、镇痛和促进血液循环[65]。黄芩属植物除含有黄酮化合物外,还含有丰富的二萜和生物碱,这些化合物具有良好的抗肿瘤活性,其生物合成途径也有待研究。飞速发展的第三代测序技术、代谢物分析技术、基因编辑技术将有助于我们进一步研究黄芩属植物活性成分的生物合成和调控,以及黄芩属植物的多样化和进化。
