大麻二酚对脂多糖诱导的小鼠乳腺上皮细胞氧化损伤的保护作用
2023-03-07张伟伟邵淑丽杨清竹
范 港 黄 鑫,2* 张伟伟,2 邵淑丽,2 杨清竹,2
(1.齐齐哈尔大学生命科学与农林学院,齐齐哈尔161006;2.齐齐哈尔大学寒区麻及制品教育部工程研究中心,齐齐哈尔161006)
乳腺炎是奶牛生产中最为常见的一种疾病,严重危害奶牛生产性能,制约奶牛养殖业和乳制品行业的健康发展。处于围产期和泌乳高峰期的奶牛乳腺组织由于其代谢旺盛,导致大量活性氧(ROS)蓄积,易受到氧化损伤,从而诱发乳腺炎等代谢性疾病[1]。病原微生物感染也是奶牛乳腺炎的主要致病因素之一,最为常见的致病菌就是大肠杆菌,其主要致病物质为细胞壁中的脂多糖(LPS)。LPS可诱导机体产生炎性因子,加速ROS的积累并破坏抗氧化防御机制,引发氧化应激,造成乳腺损伤。抗生素虽然对乳腺炎有一定的治疗作用,然而持续大量地使用抗生素不仅会引发病菌的耐药性,还会导致药物残留于奶牛乳腺中,危害人类健康[2-3]。因此,寻找安全高效的抗氧化物质,以缓解奶牛氧化应激造成的危害,对于提高奶牛泌乳性能具有重要意义。近年来,从植物中提取的一些天然活性成分因具有高效、安全和无药物残留等特点,已被广泛用于动物乳腺炎的相关研究,天然活性成分的开发和利用已成为治疗奶牛乳腺炎的有效途径。

1 材料与方法
1.1 试验材料
小鼠乳腺上皮细胞HC11购自北京北纳创联生物技术研究院;CBD(HPLC≥98%)购自成都普瑞法科技公司;LPS(大肠杆菌O55∶B5)、BCA蛋白定量试剂盒、MTT法细胞活力检测试剂盒、RIPA裂解液、ROS检测试剂盒购自上海碧云天生物技术有限公司;维生素E、脱脂奶粉、二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;Trizol购自Invitrogen公司;蛋白酶体抑制剂购自MCE公司;RPMI-1640干粉、胎牛血清(FBS)购自Gibco公司;T-AOC、GSH-Px检测试剂盒购自南京建成生物工程研究所;微量MDA检测试剂盒购自江苏凯基生物技术股份有限公司;SOD检测试剂盒购自合肥兰杰柯科技有限公司;逆转录试剂盒购自东洋纺(上海)生物科技公司;SYBR®Premix Ex TaqTM试剂盒购自宝生物工程(大连)有限公司;聚偏氟乙烯(PVDF)转印膜购自GE Amersham公司;Nrf2、HO-1、NQO1、SOD1和β-肌动蛋白(β-actin)一抗购自Proteintech公司;二抗(IRDye®800CW Goat anti-Rabbit IgG)购自Abcam公司。
1.2 主要设备
CO2细胞培养箱、NanoDrop ND-2000C微量紫外分光光度计购自Thermo Fisher Scientific公司;Z32HK高速台式冷冻离心机购自Eppendorf公司;Spark 10M多功能酶标仪购自TECAN公司;倒置荧光显微镜购自Olympus公司;Mastercycler Realplex 4荧光定量PCR仪购自Eppendorf公司;Odyssey IR双红外荧光成像仪购自LI-COR公司。
1.3 试验方法
1.3.1 MTT法检测LPS、CBD对HC11细胞活力的影响
试验分为对照组(接种细胞但不加药处理)、LPS(1 μg/mL)组、不同浓度(2、4、6、8、10、20 μmol/L)CBD组以及不同浓度(2、4、6 μmol/L)CBD+LPS组(先添加CBD预处理1 h后再加入LPS),每组设置5个重复孔。将处于对数期的HC11细胞接种于96孔板中(5×103个/孔),培养过夜。药物处理24 h后,各孔加入10 μL MTT(5 mg/mL),继续培养4 h后吸出培养液,各孔加入100 μL DMSO,10 min后检测各孔在490 nm的吸光度(OD)值并进行计算,试验重复3次。
1.3.2 CBD对LPS诱导的HC11细胞内ROS和MDA含量的影响
试验分为对照组、LPS组、2 μmol/L CBD+LPS组、4 μmol/L CBD+LPS组、6 μmol/L CBD+LPS组和维生素E+LPS组(10 mmol/L维生素E预处理1 h后,与LPS共处理24 h,作为阳性对照)。药物处理24 h后弃培养基,使用无血清培养基洗涤细胞2~3遍,加入稀释的DCFH-DA,37 ℃孵育20 min后洗涤细胞3次,使用倒置荧光显微镜对各组细胞样品进行拍照。MDA含量检测方法参照试剂盒说明书进行操作。
1.3.3 CBD对LPS诱导的HC11细胞内GSH-Px、SOD活性及T-AOC的影响
试验分为对照组、LPS组及2μmol/LCBD+LPS组、4 μmol/L CBD+LPS组、6 μmol/L CBD+LPS组。当细胞汇合度达到70%~80%时,先加入不同浓度CBD预处理1 h,然后加入LPS处理;药物处理24 h后,弃培养基,磷酸盐缓冲液(PBS)洗涤细胞2~3次,胰蛋白酶消化细胞并转移至1.5 mL离心管中,之后严格按照GSH-Px、SOD及T-AOC检测试剂盒说明书进行操作。
1.3.4 实时荧光定量PCR(qRT-PCR)检测CBD对LPS诱导的HC11细胞内抗氧化相关基因mRNA表达的影响
试验分组及药物处理方法同1.3.3。药物处理24 h后收集细胞,提取细胞总RNA并反转录为cDNA。以β-actin作为内参基因,检测Nrf2、HO-1、NQO1和SOD1的mRNA表达情况。实时荧光定量PCR引物序列见表1。采用10 μL反应体系:AceQ®qPCR SYBR®Green Master Mix 5.0 μL,上、下游引物各0.5 μL,cDNA(稀释5倍)2.0 μL,双蒸水(ddH2O)2.0 μL。反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,95 ℃ 15 s,60 ℃ 30 s,进行40个循环。qRT-PCR结果采用2-△△Ct法进行处理。

表1 实时荧光定量PCR引物序列
1.3.5 Western blot检测CBD对LPS诱导的HC11细胞内抗氧化相关蛋白表达的影响
试验分组及药物处理方法同1.3.3。药物处理24 h后,每孔加预冷PBS清洗3次;每孔加入适量RIPA裂解液(含蛋白酶体抑制剂)后4 ℃摇床裂解30 min;将裂解液转移至预冷的1.5 mL离心管中,4 ℃、12 000 r/min离心10 min,留上清液;从各组样品中吸取20 μL上清液,用BCA蛋白定量试剂盒测定其蛋白浓度,其余上清中加入6×上样缓冲液,沸水变性10 min;根据蛋白浓度测定结果,用1×上样缓冲液调平各组样品的蛋白浓度。蛋白经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜后用含5%脱脂奶粉的封闭液封闭。蛋白条带经一抗(1∶1 000稀释)、二抗(1∶10 000稀释)孵育后,利用Odyssey红外荧光扫描仪对蛋白条带进行扫描。
1.4 数据处理与分析
使用Image J软件对Western blot结果进行灰度分析,使用GraphPad Prism 5.0软件对数据进行处理分析并作图,数据均以平均值±标准差(mean±SD)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 LPS、CBD对HC11细胞活力的影响
利用MTT法检测不同浓度CBD对HC11细胞活力的影响,结果如图1-A所示。CBD浓度在20 μmol/L以内时对HC11细胞活力均无显著影响(P>0.05),且CBD浓度为2、4、6 μmol/L时HC11细胞活力与对照组相比略有上升。后续试验采用2、4、6 μmol/L CBD对HC11细胞进行预处理,以探究其对LPS诱导的HC11细胞氧化损伤是否具有保护作用。本研究进一步检测了LPS单独处理以及2、4、6 μmol/L CBD+LPS共处理对HC11细胞活力的影响,结果如图1-B所示。LPS单独处理和2、4、6 μmol/L CBD+LPS共处理对HC11细胞活力均无显著影响(P>0.05)。上述试验结果表明,LPS和CBD对HC11细胞活力无影响,后续试验结果不受细胞活力变化的影响。

A:CBD对HC11细胞活力的影响;B:LPS与CBD+LPS对HC11细胞活力的影响。CON:对照组;CBD:CBD组;LPS:LPS组;CBD+LPS:CBD+LPS组;2、4、6、8、10、20:CBD作用浓度(μmol/L)。各组数据柱上的数值为与对照组相比较的P值。
2.2 CBD对LPS诱导的HC11细胞内ROS、MDA含量的影响
DCFH-DA是一种荧光探针,本身无荧光,进入细胞后会被细胞内的酯酶水解生成DCFH,从而使探针装载到细胞内。细胞内的ROS可以将其氧化生成有绿色荧光的DCF,其荧光强度反映了细胞内ROS的含量。CBD对LPS诱导的HC11细胞内ROS含量的影响如图2所示。与对照组相比,1 μg/mL LPS处理后HC11细胞内生成大量ROS,绿色荧光强度较高;维生素E+LPS处理后HC11细胞内ROS含量显著降低,几乎检测不到绿色荧光,而利用2、4、6 μmol/L CBD预处理后HC11细胞内ROS含量明显下降,其中以6 μmol/L CBD预处理后效果最显著。
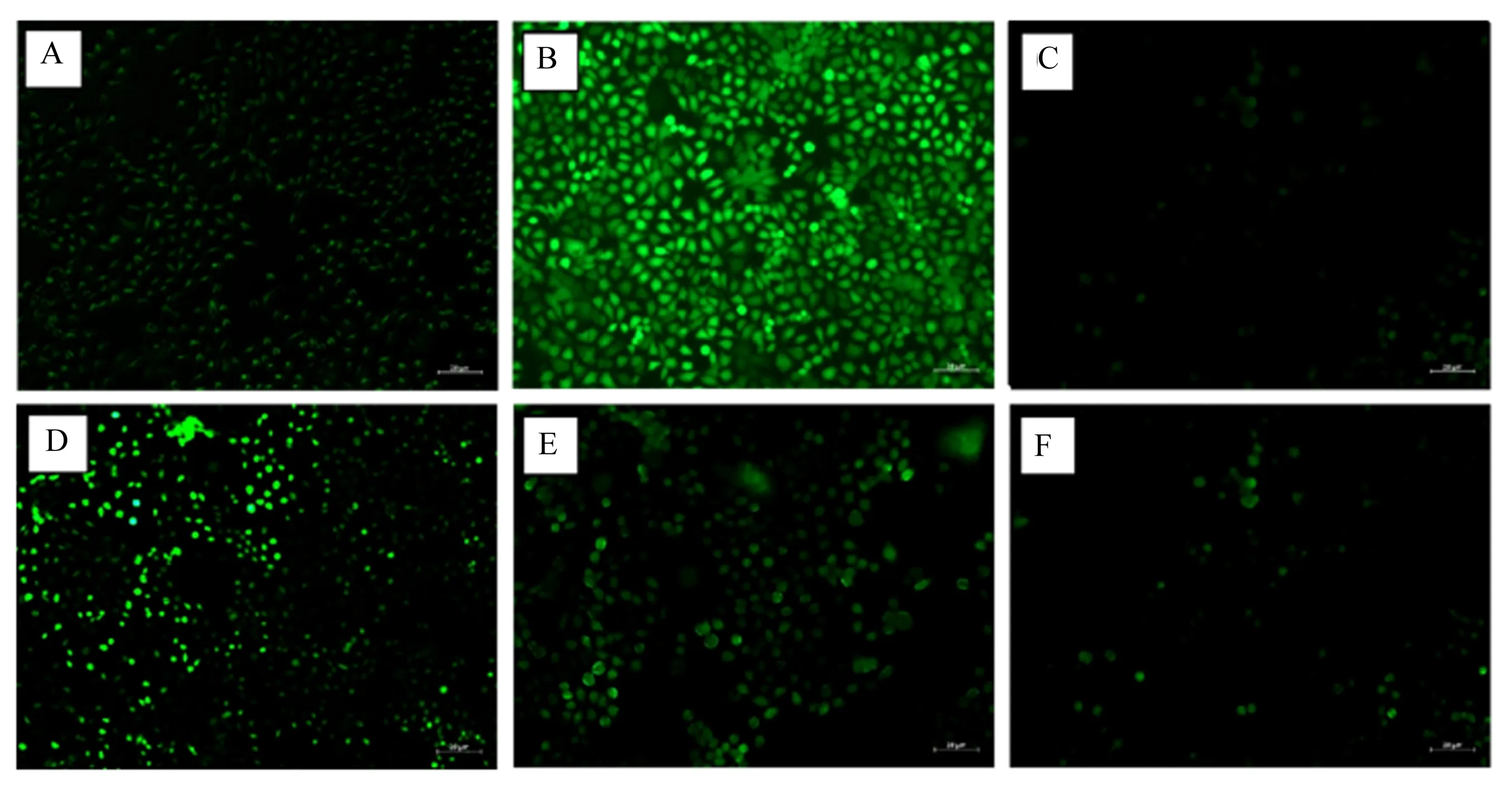
A:对照组;B:LPS组;C:维生素E+LPS组;D:2 μmol/L CBD+LPS组;E:4 μmol/L CBD+LPS组;F:6 μmol/L CBD+LPS组。
CBD对LPS诱导的HC11细胞内MDA含量的影响如表2所示。与对照组相比,1 μg/mL LPS处理后HC11细胞内MDA含量显著上升(P<0.05);与LPS相比,2、4、6 μmol/L CBD预处理后HC11细胞内MDA含量均显著下降(P<0.05),其中以6 μmol/L CBD+LPS组MDA含量最低。
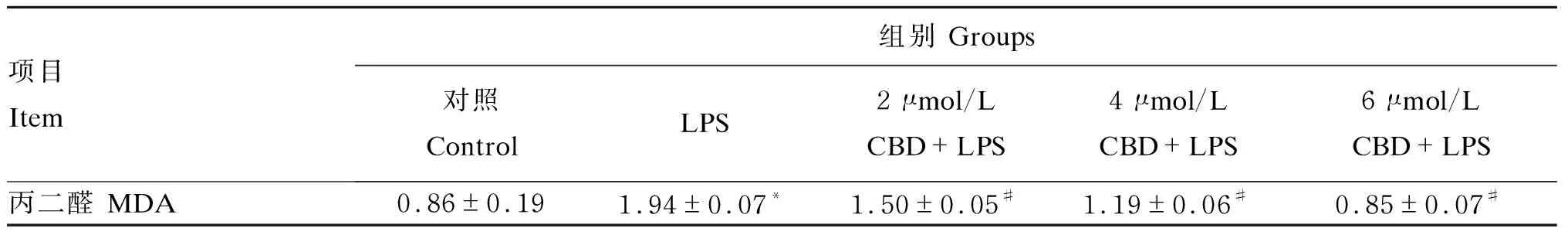
表2 CBD对LPS诱导的HC11细胞内MDA含量的影响
2.3 CBD对LPS诱导的HC11细胞内GSH-Px、SOD活性及T-AOC的影响
CBD对LPS诱导的HC11细胞内GSH-Px、SOD活性及T-AOC的影响如表3所示。与对照组相比,1 μg/mL LPS处理后,HC11细胞内GSH-Px、SOD活性和T-AOC均极显著降低(P<0.01)。与LPS组相比,4、6 μmol/L CBD预处理后HC11细胞内GSH-Px、SOD活性和T-AOC均极显著升高(P<0.01);2 μmol/L CBD预处理后HC11细胞内GSH-Px活性无显著变化(P>0.05),T-AOC显著升高(P<0.05),SOD活性极显著升高(P<0.01)。由以上结果可知,6 μmol/L CBD预处理对LPS诱导的HC11细胞内GSH-Px、SOD活性和T-AOC的保护作用最为明显。

表3 CBD对LPS诱导的HC11细胞内GSH-Px、SOD活性及T-AOC的影响
2.4 CBD对LPS诱导的HC11细胞内抗氧化相关基因mRNA表达的影响
CBD对LPS诱导的HC11细胞内抗氧化相关基因mRNA表达的影响如图3所示。与对照组相比,1 μg/mL LPS处理后HC11细胞内Nrf2、NQO1、SOD1 mRNA相对表达量极显著下调(P<0.01),HO-1 mRNA相对表达量显著下调(P<0.05);与LPS组相比,2、4、6 μmol/L CBD预处理后HC11细胞内Nrf2、HO-1、NQO1和SOD1 mRNA相对表达量均极显著上调(P<0.01)。
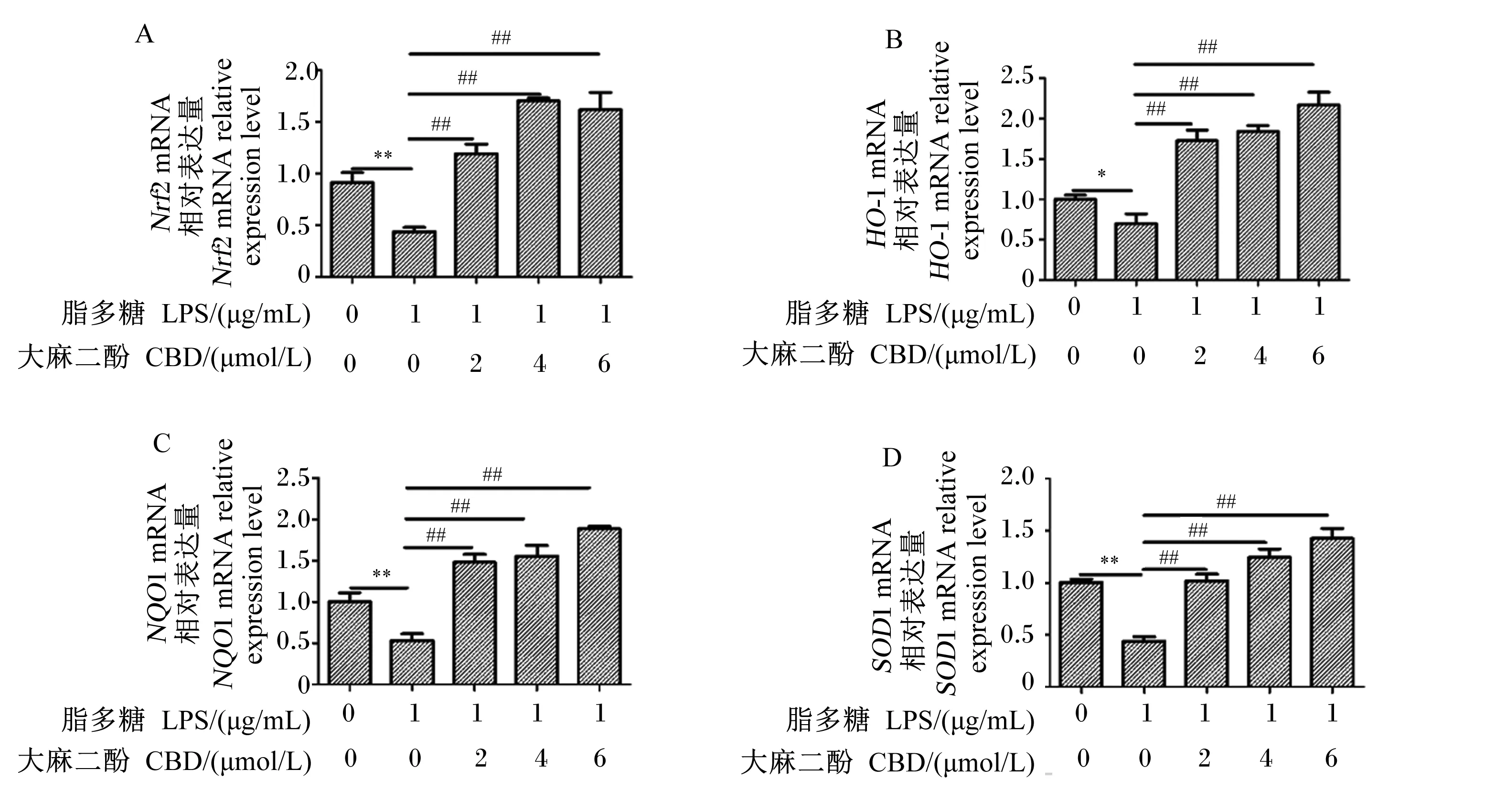
“*”表示与对照组相比差异显著(P<0.05),“**”表示与对照组相比差异极显著(P<0.01),“#”表示与LPS组相比差异显著(P<0.05),“##”表示与LPS组相比差异极显著(P<0.01)。下图同。

图4 CBD对LPS诱导的HC11细胞内抗氧化相关蛋白表达的影响
2.5 CBD对LPS诱导的HC11细胞内抗氧化相关蛋白表达的影响
CBD对LPS诱导的HC11细胞内抗氧化相关蛋白表达的影响如图5所示。与对照组相比,1 μg/mL LPS处理后,HC11细胞内HO-1、NQO1和SOD1蛋白相对表达量极显著下调(P<0.01),Nrf2蛋白相对表达量显著下调(P<0.05);与LPS组相比,4、6 μmol/L CBD预处理后HC11细胞内Nrf2、HO-1、NQO1和SOD1蛋白相对表达量均极显著上调(P<0.01);2 μmol/L CBD预处理后HC11细胞内Nrf2、NQO1和SOD1蛋白相对表达量均极显著上调(P<0.01),HO-1蛋白相对表达量显著上调(P<0.05)。
3 讨 论
乳腺上皮细胞不仅是乳腺组织中合成乳蛋白、乳脂和乳糖等基本乳成分的主要场所,也是乳腺的天然屏障。当乳腺上皮细胞受到损伤时,其屏障功能丧失,导致机体发生氧化应激及炎症反应。本研究利用LPS诱导建立HC11细胞氧化损伤模型。在前期研究中,已筛选出建立氧化损伤细胞模型的LPS最佳作用浓度和处理时间分别为1 μg/mL和24 h。Guo等[18]利用此方法诱导原代牛乳腺上皮细胞(BMECs)发生炎症反应以探究烟酸对乳腺炎的缓解作用。Lai等[19]在研究中也采用此方法建立小鼠乳腺上皮细胞(mMECs)炎症反应模型以探究靛玉红对小鼠乳腺炎的治疗作用。许多乳腺炎的相关研究均采用类似方法建立氧化损伤或炎症反应细胞模型。
当机体内ROS产生速度大于抗氧化剂的清除速度时,过量的ROS会攻击细胞内DNA和蛋白质,从而引发细胞氧化损伤,诱发乳腺炎等代谢性疾病。此外,机体发生氧化应激时会发生脂质氧化并产生包括MDA在内的一系列复杂化合物,其过量积累会引发细胞膜结构和功能发生改变,从而损伤细胞。因此,MDA含量可间接体现机体的氧化损伤程度[20]。本研究以细胞内ROS和MDA含量作为衡量机体氧化损伤程度的2个重要指标。采用DCFH-DA探针法和TBA法分别检测了不同处理HC11细胞内ROS和MDA含量,结果显示,与LPS组相比,不同浓度CBD预处理后HC11细胞内中ROS和MDA含量均显著降低,其中以6 μmol/L CBD预处理时效果最为显著。
抗氧化酶活性是反映细胞氧化应激状态的主要指标之一。当机体内产生大量ROS时,抗氧化酶会起到防御作用,清除过多的ROS以维持机体正常生理功能[20]。GSH-Px是机体中广泛存在的一种过氧化物分解酶,能催化还原型谷胱甘肽(GSH)还原脂质氢过氧化物成羟基化合物,从而清除自由基,在保护细胞免受自由基损伤过程起着关键作用[21]。SOD是一种能够清除机体内氧自由基,尤其是超氧阴离子自由基的抗氧化酶,对机体的氧化与抗氧化平衡起到至关重要的作用[22]。机体中存在的各种抗氧化大分子、小分子和酶的总体水平即体现了该体系内的T-AOC,它是反映机体抗氧化功能综合表现的指标[23]。因此,本试验通过检测不同浓度CBD对LPS诱导的HC11细胞内GSH-Px、SOD活性和T-AOC的影响,以探究CBD对LPS诱导的乳腺上皮细胞氧化损伤的保护作用。结果显示,当利用3种不同浓度CBD预处理HC11细胞后,细胞内GSH-Px、SOD活性及T-AOC较LPS组显著或极显著升高,该结果表明,CBD能够通过提升细胞内抗氧化酶的活性清除过多的ROS和MDA,从而缓解LPS诱导的细胞氧化损伤。
Nrf2调节涉及细胞稳态的多种基因。正常情况下,Nrf2与Kelch样环氧氯丙烷相关蛋白1(Keap1)在细胞质中形成复合体呈失活状态。当发生氧化应激时,Keap1与Nrf2解离,Nrf2进入细胞核内与DNA上相应靶位点结合,可激活HO-1、NQO1和SOD1等抗氧化酶活性,维持机体氧化平衡状态[24]。Wang等[25]研究证实,2-甲基壬基酮(鱼腥草中提取的一种天然活性成分)可通过激活Nrf2信号通路产生HO-1,从而减少LPS诱导的MAC-T细胞氧化损伤。Li等[26]研究表明,姜黄素(一种天然酚类物质)通过激活Nrf2信号通路上调HO-1和NQO1的表达,从而减轻LPS诱导的MAC-T细胞氧化损伤及炎症反应。为了研究CBD对Nrf2及相关抗氧化酶基因和蛋白表达的影响,本试验通过qRT-PCR和Western blot分别检测了不同组HC11细胞内Nrf2、HO-1、NQO1和SOD1 mRNA及其编码蛋白的相对表达水平。结果显示,与LPS组相比,不同浓度CBD预处理后HC11细胞内Nrf2 mRNA及其编码蛋白的相对表达量均极显著上调,HO-1、NQO1和SOD1等抗氧化酶的mRNA和蛋白相对表达水平也均显著或极显著上调,与上述研究结果类似。综上所述,CBD可以通过激活Nrf2信号通路促进抗氧化酶HO-1、NQO-1和SOD1的表达,对LPS诱导的HC11细胞氧化损伤起到保护作用。
4 结 论
CBD可通过激活Nrf2信号通路促进HO-1、NQO-1和SOD1等抗氧化酶的表达,提高细胞总抗氧化能力,清除细胞内过多的ROS和MDA,对LPS诱导的HC11细胞氧化损伤起到一定的保护作用,当CBD浓度为6 μmol/L时保护效果最为显著。因此,CBD具有作为饲料添加剂应用于奶牛生产以提高奶牛乳腺组织抗氧化机能的潜力。
