桑叶提取物对鳜鱼生长性能、血清免疫指标、抗氧化能力及肝脏和肠道健康的影响
2023-03-07周东来汪福保李庆荣邝哲师邢东旭邹宇晓刘振兴廖森泰
周东来 刘 凡 汪福保 李庆荣 邝哲师 邢东旭 邹宇晓 刘振兴 杨 琼* 廖森泰*
(1.广东省农业科学院蚕业与农产品加工研究所,广州510610;2.佛山市南海区杰大饲料有限公司,佛山528211;3.广东省农业科学院动物卫生研究所,广州510640)
鳜鱼(Sinipercachuatsi)隶属于鲈形目(Perciformes)真鲈科(Percichthyidae)鳜属(Siniperca),俗称桂花鱼,是我国久负盛名的淡水经济鱼类。鳜鱼因肉质鲜美、无肌间刺以及营养价值高等特点,深受国内外消费者喜爱[1]。自20世纪70年代鳜鱼人工繁殖技术取得突破后,鳜鱼人工养殖迅速发展,《2022中国渔业统计年鉴》数据显示,2021年我国的鳜鱼养殖总产量达到37.4万t,产值超过200亿元[2]。鳜鱼为肉食性鱼类,以摄食活饵料鱼为主,随着鳜鱼摄食机理和配合饲料驯化技术的进步,目前已经初步实现了鳜鱼人工配合饲料养殖[3-4]。在人工配合饲料养殖过程中,脂肪肝和肠道损伤是影响鳜鱼成活率的主要隐性威胁[5]。而且,鳜鱼在养殖过程中因病害频发、成活率较低而大量使用渔药和抗生素,这也会严重影响鳜鱼的质量安全。因此,筛选能够促进鳜鱼生长、增强免疫力、提高抗氧化能力和保护肝肠功能的适宜饲料添加剂是促进鳜鱼养殖业健康发展的关键。
桑树(MorusalbaL.)在我国种植历史悠久,而桑叶也被广泛用作食品和中草药原料[6-7]。桑叶中富含多糖、黄酮类、生物碱、多酚等多种天然活性物质[6,8]。研究表明,桑叶具有降血糖[9]、降血脂[10]、抗菌[11]、抗氧化[12]、抗病毒[13]和抗炎[14]等多种功能。桑叶提取物(mulberry leaf extract,MLE)一般是由晒干粉碎后的桑叶粉经过正丁醇、乙醇和水等溶剂经过加热提取后得到的混合物[15],含有大量的多糖类、黄酮类、生物碱类等生物活性物质[13]。目前对桑叶及其提取物进行了广泛的研究,主要集中在提取工艺[6]、药理活性[16]、临床应用[17]、营养和功能成分[6]、饲料蛋白质源替代[18]等方面,但其作为饲料添加剂在水产养殖上的应用研究较少。Li等[19]研究发现,饲料中添加MLE可改善大鲵的生长性能,提高饲料利用率,改善肠道和肝脏的抗氧化能力。另外,王咏梅等[20-21]发现,在饲料中添加桑叶黄酮对凡纳滨对虾生长性能和体成分没有显著性影响,但可提高凡纳滨对虾抗氧化能力,促进凡纳滨对虾肠道发育,增加肠道菌群多样性。此外,饲料中添加桑叶黄酮对吉富罗非鱼生长性能没有显著影响,但能够改善吉富罗非鱼的血清和肝脏抗氧化指标,提高抗亚硝酸盐应激能力[22]。目前,鲜见使用MLE作为饲料添加剂研究其对鳜鱼生长性能、免疫功能及肝肠功能影响的报道。因此,本试验旨在研究3种不同MLE添加水平对鳜鱼生长性能、抗氧化功能、血清免疫指标、肝脏和肠道组织形态的影响,为MLE在鳜鱼配合饲料中的合理应用提供理论依据。
1 材料与方法
1.1 MLE的制备工艺及主要活性成分含量测定
首先进行桑叶样品预处理。将采摘的新鲜桑叶洗净、晒干后粉碎,过60目筛网。将桑叶样品粉末装入烧瓶中,加入20倍体积的石油醚,放置过夜,然后采用60 ℃水浴回流处理2 h,过滤,留滤渣风干、备用。桑叶提取物提取步骤如下:称取一定量的预处理过的桑叶粉,置于烧瓶中,加入30倍体积75%乙醇溶液,40 ℃超声辅助提取,每次提取30 min,重复3次。过滤,弃滤渣,将滤液合并,经减压浓缩、冷冻干燥,即得MLE粉末,4 ℃保存备用。
MLE中主要活性成分含量测定。参照文献[23]中的苯酚-硫酸法和硝酸铝-亚硝酸钠比色法分别测定桑叶多糖和桑叶黄酮的含量。以葡萄糖为标准品,以葡萄糖溶液质量浓度(mg/mL)为横坐标,以吸光度(OD)490 nm为纵坐标,得标准曲线方程:y=10.305x+0.011 6,R2=0.996 4,利用葡萄糖溶液质量浓度标准曲线计算桑叶多糖的含量。以芦丁为标准品,以芦丁溶液质量浓度(mg/mL)为横坐标,以OD510 nm为纵坐标,得标准曲线方程:y=5.667x+0.001,R2=0.999 9,利用芦丁标准曲线计算桑叶黄酮的含量。桑叶多糖和桑叶黄酮的提取得率计算公式如下:

式中:me为MLE的质量(g);C为MLE中桑叶多糖或桑叶黄酮的含量(mg/g);mp为桑叶粉的质量(g)。
1.2 试验饲料
根据鳜鱼的营养需求,以鱼粉、肠黏膜蛋白粉等为蛋白质源,以鱼油、豆油和大豆磷脂为脂肪源,配制基础饲料。在基础饲料中分别添加0(对照组)、1(MLE1组)、5(MLE5组)和10 g/kg(MLE10组)的MLE,配制成4种等氮等脂饲料。试验饲料组成及营养水平见表1。
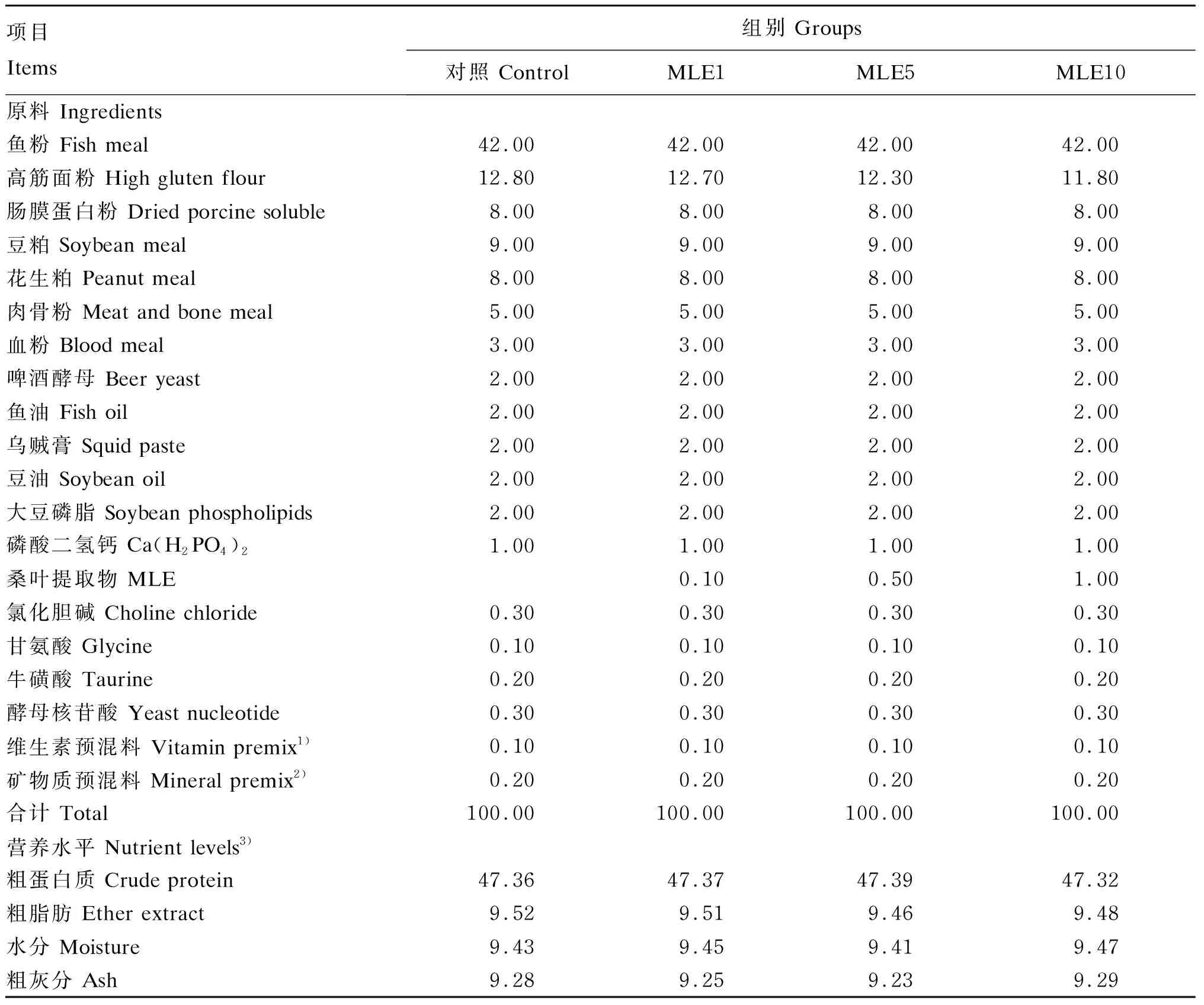
表1 试验饲料组成及营养水平(干物质基础)
膨化饲料制备方法如下:首先,按表1配比称取各原料,然后将称取后的各原料混合均匀,经过超微粉碎机粉碎,使所有成分都能够通过250 μm的筛网;再将混合均匀的原料移入调制解调器,通入102 ℃的水蒸气调制8 min,然后在95 ℃的温度下进行挤压膨化制粒;再在80 ℃条件下将饲料颗粒烘干,饲料冷却后分装并储存于-20 ℃冰箱中备用(饲料由佛山市南海区杰大饲料有限公司代加工)。
1.3 饲养管理
试验所用鳜鱼由佛山市三水区合洋水产有限公司提供,鳜鱼苗经过人工驯化后能够正常采食人工配合饲料。鳜鱼驯化的基本流程为:先投喂活饵待摄食正常后逐步过渡到投喂死的饵料鱼,聚群抢食状态良好后再过渡到投喂添加诱食剂的人工配合饲料,使鳜鱼的味感和视觉逐渐适应并最终完全适应人工配合饲料。发现鱼苗个体不均匀以及大鱼吃小鱼现象时要及时分筛,放苗密度根据鱼的规格大小为1 000~2 000 尾/m3,整个驯食过程7~10 d。养殖试验在佛山市南海区杰大饲料有限公司养殖基地的室内循环水养殖系统中进行,养殖系统由12个养殖桶(有效体积为400 L)和1个生化过滤系统组成,养殖水源为经过过滤、消毒、曝气处理后的自来水,养殖期间少量补充蒸发水和排污水。
选择当年培育驯化后的体质健壮、大小均匀的鳜鱼[体重为(42.35±0.07) g]540尾,随机分为4组,每组3个重复,每个重复45尾。正式试验前先用基础饲料试养14 d,正式试验为期72 d,日投饲率为体质量的2%~3%,每天08:30—09:00、16:00—16:30各投喂1次,将投喂后0.5 h内未吃完的饲料捞出烘干后称重,准确记录每次投喂后鳜鱼采食量。试验期间养殖水温为25~30 ℃。保证养殖水体中溶解氧浓度为6.0~8.5 mg/L,pH为7.2~8.0,氨氮浓度≤0.10 mg/L,亚硝酸盐氮浓度≤0.05 mg/L。
1.4 样品采集与制备
养殖试验持续72 d,养殖72 d后采集样品。采集样品前,先对试验鳜鱼禁食24 h,然后从每组随机取15尾鱼(每个桶5尾鱼),用MS-222进行麻醉后,测量体长、体重,然后将鳜鱼进行解剖,并分别测定内脏、肝胰脏和肠道的重量。
每组随机取9尾鱼(每个桶3尾鱼),分离肠道,去除表面脂肪,分别取长度约1 cm的中肠,用3%多聚甲醛固定液固定,用于石蜡组织切片;分离出肝脏,在相同部位切取约0.5 cm3的肝脏,用3%多聚甲醛固定液固定,用于石蜡组织切片。
每组随机取9尾鱼(每个桶3尾鱼),用注射器进行尾部静脉采血,将血液4 ℃静置2 h,然后3 000 r/min离心10 min,取上层血清保存于-20 ℃冰箱,用于血清免疫指标、抗氧化指标和酶活性测定。
1.5 指标测定
1.5.1 生长性能及形体指标测定
生长性能和形体指标的测定参照文献[24]的试验方法,具体的计算公式如下:
增重率(weight gain rate,WGR,%)=
100×(Wt-W0)/W0;
肥满度(condition factor,CF,g/cm3)=100×Wt/L3;
特定生长率(specific growth rate,SGR,%/d)=
100×(lnWt-lnW0)/t;
脏体指数(viscera somatic index,VSI,%)=100×
Wv/Wt;
肝体指数(hepatopancreas somatic index,HSI,%)=
100×Wh/Wt;
肠体指数(viserosomatic index,VI,%)=100×
Wi/Wt;
饲料系数(feed conversion ratio,FCR)=F/
(Wt-W0);
成活率(survival rate,SR,%)=100×Nt/N0。
式中:Wt和W0分别为试验鱼的终末体质量(FBW)和初始体质量(IBW)(g);t为养殖试验天数(d);F为饲料摄入量(g);N0和Nt分别为试验开始和结束时试验鱼的尾数(尾);L为鱼体长(cm);Wv为内脏重(g);Wh为肝胰脏重(g);Wi为肠道重(g)。
1.5.2 血清抗氧化指标测定
血清过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)活性及总抗氧化能力(T-AOC)、丙二醛(MDA)和还原型谷胱甘肽(GSH)含量均采用南京建成生物工程研究所的试剂盒进行测定,具体的测定方法参照每个试剂盒的说明书进行。
1.5.3 血清免疫指标测定
采用南京建成生物工程研究所试剂盒对血清白蛋白(ALB)、总蛋白(TP)含量及碱性磷酸酶(AKP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)和溶菌酶(LZM)活性进行测定,具体的测定方法参照试剂盒说明书进行。
1.5.4 肠道、肝脏染色组织切片的制备及观察
取上述用多聚甲醛溶液固定的肠道和肝脏组织,制作常规石蜡切片,切片厚度为6 μm,用苏木素-伊红(HE)染色。利用全景切片数字扫描仪(PANNORAMIC-1000,3DHISTECH)对切片进行扫描拍照,利用CaseViewer 2.2(3DHISTECH)软件截取切片组织照片。截图完成后使用Image-Pro Plus 6.0(Media Cybemetics)分析软件分别测量肠绒毛高度、绒毛宽度和肌层厚度。
1.6 数据处理及统计分析
试验结果均用平均值±标准差(mean±SD)表示,采用SPSS 26.0统计软件中one-way ANOVA程序进行单因素方差分析,Duncan氏法进行多重比较,P<0.05表示差异显著。
2 结 果
2.1 MLE主要活性成分及含量
由表2可知,利用75%乙醇溶液提取的MLE中主要活性成分为桑叶多糖和桑叶黄酮。其中,MLE中桑叶多糖的含量为513.44 mg/g,提取得率为15.57%;桑叶黄酮的含量为88.23 mg/g,提取得率为2.69%。
2.2 MLE对鳜鱼生长性能的影响
由表3可知,与对照组相比,在饲料中添加1、5和10 g/kg的MLE对鳜鱼的终末体质量、特定生长率、增重率、饲料系数和成活率都没有显著影响(P>0.05),但随着饲料中MLE添加水平的提高,鳜鱼的成活率逐渐提高。

表2 MLE中的主要活性成分及含量
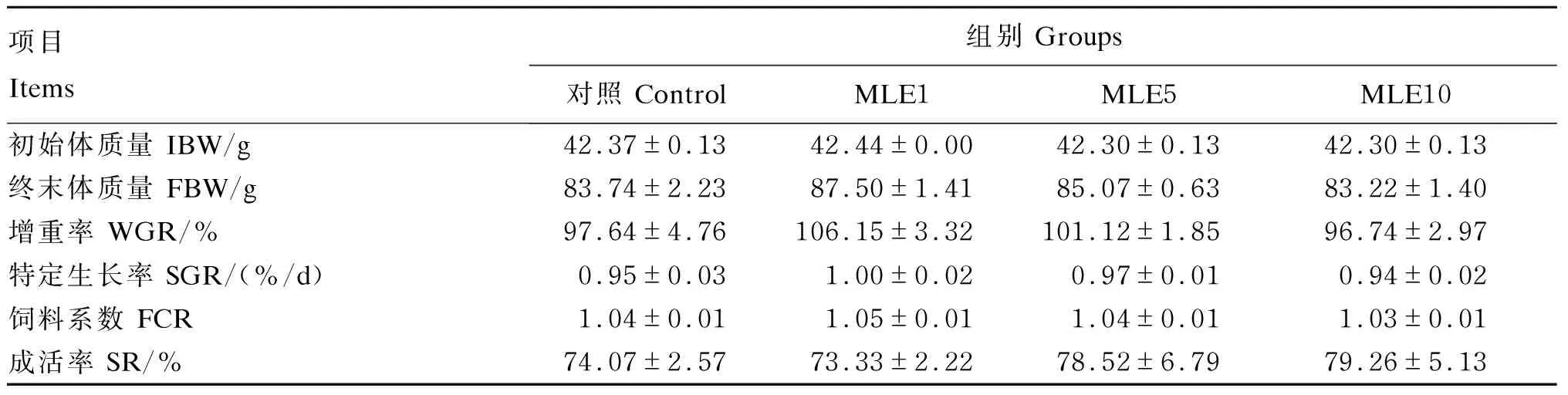
表3 MLE对鳜鱼生长性能的影响
2.3 MLE对鳜鱼形体指标的影响
由表4可知,与对照组相比,饲料中添加1和5 g/kg的MLE对鳜鱼的脏体指数、肝体指数、肠体指数和肥满度都没有显著影响(P>0.05);饲料中添加10 g/kg的MLE能显著降低鳜鱼脏体指数(P<0.05),但对肝体指数、肠体指数和肥满度都没有显著影响(P>0.05)。随着饲料中MLE添加水平的提高,鳜鱼的脏体指数逐渐降低,添加10 g/kg MLE时,脏体指数最低,并且显著低于其他组(P<0.05)。

表4 MLE对鳜鱼形体指标的影响
2.4 MLE对鳜鱼血清免疫指标的影响
由表5可知,与对照相比,饲料中添加1 g/kg的MLE能够显著降低鳜鱼血清AST和ALT的活性(P<0.05),显著提高TP的含量(P<0.05),但对LYZ的活性没有显著影响(P>0.05);添加5 g/kg的MLE显著降低鳜鱼血清ALT和LYZ的活性(P<0.05),显著降低TP的含量(P<0.05),但对AST的活性没有显著影响(P>0.05);添加10 g/kg的MLE显著降低血清AST和LYZ的活性(P<0.05),显著降低TP的含量(P<0.05),但对ALT的活性没有显著影响(P>0.05);此外,添加1、5和10 g/kg的MLE对血清AKP的活性和ALB的含量都没有显著影响(P>0.05)。
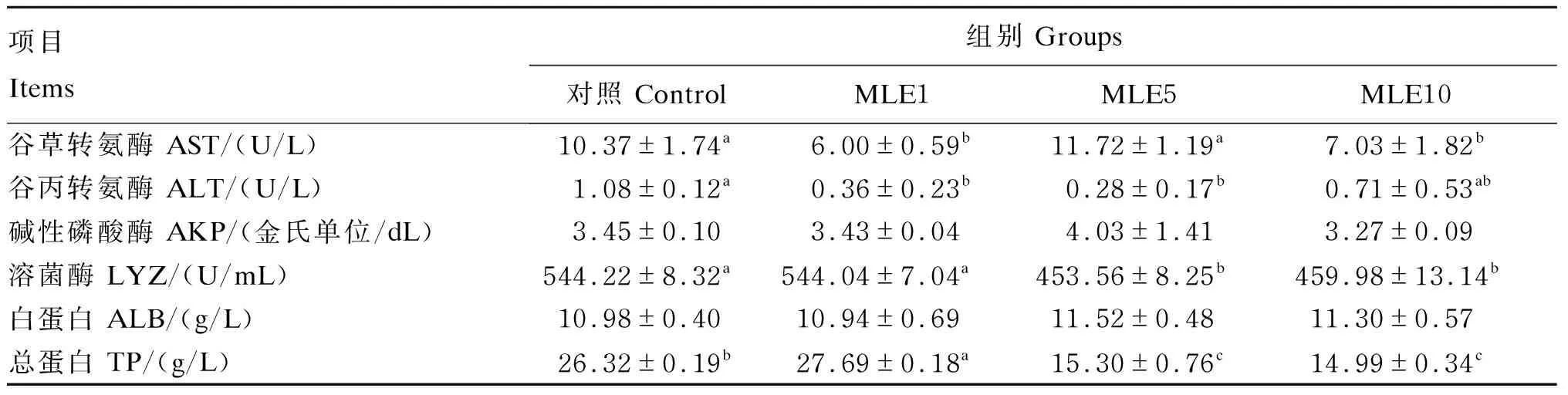
表5 MLE对鳜鱼血清免疫指标的影响
2.5 MLE对鳜鱼血清抗氧化能力的影响
由表6可知,与对照组相比,饲料中添加1 g/kg的MLE能够显著提高鳜鱼血清中MDA的含量和T-SOD的活性(P<0.05),显著降低鳜鱼血清中T-AOC和GSH含量(P<0.05);添加5 g/kg的MLE能够显著提高鳜鱼血清中GSH含量(P<0.05),显著降低MDA的含量(P<0.05),但对T-AOC和T-SOD的活性没有显著影响(P>0.05);添加10 g/kg的MLE能够显著提高鳜鱼血清中GSH和MDA的含量(P<0.05),但对T-AOC和T-SOD的活性没有显著影响(P>0.05);而饲料中分别添加1、5和10 g/kg的MLE对血清CAT的活性都没有显著影响(P>0.05)。
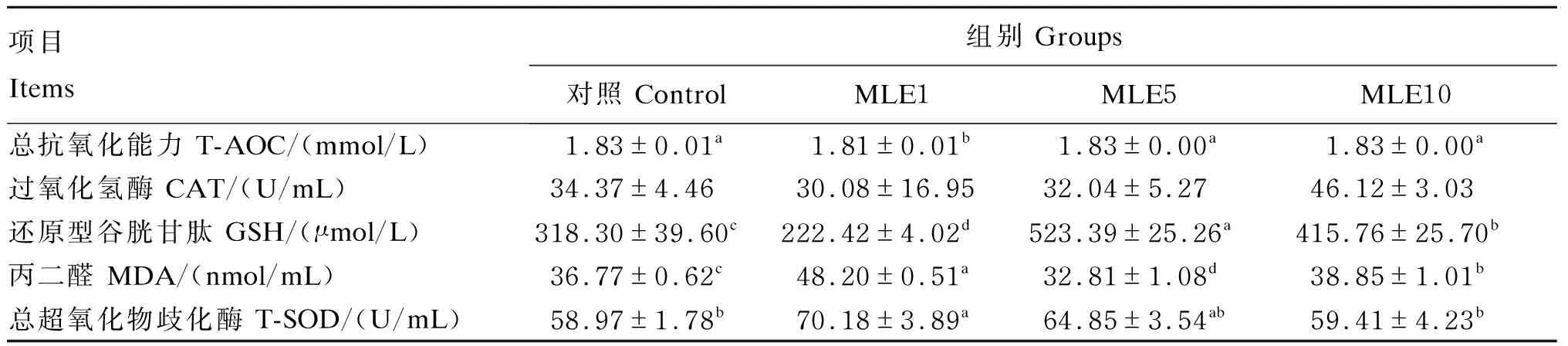
表6 MLE对鳜鱼血清抗氧化能力的影响
2.6 MLE对鳜鱼肝脏和肠道组织结构的影响
如图1所示,对照组鳜鱼肠道黏膜组织清晰,结构完整,排列有序,无混乱、脱落的现象。随着MLE添加水平升高,鳜鱼肠道褶皱增多,绒毛高度增加,绒毛数量增加,肠道空腔率降低。进一步统计分析发现,当MLE的添加水平为10 g/kg时,绒毛高度显著高于对照组(P<0.05);而各组之间绒毛宽度和肌层厚度无显著差异(P>0.05)(表7)。

ML:肌层;D:肠绒毛;SM:黏膜下层;GC:杯状细胞。
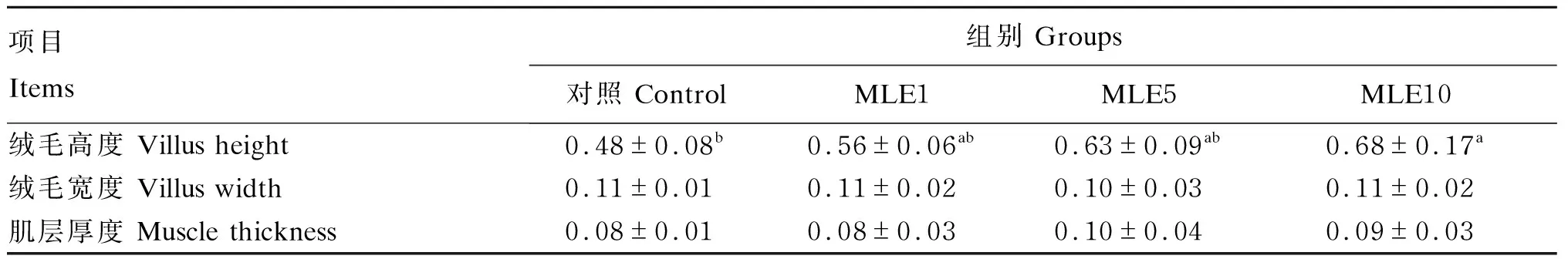
表7 MLE对鳜鱼肠道绒毛高度、绒毛宽度和肌层厚度的影响
各组鳜鱼肝脏组织切片如图2所示,对照组肝细胞排列较整齐,细胞核和细胞膜界限清晰,但肝细胞有空泡化现象。而添加不同水平MLE后都能够改善肝细胞空泡化现象,细胞形态正常,肝血窦、细胞核等结构清晰,无细胞质空泡化和细胞核偏移聚集等现象,尤其是MLE添加水平为1 g/kg时。
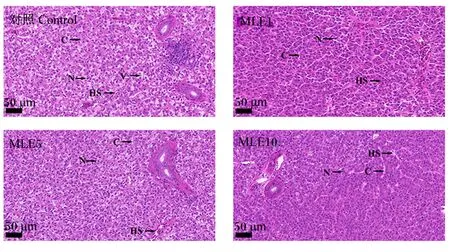
V:细胞质空泡化;HS:肝血窦;N:细胞核;C:细胞膜。
3 讨 论
3.1 饲料中添加MLE对鳜鱼生长性能和形体指标的影响
目前,MLE作为饲料添加剂在水产养殖中的应用较少,对生长性能的研究结论也各不相同。王咏梅等[20]发现在饲料中添加10~300 mg/kg的桑叶黄酮对凡纳滨对虾生长性能和体成分没有显著性影响。同样,在罗非鱼的研究中发现,饲料中添加50~1 000 mg/kg的桑叶黄酮对吉富罗非鱼的生长性能没有显著影响[22]。然而,Li等[19]研究发现,饲料中添加适量的MLE可改善大鲵的生长性能,提高肠道消化吸收能力,终末体均重、增重率和特定生长率随着饲料MLE添加水平的增加而增加,达到9.0 g/kg后下降,不同MLE添加水平对于成活率没有显著影响。在鲫鱼中的研究发现,饲料中添加15~60 g/kg的MLE可显著促进鲫鱼的生长,最适的MLE添加水平为46.93 g/kg,超过101.06 g/kg后会抑制鲫鱼的生长[25]。也有研究表明,在饲料中添加少量的桑叶粉或发酵桑叶粉不影响动物的生长,但添加量过高会抑制动物的生长,主要是由于桑叶粉中粗纤维含量较高,也存在很多抗营养因子,影响营养物质的消化吸收[26-27]。本试验中,与对照组相比,在饲料中添加1~10 g/kg的MLE对鳜鱼的终末体均重、增重率、特定生长率和饲料系数没有显著影响,这与在凡纳滨对虾[20]和吉富罗非鱼[22]中的研究结论一致,说明通过提取的方法可以有效保留桑叶中的活性物质,同时去除抗营养因子,有利于桑叶在水产养殖中的广泛应用。
3.2 饲料中添加MLE对鳜鱼血清免疫指标的影响
血清免疫指标包括AST、ALT、AKP、LYZ、ALB和TP等。ALT和AST是存在于肝脏中的重要转氨酶,当肝脏细胞受损时,大量的ALT和AST会进入血液,从而导致血清中转氨酶活性升高,因此,血清转氨酶活性是反映肝细胞受损伤程度的主要指标[28]。Li等[19]在大鲵中研究发现,9 g/kg的MLE能够降低血清AST和ALT的活性,但超过12 g/kg的MLE能够显著提高血清AST和ALT的活性。同样,王咏梅等[20]研究发现,适宜水平的桑叶黄酮能降低血清ALT活性,但高浓度桑叶黄酮可能对凡纳滨对虾肝胰腺造成负面影响。本研究中,饲料中添加1 g/kg的MLE能显著降低血清AST和ALT的活性,添加5 g/kg的MLE显著降低ALT的活性,添加10 g/kg的MLE显著降低AST的活性。这说明添加适宜水平的MLE确实能够改善鳜鱼肝脏健康。AKP广泛存在于高等动物的各个组织中,是生物体内一种重要的代谢调控酶,通过调节蛋白(酶)的去磷酸化过程,在水产动物对营养物质的吸收与利用过程中发挥着重要的作用。饲料营养成分组成的改变可直接影响动物体内AKP的活性[29]。本试验中,添加1、5和10 g/kg的MLE对血清AKP的活性都没有显著影响,说明添加MLE不影响鳜鱼营养物质的吸收和利用。LYZ是鱼类先天免疫的重要指标之一,在机体中广泛分布,是鱼类血清中重要的杀菌剂,能够分解革兰氏阳性菌,并与补体甚至一些革兰氏阴性菌相结合,良好的LYZ活性有助于鱼类抵抗水域中各种病原的侵袭[30]。本研究发现,饲料中添加1 g/kg的MLE对鳜鱼血清LYZ的活性没有显著影响,但添加5和10 g/kg的MLE能够显著降低鳜鱼血清LYZ的活性。血清TP包括ALB和球蛋白,ALB由肝脏合成,参与维持血浆胶体渗透压,血清TP和ALB含量的高低是反映机体蛋白质合成代谢强弱的重要标志[31]。有研究表明,饲料中添加1 200 mg/kg的桑叶正己烷提取物、乙醇提取物、水提取物和粗提物均能显著提高小鼠血清ALB和TP的含量[32]。在本研究中发现,饲料中添加1、5和10 g/kg的MLE对血清ALB的含量都没有显著影响,而添加1 g/kg的MLE能显著提高鳜鱼血清TP的含量,而添加5和10 g/kg的MLE显著降低鳜鱼血清TP的含量。这说明低添加水平(1 g/kg)的MLE有助于提高鳜鱼体内蛋白质的合成效率。
3.3 饲料中添加MLE对鳜鱼血清抗氧化能力的影响
氧化应激在水产养殖中十分常见,当鱼体受到强烈刺激时会导致体内的抗氧化系统失去平衡,使鱼体内的代谢发生紊乱,长期的氧化应激会影响鱼的生长速度,也会导致鱼的品质下降[33]。动物机体在进化过程中形成了一套抗氧化系统,包括酶促系统和非酶促系统。其中,酶促抗氧化系统包括T-AOC、T-SOD和CAT等,SOD主要催化超氧离子自由基歧化反应,可以将呼吸链产生的超氧阴离子转化成H2O2和O2,从而消除活性氧(ROS)对机体的直接毒害作用。而CAT通过催化过氧化氢分解来保护细胞免受氧化损伤[30]。在正常的新陈代谢或受到损伤条件下,机体都会不断产生ROS,通过增强关键的抗氧化酶活性来避免或修复ROS可能对组织造成的氧化损害[34]。此外,GSH和MDA是常见的非酶促抗氧化指标。在正常生理情况下,机体内ROS的产生和清除处于动态平衡。但当水产动物受到氧化应激或损伤时,导致体内氧化/抗氧化平衡失调,代谢产生的过量ROS会攻击磷脂双分子层中的多不饱和脂肪酸,造成脂质过氧化并生成MDA,因此,MDA被认为是细胞氧化损伤和肝胰脏损伤程度的重要标志之一[29]。同时,MDA能够与蛋白质、核酸和氨基磷脂等的亲核基团发生交联聚合,它的过度积累会导致细胞毒性[30]。GSH作为最重要的非酶促抗氧化物,具有清除自由基和过氧化氢等功能,因而GSH含量的多少也是衡量机体抗氧化能力的重要指标。
MLE的抗氧化作用在一些研究中已经得到证实。有研究表明,基础饲料中添加1 200 mg/L的桑叶水溶物或粗提物都能够提高小鼠的抗氧化功能,血清GSH-Px和T-SOD的活性都显著提高[32]。在大鲵中的研究发现,MLE能显著提高肠道T-AOC活性,降低肠道MDA含量,但对T-SOD的活性没有显著影响[35],MLE也能够显著提高大鲵肝脏T-AOC和T-SOD的活性,并且显著降低肝脏MDA的含量[36]。在蛋鸡研究中发现,桑枝叶提取物不同程度提高了蛋鸡血清T-AOC、GSH-Px和SOD含量,降低了蛋鸡血清MDA的含量[37]。桑叶水提物也可以降低糖尿病大鼠血清中MDA的含量[38]。本研究中,饲料中添加1 g/kg的MLE能够显著提高鳜鱼血清中T-SOD的活性;添加5 g/kg的MLE显著提高鳜鱼血清中GSH的含量,显著降低MDA的含量;添加10 g/kg的MLE显著提高鳜鱼血清中的GSH含量。这些结果与前人的研究结果基本一致。MLE对提高鳜鱼抗氧化能力具有良好效果的原因可能是由于其富含的黄酮类和多糖类等生物活性物质通过提高机体抗氧化酶活性、清除脂质过氧化物和抑制脂质过氧化反应来达到抗氧化作用,但具体作用机制还需进一步研究。
3.4 饲料中添加MLE对鳜鱼肝脏和肠道组织形态的影响
肠道是动物吸收营养物质的主要器官,主要通过肠上皮细胞的肠绒毛来吸收营养物质,肠道的皱襞密度、绒毛高度和宽度会直接影响营养物质的吸收效率[39]。肠道绒毛高度越高、数量越多、宽度越宽,肠道的吸收面积就越大。而肠壁肌层厚度也会影响营养物质的吸收利用率[29]。冯麒凤等[35]在大鲵中研究表明,MLE能够显著增加肠黏膜绒毛数量,提高绒毛高度。王咏梅等[21]研究表明,桑叶黄酮可以改善凡纳滨对虾的肠道结构,提高凡纳滨对虾对营养物质的消化和吸收能力。本研究中,随着MLE添加水平升高,鳜鱼肠道褶皱增多,绒毛高度增加,当MLE的添加水平为10 g/kg时,绒毛高度显著高于对照组,各组之间绒毛宽度和肌层厚度无显著差异。这说明MLE能够改善鳜鱼肠道健康,促进营养物质吸收。
观察肝脏组织形态是了解肝脏病理情况的一个重要手段。Huang等[40]在母鸡中研究发现,对照组肝脏组织脂质空泡改变,炎性细胞浸润明显,而添加低水平和高水平桑叶黄酮后肝细胞病理症状均有所缓解,炎症细胞及空泡改变较少。同样,在高脂高糖饲料诱导的小鼠中,添加桑叶水提物能够改善肝脏细胞脂肪变性和堆积[41]。在本试验中也观察到类似的结果,使用基础饲料饲喂的鳜鱼肝细胞有空泡化现象,而添加不同水平的MLE后都能够改善肝细胞空泡化现象,尤其是添加1 g/kg的MLE后,肝细胞形态正常,肝血窦、细胞核等结构清晰,无空泡化和细胞核偏移聚集等现象,这可能是由于桑叶黄酮改善了肝脏细胞的脂质代谢,说明MLE确实能够改善鳜鱼的肝脏健康。
4 结 论
在鳜鱼配合饲料中添加1~10 g/kg的MLE不影响鳜鱼的生长性能,但随着MLE添加水平的提高,鳜鱼的成活率不断提高。此外,添加适量的MLE能够提高鳜鱼血清抗氧化能力和免疫功能,并且改善鳜鱼的肝脏和肠道健康。根据本试验结果,鳜鱼配合饲料中MLE的推荐添加水平为1 g/kg。
