运输前灌服谷氨酰胺对运输应激雏鸡肠黏膜上皮细胞线粒体功能及坏死性凋亡信号通路的影响
2023-03-07刘汝杰李明晔孙泽威仲庆振
刘汝杰 李明晔 孙泽威,2,3 仲庆振,2,3*
(1.吉林农业大学动物科学技术学院,长春130118;2.动物生产及产品质量安全教育部重点实验室,长春130118;3.吉林省动物营养与饲料科学重点实验室,长春130118)
雏鸡破壳后需从孵化场运输至养殖场,在运输过程中会导致雏鸡机体遭受巨大的挑战,而这些挑战往往作为应激源造成雏鸡出现应激反应,如心跳加速、恐惧不安、呼吸急促等[1-2]。研究表明,长时间运输可对动物肠道造成严重的应激反应,表现为肠道绒毛顶端受损、肠道通透性改变、绒毛和隐窝受损及紧密连接蛋白表达下降等[3-5]。此外,肠黏膜是肠上皮细胞的第1道防线,在感受和响应外界刺激时需要消耗大量能量,而线粒体作为细胞能量的供应站,在应激条件下,外界的刺激可引起线粒体氧化应激损伤,导致线粒体跨膜电位发生变化、能量供应减弱,甚至引起肠上皮细胞凋亡[6]。为了缓解应激造成危害,线粒体可通过上调烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)/还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotides,NADH)比值,从而减轻线粒体氧化应激,减缓细胞凋亡进程[7]。研究表明,运输应激导致肠黏膜上皮细胞中线粒体受到损伤,且细胞出现坏死性凋亡现象[8]。坏死性凋亡亦称为程序性死亡,受体相互作用蛋白激酶1(receptor interacting serine/threonine protein kinase 1,RIPK1)、受体相互作用蛋白激酶3(receptor interacting serine/threonine protein kinase 3,RIPK3)和混合谱系激酶结构域样假激酶(mixed lineage kinase domain like pseudokinase,MLKL)是调控坏死性凋亡的关键信号因子,是坏死性凋亡中的特殊标志物[9]。并且,雏鸡肠道功能及形态的发育将直接影响其后期生长、免疫及抗病等方面[10]。因此,通过营养调控改善运输应激对雏鸡肠道健康的不利影响是亟待解决的问题。
谷氨酰胺(glutamine,Gln)不仅是蛋白质、核酸合成的前体,更是肠黏膜细胞快速增值的主要能量来源[11]。研究表明,外源补充Gln可提高肉鸡生长性能[12-13]、改善肠道健康[14-15]、提高机体免疫力[16-17]等。张柏林等[18]研究饲粮添加Gln对肉鸡免疫应激的影响,结果表明,饲粮添加1% Gln可显著改善肠道形态并减弱应激状态下炎性细胞因子的过度产生,从而缓解免疫应激对肉鸡产生的不良影响。徐娟等[19]以吉林白鹅为研究对象,通过腹腔注射Gln研究热应激对吉林白鹅的影响,结果表明,腹腔注射Gln可上调空肠黏膜热休克蛋白70及紧密连接蛋白mRNA和蛋白表达水平,有效缓解热应激状态下肠黏膜的损伤现象。吴艳[20]以SD大鼠为试验对象,建立运输应激模型,通过灌服Gln来研究其对缓解运输应激的机制,结果表明,Gln可通过影响运输应激大鼠的血清、神经中与应激密切相关的部分生物活性物质含量以及热休克蛋白72 mRNA表达水平来缓解运输应激。但关于Gln在缓解运输应激雏鸡肠黏膜上皮细胞线粒体功能及坏死性凋亡信号通路方面的研究鲜有报道。因此,本试验选取1日龄爱拔益佳(AA)肉鸡为试验对象,探究运输前灌服不同水平Gln对运输应激雏鸡肠黏膜上皮细胞线粒体功能及凋亡信号通路的影响,从而为集约化养殖提高生产效益。
1 材料与方法
1.1 试验动物与试验设计
试验选取1日龄AA肉鸡300只,随机分为5个组(A、B、C、D和E组),每组5个重复,每个重复12只鸡。A、B组运输前灌服1 mL生理盐水,C、D和E组运输前分别灌服1 mL质量分数为0.50、0.75和1.00 g/kg的Gln。灌服均在雏鸡出壳后1 h内完成,灌服结束后A组不做运输应激处理,B、C、D和E组以70 km/h的速度运输应激5 h。
1.2 样品采集
运输试验结束后,每个重复随机选取4只肉鸡进行屠宰,分别采集空肠肠道及空肠黏膜,装入提前标记的冻存管中,并将其放于液氮中保存。空肠肠道后续使用线粒体分离试剂盒(碧云天生物技术有限公司)进行线粒体分离。空肠黏膜用于测定坏死性凋亡信号通路相关基因表达。
1.3 测定指标与方法
1.3.1 线粒体跨膜电位测定
采用JC-1荧光标记法检测线粒体跨膜电位的变化,具体试验方法严格按照试剂盒步骤进行。
1.3.2 线粒体NAD+和NADH含量的测定
采用碧云天生物技术有限公司试剂盒测定线粒体NAD+和NADH含量,按照试剂盒说明书进行操作,并计算NAD+/NADH比值。
1.3.3 线粒体ATP含量测定
采用南京建成生物工程研究所试剂盒测定线粒体ATP含量,按照试剂盒说明书进行操作。
1.3.4 空肠黏膜RIPK1、RIPK3及MLKLmRNA表达水平测定
RNA的提取:使用RNAiso Plus试剂进行总RNA的提取。取适量空肠黏膜样品置于装有1 mL预冷的RNAiso Plus的RNase-Free试管中进行匀浆,随后加入氯仿进行抽提,离心后抽取适量上清并加入异丙醇,使RNA沉淀,沉淀的RNA用75%的酒精洗涤3次,晾干后重溶,并取重溶后的RNA取2 μL用UVS-99微量核酸蛋白检测仪检测浓度和纯度。
选择符合标准的RNA,参照反转录试剂盒的步骤进行反转录,并将获得的cDNA于-80 ℃保存。
荧光定量PCR实时分析:目的基因和内参β-肌动蛋白(β-actin)的序列见表1。利用TB Green Premix Ex Taq试剂盒(No.RR420A)进行荧光定量PCR试验,按照试剂盒说明书进行操作。基因表达的相对定量计算参照Curi等[21]的方法。
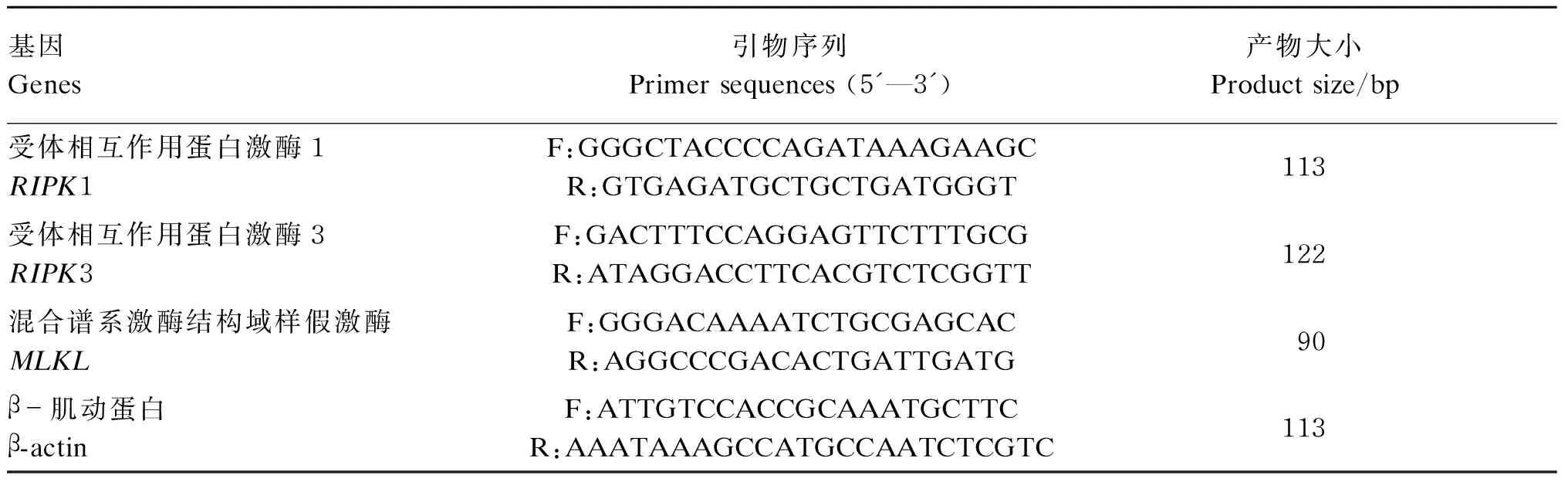
表1 引物序列
1.4 空肠黏膜RIPK1、RIPK3及MLKL蛋白表达水平测定
取20 mg空肠黏膜组织置于裂解液中匀浆至充分裂解,12 000 r/min离心10 min,取上清液用考马斯亮蓝法测定蛋白含量。蛋白通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样分离,将分离得到的蛋白条带转印至聚偏二氟乙烯膜上,置于封闭液中室温、摇床缓慢摇动下封闭1 h,然后将封闭后的膜直接放入一抗工作液中,4 ℃反应过夜,孵育结束后用1×TBST洗膜3次,将洗涤后的一抗反应膜放入二抗工作液中,室温避光孵育1 h。使用Image J软件进行蛋白灰度值分析。
1.5 数据分析
数据采用SPSS 22.0统计中的ANOVA过程进行单因素方差分析,利用Duncan氏法进行多重比较,结果用“平均值±标准差”表示,P<0.05表示差异显著。
2 结 果
2.1 运输前灌服Gln对运输应激雏鸡空肠线粒体跨膜电位及NAD+、NADH含量的影响
如图1所示,与A组相比,B、C、D和E组空肠线粒体跨膜电位显著降低(P<0.05);与B组相比,C、D和E组空肠线粒体跨膜电位显著提高(P<0.05)。与A组相比,B、C、D和E组空肠线粒体NAD+含量和NAD+/NADH比值显著降低(P<0.05),NADH含量显著增加(P<0.05)。与B组相比,D和E组空肠线粒体NAD+含量和NAD+/NADH比值显著增加(P<0.05),其中,D组空肠线粒体NAD+含量与A组无显著差异(P>0.05)。与B组相比,C、D和E组空肠线粒体NADH含量显著降低(P<0.05),但仍显著高于A组(P<0.05)。D组空肠线粒体NAD+含量和NAD+/NADH比值显著高于C和E组(P<0.05)。
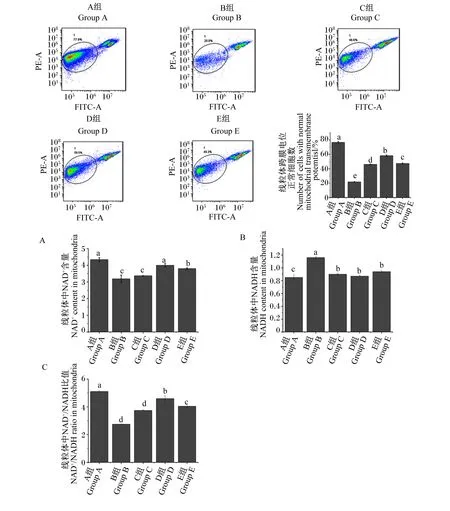
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。
2.2 运输前灌服Gln对运输应激雏鸡空肠线粒体ATP含量的影响
如图2所示,与A组相比,B、C、D和E组空肠线粒体ATP含量显著降低(P<0.05);与B组相比,C、D和E组空肠线粒体ATP含量显著增加(P<0.05),但仍显著低于A组(P<0.05)。
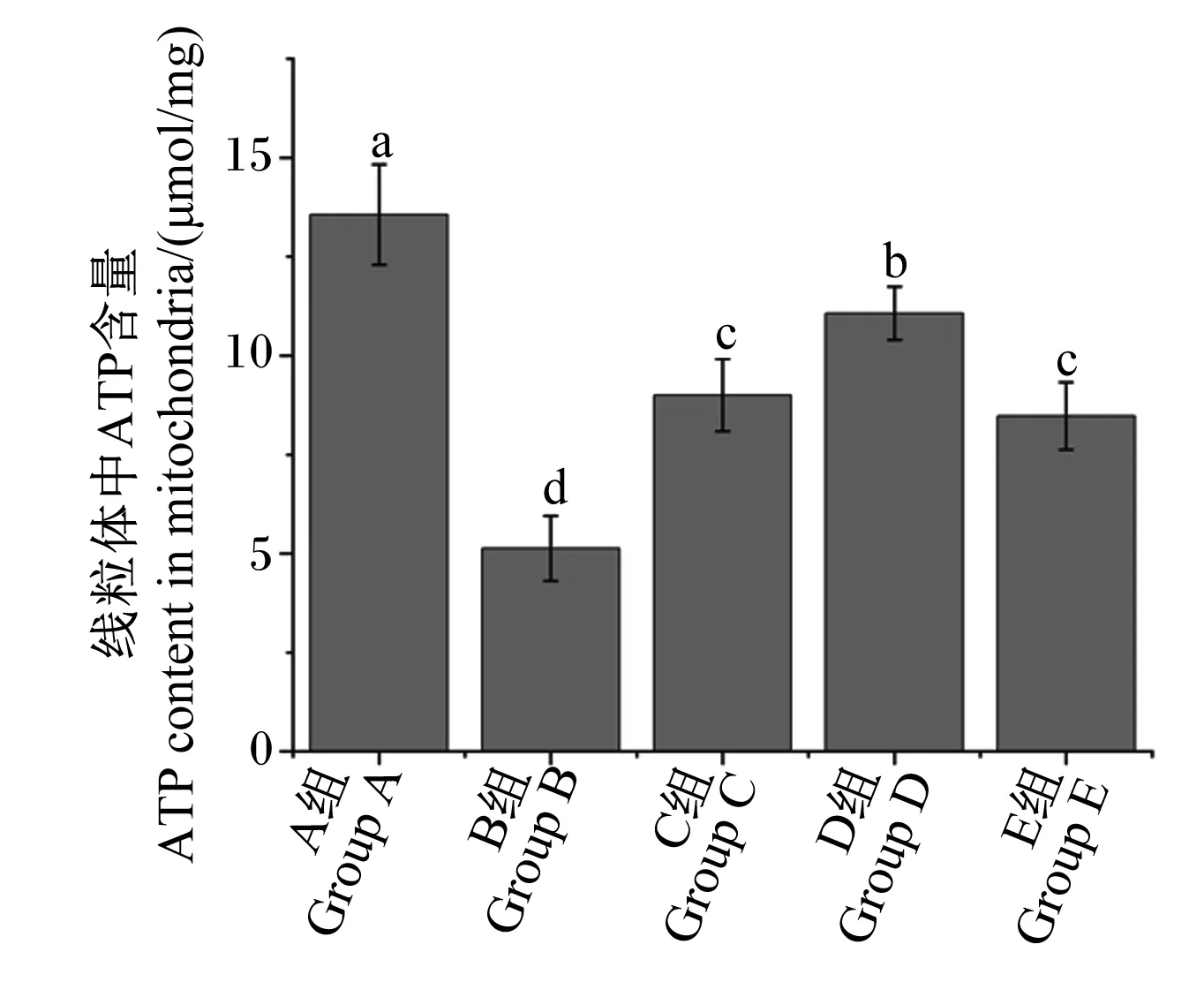
图2 运输前灌服Gln对运输应激雏鸡空肠线粒体ATP含量的影响
2.3 运输前灌服Gln对运输应激雏鸡空肠黏膜坏死性凋亡信号通路的影响
如图3所示,与A组相比,B、C、D和E组空肠黏膜RIPK1、RIPK3和MLKLmRNA表达水平显著增加(P<0.05);与B组相比,C、D和E组空肠黏膜RIPK1、RIPK3和MLKLmRNA表达水平显著降低(P<0.05),但仍显著高于A组(P<0.05)。
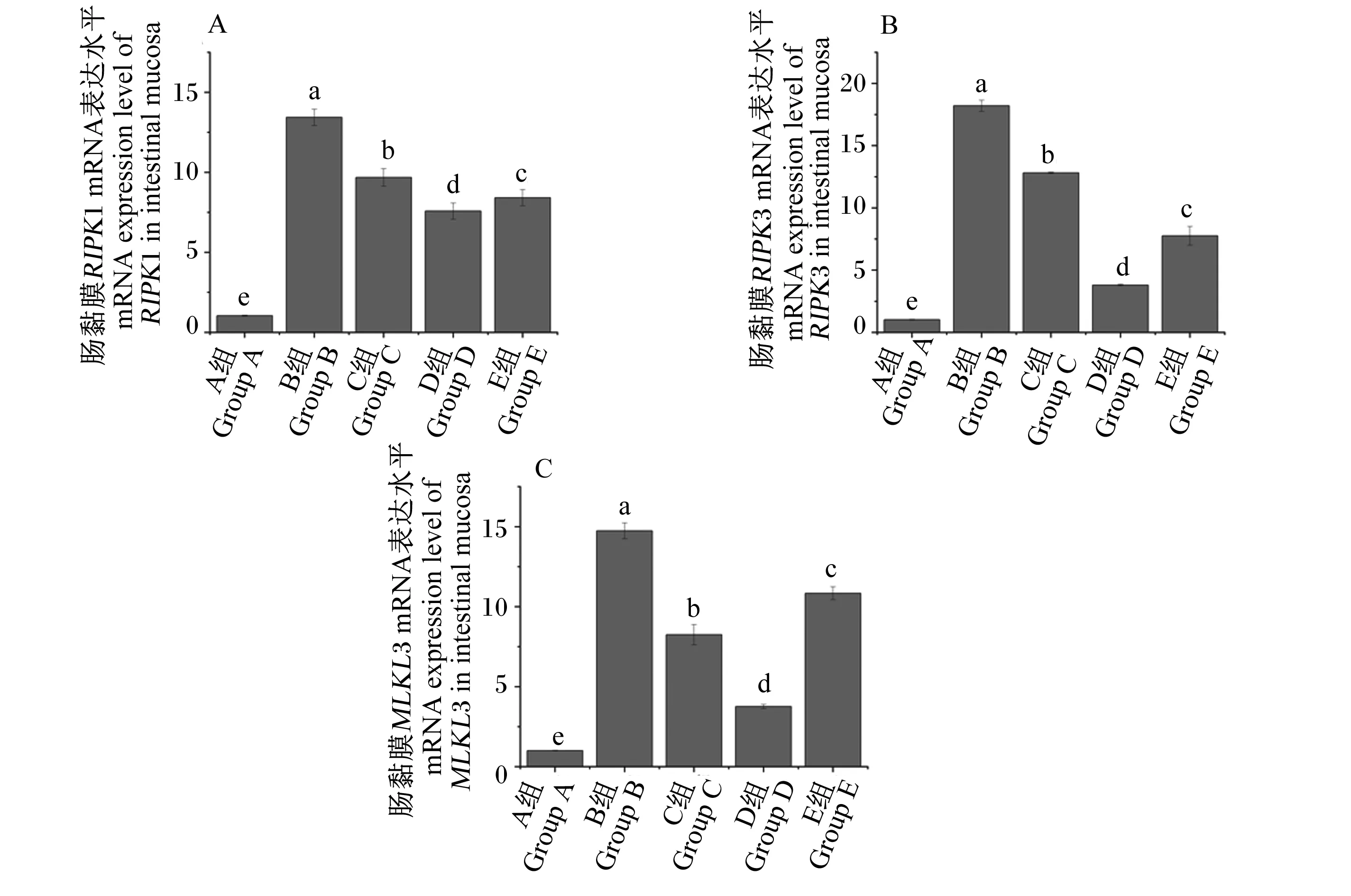
图3 运输前灌服Gln对运输应激雏鸡空肠黏膜坏死性凋亡信号通路相关基因表达的影响
如图4所示,与A组相比,B、C、D和E组空肠黏膜RIPK1、RIPK3和MLKL蛋白表达水平显著增加(P<0.05);与B组相比,C、D和E组空肠黏膜RIPK1、RIPK3、MLKL蛋白表达水平显著降低(P<0.05),但仍显著高于A组(P<0.05)。
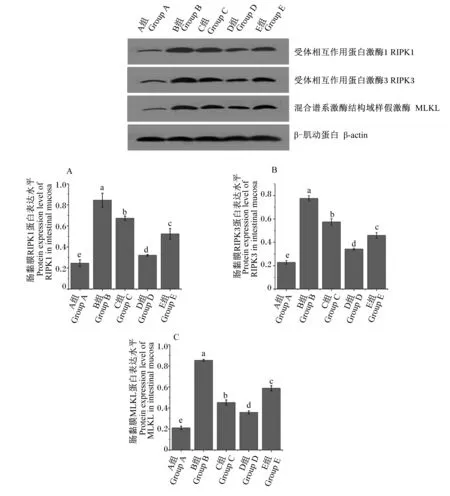
图4 运输前灌服Gln对运输应激雏鸡空肠黏膜坏死性凋亡信号通路相关蛋白表达的影响
3 讨 论
3.1 Gln对运输应激雏鸡线粒体功能的影响
线粒体生成和释放ATP、进行氧化磷酸化的先决条件是具有内负外正的正常跨膜电位[22]。而在细胞凋亡的过程中往往伴随着线粒体跨膜电位的破坏,这被广泛认为是细胞凋亡过程中最早发生的事件之一。在细胞凋亡的过程中,线粒体通透性发生改变,两侧离子梯度消失,导致线粒体跨膜电位破坏、呼吸链与氧化磷酸化失耦联、ATP合成停止等,最终导致细胞凋亡。本试验选取JC-1进行染色后,使用流式细胞仪检测线粒体跨膜电位。JC-1是一种亲脂阳离子染料,线粒体跨膜电位较高时JC-1在基质中汇聚形成聚合物,可产生红色荧光;当线粒体跨膜电位较低时,JC-1不能聚集在线粒体基质中,以单体形式存在产生绿色荧光。研究表明,当细胞受到外界刺激时会引起线粒体跨膜电位发生异常变化[23]。同样,本试验结果显示,由于5 h的运输导致雏鸡空肠线粒体产生应激反应致使跨膜电位崩溃,这提示,5 h的运输促进了细胞的凋亡。研究表明,线粒体功能出现障碍大部分原因是由氧化应激所引起[24],在本试验中,灌服Gln后,可观察到红色荧光增强,这表明Gln可有效缓解运输应激引起的雏鸡线粒体跨膜电位的下降。这可能的是由于在运输状况下线粒体产生大量活性氧引起氧化应激,而Gln作为合成谷胱甘肽的合成前体被肠细胞吸收后合成大量的谷胱甘肽提高抗氧化能力,从而减轻了空肠线粒体跨膜电位受损[25]。
NAD+是一种接受氢化物的辅酶,其还原态为NADH,二者在细胞代谢和能量产生中发挥着重要作用,能够参与线粒体能量代谢、维持钙稳态、基因表达、氧化应激、衰老和凋亡。本试验结果表明,运输应激导致NAD+向其还原态NADH的转化,使细胞氧化还原状态发生改变,降低了NAD+含量以及NAD+/NADH比值。研究表明,当细胞受到损伤或应激时,可通过上调NAD+/NADH比值,以增强线粒体抵御应激的能力[7],这与本试验研究结果一致。本研究发现,运输前灌服Gln可不同程度改善空肠线粒体NAD+和NADH含量,当灌服剂量为0.75 g/kg时效果较好,可能的原因是Gln被细胞吸收后转化为谷氨酸,谷氨酸进入三羧酸循环经过一系列酶促反应转化为NADH,NADH在电子传递的过程中产生NAD+,从而增加了NAD+和NADH含量[26]。
ATP含量通常作为评价细胞能量状态的指标。ATP合成的主要场所是线粒体,线粒体通过氧化磷酸化负责细胞90%以上的能量来源[27]。线粒体具有突出的“储备能力”,当机体遭受严重应激时,这种“储备能力”将被消耗[28-29]。研究表明,运输应激可加速机体的能量代谢,使能量代谢池中可直接消耗能量物质减少[30-31]。与此相似,本研究结果显示,5 h的运输应激导致空肠线粒体ATP含量显著减少。Li等[32]研究运输应激对心肌细胞能量储备情况的影响,结果表明,4和8 h的运输应激显著增加了心肌细胞中ATP含量,这与本试验结果不一致,可能是由于取样部位不同和心脏损伤的代偿反应所致。Gln可显著增加ATP含量,增强能量代谢池中可消耗能量物质,从而保障相关组织在抵抗应激时的能量来源,发挥最大的保护作用。本研究表明,Gln改善了空肠线粒体的基本产能功能,这可能由于运输前灌服Gln增加了线粒体中NADH和NAD+含量,而在电子传递的过程中,NADH被分解为NAD+,产生H+和1对电子,H+可用于驱动位于线粒体内膜上的某种“泵”,以ATP的形式产生了大量的能量。
3.2 Gln对运输应激雏鸡空肠黏膜坏死性凋亡信号通路的影响
细胞坏死性凋亡的特征是细胞肿胀、膜破裂和细胞内容物的释放[33]。研究表明,坏死性凋亡是一种“受控”的死亡类型,这涉及RIPK1-RIPK3-MLKL介导的坏死级联反应[34]。坏死性凋亡可由激活炎症和细胞死亡的细胞外刺激物引起,该过程涉及多种磷酸化和泛素化等复杂过程。首先RIPK1被凋亡抑制因子(inhibitor of apoptosis proteins,IAPs)泛素化,并通过核因子-κB(nuclear factor-κB,NF-κB)激活,在检测“死亡信号”后,RIPK1被去泛素化酶圆柱瘤蛋白(cylindromatosis,CYLD)去泛素化从而招募RIPK3。RIPK1/RIPK3复合物可招募并磷酸化MLKL,导致细胞膨胀、膜溶解和细胞内物质不可控释放,使细胞坏死性凋亡[35]。本试验结果显示,运输应激显著增加了空肠黏膜当中RIPK1、RIPK3和MLKLmRNA和蛋白的表达。Huang等[36]体外研究发现,热应激可引起RIPK1和MLKLmRNA的表达水平显著增加,这与本试验结果一致。以上结果提示,Gln可通过抑制坏死性凋亡相关基因的表达缓解运输应激导致的细胞坏死性凋亡发生的进程,从而保护了肠道稳态。
4 结 论
运输前灌服Gln能够缓解因运输导致的雏鸡应激反应,增强肠黏膜线粒体产能功能,降低肠黏膜细胞凋亡进程,从而一定程度上有效缓解运输刺激引起的雏鸡肠黏膜应激反应,且以灌服剂量为0.75 g/kg时效果较好。
