辣蓼黄酮乙酸乙酯部分抑制炎症因子产生及p38丝裂原活化蛋白激酶和细胞外调节蛋白激酶1/2蛋白磷酸化调节猪圆环病毒2型诱导的炎症反应
2023-03-07韦玉衡谢小东王秋华于美玲韦英益胡庭俊
陈 奇 韦玉衡 谢小东 赵 怡 王秋华 于美玲 韦英益 胡庭俊
(广西大学动物科学技术学院,南宁530005)
猪圆环病毒(porcine circovirus,PCV)是单链环状DNA病毒,目前已发现4个型(PCV1~PCV4)[1],感染宿主会减少其树突状细胞的数量,并抑制病毒抗原向T淋巴细胞传递,进而导致免疫活性T/B淋巴细胞数量减少,抑制宿主的免疫系统,导致宿主抵抗力下降[2]。此时,易造成其他病毒或细菌的感染而继发其他疾病,如猪皮炎和肾病综合征(PDNS)、仔猪心肌炎、母猪繁殖障碍、断奶猪和育肥猪的呼吸道疾病以及仔猪先天性震颤(CT)等[3]。PCV感染在全世界的养猪地区普遍存在,给全球养猪业造成了重大的经济损失。
近年来,中草药及其活性成分在预防和治疗动物疾病方面取得了一定的成果。辣蓼(PolygonumhydropiperL.)为蓼科(Polygonaceae)植物的干燥全草,含有黄酮类化合物、挥发油、鞣质类等物质[4]。辣蓼具有抗氧化、抗菌、抗高血压、抗炎和镇静等多种药理活性作用[5-6]。另外,根据体内外抗炎试验表明,辣蓼主要成分中的黄酮类化合物可以通过抑制环氧合酶-2(COX-2)、脂氧化酶(LOXs)、诱导性一氧化氮合成酶(iNOS)、核因子-κB(NF-κB)和激活蛋白-1(AP-1)的活性,再通过激活Ⅱ期抗氧化解毒酶依赖还原型辅酶Ⅰ/Ⅱ醌氧化还原酶(NQO1)、丝裂原活化蛋白激酶(MAPK)、蛋白激酶C(PKC)和核因子红细胞2-相关因子2(Nrf2)的活性来发挥抗炎作用[7]。从意大利黑麦草(Loliummultiflorum)中分离出的黄酮类化合物同样也能抑制MAPK和NF-κB的活性[8]。任守忠等[9]在研究辣蓼提取物对大鼠急性胃黏膜损伤的保护作用时,发现辣蓼提取物能增强胃黏膜损伤大鼠的抗氧化能力,表明辣蓼提取物具有清除氧自由基的生物活性。Peng等[10]对辣蓼黄酮进行了抗氧化能力测定,结果表明其具抗氧化活性。谷俐媛等[11]在研究辣蓼黄酮对脂多糖(LPS)诱导的RAW264.7细胞的炎症反应的调控作用试验中,发现辣蓼黄酮乙酸乙酯部分(FEA)和辣蓼黄酮正丁醇部位(FNB)均能减少LPS刺激所诱导的活性氧(ROS)、一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)的释放,从而发挥抗炎特性。谷俐媛等[12]还发现,FNB能够减少LPS刺激所诱导的内毒素血症小鼠模型中炎性细胞因子TNF-α、IL-1β、IL-6和IL-8等的释放,同时,FEA则能够减少炎性细胞因子TNF-α、干扰素-α(IFN-α)、干扰素-γ(IFN-γ)和白细胞介素-2(IL-2)的mRNA表达,表明辣蓼黄酮可以减轻LPS诱导的内毒素血症对小鼠的损伤。以上研究表明,PCV2的感染可诱导细胞氧化应激与炎症的发生,且辣蓼黄酮具有良好的抗炎作用。
蛋白质的磷酸化与去磷酸化,参与和调控生命体信号转导、基因表达和细胞周期等诸多生命过程,在生命体内至少有30%的蛋白质被磷酸化后,参与生命活动[13-14]。通过蛋白质的磷酸化和去磷酸化,可以调节MAPK信号通路等多种Toll样受体(TLR)依赖性信号分子的激活和失活,从而调节炎症反应[15]。大量证据表明LPS通过激活NF-κB、MAPK和磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)通路导致促炎介质和细胞因子的过量产生[16-17]。PCV2感染通过激活NF-κB信号通路进而诱导机体炎症反应的发生,而NF-κB通路与MAPK通路密切相关[18-21]。FEA具有抗病毒活性,由此推测,FEA可能通过减少炎症因子的产生并抑制p38 MAPK和细胞外调节蛋白激酶(ERK)1/2蛋白磷酸化而调节PCV2诱导的猪肺泡巨噬细胞(3D4/2细胞)的炎症反应。
本研究用PCV2体外感染3D4/2细胞,建立病毒感染的炎症模型,观察FEA对细胞内炎性因子的影响,并观察在FEA作用后MAPK通路和ERK1/2通路上的关键蛋白磷酸化表达是否得到抑制,进而阐明FEA的抗炎作用及其调节炎症反应的分子机制。
1 材料与方法
1.1 FEA的制备和试剂
FEA纯度为56.53%,经XDA-8大孔吸附树脂分离纯化后,得到淡黄色粉末物质,由广西大学动物科学技术学院兽医药理实验室制备。胎牛血清(FBS)和DMEM培养基购自美国Gibco公司;CCK-8检测试剂盒购自上海碧云天生物技术公司;猪IL-6、白细胞介素-10(IL-10)、IFN-γ、环氧合酶-1(COX-1)、COX-2的酶联免疫吸附测定(ELISA)试剂盒购自江苏晶美公司;LPS购自美国Sigma公司;芦丁对照品购自北京索莱宝公司;Trizol总RNA提取试剂、蛋白酶抑制剂、磷酸酶抑制剂和预冷RIPA裂解缓冲液购自北京康维世纪公司生物公司;ChamQ Universal SYBR qPCR Master Mix购自南京诺唯赞生物公司;Chemiluminescent HRT Substrate超敏发光显色液购自美国millipor公司;BCA购自上海Biotech公司;一抗β-肌动蛋白(β-actin)、p38 MAPK、磷酸化p38丝裂原活化蛋白激酶(p-p38 MAPK)、ERK1/2、磷酸化细胞外调节蛋白激酶1/2(pERK1/2)和二抗均购自美国CST公司。
1.2 病毒和细胞
PCV2:SH株,为南京农业大学动物疫病诊断与免疫实验室分离保存(GenBank登录号:AY686763),经猪肾细胞(PK-15细胞)增殖后测得病毒滴度为10-2半数组织细胞感染量(TCID50)/mL。3D4/2细胞由广西大学预防兽医实验室惠赠,经广西大学动物科学技术学院基础兽医学药理实验室培养冻存。
1.3 试验设计
试验共设置7个组,分别为空白对照组、PCV2感染组、LPS阳性对照组、芦丁阳性对照组和FEA药物组(25、50和100 μg/mL),每组4个重复。LPS溶于10% FBS-DMEM培养液(终浓度为0.1%)。芦丁溶于二甲基亚砜(DMSO)后加入10% FBS-DMEM完全培养液(DMSO终浓度小于0.1%)。FEA溶于DMSO后加入10% FBS-DMEM完全培养液(DMSO终浓度小于0.1%)。调整3D4/2细胞浓度至1×106个/mL,均匀接种在6孔细胞培养板上,2 mL/孔,空白对照组加入2 mL无血清DMEM,LPS阳性对照组加入2 mL浓度为1 μg/mL的LPS,PCV2感染组加入2 mL PCV2病毒液(10-2TCID50/mL);PCV2接种2 h后,芦丁阳性对照组加入2 mL的40 μg/mL芦丁,各FEA组分别加入2 mL的25、50和100 μg/mL FEA。37 ℃,5% CO2条件下培养8 h。
1.4 PCV2的增殖和鉴定
复苏并传代PK-15细胞,并使用10% FBS的DMEM培养液进行培养,待其长成单层细胞后,调整PK-15细胞浓度至1×105个/mL,100 μL/孔均匀接种至96孔细胞培养板。接种PCV2毒液,吸附2 h后,吸弃病毒液,磷酸盐缓冲液(PBS)洗涤细胞3次。而后加入5% FBS的DMEM培养液于37 ℃、5% CO2培养箱中培养48 h。而后,收获细胞毒液,并反复冻融3次后,5 000 r/min离心5 min,收集上清液,分装至1.5 mL的EP管中备用。
采用PCR检测病毒核酸,首先根据GenBank设计PCV2引物,由上海生工生物工程股份有限公司合成(F:5′-CACTTCTTTCGTTTTCAG-3′;R:5′-TTTATCACTTCGTAATGGT-3′)(GenBank登录号:MT376724.1),然后按照北京康维世纪生物公司的DNA提取试剂盒说明书(CW0548)操作。抽提病毒DNA后进行PCR扩增,扩增体系为:无菌水8.5 μL;2×Mix酶12.5 μL;引物1(P1)1 μL;引物2(P2)1 μL;DNA 2 μL;总体系为25 μL。PCR扩增程序为:94 ℃预变性3 min;94 ℃ 40 s;55.5 ℃ 40 s;72 ℃ 40 s,进行30个循环,94 ℃延伸7 min。最终PCR产物用1%琼脂糖凝胶进行电泳,观察扩增片段的大小。
1.5 CCK8法检测3D4/2细胞活力
将3D4/2细胞浓度调整至1×105个/mL,每孔100 μL接种至96孔板中培养过夜。次日,吸弃细胞培养上清液,PBS洗涤细胞3次后,各FEA组分别加入200 μL的25、50、100、200、400和800 μg/mL的FEA,空白对照组加入200 μL的10% FBS的DMEM。培养48 h后,每孔加入20 μL的CCK8溶液,并将96孔细胞培养板在37 ℃、5% CO2的培养箱中孵育2 h,避光取出96孔板,并在450 nm处检测其吸光度(OD)值,细胞活力计算公式如下:
细胞活力=(试验组OD-空白对照组OD)/
(对照组OD-空白对照组OD)。
1.6 ELISA检测炎性因子及相关酶活性
按照1.3进行分组与处理,而后使用ELISA试剂盒,按照操作说明书测定IFN-γ、IL-6、IL-10等炎性细胞因子含量及COX-1和COX-2活性。
1.7 定量PCR(q-PCR)检测mRNA的表达
按照1.3进行分组与处理,调整3D4/2细胞浓度至1×106个/mL,将细胞接种于6孔板中,2 mL/孔,37 ℃、5% CO2培养过夜。提取总RNA并反转录为cDNA,用于q-PCR检测相关基因的表达。COX-2、IL-6、IL-10、c-fos、c-jun、c-myc、p38MAPK、ERK和甘油醛-3-磷酸脱氢酶(GAPDH)等基因的引物序列见表1。以GAPDH为内参,用2-ΔΔCt方法计算mRNA相对表达水平。

表1 基因序列
1.8 Western Blotting检测蛋白表达水平
按照1.3进行分组与处理,调整3D4/2细胞浓度至1×106个/mL,将细胞接种于6孔板中,2 mL/孔,37 ℃、5% CO2培养过夜。提取总蛋白后,根据BCA蛋白浓度测定说明书测定蛋白浓度,并用Western Blotting检测蛋白表达水平。操作方法同其他研究[18,22-24],简述如下:蛋白质经过聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移到聚偏二氟乙烯膜(PVDF)膜上,在4 ℃下用5% BSA封闭缓冲液封闭1.5 h,用5%脱脂奶粉以1∶1 000倍稀释p38 MAPK、p-p38 MAPK、ERK1/2、pERK1/2和β-actin抗体,并在4 ℃下孵育过夜,1×TBST洗涤3次后,将聚偏二氟乙烯(PVDF)膜与二抗在37 ℃下共孵育1.5 h,1×TBST洗涤3次后,使用ChemiluminescentHRT Substrate超敏发光显色液对PVDF膜进行避光显色。使用蛋白成像仪观察蛋白条带。各蛋白表达用β-actin进行标准化,以评估蛋白条带的相对表达水平。
1.9 统计分析
使用SPSS 21.0进行统计分析。数据采用单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较。数据以平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 PCV2的增殖和鉴定
将PCV2接种于PK-15细胞中,培养48 h,收集病毒,提取病毒DNA,采用q-PCR检测病毒核酸,产物进行1%琼脂糖凝胶电泳。图1显示目标片段的扩增量约为107 bp。
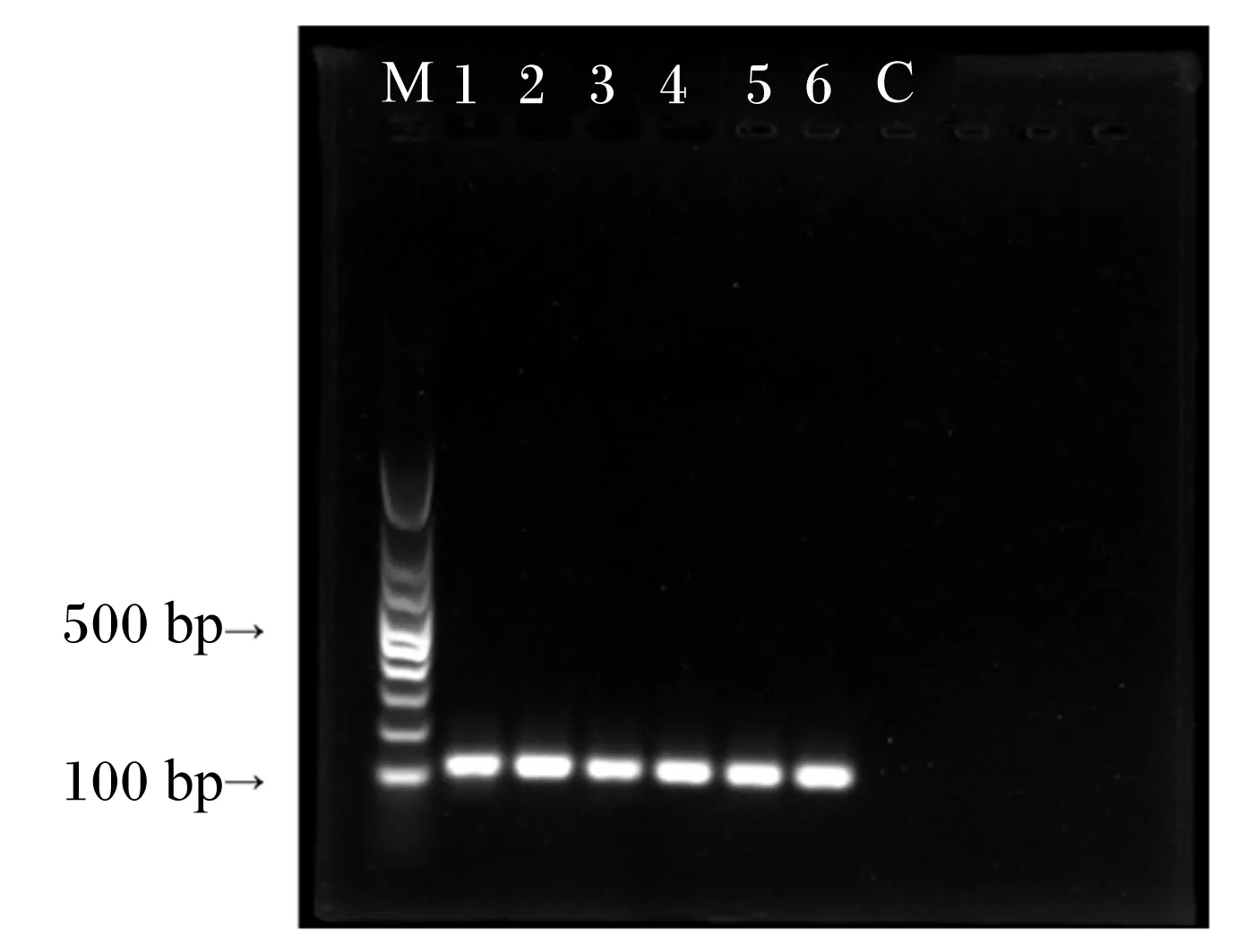
C为未感染PCV2的PK-15细胞;1~5分别为PK-15细胞感染后4、8、12、24、48 h;6为阳性对照;M为DNA Marker。
2.2 FEA对3D4/2细胞的细胞活力的影响
如表2所示,与空白对照组相比,200、400和800 μg/mL的FEA作用于3D4/2细胞后,细胞活力极显著降低(P<0.01);而25、50和100 μg/mL的FEA作用于3D4/2细胞后,细胞活力无显著差异(P>0.05)。因此,选择25、50和100 μg/mL的FEA作为后续试验的用药浓度。
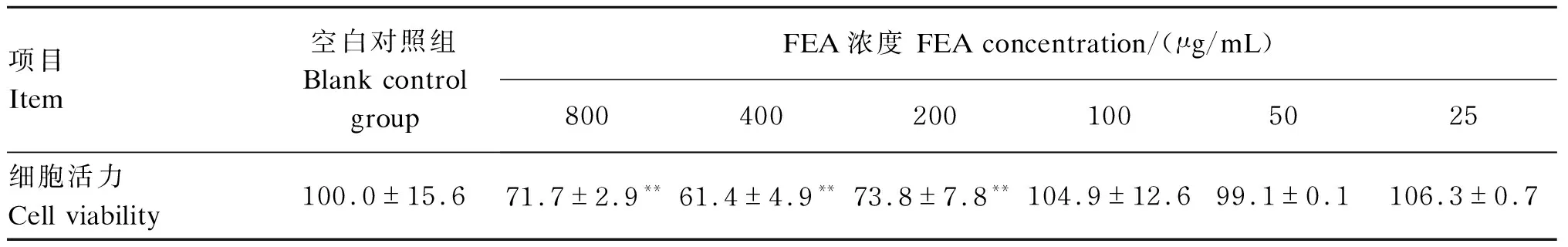
表2 FEA对3D4/2细胞的细胞活力的影响
2.3 FEA对PCV2感染3D4/2细胞的炎症细胞因子水平和相关酶的活性的影响
如图2-A、图2-B、图2-C所示,与空白对照组相比,PCV2感染后,PCV2感染组的IL-6、IL-10和IFN-γ含量升高(P>0.05);与PCV2感染组相比,FEA处理后,25、50和100 μg/mL FEA药物组的IL-6、IL-10和IFN-γ含量显著或极显著降低(P<0.05或P<0.01)。如图2-D、图2-E所示,与空白对照组相比,PCV2感染后,PCV2感染组的COX-1和COX-2活性显著升高(P<0.05);与PCV2感染组相比,FEA处理后,25和100 μg/mL FEA药物组的COX-1和COX-2活性显著降低(P<0.05)。
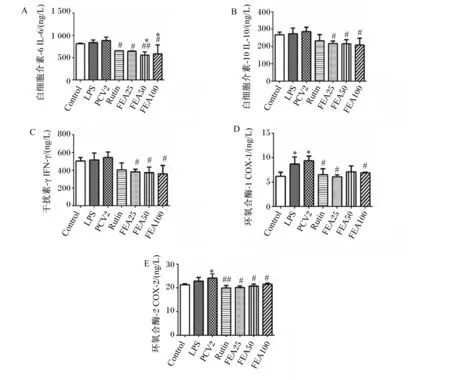
Control:空白对照组;PCV2:PCV2感染组;LPS:LPS阳性对照组;Rutin:芦丁阳性对照组;FEA25:25 μg/mL FEA药物组;FEA50:50 μg/mL FEA药物组;FEA100:100 μg/mL FEA药物组。*表示与空白对照组相比差异显著(P<0.05),**表示与空白对照组相比差异极显著(P<0.01);#表示与PCV2感染组相比差异显著(P<0.0 5),##表示与PCV2感染组相比差异极显著(P<0.01)。下图同,
2.4 FEA对PCV2感染3D4/2细胞IL-6、IL-10、COX-2、c-fos、c-jun、c-myc、p38 MAPK和ERK的mRNA相对表达水平的影响
如图3所示,与空白对照组相比,PCV2感染后,PCV2感染组的IL-6、IL-10、COX-2和c-fos的mRNA相对表达水平显著或极显著升高(P<0.05或P<0.01)。与PCV2感染组相比,FEA处理后,25、50和100 μg/mL FEA药物组的IL-6、IL-10、COX-2和c-fos的mRNA相对表达水平显著或极显著降低(P<0.05或P<0.01)。其中,25 μg/mL的FEA作用效果最佳。

图3 FEA对PCV2感染3D4/2细胞IL-6、IL-10、COX-2和c-fos mRNA相对表达水平的影响
如图4所示,与对照组相比,PCV2感染后,PCV2感染组的c-jun、c-myc、MAPK和ERK的mRNA相对表达水平均显著升高(P<0.05)。与PCV2感染组相比,FEA处理后,25和100 μg/mL FEA药物组的c-jun、c-myc、MAPK和ERK的mRNA相对表达水平显著或极显著降低(P<0.05或P<0.01)。其中,25 μg/mL的FEA作用效果最佳。
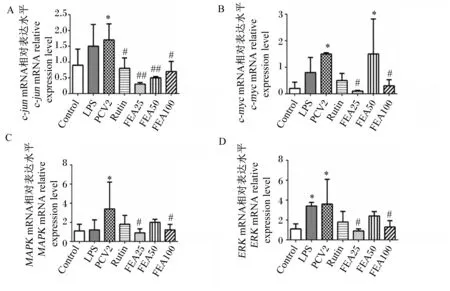
图4 FEA对PCV2感染3D4/2细胞c-jun、c-myc、MAPK和ERK mRNA相对表达水平的影响
2.5 FEA对PCV2感染3D4/2细胞中p38 MAPK和ERK1/2通路关键蛋白的调节作用
如图5所示,与对照组相比,PCV2感染后,p38 MAPK、p-p38 MAPK、ERK1/2和p-ERK1/2的蛋白相对表达水平均极显著升高(P<0.01)。与PCV2感染组相比,FEA处理后,25、50和100 μg/mL FEA药物组的p38 MAPK、p-p38 MAPK、ERK1/2和磷酸化细胞外调节蛋白激酶1/2(p-ERK1/2)的蛋白相对表达水平均极显著降低(P<0.01)。其中,25和100 μg/mL的FEA作用效果最佳。

图5 FEA对PCV2感染的3D4/2细胞中p38 MAPK、ERK1/2蛋白相对表达水平的影响
3 讨 论
PCV2是断奶仔猪多系统衰弱综合征(PMWS)的主要致病因子[25]。PCV2感染巨噬细胞将促进炎性因子的表达,当病毒侵入宿主细胞后,免疫细胞释放的细胞因子和趋化因子是消除入侵病原体的必要因素[26]。但炎症介质的过度释放同样也不利于机体抵抗病毒感染[27]。研究表明,在多种炎症的刺激下,COX会诱导花生四烯酸产生前列腺素E2(PGE2)和COX-2,而COX-2的过度表达会促进炎症信号级联反应[28]。巨噬细胞在由炎症引发的先天性和适应性免疫应答中起关键作用[29]。IL-10是一种具有抗炎和免疫抑制作用的细胞因子,由巨噬细胞、树突状细胞、T细胞和B细胞分泌,主要在晚期免疫效应阶段产生[30]。IL-10的产生将抑制其他促炎细胞因子的产生,如白细胞介素-1(IL-1)、IL-2、IFN-γ和TNF-α等[6]。此外,Borghetti等[31]研究表明,PCV2感染的早期阶段,TNF-α、IL-8和IL-1β的基因表达增加,证明了在PCV2感染的早期阶段,炎症反应更加迅速。此外,Sipos等[32]研究发现,PDNS猪外周血单核细胞中IFN-γ和IL-6的mRNA表达上调。Yang等[33]研究发现,PCV2感染的3D4/2细胞中,IL-1β、TNF-α、IL-6和IL-10的mRNA表达水平增加,进而诱发炎症反应。在本试验中,PCV2感染3D4/2细胞后,IL-6、IL-10和IFN-γ含量呈上升的趋势,但与空白对照组相比无显著差异,其可能的原因是,细胞炎性因子的分泌水平较基因的表达而言相对滞后,因此在取细胞上清液进行测定时,尚未得出差异显著的结果。另外,PCV2感染3D4/2细胞使得COX-1和COX-2活性显著增加。这与前人的研究结果相类似。而FEA处理后,可使得IL-6、IL-10、IFN-γ含量和COX-1、COX-2活性显著减少,说明FEA能有效调节PCV2诱导的炎症反应,并抵抗病毒感染。
黄酮类化合物因其具有抗炎和抗氧化等生物活性,成为了科学研究领域值得探索的药物。Hsieh等[34]研究表明,人参皂苷Rh2(GRh2)可减少促炎因子TNF-α、一氧化氮(NO)和IL-1β的产生,并促进肺脏组织中白细胞介素-4(IL-4)、IL-6和IL-10的产生。此外,GRh2还会抑制核因子-κB抑制蛋白(IκB-α)、ERK、c-Jun氨基末端激酶(JNK)、p38 MAPK、原癌基因丝氨酸/苏氨酸蛋白激酶(Raf-1)、丝裂原活化蛋白激酶激酶(MEK)、一氧化氮合成酶(iNOS)和COX-2的蛋白表达水平。还有相关研究表明,黄酮类化合物可减少各种炎性细胞因子或趋化因子的表达。例如,在LPS诱导的人血单核细胞中,染料木黄酮会减弱细胞因子IL-1β、IL-6和TNF-α的分泌[35]。病毒的感染通常伴随着炎症的发生,病毒感染诱导细胞产生炎症因子,在此过程中NF-κB被激活,一方面其通过分泌抗病毒细胞因子如IFN-γ等发挥抗病毒作用,另一方面NF-κB通过激活ERK1/2、p38 MAPK和PI3K/Akt信号通路诱导促炎介质和细胞因子的过量产生[16,20]。研究发现,PCV2感染也同样通过以上通路参与炎症反应[19-21]。在本研究中,我们发现PCV2感染3D4/2细胞后,炎症因子IL-6、IL-10、COX-1和p38MAPK和ERK1/2 mRNA相对表达水平升高,FEA处理后,p38MAPK和ERK1/2 mRNA相对表达水平下降。这表明FEA可通过p38 MAPK和ERK1/2信号通路调节炎症反应,这与上述的研究报道结果一致。另外,FEA也降低了PCV2感染3D4/2细胞中COX-2、IL-10和IL-6的mRNA相对表达水平,其中25 μg/mL的浓度效果最好。这些结果说明,FEA通过下调炎症相关mRNA的表达抵抗病毒感染诱导的炎症反应。
c-fos、c-jun、c-myc为原癌基因家族早期基因,大量研究表明原癌基因参与了各种不同的细胞过程,如增殖、分化和凋亡[36]。c-myc编码一种核磷蛋白和一种转录因子。此外,c-fos和c-jun所编码的蛋白还可构成二聚体活性蛋白-1(activation protein-1,AP-1),而AP-1是一种核转录活化因子,已被证实在各种炎症蛋白的表达中起着关键作用。另外,AP-1还参与了炎性信号的调控[37]。本研究发现,PCV2感染3D4/2细胞后,原癌基因c-fos、c-jun和c-myc的mRNA相对表达水平增加。不仅如此,炎症细胞因子IL-6、IL-10和COX-2的mRNA相对表达水平也增加,这表明原癌基因的表达与炎症因子的基因转录有关。25~100 μg/mL的FEA可显著降低PCV2感染3D4/2细胞中的c-fos、c-jun和c-myc的mRNA相对表达水平,表明FEA可能通过调节炎症相关基因的转录起始水平来抑制炎性因子的释放。
蛋白质磷酸化是真核生物中关键的可逆翻译后修饰方式,蛋白质的磷酸化与去磷酸化,参与调控诸多生命过程,如免疫应激、基因表达、细胞增殖、信号转导等。在生命体内至少有30%的蛋白被磷酸化修饰后参与生命活动[13-14]。本研究发现,PCV2感染3D4/2细胞后,p38 MAPK和ERK1/2的蛋白磷酸化水平显著增加,而FEA处理显著抑制了ERK1/2和p38 MAPK的磷酸化,这与基因表达的结果一致。这表明FEA可能通过抑制MAPK和ERK1/2信号通路来减少PCV2感染3D4/2细胞的炎症反应。综上所述,FEA可通过抑制MAPK和ERK1/2信号通路的相关蛋白磷酸化发挥抗炎作用,可作为一种潜在的有效药物以防治病毒诱导的炎症性疾病。
4 结 论
FEA通过抑制p38 MAPK和ERK1/2通路的关键蛋白的磷酸化,减少相关炎症细胞因子的分泌,降低相关炎症细胞因子的mRNA相对表达水平,而保护3D4/2细胞受PCV2诱导的炎症损伤。此外,25 μg/mL的FEA为适宜的作用剂量。
