复合益生菌对猪生长性能、腹泻率、肠道菌群及代谢物和猪舍氨气浓度的影响
2023-03-07蒋广志戴茜茜陈梅香刘明刚
蒋广志 戴茜茜 陈梅香 刘明刚 李 杰 阮 波 李 亮*
(1.安徽农业大学动物科技学院,合肥230036;2.安徽禾丰牧业有限公司,亳州236000;3.重庆三峡职业学院,重庆404155;4.福建省莆田市城厢区农业农村局,莆田351100;5.四川农业大学动物医学院,成都611130;6.福建洛东生物技术有限公司,莆田351162)
随着养殖业的高速发展、抗生素添加剂的滥用,耐药细菌在动物和人类之间传播已成为潜在威胁[1]。为此,我国农业农村部颁布了饲料中禁止添加抗生素等相关规定。但肠道致病菌对养殖业的危害依旧十分严重,因此,寻找绿色“替抗”饲料添加剂已成为当下研究热点。益生菌具有平衡肠道微生物群、改善肠道健康、加强肠道免疫功能、促进营养物质消化利用和提高动物生长性能等特点,目前已经成为“替抗”产品的重要研究对象。钟晓霞等[2]发现,饲喂复合益生菌(枯草芽孢杆菌、丁酸梭菌、酿酒酵母和淀粉芽孢杆菌)能提高断奶仔猪的采食量,而王磊等[3]发现,枯草芽孢杆菌、地衣芽孢杆菌和酿酒酵母的组合能抑制胃肠道中有害菌的增殖,对胃肠道有正面影响。但现在有关益生菌对猪胃肠道菌群调控作用的研究报道还相对较少,其促进猪只生长、改善胃肠道功能的机理还有待进一步的研究。因此,本试验旨在研究添加复合益生菌对猪生长性能、腹泻率和猪舍氨气浓度的影响,并采用高通量测序和非靶向代谢组学技术对试验组和对照组的肠道菌群和代谢物差异进行分析,以期为益生菌作用机理提供数据支撑。
1 材料与方法
1.1 试验材料
试验所用复合益生菌主要成分是枯草芽孢杆菌(LDS0411)、凝结芽孢杆菌(LDC0429)和酿酒酵母,其组成见表1。

表1 复合益生菌组成
1.2 试验动物及饲养管理
试验地点为安徽阜阳某大型企业的养殖场,其猪舍为封闭式,猪舍大小(长×宽×高)为90.0 m×10.0 m×2.5 m。试验动物为45日龄同一批次的健康仔猪。饲喂方式按照场内饲养员日常操作进行,对照组和试验组每日饲粮饲喂量相同,猪群自由饮水。其余日常清扫消毒、免疫等工序按照该公司规程进行。
1.3 试验设计及饲粮
1.3.1 试验1:猪舍氨气浓度和猪只腹泻率的测定
从1 000头猪中挑选体重[(15.5±0.5) kg]相近的猪40头备用,将剩余的960头猪根据体重和性别平均分在2组,分别在2个栋舍中饲养,每组16个重复,每个重复30头。对照组猪群喂食基础饲粮,试验组猪群喂食基础饲粮+复合益生菌(每1 000 kg饲粮添加100 g复合益生菌),每日测定猪舍氨气浓度。每栋猪舍再各随机选取体重接近的3栏猪,每栏30头,用于考察猪的腹泻情况。试验期30 d。
1.3.2 试验2:猪只料重比、肠道菌群及代谢物的测定
将试验1中挑选出的40头猪在另一个栋舍中随机分为2组,每组4个重复,每个重复5头。对照组猪群喂食基础饲粮,试验组猪群喂食基础饲粮+复合益生菌(每1 000 kg饲粮添加100 g复合益生菌),对猪只料重比、肠道菌群及代谢物进行研究。试验期30 d。
1.3.3 试验饲粮
基础饲粮使用养殖公司的常规饲粮,其组成及营养水平见表2。
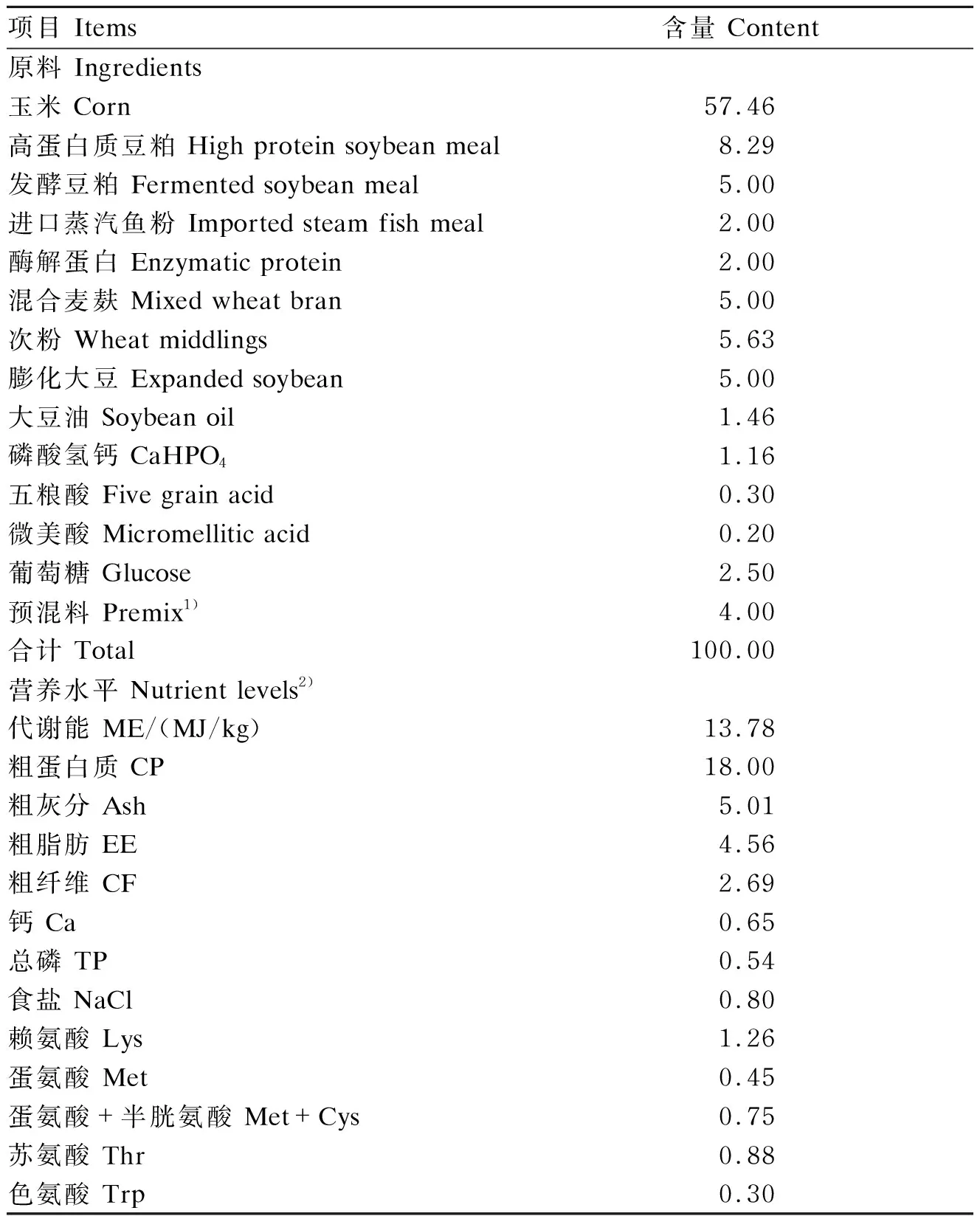
表2 基础饲粮组成及营养水平(风干基础)
1.4 猪舍氨气浓度监测
每日于06:00用氨气检测仪(希玛AR8500)在猪舍的前、中、后3个位置对试验1中2个栋舍氨气浓度进行检测,氨气浓度取3次测量的平均值。氨气检测仪为电子式测量仪,分辨率为0.1 μL/L,基本误差为2%。
1.5 进食和肠道排泄状态监测
每日07:00和15:00观察各组猪群排便情况,记录每日每组试验猪腹泻(出现水样粪便、粪便不成形或屁股红肿的情况)头数。
腹泻率(%)=100×试验期腹泻头数/
(试验头数×试验天数)。
1.6 生长性能测定
记录试验2中猪群每日的耗料量,分别于饲喂第0、30天对各栏猪进行空腹称重,计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
平均日增重(g)=(试验末重-
试验初重)/试验天数;
平均日采食量(g)=饲粮消耗总量/试验天数;
料重比=平均日采食量/平均日增重。
1.7 肠道微生物测定
饲喂30 d后,从试验2中每栏(重复)各取1头猪在屠宰场屠宰,截取各猪只十二指肠同一部位,无菌采集十二指肠内容物。放入液氮罐中保存,用于后期分析。
将肠道样品在干冰的条件下送至深圳华大基因医学有限公司,样品测定按照公司试验操作流程进行,步骤如下:用试剂盒(QIAGEN,德国)提取十二指肠中的微生物基因组,用酶标仪检测DNA纯度和浓度。使用引物515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’)进行PCR扩增。扩增条件为98 ℃预变性1 min, 98 ℃变性10 s,50 ℃下退火30 s,72 ℃下延长30 s,30个循环,最后72 ℃延伸5 min。使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于Elution Buffer,贴上标签,完成建库。使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq2500平台进行测序。利用软件USEARCH(v7.0.1090)下的UPARSE在97%相似度下进行聚类,得到操作分类单元(OTU)代表序列。通过核糖体数据库分类器RDP classifer(v2.2)将OTU代表序列与Greengene数据库比对进行物种注释。
1.8 肠道代谢组学分析
试验采用Waters 2D UPLC(Waters,美国)串联Q Exactive高分辨质谱仪(Thermo Fisher Scientific,美国)进行液相色谱-串联质谱联用(LC-MS/MS)分析和检测,使用Compound Discoverer 3.0(Thermo Fisher Scientific,美国)软件进行LC-MS/MS数据处理。使用PLS-DA模型前2个主成分的差异权重贡献值(VIP),结合单变量分析获得的差异变化倍数(fold-change,FC)和t检验的结果来筛选差异代谢物并对代谢物进一步分析。
1.9 数据处理
采用SPSS 21.0统计软件进行单因素方差分析(one-way ANOVA),并应用Duncan氏法进行多重比较。以P<0.05为差异显著,P<0.01为差异极显著。结果表示为平均值±标准差。
2 结果与分析
2.1 复合益生菌对猪舍氨气浓度的影响
猪舍氨气浓度为每栋猪舍试验最后1周平均浓度进行比较。如表3所示,与对照组相比,添加复合益生菌的猪舍氨气浓度极显著下降(P<0.01)。

表3 复合益生菌对猪舍氨气浓度的影响
2.2 复合益生菌对猪腹泻率的影响
如表4所示,与对照组相,复合益生菌的添加有降低猪的腹泻率的趋势,但是差异不显著(P>0.05)。

表4 复合益生菌对猪腹泻率的影响
2.3 复合益生菌对猪生长性能的影响
如表5所示,与对照组相比,添加复合益生菌显著提高平均日增重(P<0.05),显著降低料重比(P<0.05)。
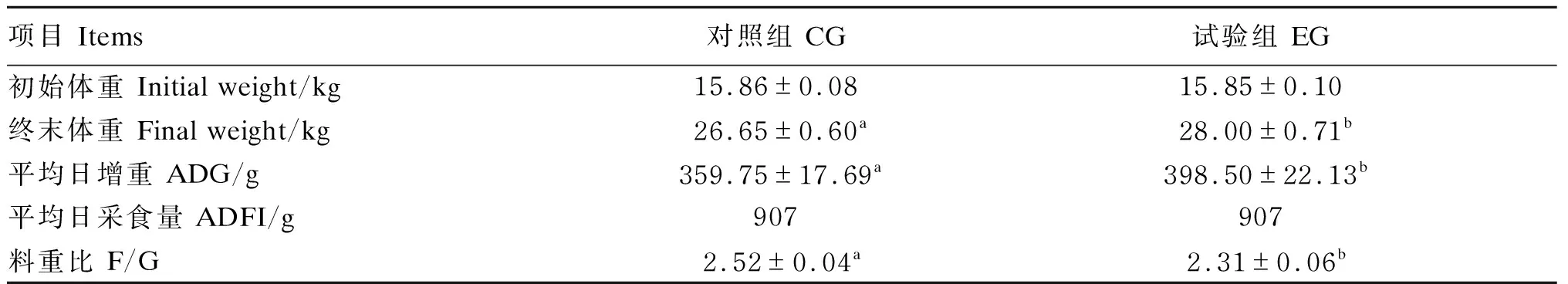
表5 复合益生菌对猪生长性能的影响
2.4 复合益生菌对猪肠道菌群多样性的影响
2.4.1 α多样性分析
测序共获得有效序列数528 038个,按照97%序列相似性聚类生成OTU 1 301个,从图1可以看出,属于试验组独有OTU有324个,而对照组有184个。与数据库进行对比进行物种注释,得到8个门,17个纲,24个目,42个科,59个属,51个种。
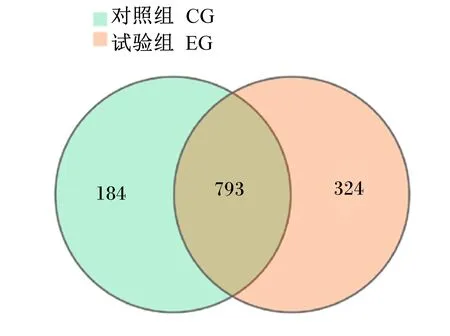
图1 Venn图
对组间进行α多样性分析,如表6所示,2组覆盖度都大于0.997,说明测序结果可以反映样品的真实情况。添加益生菌后Shannon指数显著提高(P<0.05),Shannon指数越高,肠道微生物多样性越大;Simpson指数有所降低,Chao1指数和Ace指数无显著变化(P>0.05)。

表6 复合益生菌对猪肠道菌群α多样性的影响
2.4.2 β多样性分析
不同组间的样品进行β多样性分析,研究试验组和对照组间的差异性。对2组数据进行主坐标分析(PCoA),结果如图2所示,可以看出各组点相互聚集且试验组和对照组点之间有明显的界线,试验组的胃肠道菌群结构发生改变,说明复合微生物具有促进肠道微生物菌群改变的作用。
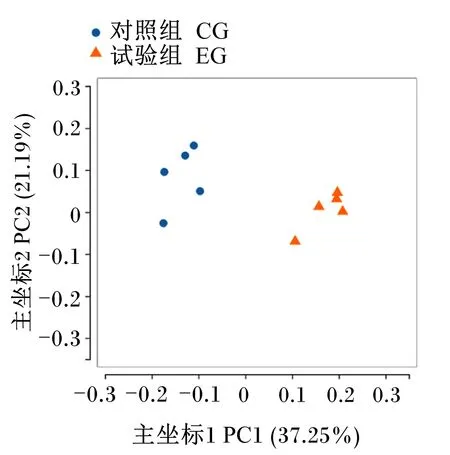
图2 主坐标分析图
2.5 复合益生菌对猪胃肠道菌群的影响
2.5.1 复合益生菌对胃肠道门水平菌群的影响
如表7所示,取相对丰度大于1%的菌落进行比较,可以发现,与对照组相比,拟杆菌门的相对丰度显著上升(P<0.05),厚壁菌门/拟杆菌门的比值显著下降(P<0.05)。
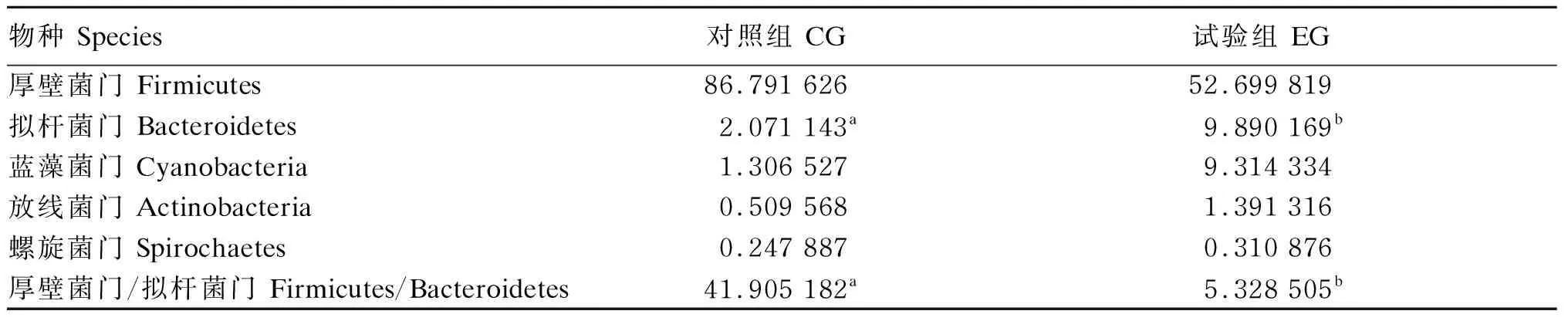
表7 门水平优势菌群丰度分布
2.5.2 复合益生菌对胃肠道属水平菌群的影响
如表8所示,取相对丰度大于1%的菌落进行比较,可以发现,与对照组相比,在添加复合益生菌后链球菌属和埃希氏杆菌属相对丰度下降,但差异不显著(P>0.05)。
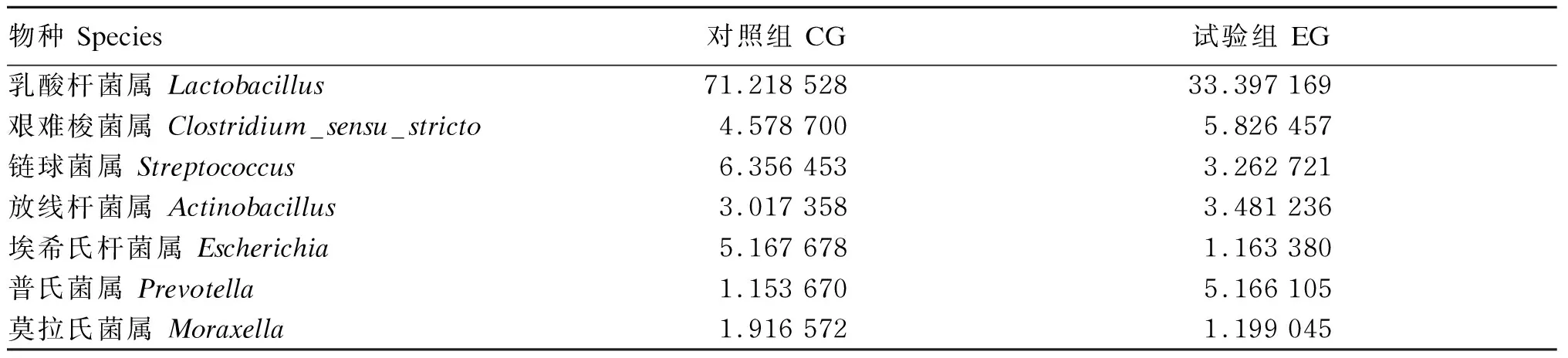
表8 属水平优势菌群丰度分布
2.5.3 复合益生菌对胃肠道菌群菌落组成差异分析
采用LEfSe方法对试验组和对照组进行差异性分析,可以有助于发现关键的生物标记物(比如关键功能类群/物种)。如图3所示,LDA大于2时,得到41种不同的微生物类群,与对照组相比,在门水平上,试验组厚壁菌门、拟杆菌门等菌门相对丰度升高;在目水平上,试验组拟杆菌目、放线菌目相对丰度升高;在科水平上,试验组瘤胃菌科、芽孢杆菌科、颤杆菌科相对丰度上升;在属水平上,试验组普氏菌属、月形单胞菌属、布劳特氏菌属相对丰度上升。
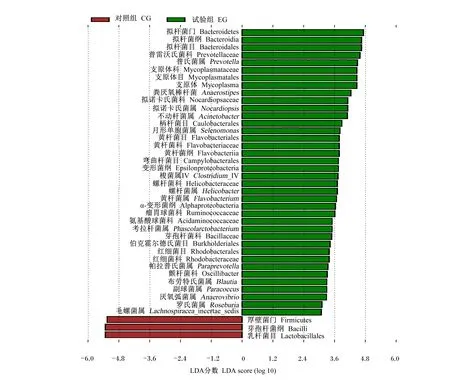
图3 猪肠道菌群不同组菌落差异分析
2.6 复合益生菌代谢组分析
2.6.1 胃肠道代谢组概述
从图4主成分分析可以看出,试验组和对照组的代谢物在正、负离子模式下相互分开并且互相聚集,说明添加复合益生菌改变了十二指肠中的代谢物。采用多元统计分析(PCA和PLS-DA)和差异变化倍数和t检验相结合的方式筛选组间差异代谢物,在2个组的十二指肠中鉴定出353种差异代谢物(257种正离子代谢物和96种负离子代谢物)。
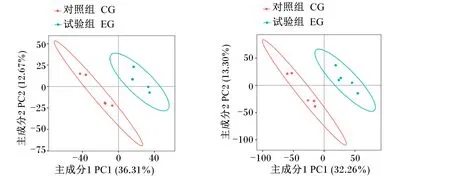
图4 代谢组主成分分析(左:正离子模式;右:负离子模式)
2.6.2 代谢组学KEGG通路富集
富集因子为注释到该通路的差异代谢物数目除以注释到该通路的所有鉴定到代谢物,该值越大,说明注释到该通路差异代谢物比例越大。圆点大小代表注释到该通路的差异代谢物的数目。通路富集到了组氨酸代谢、瞬时受体电位(TRP)通道响应、腺苷酸活化蛋白激酶(AMPK)通路、磷脂信号通路。

图5 代谢通路富集分析气泡图(左:正离子模式;右:负离子模式)
3 讨 论
3.1 复合益生菌对猪生长性能和猪舍氨气浓度的影响
越来越多的研究表明,复合益生菌制剂作为饲料添加剂在畜牧养殖行业可调节动物机体肠道菌群,进而在实际生产中提高机体生长性能及改善各种胃肠道疾病的过程中扮演重要角色[4]。前期报道显示,饲喂复合乳酸菌和枯草芽孢杆菌后猪群的生长性能相关指标改善的同时,育肥猪群结肠中瘤胃球菌属的相对丰度升高[5]。刘熙文[6]研究发现,枯草芽孢杆菌、粪肠球菌和丁酸梭菌一起饲喂后,随使用时间的增加,育肥猪生长性能提高的效果越明显。本试验中所选用复合益生菌由枯草芽孢杆菌、凝结芽孢杆菌和酿酒酵母等组成。其中,枯草芽孢杆菌和凝结芽孢杆菌具有提高猪群的平均日增重、降低料重比[7-8]和优化肠道菌群等功效。酵母菌可改善乳酸菌的生物学活性,在促进动物生长、提高免疫应答和抵抗疾病等过程中发挥重要作用。研究结果显示,添加该复合益生菌后可降低猪只的料重比,这与前人添加芽孢杆菌后改善猪群生长性能的结果相似,但由于菌株品种、添加剂量、试验动物和试验环境等因素存在差异,改善的生长性能程度也不尽相同。我们进一步对比后发现,本试验所提升的效果更为显著,推测可能与枯草芽孢杆菌和其余2种菌种的互作有关。
氨进入体内后,由肺泡入血,并会与血红蛋白结合,造成体内血氨、肠氨浓度过高,引起贫血和组织缺氧。而氨的解毒需要消耗大量能力,会增加机体的负担,摄入的能量也相对减少,进而影响料重比。通常规模化猪场养殖密度大,环境封闭氨气浓度高,易对猪群健康造成伤害。张静[9]发现,不同浓度氨气刺激可导致断奶仔猪肺组织基因表达差异,从而破坏肺组织的正常结构,对断奶仔猪的免疫功能产生影响。Wu等[10]研究结果显示,氨气浓度过高会引起动物局部或全身性的炎症。此外,周莹[11]揭示氨暴露会使呼吸道和胃肠道屏障遭到破坏,进而影响猪群生长发育。本研究结果显示,添加复合益生菌显著降低了猪舍氨气浓度,说明复合益生菌可以改善猪场环境,提升动物福利和养殖效益。我们推测氨气浓度变化与复合益生菌调节猪群肠道菌群存在关联,为此后续我们进一步开展了猪胃肠道菌群及其代谢物的相关研究。
3.2 复合益生菌对猪胃肠道菌群和代谢的影响
众所周知,肠道菌群微平衡对机体健康十分必要。然而,目前限抗的大背景下,利用益生菌改善菌群微平衡为当下研究热点。报道显示,凝结芽孢杆菌对猪霍乱沙门氏菌的抑制相较于抗菌药物金霉素和土霉素效果更优,对大肠杆菌K88、大肠杆菌K99有显著抑制作用[12]。高娟娟等[13]阐明了枯草芽孢杆菌分泌的抑菌蛋白可以抑制大肠杆菌和金黄色葡萄球菌生长的作用机制。本试验中,大肠杆菌属和链球菌属相对丰度的减少,可能就与凝结芽孢杆菌和枯草芽孢杆菌抑菌特性有关。
本研究进一步发现,在猪群饲粮中添加复合益生菌后,导致肠道中厚壁菌门/拟杆菌门的比值下降和帕拉普氏菌属的相对丰度的升高。厚壁菌门/拟杆菌门的比值常被作为病理生理标志物,其比值可影响碳水化合物代谢和短链脂肪酸产生[14],比值还与脂肪的堆积和病理引起的肥胖呈正相关关系[15-17],说明添加复合益生菌有益于猪群提高身体机能,降低病理性的脂肪堆积。而帕拉普氏菌属的相对丰度与猪的生长性能息息相关,Tan等[18]发现,帕拉普氏菌属相对丰度和料重比呈正相关。本试验中,帕拉普氏菌属的相对丰度升高,而料重比降低,与Tan等[18]的研究结果一致。这说明添加复合益生菌有助于提高饲料的利用率。
此外,物种差异判别分析LEfSe的结果表明,瘤胃球菌科的相对丰度显著上升。瘤胃球菌表面的蛋白热激蛋白A和热激蛋白在体内可以激活免疫球蛋白[19],利用糖结合蛋白降解黏液蛋白[20],分泌瘤胃球菌素抑制有害菌属的核酸合成,从而维护肠道黏膜的安全,促进肠道健康。我们观察到,添加复合益生菌后,猪群的腹泻率下降,推测可能与瘤胃球菌科的相对丰度显著上升有关,但该推论还需进一步探讨验证。
组氨酸是半必需氨基酸,而它主要由肠道内微生物代谢生成,所以复合益生菌可能通过影响菌群的变化,从而影响组氨酸的生成进而对组氨酸的代谢通路产生作用。Elenkov等[21]发现在组氨酸代谢的过程中可产生组胺,并抑制体内肿瘤坏死因子-α(TNF-α)的产生,同时可以防止细菌的移位。Sun等[22]揭示了组氨酸具有治疗炎症反应、氧化应激和代谢紊乱的作用[23]。在本研究中,我们进一步探索了添加复合益生菌后对菌群差异变化所导致的代谢产物影响。KEGG分析结果表明,差异代谢物主要富集在组氨酸代谢、TRP通道响应、AMPK通路和磷脂信号通路上。因此,复合益生菌的添加是否通过对组氨酸代谢通路的影响而改善了猪群亚健康状态还需进一步研究。有研究显示,TRP通道与胃肠道消化改善[24]和胃黏膜病变[25]有关,而试验中差异代谢产物富集在TRP的炎症因子调节上,所以益生菌可能引起了胃肠道的炎症变化。Zhao等[26]研究发现,乳酸杆菌影响脂肪酸代谢通过AMPK通路抑制了氧化应激,而氧化应激与胃肠道炎症的促进有关。因此,我们推测复合益生菌可能通过影响上述通路的代谢物的改变,进而减少了氧化应激并降低了炎症反应,最终改善了猪群腹泻率等情况,提高了猪群的健康水平。
试验中我们通过微生物组学和代谢组学研究了3种益生菌的复合对肠道菌群和代谢产物的影响,遗憾的是我们并不知道这些是由于它们共同发挥功能产生的影响,还是单一菌群发挥功能产生的影响。但是Chang等[27]的研究结果显示,添加枯草芽孢杆菌会使瘤胃液中瘤胃球菌科和帕拉普氏菌属的相对丰度升高,而厚壁菌门/拟杆菌门的比值下降,与本试验的结果相似,结合试验的相关数据,我们初步推测枯草芽孢杆菌在对胃肠道菌群的影响所占比重比较大。在肠道代谢物的相关研究中,有研究发现枯草芽孢杆菌的发酵产物会影响AMPK的产生[28]。而酵母菌可能对TRP通道的响应有着重要的影响,Kokke等[29]在1963年报道了酵母的卵磷脂分解代谢中有磷脂酶A的活性,在磷脂酶A可以使花生四烯酸从磷脂膜上释放出来,花生四烯酸与多巴胺的结合产生花生四烯酰多巴胺,花生四烯酰多巴胺可以通过TRP通道在炎症中发挥作用[30]。但是这些结果是单一菌种的作用,还是菌种之间的联合作用,我们还需要在后续进行不同的分组试验来进一步深入探究。
4 结 论
猪饲粮中添加复合益生菌可提高胃肠道菌群多样性,显著提高拟杆菌门相对丰度,提高猪的生长性能,改善猪舍氨气浓度,降低猪的腹泻率。
