基于Lachancea thermotolerans-Saccharomyces cerevisiae双酵母混合发酵酸啤酒的工艺研究
2023-03-07付晓芬郭立芸侍亚敏谢鑫宋玉梅李十中
付晓芬,郭立芸,侍亚敏,谢鑫,宋玉梅,李十中
1(北京燕京啤酒股份有限公司技术中心,啤酒酿造技术北京市重点实验室,北京,101300)2(清华大学核能与新能源技术研究院,北京,100084)
伴随着生活方式的转变与消费需求的多元化,新一代啤酒消费者对于个性化酿造和新风格啤酒的需求日益增长,促使啤酒企业不断向产品多元化和高端化方向布局。非酿酒酵母是商业啤酒酿造中的非常规酵母,虽然其发酵性能不如酿酒酵母,但其对啤酒总体香气特征的复杂性和多样性有着积极的影响。近年来,对非传统酵母的开发和应用成为中外葡萄酒和精酿啤酒的热点,针对非酿酒酵母在发酵技术和方法上也不断产生新的观点[1-2]。将具有不同特性的非酿酒酵母与常规酿造酿酒酵母进行组合发酵,改良原有产品的风格缺陷,增强产品的风味,这种基于不同酵母的混菌发酵模式在葡萄酒的规模酿造中已得到较好的应用[3-5],但鲜有将这种混菌发酵技术应用于大规模啤酒生产中的尝试。虽然这种基于不同酵母混菌发酵开发特色啤酒的方法极具前景,但因其需对工艺条件进行重大调整,以及发酵过程的稳定性等问题的存在,很多大规模酿造工厂不愿在工业条件下使用混合发酵方式生产啤酒。
近年来,人们对风味高度复杂的酸啤酒的兴趣大大增加[6]。与常规的艾尔啤酒和拉格啤酒相比,酸啤酒含有大量的有机酸(如乳酸和乙酸),使得其pH值偏低。传统酸啤酒的生产起源于比利时传统酸啤酒Lambic酿造工艺[7-8],该工艺利用复杂的微生物菌群自发发酵进行生产,通过长期的发酵过程(1~3年)可形成富含多种代谢物的传统酸啤酒。然而,传统酸啤酒的酿造工艺存在发酵周期长、酿造过程不可控、产品质量稳定性差等诸多问题降低了其大规模生产的可能性。为了规避野生菌群引发的产品质量不稳定和发酵失败风险大等问题,在煮沸麦芽汁前接入乳酸菌发酵剂进行糖化锅酸化法(kettle souring)[6,9],48 h后依次进行煮沸、酿酒酵母发酵与木桶老化。采用此方法生产酸啤酒虽然发酵耗时相对较短,但提前酸化工艺仍然增加了工艺操作步骤,且对后期的罐体消杀要求较高。同时,煮沸后乳酸菌产生的挥发性物质减少,也是其缺点之一。虽然可使用木桶陈酿来增加啤酒香气的复杂性,但这又延长了酸啤酒的生产周期。另有研究[10-11]将乳酸菌与酿酒酵母混合发酵或发酵后期添加乳酸菌进行酸啤酒生产,但由于大部分乳酸菌属于细菌,受到啤酒花的抑制作用,很难在酿酒酵母存在的情况下形成生长优势,所以其产生的乳酸和其他风味物质也很有限。国内外对酸啤酒的研究和开发已是热点,但鲜有研究利用不同酵母进行可调控的混合发酵酸啤酒。
为了获得一款适用于大规模生产且果味馥郁的酸啤酒产品,本研究选择在基质利用和风味产生方面具有一定潜力的不同酵母菌种组合构建稳定的双酵母混菌发酵体系,基于工业条件下成熟稳定的啤酒酿造工艺,利用工业标准麦芽汁(不添加外源风味物质)生产新型果味酸啤酒。
1 材料与方法
1.1 材料
1.1.1 菌株
酿酒酵母Saccharomycescerevisiae68obg、耐热拉钱斯氏酵母LachanceathermotoleransFBA-2、布鲁塞尔酒香酵母BrettanomycesbruxellensisWDB24菌株由实验室菌种保藏中心提供;马克斯克鲁维酵母Kluyveromycesmarxianus1695、Kluyveromycesmarxianus1042和耐热拉钱斯氏酵母Lachanceathermotolerans1548菌株由中国普通微生物菌种保藏管理中心提供。
1.1.2 培养基与溶液
扩培培养基:麦芽汁由某公司糖化车间生产,115 ℃灭菌20 min。
发酵培养基:添加终体积分数为2%果葡糖浆至麦芽汁,以增加非酿酒酵母可利用糖含量,115 ℃灭菌20 min。
1.1.3 实验试剂
次甲基蓝(分析纯),天津百世化工有限公司;硫酸钙(分析纯),天津市风船化学试剂科技有限公司;水合茚三酮、乙醛等标准品(色谱纯),上海阿拉丁生化科技股份有限公司;葡萄糖、果糖、蔗糖、麦芽糖、麦芽三糖(色谱纯),大连美仑生物技术有限公司,叠氮溴化乙锭(分析纯),美国Sigma公司。
1.1.4 仪器与设备
Agilent 1260高效液相色谱仪、G1888-6890气相色谱仪,美国安捷伦科技有限公司;UV1280紫外可见分光光度计,日本岛津公司;ABI7500定量PCR仪,美国Applied Biosystems公司;DX-320离子色谱仪,美国戴安公司;Anton Paar(Ⅳ型)啤酒分析仪,安东帕公司;生化培养箱,上海智城分析仪器制造有限公司;IY1200酵母计数仪,上海睿钰生物科技有限公司;FE28 pH计,上海梅特勒-托利多仪器有限公司;MIR-253型生化培养箱,日本三洋公司;超净工作台,苏州净化设备有限公司;高压灭菌器,日本HIRAYAM公司。
1.2 实验方法
1.2.1 啤酒发酵实验
活化后菌液接种至含250 mL麦芽汁的500 mL三角瓶中,25 ℃静置培养24 h,制备种子液,按1×107~1.2×107CFU/mL的接种量接种至麦芽汁发酵培养基中,20 ℃静置培养7 d,然后将600 mL发酵液注入无菌卡箍瓶中,压盖后在0 ℃下贮酒7 d。(每个样品3个平行)。
1.2.2 双酵母混合发酵体系不同种酵母数量变化分析
将qPCR与叠氮溴化乙锭(ethidium monoazide bromide, EMA)活菌处理技术相结合,实现对混合发酵体系中各菌株定量分析,从而可以快速表征双酵母混合发酵体系各酵母的动态变化趋势。
与亚甲基蓝染色法显微监测法分析细胞死亡率[12]进行关联分析,酵母死亡率测定采用亚甲基蓝染色法。确定适用于2株酵母菌种的EMA预处理条件为EMA浓度在20 μmol/L、避光放置10 min后,将样品放置在距500 W卤素灯10 cm处曝光15 min,可有效抑制死菌DNA的扩增,从而排除死菌DNA扩增对qPCR菌株定量的影响。将已知浓度的酵母纯培养菌液,进行10倍梯度稀释,之后分别进行EMA-qPCR检测,其中两酵母特异性引物分别为S.cerevisiaeCESP-F:ATCGAATTTTTGAACGCACATTG,SCER-R:CGCAGAGAAACCTCTCTTTGGA[13];L.thermotoleransLTH2-F CGCTCCTTGTGGGTGGGGAT,LTH2-R CTGGGCTATAACGCTTCTCC[14]。30 μL的qPCR反应体系为12 μL的Sybrgreen Mix(天根),1 μL上游引物和下游引物,1 μL的模板DNA,15 μL的灭菌水。qPCR反应程序为95 ℃ 5 min,40个循环,每个循环95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,在每个循环的延伸阶段进行荧光信号检测,最终得到104、105、106、107、108、109CFU/mL活细胞的标准曲线, 确定qPCR相应循环阈值(cycle threshold, Ct)和平板计数之间的相关性,实现各菌株的定量分析,最后应用EMA-qPCR监测技术动态表征双酵母混合发酵体系中各单菌生长状态。
1.2.3 双酵母混合发酵体系稳定性实验
将混菌发酵体系逐级进行发酵体积放大,分别进行500 mL三角瓶、2 L发酵瓶、100 L发酵罐双酵母混合发酵酸啤酒实验,监测发酵过程各关键参数和风味的稳定性。
1.2.4 有机酸含量的测定
有机酸对啤酒的风味和口感有很大影响,是评价酸啤酒的重要指标。采用离子色谱方法测定酒液中的有机酸(乳酸、乙酸、甲酸、丙酸、丙酮酸、琥珀酸、酒石酸、草酸、富马酸和柠檬酸)成分。将混合标准溶液与样品待测液分别注入离子色谱仪,测得各有机酸的响应值(峰面积),经与标准溶液色谱图比较响应值(峰面积)得到待测样品有机酸浓度。
1.2.5 酒精度、发酵度的测定
根据GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》对真正发酵度及酒精度进行测定[15]。
1.2.6 可发酵糖含量的测定
使用高效液相色谱仪对发酵液中的主要糖类进行测定[16]。
1.2.7 风味物质含量的测定
使用气相色谱仪对蒸馏后的发酵液中风味物质进行测定[12]。气相色谱条件:色谱柱Agilent CP-WAX(50 m×250 μm×0.25 μm),载气为高纯氮气(>99.999%);柱流速为1 mL/min;进样口温度250 ℃;检测器温度148.8 ℃;程序升温:起始温度35 ℃,保持1 min,以3 ℃/min升至70 ℃,保持15 min,再以3.5 ℃/min升至190 ℃,保持22 min;进样体积为1 μL;分流进样,分流比30∶1。
1.2.8 啤酒感官品评
目前啤酒行业广泛采用的描述类感官评价方法是定量描述分析法(quantitative descriptive analysis, QDA),由10名啤酒感官评定专业人员组成评定小组,对啤酒的口感、口味和香气进行感官评定,并按照风味强度评分。
2 结果与分析
2.1 产酸酵母的筛选实验
参考相关研究[17-19],对具有一定产酸能力和麦芽汁发酵特性的非酿酒酵母进行分析,结果表明,与啤酒酵母68obg相比,大部分非酿酒酵母都只能利用麦芽汁中的葡萄糖、果糖和蔗糖,对麦芽糖、麦芽三糖等麦芽低聚糖基本不代谢,只有L.thermotoleransFBA-2利用少量的麦芽糖,且代谢速率明显低于酿酒酵母。
对5株非酿酒酵母的有机酸种类和产量进行分析,如表1所示,菌株L.thermotoleransFBA-2的乳酸产量最大,为2.573 g/L。但由于其乳酸和有机酸总量均高于其他菌株,感官品评的结果显示,酸感明显,综合感官品评和风味物质检测,选择协调性和爽口性更佳的L.thermotoleransFBA-2酿造酸啤酒。

表1 五株非酿酒酵母利用麦芽汁发酵有机酸产量情况 单位:mg/L
2.2 酵母单一菌株发酵实验
对S.cerevisiae68obg和L.thermotoleransFBA-2进行单一菌株的麦芽汁发酵实验,S.cerevisiae68obg发酵效率高,且产酯丰富,酒体丁香风味明显[20]。如图1所示,L.thermotoleransFBA-2对麦芽糖的利用能力低,不利用麦芽三糖等麦芽低聚糖,残糖含量较高。如表1所示,单一菌株L.thermotoleransFBA-2的发酵产物中乳酸和总酸的产量最高,但受限于碳源的利用能力,其他风味物质的产量较低,主要的杂醇异丁醇和异戊醇则明显低于S.cerevisiae68obg,导致总醇较低,但酯含量比S.cerevisiae68obg高。

图1 单一菌株利用麦芽汁中可发酵糖情况
发酵过程的失重情况如图2所示,与S.cerevisiae68obg相比,非酿酒酵母L.thermotoleransFBA-2发酵速率较慢,S.cerevisiae68obg与L.thermotoleransFBA-2发酵液的酒精度分别为6.75%vol和2.11%vol。感官品评的结果也表明,菌株L.thermotoleransFBA-2的发酵酒液酸感突出,影响了酒体的协调性和适饮性,其他风味表现不突出,与S.cerevisiae68obg发酵所得的标准啤酒相比,风格差异较大。在葡萄酒的研究[21]中发现,将耐热拉钱斯氏酵母与酿酒酵母混合发酵可增加总酸度、甘油、多糖、2-苯基乙醇等的产量,同时降低葡萄酒的挥发性酸度。可见,选择S.cerevisiae68obg作为双酵母混合发酵体系的基础酵母,菌株L.thermotoleransFBA-2作为构建双酵母混合发酵酸啤酒的风格酵母,可混合酿造酸味协调的酸啤酒。

图2 单一菌株麦芽汁发酵过程失重情况
2.3 啤酒混菌发酵体系中非酿酒酵母与酿酒酵母最适配比的确定
混合发酵过程存在不同酵母之间的相互作用。大量研究表明[22-23],非酿酒酵母与酿酒酵母混合发酵与单菌株发酵之间代谢活动存在差异,混合发酵体系中不同酵母菌株的比例对啤酒最终口味起决定性作用。因此,我们将风格酵母L.thermotoleransFBA-2和基础酵母S.cerevisiae68obg按照100∶1、50∶1、10∶1、1∶1、1∶10、1∶50和1∶100的比例共同接种于发酵麦芽汁中,并添加2%的果葡糖浆,以促进混菌发酵体系中非酿酒酵母充分的生长。
如图3所示,当混合发酵体系中风格酵母L.thermotoleransFBA-2和基础酵母S.cerevisiae68obg接种比例为1∶100、1∶50、1∶10时,菌株S.cerevisiae68obg有明显的生长优势,细胞增长速率高于风格酵母L.thermotoleransFBA-2,快速成为主导菌株。即使在添加果葡糖浆后的麦芽汁中,与基础酵母S.cerevisiae68obg竞争利用葡萄糖、果糖、蔗糖,风格酵母L.thermotoleransFBA-2无法形成生长优势,从而无法对最终的啤酒产品组分产生大的影响。

图3 不同配比混菌发酵24 h后各酵母细胞状态
当混合发酵体系中风格酵母L.thermotoleransFBA-2和基础酵母S.cerevisiae68obg接种比例为100∶1、50∶1时,风格菌株L.thermotoleransFBA-2占据了绝对的生长优势,即使在发酵后期,菌株S.cerevisiae68obg也没有在酵母数量上的形成优势,而当混合发酵体系中风格酵母L.thermotoleransFBA-2和基础酵母S.cerevisiae68obg接种比例为10∶1时,酵母L.thermotoleransFBA-2启动发酵,发酵中期,逐步衰亡。然后,S.cerevisiae68obg开始占据主导地位,使发酵继续,直至完成。
2.4 耐热拉钱斯氏酵母与酿酒酵母混合发酵麦芽汁生产新型果味酸啤酒
综合啤酒混合发酵体系中风味物质分析和感官品评结果,选择L.thermotoleransFBA-2和S.cerevisiae68obg混合接种比例为10∶1,麦芽汁中总酵母数控制在1.0×107~1.2×107CFU/mL,利用EMA-qPCR监测技术动态表征双酵母混合发酵体系中各单菌生长状态。
2.4.1 EMA-qPCR定量分析建立各酵母标准曲线
使用EMA-qPCR分别建立了L.thermotoleransFBA-2和S.cerevisiae68obg的活细胞含量与Ct值之间的标准曲线,Ct值与活菌浓度呈线性关系,L.thermotoleransFBA-2的标准曲线方程为y=-3.118 2x+38.952,相关系数为R2=0.988 3,如图4所示,S.cerevisiae68obg的标准曲线方程为y=-3.221 5x+37.235,相关系数为R2=0.993 8,线性关系均良好。EMA-qPCR检测方法与传统的平板计数法相比较,能将检测时间从36 h缩减至3~4 h,可大大提高检测效率。
2.4.2 混合发酵麦芽汁生产新型果味酸啤酒过程分析
利用EMA-qPCR技术动态表征双酵母混合发酵体系中各单菌生长状态,如图4所示,由于接种比例大,L.thermotoleransFBA-2在进罐第1天后,酵母数量显著增加,成为优势菌株,对发酵过程的监测发现,1 d后发酵液的pH值从5.42降至3.51,发酵2 d后pH值为3.33,并一直保持到第7天。2 d后,随着可利用糖的耗尽,L.thermotoleransFBA-2活性下降,而后S.cerevisiae68obg利用发酵液中残留的麦芽糖和麦芽三糖等可发酵糖,其酵母数不断增加,由于L.thermotoleransFBA-2在发酵前期处于优势地位,对S.cerevisiae68obg有明显的抑制作用,相比于S.cerevisiae68obg的单菌发酵,其酵母数量增长受限,最高仅为1.38×107CFU/mL,因此,发酵结束后酒液中由S.cerevisiae68obg产生的醇类物质相对含量下降,发酵液的酒精度在5.55%vol。

图4 EMA-qPCR动态表征双酵母混合发酵体系中各酵母数变化情况
从实验室条件逐级放大有效发酵体积到100 L发酵罐麦芽汁发酵实验,如表2、表3所示,通过对发酵过程中相关关键参数的监测,乳酸含量为1.5~1.8 g/L,酒液pH值为3.3~3.4,酒精度约在5%vol,可见由非酿酒酵母与酿酒酵母构建的啤酒双酵母混合发酵体系具有一定的稳定性。
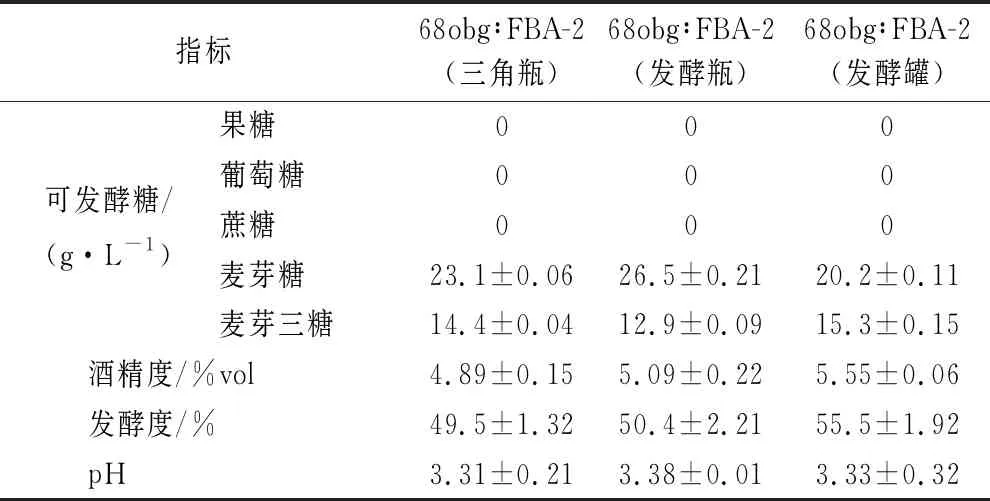
表2 双酵母混合发酵酸啤酒发酵性能参数
在双酵母混合发酵体系中非酿酒酵母和酿酒酵母之间的相互作用[24]会引发酶类和挥发性物质的产量提升,非酿酒酵母L.thermotoleransFBA-2除了产生一定量的乳酸降低酒液pH值,也能给啤酒带来更多的复杂香气,如表3所示,相比于单一菌株发酵,双酵母混合发酵酸啤酒体系其风味物质产量都有所提高,产生了更多乙酸异丁酯和乙酸异戊酯等酯类物质,增强了酸啤酒的水果香气,感官品评结果也表明,利用双酵母混合发酵体系酿造的酸啤酒融合了2种酵母的特性,酒体果香馥郁,对啤酒的质量产生积极影响(图5)。

表3 双酵母混合发酸啤酒常规风味物质及有机酸产量

图5 单一菌株及双酵母混菌发酵啤酒感官品评结果
3 结论
将非酿酒酵母L.thermotoleransFBA-2作为混菌发酵的风格菌株,基于其对常规啤酒发酵用麦芽汁的利用情况,优化原料配方,并选择一株常规发酵酿酒酵母S.cerevisiae68obg作为基础发酵菌株,以便保证啤酒的基调,构建了啤酒双酵母混合发酵体系,并确定了最优接种比例L.thermotoleransFBA-2∶S.cerevisiae68obg为10∶1,用混菌发酵生产的酸啤酒中含有1.5~1.8 g/L乳酸,pH值为3.3~3.4,酒精度约为5%vol,风味丰富度高、爽口协调、果香馥郁,不过分强调酸味。实验室条件和100 L发酵罐放大实验结果表明,利用双酵母发酵体系发酵酸啤酒不仅能够融合2种酵母的特性,还可以对啤酒的质量产生积极影响,酒体果香馥郁,并且这一工艺消除了现有酸啤酒的工艺弊端,简化了酿造操作环节,缩短了发酵时间,可实现更快速的发酵和高水平的过程控制,能够促进酸啤酒的大规模生产应用。
