胃癌组织DRP1、TFF1蛋白表达及其与临床病理特征和生存的关系
2023-03-05曾劼
曾劼
受饮食习惯等因素影响,消化道肿瘤位居我国癌症发病率首位,其中胃癌为其中发病率最高的消化系统肿瘤[1]。目前对胃癌预后的评估多依赖肿瘤的生物学特性,但有研究提出,在胃黏膜病理学改变过程中有多重生物因子的参与,胃癌的发展过程并非由胃癌分化程度等临床特征单独决定,还由各种细胞因子所提供的肿瘤微环境共同参与[2-3]。动力相关蛋白1(DRP1)为线粒体相关蛋白,而线粒体与细胞增殖、分化、凋亡过程密切相关,故DRP1 或可为肿瘤发生与发生过程中的重要因素[4-5]。三叶因子1(TFF1)则为胃黏膜保护因子,还可参与胃黏膜损伤后修复进程,既往研究发现,其在乳腺癌等恶性肿瘤中高表达提示患者预后不佳,但其在消化道肿瘤中表达意义还尚待讨论[6-7]。故本研究通过分析动DRP1、TFF1 在胃癌组织中的表达,评估其余患者临床特征与生存情况的相关性,旨在探讨DRP1、TFF1 在胃癌发生与发展过程中的作用机制,为临床评估胃癌患者预后提供参考,现将结果报道如下。
1 资料与方法
1.1 一般资料 回顾分析2019 年1 月-2021 年6 月赣州市赣县区人民医院收治的80 例胃癌患者的临床资料。纳入标准:(1)参照文献[8]经活检、胃镜等确诊为胃癌;(2)于本院接受胃癌组织DRP1、TFF1 蛋白表达相关检查;(3)临床资料完整。排除标准:(1)复发性胃癌;(2)转移性胃癌;(3)合并自身免疫性疾病。本研究经赣州市赣县区人民医院医学伦理委员会批准。
1.2 方法
1.2.1 检测方法 于消化内镜下或手术过程中取约2 cm 病变处组织标本,采用甲醛液进行单纯固定,固定时间应在24 h 以上,24 h 后取出固定完成的病理组织,用无菌手术刀修剪病理组织并进行脱水包埋处理,包埋完成后将标本置于-20 ℃进行冷藏凝固,石蜡凝固后将标本取出再次修剪并切成4 μm薄片,进行免疫组化染色,磷酸缓冲盐溶液稀释后孵育,再次使用磷酸缓冲盐溶液冲洗后,显色剂进行染色,使用流动清水冲洗后进行复染并封片,于显微镜下观察DRP1、TFF1 蛋白表达水平。
1.2.2 分组方法 分组依据为DRP1、TFF1 蛋白表达水平,按照DRP1 蛋白检测结果将检测结果为DRP1 高表达和低表达,分别纳入DRP1 高表达组和DRP1 低表达组。按照TFF1 蛋白检测结果将TFF1 高表达和低表达,分别纳入TFF1 高表达组和低表达组。
1.2.3 评估标准 DRP1、TFF1 病理切片均有两位工作经验在10 年以上的病理医师进行双盲阅片,应于显微镜下观察5 个高倍视野后根据染色细胞比例评估,依据染色细胞比例将比例为<5%、5%~25%、26%~50%、51%~75%、76%~100%的分别记为0~4 分。再分别将无染色-棕褐色记为0~3 分,两分值乘积在0~3 分的纳入低表达组,≥4 分则纳入高表达组[9]。
1.3 观察指标 对比DRP1 高表达组和DRP1 低表达组、TFF1 高表达组和TFF1 低表达组恶性程度、肿瘤分期、淋巴转移、浸润深度、生存时间及随访12 个月的生存情况差异。
1.4 统计学处理 采用SPSS 20.0 分析处理数据,计数资料用率(%)表示,组间比较采用χ2检验,计量资料以(±s)表示,组间比较采用t检验,P<0.05 提示差异有统计学意义。采用Pearson 相关性分析两蛋白表达水平与患者临床特征的相关性,绘制生存曲线,采用logistic 相关性分析两蛋白表达水平与患者生存时间相关性。
2 结果
2.1 患者一般资料 80 例患者中男47 例,女33 例;年龄42~73 岁,平均(56.95±12.18)岁。DRP1 高表达组和DRP1 低表达组,各包括42 例和38 例患者,DRP1 高表达组和DRP1 低表达组,各包括42 例和38 例患者。
2.2 不同DRP1 蛋白表达水平临床特征对比 DRP1高表达组未/低分化、晚期、有淋巴转移、浸润深度已达深肌层比例均明显高于DRP1 低表达组(P<0.05),见表1。

表1 不同DRP1蛋白表达患者临床特征比较[例(%)]

表1 (续)
2.3 不同TFF1 蛋白表达水平患者临床特征比较 TFF1 高表达组未/低分化、晚期、有淋巴转移、浸润深度已达深肌层比例明显低于TFF1 低表达组(P<0.05),见表2。

表2 不同TFF1蛋白表达患者临床特征对比[例(%)]

表2 (续)
2.4 不同DRP1 蛋白表达水平生存情况对比 随访12 个月后,DRP1 高表达组生存率78.57%(33/42),明显低于DRP1 低表达组的97.37%(37/38),差异有统计学意义(χ2=6.445,P=0.011),见图1。
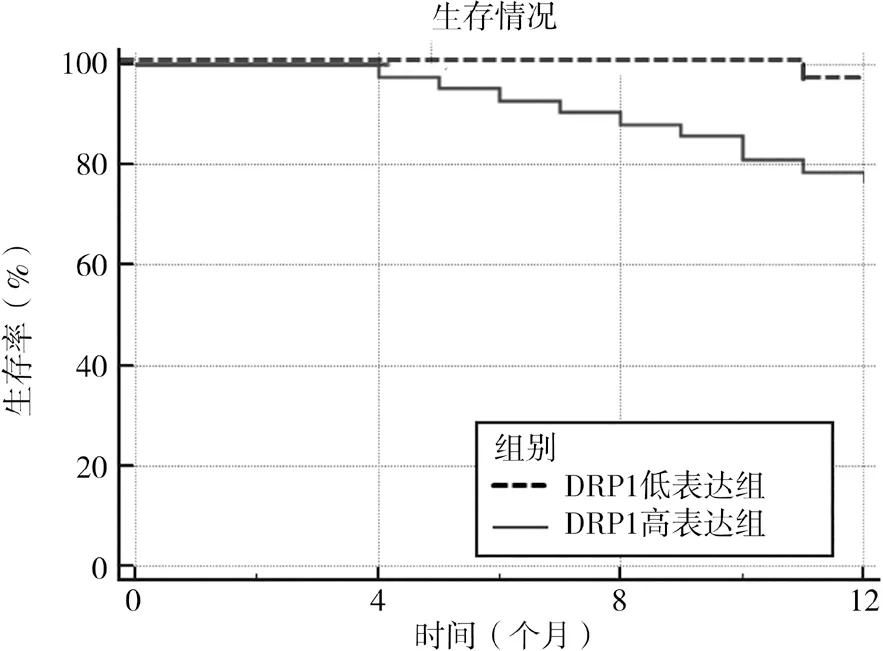
图1 不同DRP1蛋白表达水平生存曲线分析
2.5 不同TFF1 蛋白表达水平生存情况比较 随访12 个月后,TFF1 高表达组生存率93.88%(46/49),明显高于TFF1 低表达组的77.42%(24/31),差异有统计学意义(χ2=4.702,P=0.030),见图2。2.6 不同DRP1 蛋白表达水平与胃癌患者临床特征及生存情况相关性分析 经Pearson 相关性分析可得,DRP1 蛋白表达水平与胃癌患者临床特征、生存显著相关(P<0.05),见表3。
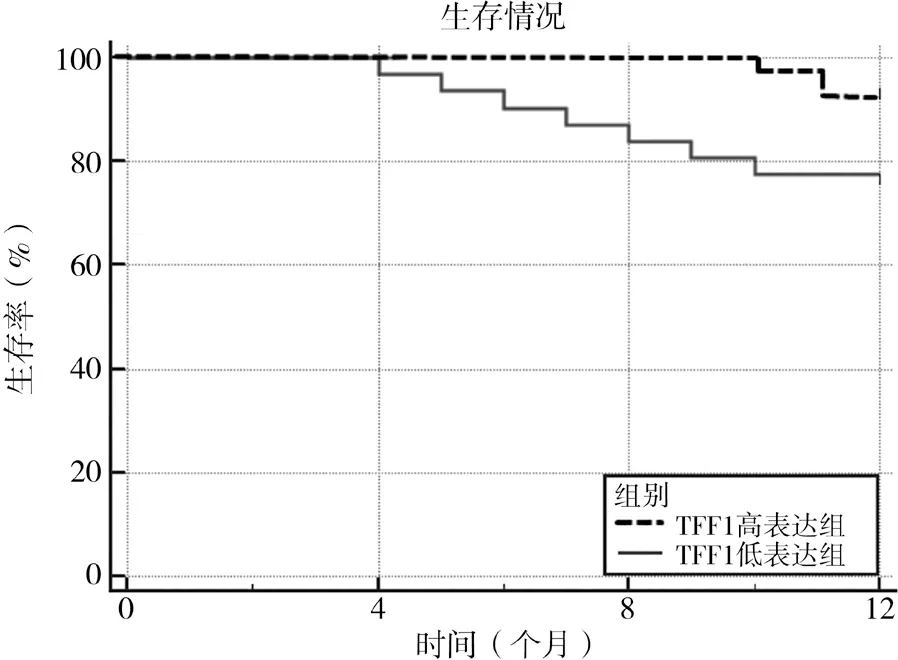
图2 不同TFF1蛋白表达水平生存曲线分析
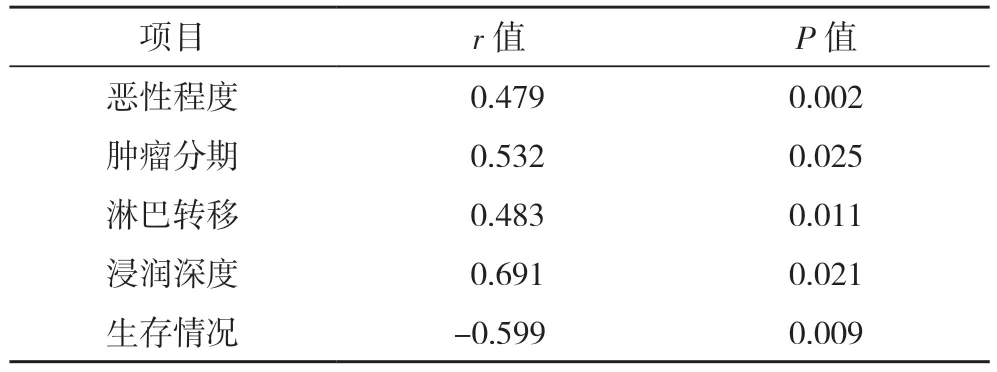
表3 DRP1蛋白与患者临床特征、生存相关性分析
2.7 不同TFF1 表达水平生存情况比较 经Pearson相关性分析可得,TFF1 蛋白表达水平与胃癌患者临床特征、生存显著相关(P<0.05),见表4。

表4 TFF1蛋白与患者临床特征、生存相关性分析
3 讨论
既往研究发现胃黏膜的恶变过程为:胃炎-黏膜上皮化生-异型增生-胃癌,而该种发展过程与蛋白的表达密切相关,故胃癌组织中蛋白表达与临床特征、患者生存预后的相关性为临床研究热点[10-11]。
DRP1 蛋白为线粒体分裂过程中的重要组成成分之一,可通过介导超螺旋结构的形成促进线粒体膜断裂从而促进新生线粒体的形成[12-14]。本研究结果显示,DRP1 蛋白高表达患者临床特征严重程度较低表达患者更高,这表明胃癌组织中DRP1 蛋白表达旺盛可提示患者肿瘤恶性程度较高,进展、侵袭程度更加严重,患者预后不佳,与既往研究结果类似[15-16]。分析其原因为,线粒体功能失常为诱发恶性肿瘤,促进其增殖发展的重要因素。线粒体的融合分裂为调控肿瘤细胞的增殖、分化及凋亡。DRP1 蛋白过度表达可促进线粒体融合分裂,既往研究表明,其可促进肿瘤细胞有丝分裂进程从而诱导肿瘤细胞增殖[17]。且既往研究显示,DRP1 蛋白高表达水平可促进肿瘤细胞的迁徙和转移,抑制其表达可促进肿瘤细胞凋亡,抑制肿瘤细胞迁移侵袭其余系统,有利于改善患者预后,但相关临床机制还尚待进一步研究论证[18]。
TFF 家族主要分泌于胃、十二指肠等消化系统,可起到保护消化道黏膜,促进黏膜损伤修复的作用,TFF1 蛋白为以胃黏膜上皮为主要表达场所的TFF家族蛋白之一[19-20]。本研究结果显示,胃癌组织中显示TFF1 蛋白低表达的患者临床特征恶性程度更高,这表明TFF1 蛋白表达水平下降可提示胃癌分化程度低下,进展、侵袭程度更加严重,患者生存时间更短,与既往研究结果一致[21]。分析其原因为,TFF1 蛋白在其余器官中呈低表达状态,既往研究显示,其在乳腺组织的高表达可提示乳腺肿瘤的发生与发展[22]。但有别于其余组织器官,TFF1 蛋白有胃黏膜保护作用,TFF1 蛋白缺乏不仅可诱导胃癌相关基因的突变,还可促进胃黏膜恶变,诱导人胃腺癌细胞生长,促进胃恶性肿瘤增殖分化[23]。既往研究显示,随着胃黏膜恶变程度提高其表达水平逐步下降[24]。
但本研究结果还存在以下3 点不足:(1)研究样本量偏少;(2)随访时间较短,统计数据显示,随不同时期及恶性程度的胃癌生存时间相差较大,但我国胃癌患者的总体五年生存率可达34%[25],但本研究结果仅随访1 年;(3)线粒体动力蛋白及TFF 家族的种类多样,但本研究仅选择其中两类研究,未来应扩大样本量,延长随访时间并纳入多样线粒体动力蛋白及TFF 家族蛋白进行下一步研究。
综上所述,DRP1、TFF1 蛋白表达水平均可影响胃癌患者临床特征,提示其预后,临床应针对此,给予下调DRP1 蛋白表达,上调TFF1 蛋白表达水平的相关治疗措施。
