华蟾素胶囊联合FOLFOXIRI方案对晚期直肠癌患者免疫功能和肿瘤标志物水平的影响*
2023-03-05程功名韩建波单留群刘旭呈石文杰丁永斌
程功名 韩建波 单留群 刘旭呈 石文杰 丁永斌
晚期直肠癌患者常伴有肿瘤细胞远处转移或侵犯周围器官组织,一般手术治疗无法进行根治性切除,可采取化疗[1]。FOLFOXIRI [伊立替康+奥沙利铂+亚叶酸钙+5-氟尿嘧啶(5-FU)]是临床上较为常用的晚期直肠癌化疗方案,各药物联合应用可产生协同的细胞毒作用和抗肿瘤活性,具有一定的临床疗效。但晚期直肠癌患者的代谢功能明显降低、免疫机制严重紊乱,而上述细胞毒性药物具有无差别性,对机体免疫功能并无明显改善作用[2]。血管新生与肿瘤细胞的生长、繁殖、转移等过程密切相关。华蟾素胶囊可通过抑制肿瘤血管生成、诱导肿瘤细胞凋亡、增强机体免疫功能等产生抗肿瘤作用[3],可能更适用于晚期直肠癌患者。基于此,南京中医药大学附属南京医院进行相关研究,结果如下。
1 资料与方法
1.1 一般资料 选择南京中医药大学附属南京医院2020 年1 月-2022 年1 月收治的62 例晚期直肠癌患者。纳入标准:(1)符合直肠癌诊断标准[4];(2)预计生存期>3 个月;(3)TNM 分期为ⅢB、Ⅳ期;(4)可耐受化疗。排除标准:(1)对本研究所用药物过敏;(2)近3 个月接受过生物治疗、放疗等其他抗肿瘤治疗;(3)合并其他部位肿瘤;(4)合并神经系统、心血管系统、呼吸系统等重大疾病。按照随机数字表法分为联合组和化疗组,各31 例。本院医学伦理委员会已批准本研究。试验获得患者及家属同意并签署知情同意书。
1.2 方法(1)化疗组予以FOLFOXIRI 方案治疗。治疗第1 天:①予以180 mg/m2伊立替康(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20061276,规格:5 mL∶100 mg)+0.9% 氯化钠250 mL 静脉滴注,维持90 min;②予以85 mg/m2奥沙利铂(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20000337,规格:50 mg)+5%葡萄糖注射液500 mL 静脉滴注,维持2 h;③予以200 mg/m2亚叶酸钙(生产厂家:广东岭南制药有限公司,批准文号:国药准字H20057260,规格:50 mg)+0.9% 氯化钠溶液250 mL 静脉滴注;④予以400 mg/m25-FU(生产厂家:天津金耀药业有限公司,批准文号:国药准字H12020959,规格:10 mL∶0.25 g)+0.9%氯化钠溶液250 mL 静脉滴注,维持2 h。治疗第2 天:予以相同剂量的亚叶酸钙及5-FU 静脉滴注。以21 d 为1 个治疗周期,共治疗6 个周期。(2)联合组在化疗组基础上予以华蟾素胶囊(生产厂家:陕西东泰制药有限公司,批准文号:国药准字Z20050846,规格:0.25 g)口服,0.5 g/次,3 次/d,于每个治疗周期的第1~14 天持续服用,治疗6 个周期。
1.3 观察指标及判定标准 治疗前及治疗后(治疗6 个周期后)观察两组免疫功能、肿瘤标志物及血管生成因子水平。(1)免疫功能:治疗前后抽取患者肘部静脉血5 mL,采用流式细胞仪(赛默飞世尔科技,型号Attune NxT)检测两组NK 细胞、CD4+细胞、CD8+细胞水平,并计算CD4+/CD8+。(2)肿瘤标志物:治疗前后抽取患者肘部静脉血5 mL,采用电化学发光法检测两组糖类抗原19-9(CA19-9)、糖类抗原125(CA125)、癌胚抗原(CEA)水平。(3)血管生成因子:治疗前后抽取患者肘部静脉血5 mL,检测两组转化生长因子-β(TGF-β)、血管内皮生长因子(VEGF)及缺氧诱导因子-1α(HIF-1α)水平,检测方法为放射免疫法。
1.4 统计学处理 数据录入SPSS 22.0 软件中分析,计数资料用率(%)表示,采用χ2检验;计量资料用(±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;等级资料采用秩和检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组基线资料对比 两组性别、年龄、TNM分期、肿瘤分化程度比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
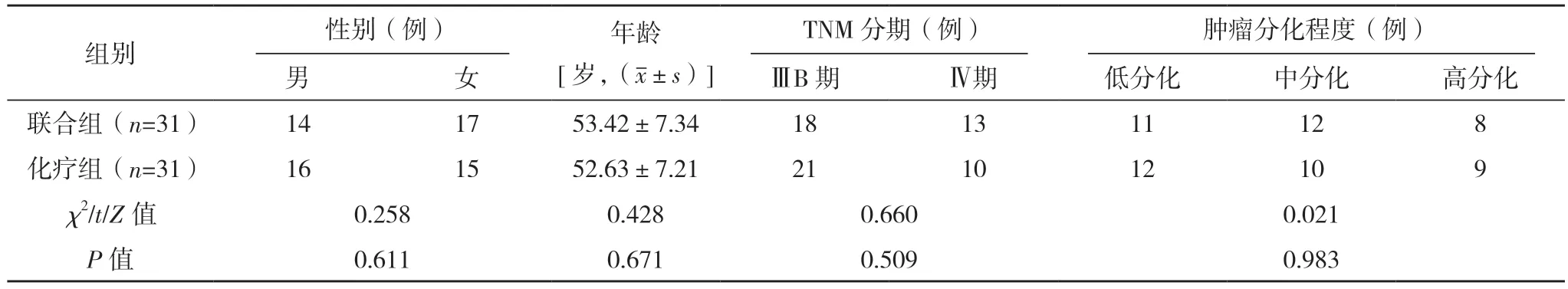
表1 两组基线资料对比
2.2 两组免疫功能对比 治疗前,两组免疫功能各指标比较,差异均无统计学意义(P>0.05);治疗后,联合组NK 细胞、CD4+、CD4+/CD8+水平均高于治疗前,且联合组均高于化疗组,联合组CD8+水平低于治疗前,且联合组低于化疗组(P<0.05)。见表2。
表2 两组免疫功能对比(±s)
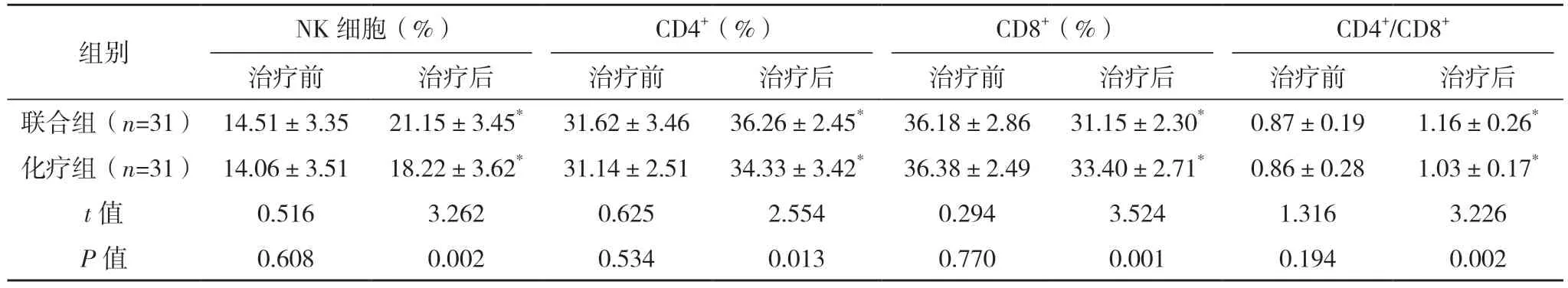
表2 两组免疫功能对比(±s)
*与治疗前比较,P<0.05。
2.3 两组肿瘤标志物对比 治疗前,两组各肿瘤标志物比较,差异均无统计学意义(P>0.05);治疗后,联合组CA19-9、CA125、CEA 水平均低于治疗前,且联合组均低于化疗组(P<0.05)。见表3。
表3 两组肿瘤标志物对比(±s)

表3 两组肿瘤标志物对比(±s)
*与治疗前比较,P<0.05。
2.4 两组血管生成因子对比 治疗前,两组各血管生成因子比较,差异均无统计学意义(P>0.05);治疗后,联合组TGF-β1、VEGF、HIF-1α 水平均低于治疗前,且联合组均低于化疗组(P<0.05)。见表4。
表4 两组血管生成因子对比(±s)
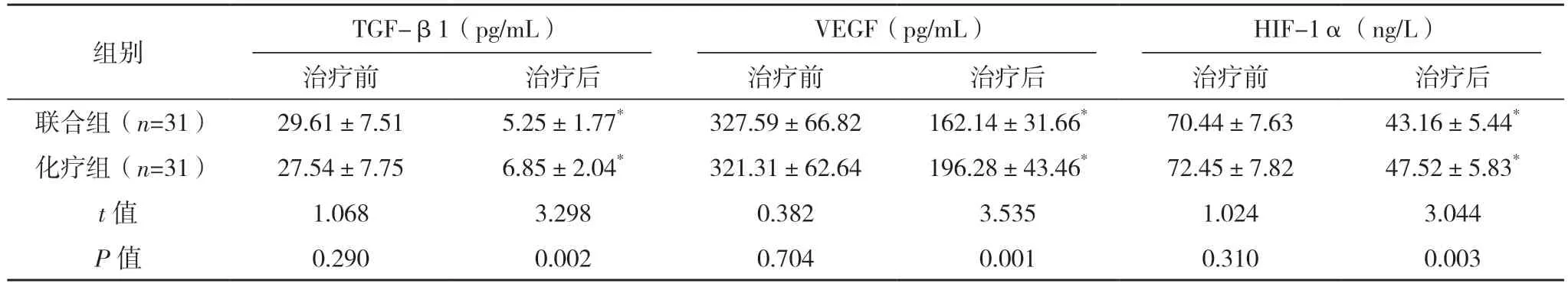
表4 两组血管生成因子对比(±s)
*与治疗前比较,P<0.05。
3 讨论
晚期直肠癌患者主要表现为腹痛、里急后重、便血、肛门疼痛、大便失禁、排便习惯改变等症状,严重影响患者日常生活[5]。晚期直肠癌常用的治疗方案为化疗,本研究中选用了FOLFOXIRI 方案,奥沙利铂、伊立替康、5-FU 等药物均可通过抑制肿瘤细胞内DNA 的合成、复制而产生抗肿瘤作用。但由于晚期直肠癌患者肿瘤细胞扩散范围较大,病情严重,单一途径的抗肿瘤药物已无法满足患者需要[6]。中医药物治疗具有多途径、多靶点、副作用小的优势。中医认为直肠癌属“癥瘕”“肠蕈”范畴,病机为机体脾胃受损或外感湿热致水汽运化失调,水湿内生,郁结于肠,阻滞气机,久而化毒,结积成块,发为本病,故治疗以清热解毒、散结消瘀为主[7]。华蟾素胶囊是一种以干蟾皮为主的中成药,具有解毒、止痛、消肿的作用。吴宏磊等[8]研究指出,该药物可通过干扰细胞周期、诱导细胞凋亡、抑制肿瘤细胞增殖、诱导自噬、破坏肿瘤微环境、减少肿瘤侵袭与转移、提高机体免疫功能、抑制肿瘤血管生成等多途径、多靶点、多环节发挥抗肿瘤作用,辅助用于晚期直肠癌患者可能效果更好。
CA19-9、CA125、CEA 均为临床常用的肿瘤标志物,在恶性肿瘤患者体内呈高表达水平,可用于直肠癌的诊断[9]。在本研究中,治疗后联合组CA19-9、CA125、CEA 水平均低于化疗组(P<0.05),说明华蟾素胶囊有助于降低晚期直肠癌患者肿瘤标志物水平,提高临床疗效。可能的原因是奥沙利铂属铂类衍生物,为细胞毒性抗肿瘤药物,可通过产生烷化结合物作用于DNA,形成链内和链间交联,抑制DNA 的合成、复制,从而达到抗肿瘤作用;伊立替康是喜树碱的衍生物,可通过特异性地作用于拓扑异构酶Ⅰ,阻止断开的DNA 单链再连接,从而阻止肿瘤细胞的分裂、繁殖;5-FU 可通过干扰胸腺嘧啶核苷酸合成酶合成过程而抑制DNA 合成,也可转化为氟尿嘧啶核苷酸,掺入进RNA 链条中,干扰蛋白质合成,进而产生杀灭肿瘤细胞的作用;亚叶酸钙可增强5-FU 的临床疗效[10-12]。华蟾素胶囊可通过干预肿瘤细胞内核酸代谢,阻断DNA 和RNA 合成过程,进而影响细胞有丝分裂,直接灭杀肿瘤细胞[13-14];也可通过干扰拓扑异构酶Ⅱ、Na+/K+ATP 酶、PKC 同工酶等活性,影响细胞分裂的各信号通路,加速肿瘤细胞凋亡[15-16];还可通过抑制肿瘤血管生成、增强机体免疫功能等方面产生抗肿瘤作用。
在本研究中,治疗后联合组NK 细胞、CD4+、CD4+/CD8+水平高于化疗组,CD8+水平均低于化疗组(P<0.05),说明华蟾素胶囊有助于增强晚期直肠癌患者机体免疫功能。可能的原因是华蟾素胶囊具有免疫调节的作用,可通过上调CD4+水平及诱导淋巴细胞分泌产生白细胞介素-2,从而提高机体细胞、体液免疫功能;也可通过增强机体NK 细胞、巨噬细胞等活性而增强免疫功能。沙晓锋等[17]通过对晚期直肠癌患者进行分组用药6周后发现,联用华蟾素组患者的免疫功能有明显增强,进一步说明华蟾素对机体免疫功能的积极影响。
肿瘤细胞的生长、繁殖过程中,血管生成具有重要作用。TGF-β1、VEGF 具有调节血管内皮细胞生长和分化的作用,可促进肿瘤细胞血管生成;HIF-1α 可在缺氧状态下促进细胞分化和血管新生[18-19]。在本研究中,治疗后联合组TGF-β1、VEGF、HIF-1α 水平均低于化疗组(P<0.05),说明华蟾素胶囊有助于抑制晚期直肠癌患者肿瘤血管生成。可能的原因是肿瘤细胞为满足自身生长、繁殖的需求,通常会以自身为中心,向四周扩散肿瘤血管汲取营养,故可从抑制血管生成的角度进行抗肿瘤治疗。华蟾素胶囊可诱导细胞凋亡,抑制细胞增殖,并可通过下调VEGF、TGF-β1 等表达,破坏肿瘤血管内皮细胞结构,阻止细胞分化、增殖,从而加快肿瘤细胞凋亡过程[20]。
综上所述,华蟾素胶囊联合FOLFOXIRI 方案治疗晚期直肠癌患者有助于抑制肿瘤血管生成,降低肿瘤标志物水平,增强机体免疫功能。
