基于真实情境发展学生化学观念与科学态度的单元复习*
——以“质量守恒定律”复习课的教学为例
2023-03-04任宁生张彩玲王凌静
任宁生 张彩玲 王凌静
(1.南京师范大学附属中学仙林学校初中部 江苏南京 210034;2.南京市栖霞区教师发展中心 江苏南京 210000)
一、教学背景
《义务教育化学课程标准(2022 年版)》中明确初中阶段化学学科的核心素养包括化学观念、科学思维、科学探究与实践、科学态度与责任,为培养学生的核心素养,需创设真实问题情境,引导学生经历真实的探究过程[1]。本节课尝试选取人民教育出版社化学九年级上册教材第五单元“质量守恒定律”为载体,创设真实情境,串联相关知识点,进行单元复习整合设计。本节复习课的主要内容包括:(1)质量守恒定律的含义及微观本质;(2)化学方程式的书写规范;(3)质量守恒定律的简单运用。
已有的教学设计主要是围绕“质量守恒定律”课题的新授课,对于“质量守恒定律”的单元复习课教学设计较少。研究内容主要围绕“质量守恒定律”相关的化学史教学[2]展开,或是针对教材实验的创新改进[3]。
质量守恒定律是学生从定性到定量认识化学变化的重要基础,在解决实际问题中扮演着非常重要的角色。通过质量守恒定律的复习课,学生能理解化学变化有新物质生成,其本质是原子的重新组合,并遵循一定的规律,在一定条件下通过化学反应可以实现物质转化。能基于真实的问题情境,多角度分析和解决生产生活中有关化学变化的简单问题。
本文选取搭载神舟十三号载人飞船的长征二号运载火箭发射成功为情境,探讨推进剂成分、空间站氧气来源等,在该情境中,学生运用质量守恒定律解决问题的同时,体验我国载人航天事业的发展与科技的日新月异,发展化学观念与科学态度。
二、教学设计
1.教学目标
(1)通过火箭两种液体推进剂相关的化学方程式的书写及简单计算,复习质量守恒定律的含义及微观本质。
(2)通过空间站中氧气来源的探究,回顾常见的制取氧气的化学方程式,能规范书写根据化学方程式的简单计算,并运用化学反应中的变化观念解决实际问题。
(3)通过对空间站中二氧化碳转化为氧气的信息介绍及登月工程重要氧气来源的畅想,体会通过化学反应实现物质转化的重要意义,初步树立运用科学为我国发展作出贡献的责任担当。
2.教学流程

图1 质量守恒定律教学流程图
3.教学实录
【环节一】质量守恒定律的含义
[教师]观看视频,神舟十三号载人飞船升空视频。
2021 年10 月16 日0 点23 分,搭载神舟十三号载人飞船的长征二号运载火箭在酒泉卫星发射中心成功发射,这是我国载人航天史上的一次突破,也是我们作为国人的又一次骄傲,今天就让我们走进航天器,从质量守恒定律的角度认识航天器的那些事。
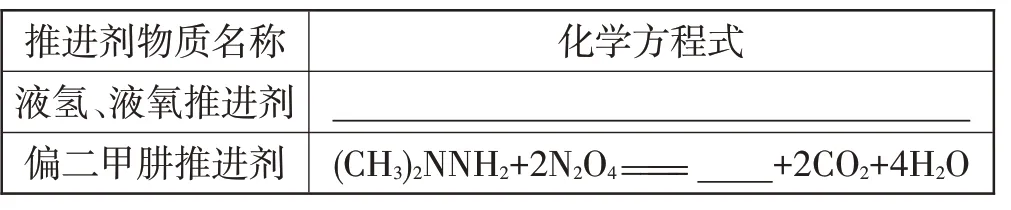
首先,燃料对于航天器而言是必不可少的,那么推进火箭升空的推进剂的主要成分有哪些?请同学们看一段来自国家航天局官方网站上的介绍,从中能给我们提供哪些信息?
【资料卡片】现代火箭向上加速是靠火箭发动机来完成的。火箭发动机点火以后,推进剂(液体燃料和氧化剂)在发动机燃烧室里燃烧,产生大量高压气体,高压气体从发动机喷管高速喷出,对火箭产生反作用力,使火箭沿气体喷射的反方向前进[4]。
[教师]通过这段文字可以发现,实际上火箭升空是利用燃料燃烧放热,在短时间内产生大量的气体喷出,使得火箭升空。其中最主要的推进剂,也就是液体燃料和氧化剂,目前被广泛运用的主要有两种,一种是液氢液氧推进剂,另一种是四氧化二氮和偏二甲肼推进剂。
[问题1]请根据所学知识和已给信息,写出对应反应的化学方程式。
[学生]根据已知信息完成化学方程式书写。
[问题2]请问,书写化学方程式的依据是什么?
[学生]化学反应前后,原子的种类和个数不变。
[教师总结]化学反应过程,就是参加反应的各物质的原子重新组合而生成其他物质的过程,所以在化学反应前后,原子的种类和个数不变,原子的质量也不发生改变。
[问题3]刚才我们从资料中看到,火箭升空是由于短时间内会产生大量气体喷出。下面我们通过计算感知一下,我们以液氢液氧推进剂为例,请同学们计算,卫星要送上预定轨道,至少需要1 800 kg推进剂,这些推进剂恰好完全反应后能生成水蒸气的质量是多少?
[学生]1 800 kg。
[问题4]为什么水蒸气的质量为1 800 kg?
[学生]因为在化学反应前后,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,反应前参加反应物质总质量为1 800 kg,所以反应后生成水蒸气质量为1 800 kg。
设计意图:通过神舟十三号载人飞船升空情境引入课堂,体验化学知识与人类社会发展密切相关,在探究实际问题的过程中,复习质量守恒定律的宏观含义和微观解释,从宏微结合的角度尝试构建化学变化过程中“变”与“不变”思想。
【环节二】根据化学方程式的简单计算
[教师引入]火箭升空后,神舟十三号载人飞船于当天与空间站进行对接,我国的三名宇航员,翟志刚、王亚平、叶光富,他们需要在空间站上工作六个月时间。这么长的时间,他们赖以生存的氧气从何而来?让我们接下来对空间站的氧气进行探秘。
[问题1]写出我们已经学过的能够生成氧气的化学方程式。
[学生]
[问题2]为什么这些物质反应后能生成氧气?
[学生]因为反应物中都有氧元素,依据化学反应前后元素的种类不变,所以生成氧气。
[问题3]我们学到的上述反应,能否都能用于空间站制氧气?
[学生]不可以,其中,氧化汞分解后生成的汞有毒,所以氧化汞不适合用于空间站制氧气。
[问题4]那剩下的四个化学反应哪一个更适合空间站制取氧气?在空间站中,对制取氧气有一定的要求,需要用尽可能少的原料产生尽可能多的氧气,请同学们分组,根据已给的相对原子质量进行计算。上述四种物质各18 g,制取氧气的质量分别是多少?请在学案上写出完整的计算过程。
请每组同学给我们分享一下计算结果。
[学生1]18 g高锰酸钾制得氧气质量为1.8 g。
[学生2]18 g过氧化氢制得氧气质量为8.4 g。
[学生3]18 g氯酸钾制得氧气质量为7.1 g。
[学生4]18 g水制得氧气质量为16 g。
[教师]结果都已算出,下面呈现几份刚才同学们的计算过程,请你评价编号为1、2、3、4号同学的计算过程(如图2所示)。

图2 学生计算过程示例
[学生1]1号计算过程不准确,所有的未知数x后不可以带单位,因为未知数x本身即为质量,不需要再额外加单位。高锰酸钾制氧气的反应条件为加热,且生成物中有二氧化锰,不需要额外添加二氧化锰做催化剂;
[学生2]2 号计算过程不准确,x=8.5 后需要加上单位,应为x=8.5 g;
[学生3]3号计算过程不准确,比例式为相对分子质量与化学计量数的乘积的比值,即物质的量比等于对应参加反应的物质的质量比,同时,比例式中氯酸钾的质量为18 g,需要加上单位。
[学生4]4号计算过程准确。
[教师总结]在根据化学方程式的计算中,需理解计算过程中每一步的意义,明晰在化学变化中的守恒关系,才能准确作答。
设计意图:在进一步探究空间站氧气来源的问题中,一方面复习根据化学方程式的简单计算的规范作答,另一方面认识解决实际问题的多角度,形成运用以化学知识为核心的科学方法,具体分析空间站中氧气来源的最优选择。
【环节三】质量守恒定律的运用
[问题1]根据刚才的分组计算,可以发现,等量的过氧化氢和水产生氧气的质量比等量的高锰酸钾和氯酸钾产生的氧气多,请问,过氧化氢和水中,哪个氧元素的质量分数更大?
[学生]过氧化氢。
[问题2]可是依据计算结果,过氧化氢产生氧气的质量却没有等量水产生的氧气多,这是为什么?
[学生]过氧化氢制氧气中,不是所有的氧元素都转移到氧气中,产生氧气的质量小于过氧化氢中氧元素质量,但是水电解过程中,水中氧元素全部转移到氧气中,所以水中氧元素的质量等于产生氧气质量。
[问题3]你的依据是什么?
[学生]化学反应前后,元素的质量不变。
[问题4]实际上,空间站中水确实是氧气的来源之一。请计算,一般来说,每名航天员每天大概需要消耗550 L(约合786 g)的氧气,若所需的氧气全部由水在一定条件下生成,需要水的质量为多少?
[学生1]可以依据化学方程式进行计算,求得水的质量约为884.3 g。
[学生2]可以依据化学反应前后元素质量不变,氧气中氧元素质量全部来源于水中氧元素,依据水中氧元素质量求得水的质量约为884.3 g。
[教师总结]我们对知识的学习重在运用知识解决问题,学会从不同角度思考问题,认识化学变化中物质质量变化的关系以及转变过程中的元素守恒,进而运用不同方法解决问题,这样才真正理解了质量守恒定律。
通过计算,我们发现,如果空间站中的氧气全部来自水,每天每名宇航员需要884.3 g 的水,我们的宇航员需要在空间站工作半年时间,可想而知,如果单靠水产生氧气,对水的需求量是非常大的。空间站还有哪些提供氧气的方法呢?请同学们看一段视频介绍。
根据视频,空间站中氧气有两个来源,其一为地面携带的氧气,其二为空间站中资源再生,这部分氧气一部分来源于水,另一部分来源于二氧化碳。空间站中的二氧化碳再利用需要首先用氢氧化钾溶液将二氧化碳吸收,下面我们在课堂中给各位体验这个过程。
[演示实验]首先将二氧化碳传感器、数据采集器与电脑相连,其次,向提前收集满二氧化碳的装置内倾倒氢氧化钾溶液,迅速将二氧化碳传感器插入装置内,微微振荡,采集数据(实验装置如图3所示)。

图3 探究氢氧化钾吸收二氧化碳实验装置图
[教师]请描述实验现象(如图4所示)。
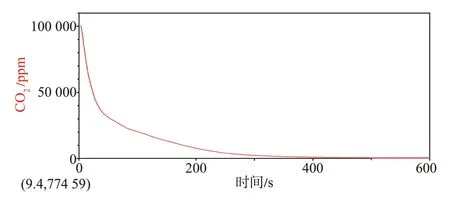
图4 二氧化碳传感器数据采集记录
[学生]装置内二氧化碳含量减少,最后几乎被吸收完全。
设计意图:通过质量守恒定律的定量计算综合运用复习内容,同时,理解水不能作为空间站中氧气供给的唯一来源的原因。进而通过视频引出空间站中吸收二氧化碳转变为氧气的尝试,学生通过数字化实验将吸收二氧化碳的过程可视化,也为接下来的深入学习做铺垫。
[教师]通过数据记录,我们发现,装置内二氧化碳含量迅速减少,说明氢氧化钾溶液确实可以吸收二氧化碳,我们从定量角度继续探究,含氢氧化钾11.2 g的氢氧化钾溶液能够吸收4.4 g 二氧化碳,生成1.8 g水和另一种物质,根据以上信息,请判断该物质的元素组成。请小组讨论,分析解决问题的思路。
请同学们汇报思路。
[学生]依据化学反应前后,元素种类不变,判断物质中一定含有钾元素和碳元素,再依据化学反应前后元素质量不变,计算反应前氧元素的总质量,反应后水中氧元素的质量,进行对比,发现反应前氧元素总质量大于水中氧元素的质量,则未知物质中除了钾元素和碳元素外,还含有氧元素。
设计意图:通过化学变化中未知物质的定量探究,综合运用复习的质量守恒定律内容解决问题。在解决问题的过程中,理解化学变化中的守恒观,学生通过科学语言的表述,建构解决该类问题的思维模型。
[教师介绍]二氧化碳与氧气的转化是目前科学家们研究的热门问题之一,这与我们国家最近提出的碳达峰和碳中和的想法是不谋而合的。杨培东教授也将焦点聚集在人工光合作用上,目前已经实现捕获空气中二氧化碳,并转化为氧气的过程。所以,二氧化碳转化为氧气并不是一种空想,在符合质量守恒定律的基础上,科学家已经实现了这种转化(如图5所示)。

图5 二氧化碳转化为氧气装置图
[教师引导]在了解完空间站的氧气来源的秘密之后,让我们再把目光放到登月工程上,我国计划在2030年前后实现航天员登月,2020年11月24日我国的嫦娥5 号月球探测器成功发射,携带月球土壤样品回到地球,请你从对月球样品的分析资料中思考:你觉得登月后航天员呼吸的氧气有哪些来源,你的依据是什么?
[学生]在化学反应的前后,元素种类不变,所以月球土壤中存在氧化物,就可以从氧化物中通过一定条件提取出氧气。
[教师]这也正是科学家的研究重点,目前,科学家已经开始研制制氧机,从月球土壤中制取氧气,并取得一定进展。
所以,通过对质量守恒定律的理解,我们用更科学的视角和更富创造性的思维去看到生活中亦或是科技前沿的信息。
设计意图:通过对二氧化碳转化为氧气的前沿实验以及登月工程中氧气来源的畅想,体验化学对促进科学技术发展的“社会责任”,强化学生学习化学的信念与动机。
三、教学反思
本节课以热点问题为情境,从火箭推进器的探究到空间站中氧气供给的探究,以此贯穿整节课。学生在复习质量守恒定律的相关知识同时,深化对化学学科变化观念的理解,认识化学变化的本质是守恒的,定量的。同时,认识化学对促进科技发展的重要意义,增强学生的民族自信心,树立学习化学的志向。通过本节课的教学,笔者发现,真实情境的有效选取和运用能够有效提升学生化学核心素养。
首先,真实情境中的问题解决过程可以引导学生形成以化学知识为核心的科学方法。在课堂中以神舟十三号载人飞船升空的真实事例为情境,选取与本节课复习内容相关的两个问题,学生在探究和解决问题的过程中,须综合运用知识,从宏微结合的角度建构质量守恒定律的“变”与“不变”的模型,通过小组合作、独立思考、实验探究等方式解决问题,该过程可以有效提升对变化观念与平衡思想的认识。
第二,真实情境和科学前沿信息的选取可以帮助学生理解化学对促进科学发展的“社会责任”。笔者在本课中选取神舟十三号升空这样受人瞩目的真实情境,挖掘其背后的化学知识,学生在探究过程中能够体验与人类发展相关的重大突破与化学学科的息息相关。在登月议题的展望中,学生运用已有知识合理展望,在此过程中也能够体验化学学科对促进科学发展的责任。
第三,真实情境和化学学科教学的有机结合,利用质量守恒定律的基本原理来探究并尝试解决航空航天以及登月中的一些关键问题,让化学教学实现了跨学科之间的应用,学生在初中化学启蒙阶段的学习过程能够让核心素养自然生长,有机融合,学以致用。
