卤素(F,Cl)取代的4,5-二甲氧基氮杂荧蒽衍生物的合成及其抑菌活性研究
2023-03-04文虹力杨方舟马养民
文虹力,杨方舟,马养民
(陕西科技大学 化学与化工学院,陕西 西安 710021)
0 引言
氮杂荧蒽生物碱是一类数量稀少的天然产物,具有高度缩合的芳香杂环,属于茚并[1,2,3-ij]异喹啉类化合物[1],如图1所示.迄今为止,仅报道了11种氮杂荧蒽生物碱,分别是Imelteine(1)[2]、Rufesine(2)[3]、Norrufescine(3)、Triclisine(4)、Telitoxine(5)[4]、Norimeluteine(6)[5]、Tatarine A(7)、Tatarine D(8)[6]、Sarumine(9)[7,8]、4,5,9-Trimethoxy-indenol[1,2,3-ij]isoquinolin-6-ol(10)、5,6,9-Trimethoxy-indenol[1,2,3-ij]isoquinolin(11)[9],其中多数是从防己科植物中分离得到.同时,氮杂荧蒽生物碱作为一类重要的具有特定生物活性的天然有机化合物[10].据相关研究,Imelteine对 HCT-116 结肠腺癌、ACHN 肾癌和A549肺癌的细胞毒性,IC50值分别为20.0 μg/mL、10.2 μg/mL和31.0 μg/mL[11].Norimeluteine和 Norrufescine对 P-388细胞,IC50值分别为3.6 μg/mL和5.8 μg/mL[12],Norrufescine 还表现出对人类免疫缺陷病毒(HIV-1)的抑制活性,在C8166细胞中的EC50值为 10.9 μM[13].
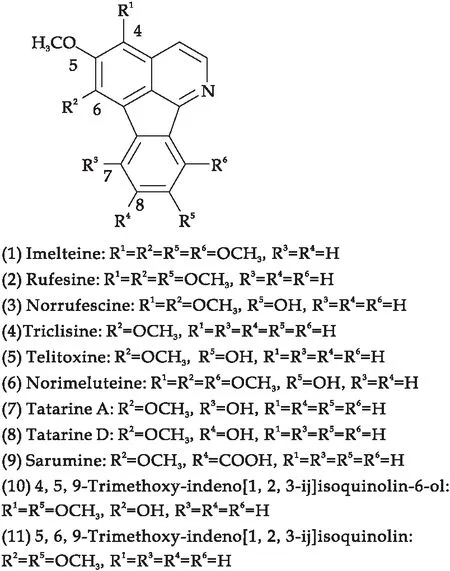
图1 11种氮杂荧蒽生物碱
氮杂荧蒽类化合物由于其天然丰度低,其各方面性能一直没有得到很好的研究.为了进一步评估这类化合物的其他生物活性,借助有机合成的方式来获得足够数量的氮杂荧蒽化合物具有重要的意义.然而,在以往的全合成中,着重探讨5,6位甲氧基取代的氮杂荧蒽类化合物的研究[14-16],缺少对存在4,5位甲氧基取代的氮杂荧蒽类化合物的合成和研究.这对该类化合物进行相关构效关系的分析是不利的.
本文以5-溴-2-羟基-3-甲氧基苯甲醛为原料,设计合成了5个含有具有卤素(F,Cl)不同位置取代以及一个不含基团取代的4,5-二甲氧基氮杂荧蒽衍生物,并进行了相关抑菌活性的测试,对枯草芽孢杆菌(Bacillussubtilis);金黄色葡萄球菌(Staphylococcusaureus);绿脓杆菌(Pseudomonasaeruginosa)、大肠杆菌(Escherichiacoli)通过二倍稀释法进行了最小抑菌浓度的测定.结果表明含氟的氮杂荧蒽衍生物对革兰氏阳性菌有明显的抑菌效果.特别是C-8取代位的氟化物对金黄色葡萄球菌抑菌效果更为显著,其MIC值为16 μg/mL.
1 实验部分
1.1 试剂与仪器
1.1.1 主要试剂
5-溴-2-羟基-3-甲氧基苯甲醛(纯度≥98%)、4-硝基苯磺酰氯(纯度≥98%)、3-氟-2-甲酰基苯硼酸(纯度≥98%)、5-氟-2-甲酰基苯硼酸(纯度≥98%)、5-氯-2-甲酰基苯硼酸(纯度≥97%)、三氟乙酸(纯度≥99%),以上试剂均购于萨恩化学技术(上海)有限公司;DBU(纯度≥99%)、四氢呋喃(纯度≥99.9%,water≤30 ppm),以上试剂均购于北京伊诺凯科技有限公司;碘甲烷(纯度≥99.5%,安徽泽升科技有限公司);硼酸化钠(纯度≥98%,西陇科学股份有限公司); 二甲基亚砜(DMSO,分析纯,上海麦克林生化科技有限公司);蛋白胨(生化试剂,北京奥博星生物技术有限责任公司);牛肉膏(生化试剂,北京奥博星生物技术有限责任公司);硫酸链霉素(医用肌注,上海伯达制药有限公司);青霉素钠(医用肌注,哈药集团制药总厂);枯草芽孢杆菌(Bacilussubtilis)、金黄色葡萄球菌(Staphylococcusaureus)、绿脓杆菌(Pseudomonasaeruginosa)、大肠杆菌(Esherichiacoli),以上菌种均来自北京保藏生物技术有限公司.
1.1.2 主要仪器
R-1001VN旋转蒸发仪(郑州长城科工贸有限公司);DH5000B电热恒温培养箱(天津市泰斯特仪器有限公司);LDZF-50L立式高温蒸汽灭菌器(上海申安医疗器械厂);SH-7四联磁力搅拌器(黄骅菲斯福实验仪器有限公司);DF-101S集热式恒温磁力搅拌器(巩义市予华仪器有限责任公司);Impact HD Q-TOF型高分辨质谱仪;AVANCE III 400 MHz型核磁共振仪.
1.2 实验方法
1.2.1 5-溴-2,3-二甲氧基苯甲醛(1)的合成[17]
于圆底烧瓶中加入5-溴-2-羟基-3-甲氧基苯甲醛3 g(12.98 mmol),15 mL DMF,充分溶解后在氮气保护下加入碳酸钾1.8 g(13.00 mmol),室温下搅拌15 min后加入碘甲烷1.843 g(12.98 mmol),将所得混合物在室温下反应24 h.处理:添加饱和NaOH溶液,并将悬浮液用乙酸乙酯稀释.分离得到有机层,多次用乙酸乙酯萃取水混合物,最后用水洗涤有机层萃取分液得到有机层,后用无水MgSO4干燥,减压浓缩,得到黄色固体3.1g,收率98%.1H NMR(400 MHz,CDCl3)δ 10.33(s,1H),7.49(d,J=2.3 Hz,1H),7.22(d,J=2.4 Hz,1H),3.97(s,3H),3.91(s,3H);13C NMR(101 MHz,CDCl3)δ 188.59,153.83,151.84,130.43,121.59,120.92,116.90,62.35,56.31.
1.2.2 (Z)-5-溴-1,2-二甲氧基-3-(2-硝基乙烯基)苯(2)的合成[18]
于100 mL耐压管中加入5-溴-2-羟基-3-甲氧基苯甲醛3.9 g(15.91 mmol)和乙酸铵653 mg(8.47 mmol),15 mL冰乙酸充分溶解后,滴加硝基甲烷2.83 g(46.36 mmol).在搅拌的条件下,于100 ℃的油浴锅中反应12 h.反应结束冷却有部分晶体析出,加水变浑浊,过滤后,多次用水进行清洗并抽滤,常温干燥得到棕黄色固体4.4 g,收率97%.1H NMR(400 MHz,CDCl3)δ 8.13(d,J=13.8 Hz,1H),7.73(d,J=13.7 Hz,1H),7.23(d,J=2.2 Hz,1H),7.16(d,J=2.2 Hz,1H),3.94(s,3H),3.93(s,3H).13C NMR(101 MHz,CDCl3)δ 153.77,148.55,139.18,133.16,125.43,123.41,118.81,116.76,61.30,56.26.
1.2.3N-(5-溴-2,3-二甲氧基苯乙基)-4-硝基苯磺酰胺(3)的合成
将三氟化硼乙醚(2.8 mL)逐滴添加到含硼氢化钠(626 mg,16.54 mmol)的四氢呋喃(20 mL)悬浮液中,并在室温于氮气气氛下将混合物搅拌15 min,然后向上述溶液中,缓慢加入含化合物2(3 g,10.41 mmol)的四氢呋喃(30 mL)溶液.反应混合物于70 ℃下加热回流4 h,随后冰浴冷却,逐滴加水,直到气体停止析出,除去冰浴,将反应混合物在85 ℃下加热回流2 h,反应停止后冷却至室温.旋干后呈现黄色膏状物,加入少量乙酸乙酯溶解,用饱和氢氧化钠溶液中和萃取多次,最后用水洗涤乙酸乙酯层,可观察到上层为黄色稍浑浊的有机层.分离得到有机层,用无水MgSO4干燥,减压浓缩,得到深黄色油状物即产物.用适量的CH2Cl2(15 mL)分别溶解2-(5-溴-2,3-二甲氧基苯基)乙-1-胺和对硝基苯磺酰氯2.54 g(11.46 mmol),在含苯胺的CH2Cl2溶液中滴加Et3N 1.175 g(11.61 mmol),在搅拌条件下,于0 ℃滴加含对硝基苯磺酰氯的CH2Cl2溶液于上述混合液中,并于室温中反应6 h.反应结束后,用水和CH2Cl2进行分液处理得下层橙黄色稍浑浊的有机层,加入无水MgSO4进行干燥,经减压浓缩,得到黄色粘稠液体,由硅胶色谱柱层析得到纯净的黄色固体4.03g,收率:87%.1H NMR(400 MHz,CDCl3)δ 8.25(d,J=8.6 Hz,2H),7.89(d,J=8.6 Hz,2H),6.83(d,J=2.2 Hz,1H),6.69(d,J=2.2 Hz,1H),5.29(t,J=5.4 Hz,1H),3.85(s,3H),3.77(s,3H),3.31(q,J=6.1 Hz,2H),2.74(t,J=6.5 Hz,2H).13C NMR(101 MHz,CDCl3)δ 153.20,149.76,146.03,145.67,132.97,127.99,124.71,124.12,116.61,114.58,60.67,55.93,44.06,29.93.
1.2.4 化合物(4a~4f)的合成
以N-(2-(2′-甲酰基-4,5-二甲氧基-[1,1′-联苯基]-3-基)乙基)-4-硝基苯磺酰(4a)化合物为例:先称取N-(5-溴-2,3-二甲氧基苯乙基)-4-硝基苯磺酰胺415 mg(0.93 mmol)于15 ml耐压管中,在氮气气氛下依次加入2-甲酰基苯硼酸180 mg(1.20 mmol),碳酸钾276 mg(2.00 mmol),四(三苯基)膦钯46 mg(0.04 mmol),最后以3∶3∶2的比例加入甲苯(1.2 mL),乙醇(1.2 mL)和水(0.8 mL)于120 ℃下搅拌24 h.反应结束加入水和乙酸乙酯萃取,得有机层,用无水MgSO4干燥,过滤,减压浓缩.用石油醚∶乙酸乙酯=5∶2进行层析纯化得到黄色粘稠液326.4 mg,收率:77%.1H NMR(400 MHz,CDCl3)δ 9.91(s,1H),8.26(d,J=8.5 Hz,2H),8.00(d,J=7.8 Hz,1H),7.97(d,J=8.5 Hz,2H),7.66(t,J=7.4 Hz,1H),7.53(t,J=7.5 Hz,1H),7.38(d,J=7.6 Hz,1H),6.81(d,J=1.9 Hz,1H),6.63(d,J=2.0 Hz,1H),5.41(t,J=5.4 Hz,1H),3.91(s,3H),3.90(s,3H),3.34(q,J=6.2 Hz,2H),2.88(t,J=6.6 Hz,2H).13C NMR(101 MHz,CDCl3)δ 192.19,152.45,149.84,146.99,146.01,144.95,134.05,133.73,133.59,131.30,130.43,128.13,128.04,127.93,124.10,124.08,113.02,60.76,55.86,44.12,30.52.
化合物4b~4e合成与上述方法一致.
N-(2-(3′-氟-2′-甲酰基-4,5-二甲氧基-[1,1′-联苯]-3-基)乙基)-4-硝基苯磺酰胺(4b)的合成:黄色粘稠液,收率:70%.1H NMR(400 MHz,CDCl3)δ 9.99(s,1H),8.27(d,J=8.3 Hz,2H),7.97(d,J=8.3 Hz,2H),7.60(q,J=7.6,7.2 Hz,1H),7.20(t,J=9.4 Hz,1H),7.14(d,J=7.8 Hz,1H),6.75(s,1H),6.61(s,1H),5.38(t,J=7.1 Hz,1H),3.89(s,3H),3.87(s,3H),3.32(q,J=6.1 Hz,2H),2.86(t,J=6.4 Hz,2H).13C NMR(101 MHz,CDCl3)δ 189.36,189.34,163.93,161.32,152.42,149.77,147.03,145.91,145.69,134.64,134.54,133.64,131.32,128.18,126.42,126.39,124.15,123.80,122.59,122.52,115.94,115.73,112.51,60.80,55.83,44.06,30.46.
N-(2-(4′-氟-2′-甲酰基-4,5-二甲氧基-[1,1′-联苯]-3-基)乙基)-4-硝基苯磺酰胺(4c)的合成:黄色粘稠液,收率:74%.1H NMR(400 MHz,CDCl3)δ 9.84(s,1H),8.27(d,J=8.3 Hz,2H),7.97(d,J=8.4 Hz,2H),7.64(d,J=8.8 Hz,1H),7.37(t,J=7.3 Hz,2H),6.77(s,1H),6.62(s,1H),5.46(t,J=5.8 Hz,1H),3.90(s,3H),3.89(s,3H),3.33(q,J=6.5 Hz,2H),2.87(t,J=6.8 Hz,2H).13C NMR(101 MHz,CDCl3)δ 191.08,163.40,160.92,152.50,149.80,147.06,145.90,141.25,141.22,135.19,135.13,132.94,132.52,132.44,131.50,128.16,124.21,124.16,121.00,120.79,113.94,113.72,112.94,60.80,55.87,44.09,30.55.
N-(2-(5′-氟-2′-甲酰基-4,5-二甲氧基-[1,1′-联苯]-3-基)乙基)-4-硝基苯磺酰胺(4d)的合成:黄色粘稠液,收率:79%.1H NMR(400 MHz,CDCl3)δ 9.83(s,1H),8.28(d,J=8.3 Hz,2H),8.03(t,J=7.2 Hz,1H),7.98(d,J=8.4 Hz,2H),7.20(t,J=8.8 Hz,1H),7.07(d,J=9.3 Hz,1H),6.79(s,1H),6.65(s,1H),5.38(t,J=5.6 Hz,1H),3.91(s,3H),3.89(s,3H),3.33(q,J=6.4 Hz,2H),2.88(t,J=6.7 Hz,2H).13C NMR(101 MHz,CDCl3)δ 190.60,166.64,164.08,152.49,149.77,147.87,147.78,147.27,145.87,132.68,131.50,131.03,130.93,130.21,128.10,124.12,123.88,117.28,117.06,115.48,115.26,112.64,60.76,55.83,43.99,30.54.
化合物4e~4f以110 ℃加热条件下,参照上述方法进行合成.
N-(2-(4′-氯-2′-甲酰基-4,5-二甲氧基-[1,1′-联苯]-3-基)乙基)-4-硝基苯磺酰胺(4e)的合成:黄色粘稠液,收率:61%.1H NMR(400 MHz,CDCl3)δ 9.85(s,1H),8.31-8.25(m,2H),8.00-7.96(m,2H),7.95(d,J=2.4 Hz,1H),7.61(dd,J=8.2,2.3 Hz,1H),7.35(d,J=8.2 Hz,1H),6.77(d,J=2.0 Hz,1H),6.63(d,J=2.1 Hz,1H),5.37(t,J=5.5 Hz,1H),3.91(s,3H),3.90(s,3H),3.33(q,J=6.2 Hz,2H),2.88(t,J=6.6 Hz,2H).13C NMR(101 MHz,CDCl3)δ 190.91,152.57,149.82,147.21,145.91,143.24,134.69,134.44,133.51,132.80,131.93,131.57,128.15,127.67,124.15,124.08,112.81,60.82,55.89,44.10,30.57.
N-(2-(5′-氯-2′-甲酰基-4,5-二甲氧基-[1,1′-联苯]-3-基)乙基)-4-硝基苯磺酰胺(4f)的合成:黄色粘稠液,收率:65%.1H NMR(400 MHz,CDCl3)δ 9.89(s,1H),8.32(d,J=8.3 Hz,2H),8.02(d,J=8.6 Hz,2H),7.99(d,J=8.4 Hz,1H),7.53(d,J=8.5 Hz,1H),7.42(s,1H),6.83(s,1H),6.68(s,1H),5.40(s,1H),3.96(s,3H),3.94(s,3H),3.37(d,J=7.1 Hz,2H),2.93(d,J=7.1 Hz,2H).13C NMR(101 MHz,CDCl3)δ 190.98,152.51,149.74,147.25,146.37,145.83,139.85,132.47,131.91,131.51,130.35,129.46,128.21,128.09,124.11,123.94,112.63,60.76,55.84,43.99,30.51.
1.2.5 化合物(5a~5f)的合成
以4,5-二甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,10b-四氢茚并[1,2,3-ij]异喹啉(5a)化合物的合成为例:用二氯甲烷(1.8 mL)溶解化合物(5a)192 mg(0.41 mmol)后,于室温条件下缓慢滴加三氟乙酸(0.2 mL),其中三氟乙酸∶二氯甲烷=1∶9,并在室温下搅拌反应3 h.反应结束后,用水和乙酸乙酯对反应液进行多次萃取,有机层用无水MgSO4干燥处理后,进行减压浓缩.再用石油醚∶乙酸乙酯=5∶1进行层析纯化得到黄色固体113 mg,收率:61%.1H NMR(400 MHz,CDCl3)δ 8.22(d,J=8.8 Hz,2H),8.14(d,J=7.6 Hz,1H),7.88(d,J=8.8 Hz,2H),7.64(d,J=7.2 Hz,1H),7.47(t,J=7.5 Hz,1H),7.38(d,J=6.4 Hz,1H),7.07(s,1H),5.32(s,1H),4.08(dt,J=14.5,4.9 Hz,1H),3.94(s,3H),3.80(s,3H),3.44(ddd,J=14.4,8.7,4.0 Hz,1H),2.90(dt,J=16.4,4.5 Hz,1H),2.32(ddd,J=16.4,8.7,4.8 Hz,1H).13C NMR(101 MHz,CDCl3)δ 153.81,149.98,145.37,145.33,144.30,140.34,134.42,132.13,132.12,128.87,128.82,127.59,127.36,126.89,124.05,119.91,102.78,61.13,60.13,56.22,47.43,22.04.
其他该类化合物与上述合成方法一致.
10-氟-4,5-二甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,10b-四氢茚并[1,2,3-ij]异喹啉(5b)的合成:黄色固体,收率:73%.1H NMR(400 MHz,CDCl3)δ 7.96-7.90(m,2H),7.52(t,J=6.8 Hz,1H),7.44(d,J=7.6 Hz,1H),7.40-7.35(m,2H),7.07(t,J=8.7 Hz,1H),6.94(s,1H),5.31(s,1H),4.55(dd,J=15.4,7.5 Hz,1H),3.94(t,J=8.3 Hz,1H),3.88(s,1H),3.72(s,1H),2.83(qd,J=18.0,8.1 Hz,2H).13C NMR(101 MHz,CDCl3)δ 162.29,159.77,153.92,149.40,146.66,145.62,143.87,143.82,133.52,133.50,132.51,131.96,131.89,128.18,127.28,127.12,125.27,123.03,115.85,115.82,114.60,114.40,102.67,60.47,60.25,56.13,47.58,20.32.
9-氟-4,5-二甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,10b-四氢茚并[1,2,3-ij]异喹啉(5c)的合成:黄色固体,收率:75%.1H NMR(400 MHz,CDCl3)δ 8.31(d,J=8.5 Hz,2H),8.01(d,J=8.6 Hz,2H),7.93(dd,J=9.2,2.5 Hz,1H),7.58(dd,J=8.4,5.0 Hz,1H),7.17(td,J=8.7,2.5 Hz,1H),7.06(s,1H),5.27(s,1H),4.11(dt,J=14.6,4.3 Hz,1H),3.95(s,3H),3.79(s,3H),3.25(ddd,J=13.9,9.8,3.4 Hz,1H),2.89(dt,J=16.2,3.8 Hz,1H),2.21(ddd,J=15.3,9.8,4.3 Hz,1H).13C NMR(101 MHz,CDCl3)δ 163.36,160.91,153.95,150.18,147.10,147.02,145.07,144.96,136.19,133.68,131.83,128.94,127.75,124.35,120.78,120.69,115.89,115.66,115.47,115.22,102.65,61.27,59.55,56.25,47.30,22.19.
8-氟-4,5-二甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,10b-四氢茚并[1,2,3-ij]异喹啉(5d)的合成:黄色固体,收率:70%.1H NMR(400 MHz,CDCl3)δ 8.26(d,J=8.8 Hz,2H),8.11(dd,J=8.5,5.2 Hz,1H),7.92(d,J=8.8 Hz,2H),7.31(d,J=5.7 Hz,1H),7.07-7.01(m,2H),5.25(s,1H),4.08(dt,J=14.4,4.7 Hz,1H),3.94(s,3H),3.80(s,3H),3.37(ddd,J=14.5,9.0,3.8 Hz,1H),2.89(dt,J=16.3,4.3 Hz,1H),2.27(ddd,J=16.3,9.0,4.6 Hz,1H).13C NMR(101 MHz,CDCl3)δ 164.88,162.43,153.90,150.07,145.77,145.21,142.58,142.49,139.88,139.86,133.48,132.99,128.90,128.82,127.55,124.18,113.55,113.33,107.28,107.05,102.96,61.17,59.43,56.24,47.34,22.01.
9-氯-4,5-二甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,10b-四氢茚并[1,2,3-ij]异喹啉(5e)的合成:黄色固体,收率:58%.1H NMR(400 MHz,CDCl3)δ 8.32(d,J=8.9 Hz,2H),8.20-8.09(m,1H),8.01(d,J=8.8 Hz,2H),7.56(d,J=8.1 Hz,1H),7.43(dd,J=8.1,1.9 Hz,1H),7.07(s,1H),5.27(s,1H),4.20-4.04(m,1H),3.95(s,3H),3.79(s,3H),3.24(ddd,J=13.9,9.9,3.3 Hz,1H),2.88(dt,J=16.2,3.7 Hz,1H),2.19(ddd,J=15.1,9.8,4.3 Hz,1H).13C NMR(101 MHz,CDCl3)δ 153.97,150.19,146.40,145.45,145.10,138.76,133.43,132.83,131.90,129.01,128.96,127.82,127.78,124.36,120.74,102.87,61.26,59.56,56.24,47.27,22.19.
8-氯-4,5-二甲氧基-1-((4-硝基苯基)磺酰基)-1,2,3,10b-四氢茚并[1,2,3-ij]异喹啉(5f)的合成:黄色固体,收率:60%.1H NMR(400 MHz,CDCl3)δ 8.28(d,J=8.4 Hz,2H),8.08(d,J=8.3 Hz,1H),7.94(d,J=8.4 Hz,2H),7.62(s,1H),7.33(s,1H),7.06(s,1H),5.25(s,1H),4.09(dt,J=14.5,4.3 Hz,1H),3.94(s,3H),3.80(s,3H),3.32(t,J=11.6 Hz,1H),2.94-2.83(m,1H),2.29-2.17(m,1H).13C NMR(101 MHz,CDCl3)δ 153.94,150.10,145.81,145.15,142.79,142.07,135.02,133.22,132.54,128.83,128.54,127.61,126.70,124.25,120.22,102.94,61.20,59.54,56.23,47.31,22.05.
1.2.6 氮杂荧蒽衍生物系列化合物(6a~6f)的合成
以化合物卤代-4,5-二甲氧基茚并[1,2,3-ij]异喹啉(6a)的合成为例:在15 mL的耐压管中加入原料(5a)44.3 mg(0.10 mmol),用DMF(2.0 mL)充分溶解后加入1,8-二氮杂二环[5,4,0]十一碳-7-烯(DBU)60 μL,于100 ℃下搅拌反应24 h.处理:用乙酸乙酯和水进行萃取分液,再以石油醚∶乙酸乙酯=4∶1进行层析纯化,真空旋干后,得到淡黄色固体,收率:82%.1H NMR(400 MHz,CDCl3)δ 8.65(d,J=6.0 Hz,1H),8.14(d,J=7.1 Hz,1H),7.76(dd,J=15.0,6.6 Hz,2H),7.67(s,1H),7.45(dt,J=18.6,7.6 Hz,2H),4.16(s,3H),4.12(s,3H).13C NMR(101 MHz,CDCl3)δ 160.21,154.37,145.20,143.36,139.78,139.08,133.81,130.04,128.35,128.21,122.37,122.28,121.37,113.77,110.93,61.98,57.26.HRMS(ESI)calculated for C17H14NO2[M+H]+:264.1019,found 264.102 3.
其他该类化合物与上述合成方法一致.
10-氟-4,5-二甲氧基茚并[1,2,3-ij]异喹啉(6b)的合成:黄色固体,收率:75%.1H NMR(400 MHz,CDCl3)δ 8.70(d,J=5.8 Hz,1H),7.70(d,J=5.8 Hz,1H),7.61(s,1H),7.50(d,J=7.2 Hz,1H),7.38(q,J=7.0 Hz,1H),7.07(t,J=8.9 Hz,1H),4.11(s,3H),4.10(s,3H).13C NMR(101 MHz,CDCl3)δ 159.81,158.10,158.08,157.27,154.12,145.89,143.90,142.11,142.06,132.75,132.73,131.79,131.72,128.12,124.87,124.73,121.83,117.41,117.39,116.31,116.10,113.62,111.50,61.98,57.26.HRMS(ESI)calculated for C17H13FNO2[M+H]+:282.092 5,found 282.092 9.
9-氟-4,5-二甲氧基茚并[1,2,3-ij]异喹啉(6c)的合成:黄色固体,收率:78%.1H NMR(400 MHz,CDCl3)δ 8.58(d,J=5.9 Hz,1H),7.69(d,J=6.1 Hz,1H),7.67(s,1H),7.56(dd,J=8.3,4.9 Hz,1H),7.47(s,1H),7.03(t,J=8.8 Hz,1H),4.08(s,3H),4.06(s,3H).13C NMR(101 MHz,CDCl3)δ 164.24,161.78,158.96,158.94,154.23,145.44,142.95,141.58,141.49,135.51,135.49,132.72,128.31,122.76,122.15,122.06,116.05,115.82,114.23,110.68,110.12,109.87,61.92,57.18.HRMS(ESI)calculated for C17H13FNO2[M+H]+:282.092 5,found 282.092 9.
8-氟-4,5-二甲氧基茚并[1,2,3-ij]异喹啉(6d)的合成:黄色固体,收率:72%.1H NMR(400 MHz,CDCl3)δ 8.59(d,J=3.2 Hz,1H),8.03(d,J=4.4 Hz,1H),7.69(dd,J=6.2,2.9 Hz,1H),7.61(d,J=3.0 Hz,1H),7.41(d,J=8.4 Hz,1H),7.06(t,J=8.9 Hz,1H),4.11(s,3H),4.09(s,3H).13C NMR(101 MHz,CDCl3)δ 165.71,163.23,159.32,154.25,145.31,144.05,142.19,142.10,135.02,132.42,128.18,123.46,123.36,122.62,114.52,114.28,113.46,111.38,109.54,109.29,61.99,57.29.HRMS(ESI)calculated for C17H13FNO2[M+H]+:282.092 5,found 282.092 9.
9-氯-4,5-二甲氧基茚并[1,2,3-ij]异喹啉(6e)的合成:黄色固体,收率:80%.1H NMR(400 MHz,CDCl3)δ 8.61(d,J=5.8 Hz,1H),8.01(s,1H),7.71(d,J=5.9 Hz,1H),7.65-7.52(m,2H),7.36(d,J=8.1 Hz,1H),4.11(s,3H),4.08(s,3H).13C NMR(101 MHz,CDCl3)δ 158.71,154.48,145.02,143.53,140.58,137.95,134.09,132.66,129.63,128.47,122.91,122.46,122.11,114.38,111.34,61.99,57.29.HRMS(ESI)calculated for C17H13ClNO2[M+H]+:298.062 9,found 298.063 5.
8-氯-4,5-二甲氧基茚并[1,2,3-ij]异喹啉(6f)的合成:黄色固体,收率:85%.1H NMR(400 MHz,CDCl3)δ 8.59(d,J=5.9 Hz,1H),7.91(d,J=8.1 Hz,1H),7.68(d,J=6.0 Hz,1H),7.62(s,1H),7.52(s,1H),7.33(s,1H),4.10(s,6H).13C NMR(101 MHz,CDCl3)δ 159.15,154.13,145.52,143.91,141.29,137.44,135.80,132.19,128.18,127.78,122.87,122.31,121.81,113.82,111.19,61.96,57.20.HRMS(ESI)calculated for C17H13ClNO2[M+H]+:298.062 9,found 298.063 4.
1.2.7 最小抑菌浓度MIC 的测定[19]
将待测化合物浓度用少量DMSO溶液溶解,再用无菌生理盐水稀释至512 μg/mL.于超净工作台上配置浓度为106 cfu/mL活化好的菌悬液,将高温灭菌好的培养液依次加入96孔孔板中,从左到右以1~12编号,从上到下依次以A-H编号.加入待测化合物时利用二倍稀释法从左到右化合物的浓度在A-1孔为256 μg/mL,A-2孔为128 μg/mL,依次下去分别为64 μg/mL,32 μg/mL,16 μg/mL,8 μg/mL,4 μg/mL,2 μg/mL,1 μg/mL,0.5 μg/mL.第11孔为空白对照组,而第12孔为加入DMSO溶液的对照组,最后加入配制好的菌悬液.每个化合物分别做三行平行对照,阳性对照组则另外使用一块96孔板进行以上相同操作.操作完毕后于37 ℃恒温培养箱培养24 h后观察96孔酶标仪上每个化合物,每排从右往左数第一个最清澈的孔,则这个孔的化合物溶度则为该化合物对此类细菌的最低抑菌浓度MIC.
2 结果与讨论
2.1 目标化合物的合成
化合物1[17]和2[18]借助相关文献报道能以97%~98%的产率合成.还原剂的选择是合成化合物3的关键.分别尝试了以四氢铝锂和硼氢化钠为还原剂,发现在以四氢铝锂为还原剂的体系中,由于其强烈的还原性,得到脱溴产物.而在以硼氢化钠为还原剂的体系中,能够以87%的产率得到化合物3,具体合成路线如图2所示.通过核磁共振氢谱和碳谱进行数据分析确定了化合物3的结构.
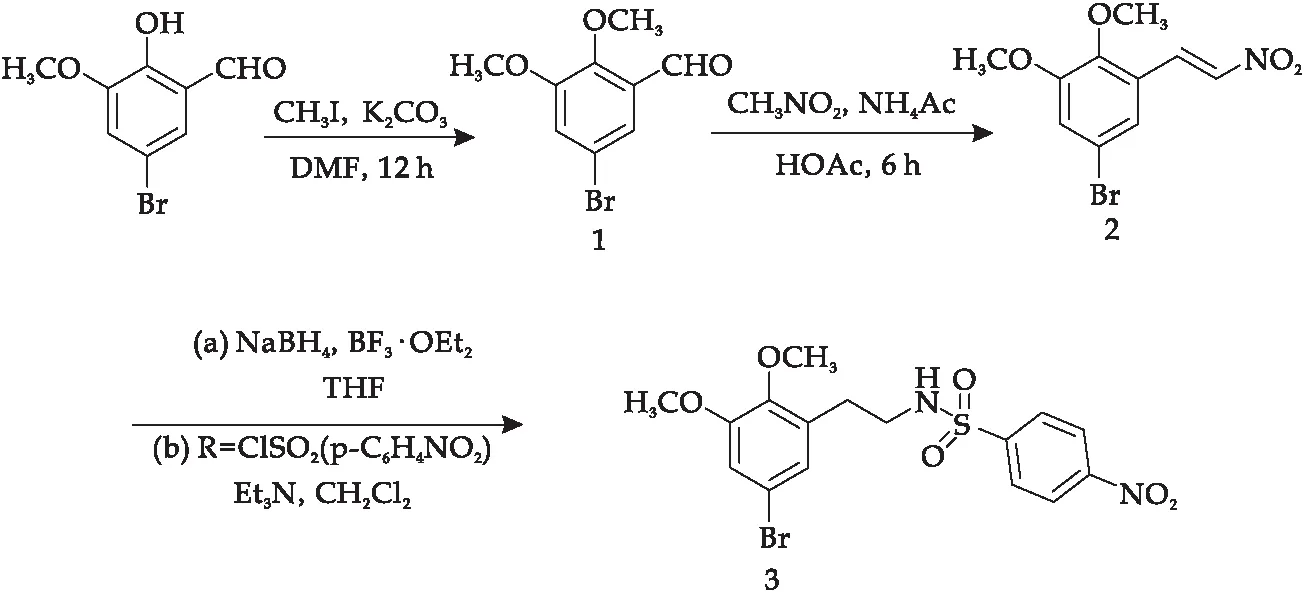
图2 化合物3的合成路线
将化合物3与2-甲酰基苯硼酸通过Suzuki偶联得到联苯中间体4.实验结果表明反应温度是决定产物生成的关键.参考相关文献[20],在合成化合物4a~4d时,于120 ℃的高温下进行反应,能以70%~79%产率得到相应产物,但在相同的温度下进行化合物4e和4f的合成时产率急剧下降.以化合物4e的合成为例,在反应结束后,通过硅胶柱色谱分离得到两个极性相近的化合物,经过NMR数据分析,发现除了目标产物4e以外还存在脱氯后的偶联产物4a.由于C-F键长比C-Cl键长短且C-F键能大于C-Cl键能.在高温下,C-Cl则更容易发生断裂,所以会出现实验中脱氯联苯产物4a.当反应温度降低为110℃时,则能以较高的产率得到化合物4e和4f,具体合成路线如图3所示.

图3 化合物4a~4f的合成路线
化合物4在三氟乙酸催化剂的存在下,通过逐级环化生成中间体5a~5f,此步骤中不同种类酸催化对反应有着极大的影响.以5a为例,在同样的室温条件下,以醋酸作为催化剂时,反应不发生.以氢溴酸作为催化剂,二氧六环作为溶剂,产率为52%.而以三氟乙酸作为催化剂,二氯甲烷作为溶剂时产率达到61%.在后续反应中,被氟原子取代的联苯化合物能以更高的产率得到相应的目标环合产物,这可能是由于氟原子具有强吸电子的特性,导致所连芳环的电子云密度降低,从而更易进行分子内环合得到目标化合物.化合物5a~5f在碱性试剂1,8-二氮杂二环[5.4.0]十一碳-7-烯(DBU)的催化下,得到最终产物 6a~6f,具体合成路线如图4所示.

图4 化合物6a~6f的合成路线
2.2 目标化合物的抑菌活性
采用了二倍稀释法对目标产物6a~6f的体外抑菌活性进行测试,选用革兰氏阳性菌金黄色葡萄球菌(Staphylococcusaureus)和枯草芽孢杆菌(Bacillussubtilis)以及革兰氏阴性菌绿脓杆菌(Pseudomonasaeruginosa)和大肠杆菌(Escherichiacoli)作为测试菌,青霉素钠和硫酸链霉素分别作为革兰氏阳性菌和阴性菌的阳性对照.测试结果如表1所示.

表1 化合物6a~6f的体外最小抑菌浓度
抑菌活性测试结果表明,大部分目标产物对指示细菌的生长存在抑制作用,化合物6a~6f对革兰氏阴性菌中绿脓杆菌(Pseudomonasaeruginosa)和大肠杆菌(Escherichiacoli)具有良好的抑菌活性.其中化合物6b、6d、6f对革兰氏阳性菌中金黄色葡萄球菌(Staphylococcusaureus)的最小抑菌浓度分别为32 μg/mL、16 μg/mL和32 μg/mL,抑菌活性显著,特别是化合物6d的最小抑菌浓度数值达到了阳性对照青霉素钠的最小抑菌浓度.由抑菌实验证实,该类化合物在抗菌药物的研究方面具有一定的应用潜力,也为该类化合物在未来的研究提供了合成方向.
3 结论
本文合成了6种新型的4,5-二甲氧基氮杂荧蒽衍生物,其中,包含5个以卤素(F,Cl)基团于不同位置取代的氮杂荧蒽化合物.采用了核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)以及高分辨质谱仪(HRMS)对其结构进行了分析表征,同时进行了相关的抑菌活性实验.测试结果表明,该类化合物对革兰氏阳性菌普遍具有良好的抑菌活性,特别是C-8位置上的F原子取代的化合物6d对金黄色葡萄球菌的最小抑菌浓度低至16 μg/mL,抑菌效果显著.该研究不仅丰富了氮杂荧蒽类化合物的种类,并为探索不同取代基团对氮杂荧蒽类化合物的生物活性影响提供了重要的理论基础.同时,也为进一步对该类化合物进行构效关系的分析提供了重要依据.
