柳氮磺砒啶联合醋氯芬酸肠溶片对AS患者炎症反应和免疫功能的影响
2023-03-04王方明刘敏黎朱笑夏宋冬明江南大学附属医院风湿免疫科无锡214000
王方明 刘敏黎 朱笑夏 宋冬明 汤 茜 孙 建 (江南大学附属医院风湿免疫科,无锡 214000)
强直性脊柱炎(ankylosing spondylitis,AS)属于一种慢性进展的炎症性疾病,该疾病的发生会导致患者肢体功能、劳动能力和生活质量降低。临床研究显示,大部分患者在疾病进展过程中其脊柱功能逐渐丧失,增加致残风险[1-2]。而机体内SOST属于分泌性的糖蛋白,能够抑制成骨细胞增殖、分化。DKK-1属于Wnt信号通路中的抑制剂,能够与相关受体进行结合,来关闭Wnt信号通路,从而抑制机体骨细胞活性。随着临床对AS研究的不断深入,发现针对此病应以缓解疼痛、阻碍疾病进展、修复损伤功能为主,多采用非甾体抗炎止痛药进行治疗,其中醋氯芬酸肠溶片属于非甾体抗炎药,具有抗炎、镇痛的作用,但在服用后会产生一定的副作用[3];而柳氮磺吡啶属于慢作用剂,其被证实具有延缓AS进展的作用[4],与醋氯芬酸肠溶片联合使用,能够有效降低其不良反应发生率,两者合用安全性较高。目前,临床对于两者联合治疗的相关研究较少,本研究采用柳氮磺吡啶联合醋氯芬酸肠溶片治疗AS患者,并探讨其对患者SOST、DKK-1水平的影响,观察临床治疗效果。
1 资料与方法
1.1 资料
1.1.1 临床资料 选取2019年2月至2021年2月于江南大学附属医院就诊的106例AS患者,按照随机数字表法将分为对照组、观察组各53例。两组在性别比例、平均年龄、平均BMI、平均病程等基线资料方面差异无统计学意义(P>0.05),具有可比性,见表1。本研究经江南大学附属医院伦理委员会审核批准,所有患者及家属知情同意。

表1 一般资料对比Tab.1 Comparison of general information
1.1.2 纳入标准 符合《强直性脊柱炎诊断及治疗指南》[5]中关于AS的诊断标准,且经影像学检查确诊。自愿参与本研究。
1.1.3 排除标准 合并结核者;免疫功能障碍者;严重骨质疏松者;合并血液系统疾病者;合并肝、肾、心等功能不全者;精神、沟通障碍者。
1.1.4 主要试剂与仪器 柳氮磺吡啶(上海福达制药有限公司,国药准字:H31020840,规格0.25 g×60片/盒);醋氯芬酸肠溶片(江苏吉贝尔药业有限公司,国药准字H20050272,规格:0.1 g×10片);特定蛋白分析仪(济南欧莱博科学仪器有限公司,型号:P 300);ESR、CRP、SOST、DKK-1 ELISA试剂盒由武汉益普生物科技有限公司提供。
1.2 方法
1.2.1 治疗方法 对照组采用柳氮磺吡啶治疗,1~2 g/次,2~3次/d,最高剂量不可超过4 g,治疗12周;观察组采用柳氮磺砒啶联合醋氯芬酸肠溶片治疗,200 mg/d,2次/d,100 mg/次,连续用药12周。柳氮磺砒啶用法用量同对照组。
1.2.2 指标观察
1.2.2.1 疾病活动情况、功能恢复情况评价 在患者入组未治疗前(治疗前)、治疗疗程结束后出院当日(治疗后)分别采用疾病活动指标评分(BASDAI)、功能指数评分(BASFI)评价患者疾病活动情况、功能恢复情况,其中BASDAI由疲乏、脊柱痛、晨僵时间、局部触痛以及关节肿痛等5个症状组成,量表得分为0~10分,分数越低说明患者疾病控制越好。BASFI评价内容为根据患者完成日常生活动作10项难度评价,要求患者独立完成穿衣/穿袜、取高处物品、弯腰拾物、登10~12级台阶、完整全天工作或者家务等,采用10分制,分数越低说明患者功能恢复越好。
1.2.2.2 胸廓活动度、脊柱活动度、疼痛情况评价 在患者入组未治疗前(治疗前)、治疗疗程结束后出院当日(治疗后)测量胸廓活动度、脊柱活动度。患者入组未治疗前(治疗前)、治疗疗程结束后出院当日(治疗后)疼痛情况采用疼痛视觉模拟评分评价,总分为10分,得分越低说明患者疼痛感越轻。
1.2.2.3 免疫炎症因子表达检测 抽取两组患者入组未治疗前(治疗前)、治疗疗程结束后出院当日(治疗后)清晨空腹静脉血3 ml,透过IgA、IgG、IgM水平评价患者机体免疫情况,采用速率散射比浊法测定IgA、IgG、IgM水平,使用特定蛋白分析仪来进行检测。
1.2.2.4 SOST、DKK-1水平测定 采用ELISA测定患者治疗前后血清ESR、CRP、SOST、DKK-1水平。具体操作按试剂盒说明书进行。
1.2.2.5 临床疗效评价 将患者临床疗效分为3个等级,即为显效、有效、无效。患者治疗后无痛感、临床症状消失为显效;患者治疗后存在轻度疼痛,临床症状明显改善为有效;患者治疗后仍存在较为强烈的疼痛,症状未改善为无效。治疗总有效率(%)=(显效例数+有效例数)/总例数×100%。
1.2.2.6 不良反应统计 统计两组用药过程中所出现的轻度胃痛、头晕、恶心呕吐、嗜睡等不良反应发生情况。
1.3 统计学处理 采用SPSS26.0统计软件进行分析处理。计量资料采用±s描述,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料采用频数和百分比表示,组间比较采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组疾病活动情况、功能恢复情况对比 如表2所示,治疗前两组BASDAI评分、BASFI评分对比,差异无统计学意义(P>0.05);治疗后两组BASDAI评分、BASFI评分均低于治疗前,差异具有统计学意义(P<0.05);治疗后观察组BASDAI评分、BASFI评分低于对照组,差异具有统计学意义(P<0.05)。
表2 两组疾病活动情况、功能恢复情况对比(±s)Tab.2 Comparison of disease activity and functional recovery between two groups (±s)
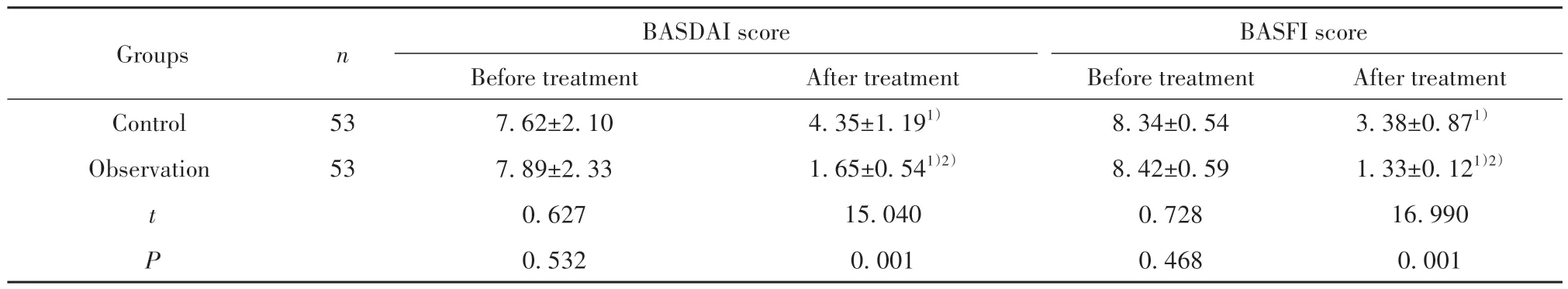
表2 两组疾病活动情况、功能恢复情况对比(±s)Tab.2 Comparison of disease activity and functional recovery between two groups (±s)
Note:Compared with the same group before treatment, 1)P<0.05; compared with control group, 2)P<0.05.
2.2 两组胸廓活动度、脊柱活动度、疼痛情况对比 如表3所示,治疗前两组胸廓活动度、脊柱活动度、疼痛评分对比,差异无统计学意义(P>0.05);治疗后两组胸廓活动度、脊柱活动度高于治疗前,疼痛评分低于治疗前,差异具有统计学意义(P<0.05);治疗后观察组胸廓活动度、脊柱活动度高于对照组,疼痛评分低于对照组,差异具有统计学意义(P<0.05)。
表3 两组胸廓活动度、脊柱活动度、疼痛情况对比(±s)Tab.3 Comparison of thoracic mobility, spinal mobility, and pain between two groups (±s)
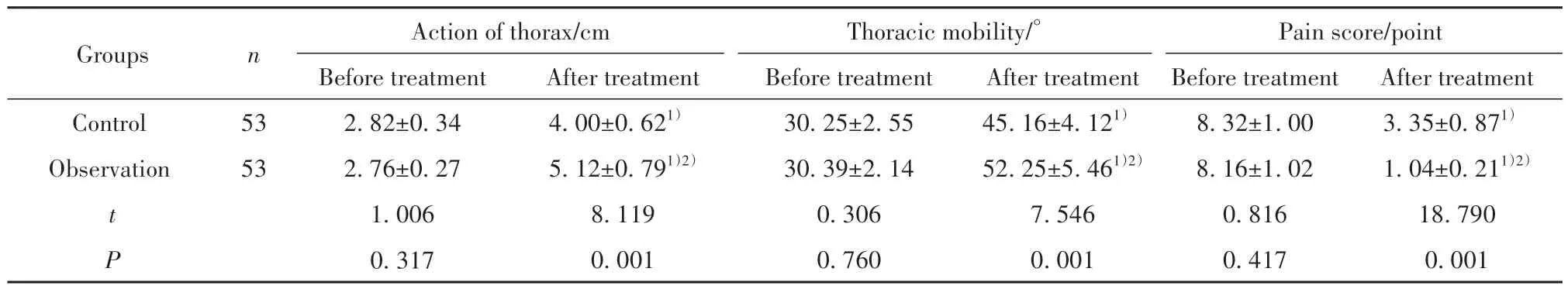
表3 两组胸廓活动度、脊柱活动度、疼痛情况对比(±s)Tab.3 Comparison of thoracic mobility, spinal mobility, and pain between two groups (±s)
Note:Compared with the same group before treatment, 1)P<0.05; compared with control group, 2)P<0.05.
2.3 两组炎症因子、免疫功能水平对比 如表4所示,治疗前两组ESR、CRP、IgA、IgG、IgM水平对比,差异无统计学意义(P>0.05);治疗后两组ESR、CRP、IgA、IgG、IgM水平均低于治疗前,差异具有统计学意义(P<0.05);治疗后观察组ESR、CRP、IgA、IgG、IgM水平低于对照组,差异具有统计学意义(P<0.05)。
表4 两组炎症因子、免疫功能水平对比(±s)Tab.4 Comparison of inflammatory factors and immune function levels between two groups (±s)
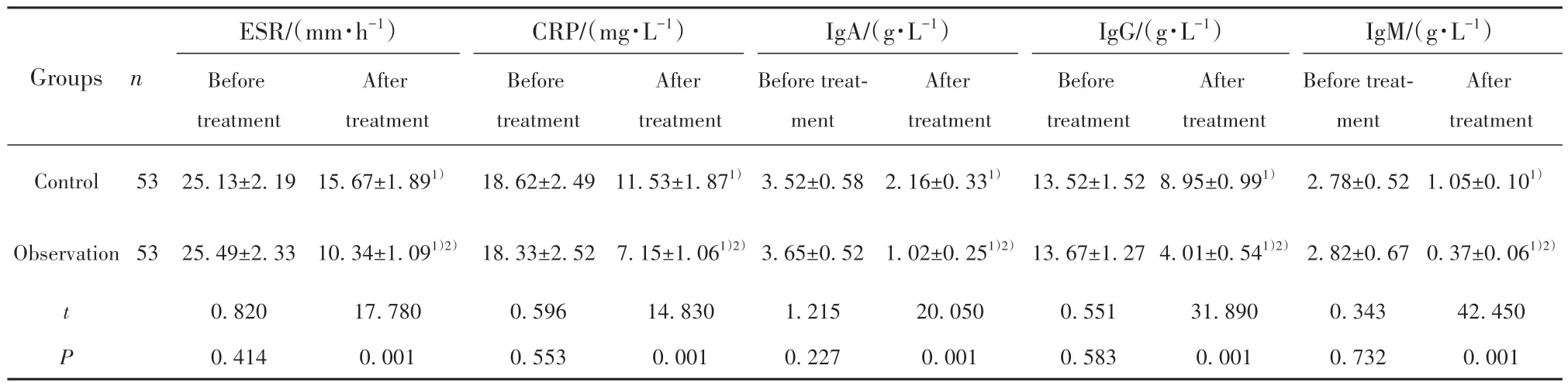
表4 两组炎症因子、免疫功能水平对比(±s)Tab.4 Comparison of inflammatory factors and immune function levels between two groups (±s)
Note:Compared with the same group before treatment, 1)P<0.05; compared with control group, 2)P<0.05.
Groups n ESR/(mm·h-1)Before treatment CRP/(mg·L-1)Before treatment IgA/(g·L-1)Before treatment IgG/(g·L-1)Before treatment IgM/(g·L-1)Before treatment Control 53 25.13±2.19 After treatment 15.67±1.891)18.62±2.49 After treatment 11.53±1.871)3.52±0.58 After treatment 2.16±0.331)13.52±1.52 After treatment 8.95±0.991)2.78±0.52 After treatment 1.05±0.101)Observation53 25.49±2.33 0.820 0.414 10.34±1.091)2)18.33±2.52 0.596 0.553 7.15±1.061)2)3.65±0.52 1.215 0.227 1.02±0.251)2)13.67±1.27 0.551 0.583 4.01±0.541)2)2.82±0.67 0.343 0.732 0.37±0.061)2)42.450 0.001 t P 17.780 0.001 14.830 0.001 20.050 0.001 31.890 0.001
2.4 两组SOST、DKK-1水平对比 如表5所示,治疗前两组SOST、DKK-1水平对比,差异无统计学意义(P>0.05);治疗后两组SOST高于治疗前,DKK-1低于治疗前,具有统计学差异(P<0.05);治疗后观察组SOST高于对照组,DKK-1低于对照组,差异具有统计学意义(P<0.05)。
表5 两组SOST、DKK-1水平对比(±s)Tab.5 Comparison of SOST and DKK-1 levels between two groups (±s)

表5 两组SOST、DKK-1水平对比(±s)Tab.5 Comparison of SOST and DKK-1 levels between two groups (±s)
Note:Compared with the same group before treatment, 1)P<0.05; compared with control group, 2)P<0.05.
2.5 两组临床疗效对比 如表6所示,与对照组相比,观察组治疗总有效率较高,差异有统计学意义(P<0.05)。

表6 两组临床疗效对比[n(%)]Tab.6 Comparison of clinical efficacy between two groups [n(%)]
2.6 两组不良反应对比 如表7所示,与对照组相比,观察组总不良反应发生率略高,但两组对比差异无统计学意义(P>0.05)。

表7 两组不良反应对比[n(%)]Tab.7 Comparison of adverse reactions between two groups [n(%)]
3 讨论
反复下腰背痛为AS的主要临床特征表现,在疾病发展过程中表现为脊柱强直、受累关节功能丧失等,发病率逐年升高,且男性高于女性,是导致我国青壮年致残的主要影响因素之一[6-7]。
相关研究指出,80%的AS患者都会出现ESR水平升高,ESR水平能够准确反映AS患者机体内的炎症反应程度以及组织的损伤程度,在临床中可作为检测疾病活动性的重要参考指标[8]。CRP主要反映人炎症反应的程度,是急性炎症反应蛋白之一,其存在对于机体气道的调理会产生重要作用,能够对机体吞噬细胞的吞噬作用进行强化,从而激活补体,自身水平骤增时,则说明机体出现炎症反应。CRP水平会急速升高,加重机体炎症反应[9]。相关研究指出,ESR、CRP水平表达异常升高与强直性脊柱炎所引起的炎症反应程度密切相关[10]。本研究结果显示,使用联合治疗方案,能够降低ESR、CRP水平,减轻患者机体炎症反应,改善患者临床症状。这是因为柳氮磺吡啶在被人体吸收后可分解成为磺胺嘧啶、5-氨基水杨酸,可明显抑制前列腺素相应结合、降解以及叶酸吸收、代谢,对局部炎症抑制。醋氯芬酸肠溶片属非甾体抗炎类药物中的一种,其可通过抑制前列腺素合成缓解疼痛,抑制局部炎症反应[11]。两者协同作用发挥更好的抗炎、镇痛作用。
IgA、IgG、IgM是由B细胞分泌而来的一类具有免疫功能的球蛋白,激活免疫系统抗原,并对病原微生物黏附宿主细胞进行抑制,阻止病毒感染的靶作用,是临床上评价AS常用的免疫指标[12-14]。相关研究指出,IgA、IgG、IgM水平表达异常升高与该病引起的免疫功能的急速降低密切相关[15]。本研究结果显示,使用联合治疗方案,能够降低IgA、IgG、IgM水平,改善患者机体免疫功能。这是因为柳氮磺吡啶联合醋氯芬酸肠溶片在治疗过程中,能够有效恢复机体失衡的免疫功能,阻碍病原微生物入侵,改善机体免疫功能,有效缓解患者病情。
SOST可反映机体骨代谢水平,其作为“胱氨酸结”结构的分泌型糖蛋白,其可负性调控骨的形成,与AS骨形成过程相关[16-17]。另外Wnt信号通路参与AS骨侵蚀、新骨形成过程,而DKK-1属于此信号通路的抑制剂,其可经与受体结合促使此信号通路失活,进而抑制骨细胞活性,抑制骨形成,与AS的发生密切相关[18-19]。相关研究指出,SOST、DKK-1能够反映AS疾病的严重程度,与疾病的发生、发展密切相关[20]。本研究发现,采用两药联合治疗的患者SOST明显升高,DKK-1明显降低,此结果提示两者联合应用可抑制AS患者骨形成过程,阻碍疾病进展,表现为SOST升高,DKK-1降低。这是因为两药联合能够有效促进成骨细胞的生长,提升成骨细胞自身活性,维持骨形态的正常状态,并且对受损的骨质进行修复,以此有效改善患者疾病的进一步发生,缓解病情严重程度。
综上所述,本研究发现,柳氮磺吡啶联合醋氯芬酸肠溶片治疗AS疗效显著,分析其发挥作用的机制可能与改善改善SOST、DKK-1表达,抑制免疫炎症反应,缓解疼痛相关。
