小儿尿液中的新蝶呤及生物蝶呤检测方法优化*
2023-03-02陈雪静马艳茹姜盼盼黄嘉雯
陈雪静 韩 婷 马艳茹 徐 蕊 姜盼盼 黄嘉雯
1.内蒙古巴彦淖尔市临河区妇幼保健院 (内蒙古 巴彦淖尔市 015000)
2.深圳罕见病代谢组学精准医学工程研究中心 (广东 深圳 518107)
3.深圳爱湾医学检验实验室 (广东 深圳 518107)
苯丙酮尿症(HPA)是一种常染色体隐性遗传病,主要是由于苯丙氨酸羟化酶(PAH)及其辅酶四氢蝶呤(BH4)缺乏导致,前者缺失称之为经典型PKU,后者的缺失为四氢蝶呤缺乏症(BH4D)[1]。6-丙酮酰四氢蝶呤合成酶(PTPS)缺失是导致四氢蝶呤缺乏症的主要原因,约占BH4D 的60%[2]。尿中新蝶呤、生物蝶呤及生物蝶呤的百分比是诊断6-丙酮酰四氢蝶呤合成酶是否缺失的关键指标[3]。目前尿液前处理方法主要有两种,一是用酸性碘化钾将还原态的BH4、BH2氧化为N和B,二是用MnO2进行氧化[4-5]。本文主要用酸性碘化钾进行氧化,该方法操作简单,具有高灵敏度,高准确度,适用于检测小儿尿液中的新蝶呤和生物蝶呤。
1 实 验
1.1 仪器试剂仪器:岛津LC-2 0 A 配合荧光检测器(日本SHIMADZU公司);RL-821型旋涡振荡混合器(北京八方世纪科技有限公司);1730QT型超声波清洗器(北京科玺世纪科技有限公司);Dragonlab移液枪(可调范围:20~200μL、100~1000μL,EPPENDORF 中国有限公司);AUX320岛津分析天平(日本SHIMADZU公司)。
试剂:新蝶呤标准品(CAS No:2009-64-5)、生物蝶呤标准品(CAS:22150-76-1)、氢氧化钠(分析纯,天津致远化学试剂有限公司);盐酸(优级纯,湖南凯信公司);碘化钾(上海安谱实验科技有限公司);碘单质(上海安谱实验科技有限公司);抗坏血酸(永华化学科技(江苏)有限公司);实验用水使用Milli-Q纯水系统(美国MIlli-pore公司)制备。
1.2 色谱条件色谱柱:Kromasil EternityXT C18色谱柱(4.6mm*250mm,5μm);流动相:甲醇:水(10:90);流速:1.0~4.0 min,总流速为0.6mL/min;4.01~11.0min,总流速为1.0mL/min;11.01~20min,总流速为0.6mL/min;检测器:激发波长350nm,发射波长460nm;柱温:22 ℃;进样量:20μL。
1.3溶液配制 0.1mol/L NaOH溶液:准确称量0.100g氢氧化钠固体于烧杯中,溶解后转移至25 mL容量瓶,混匀配成0.1mol/L溶液。6.0mol/L HCI溶液:准确吸取10mL盐酸(体积分数是36.0%~38.0%),用超纯水定容至20mL,混匀配制成6.0mol/L溶液。0.1mol/L盐酸:取200μL 6mol/L盐酸溶液加水定容到12 mL,0.05mol/L I2-KI溶液:将2.6g KI溶解于50mL水中,然后加入0.325g I2单质充分溶解。0.05 mol/L抗坏血酸:称取0.44g固体粉末溶解于50mL水中。
标准溶液的配制:分别精密称取新蝶呤对照品10mg,生物蝶呤对照品5mg于25mL容量瓶中,用0.1mol/L氢氧化钠溶解并稀释至刻度,摇匀,得到400μg/mL的新蝶呤储备液和200μg/mL的生物蝶呤储备液,置-4℃的冰箱保存。取一定量的新蝶呤和生物蝶呤配制成混合标准液(新蝶呤16.0μg/mL,生物蝶呤17.28μg/mL)。
1.4 实验方法
1.4.1 标准曲线的绘制 将1.3中混合的标准溶液,按照等比例稀释方式,用0.1 mol/L盐酸稀释成以下浓度:新蝶呤:1.0,0.5,0.2,0.1,0.05,0.025,0.0125,0.00625μg/mL;生物蝶呤:1.08,0.54,0.216,0.108,0.054,0.027,0.0135,0.00675μg/mL。依次进样,以峰面积对浓度做线性回归方程,分别得到新蝶呤和生物蝶呤的标准曲线。
1.4.2 样品的预处理 取原尿样品1mL,置于10mL试管中,加入6mol/L盐酸75uL,使pH为1~2,加入0.05mol/L I2-KI溶液1mL,暗处室温放置30min,滴加0.05mol/L抗坏血酸还原液1mL,用水定容至5mL,摇匀,过微孔滤器,取20μL进样分析。
2 结 果
2.1 线性范围与检出限按照1.4.1配制标准曲线,新蝶呤在0.00625-1.00μg/mL内线性良好,线性回归方程为:Y=1*10^7X -40274,相关系数:r=0.9999;生物蝶呤在0.00675-1.08μg/mL内线性良好,线性回归方程为:Y=1*10^7X - 58688,相关系数:r=0.9999。
2.2 回收率
2.2.1 批内精密 加入一定体积及浓度的混标,使新蝶呤的浓度分别为0.0125,0.1,0.5μg/mL,生物蝶呤的浓度分别为0.0135,0.108,0.54μg/mL,探究样品在3个浓度下的批内精密度。由表1可见,新蝶呤和生物蝶呤的批内精密度在94.35%~101.96%,RSD<6%。
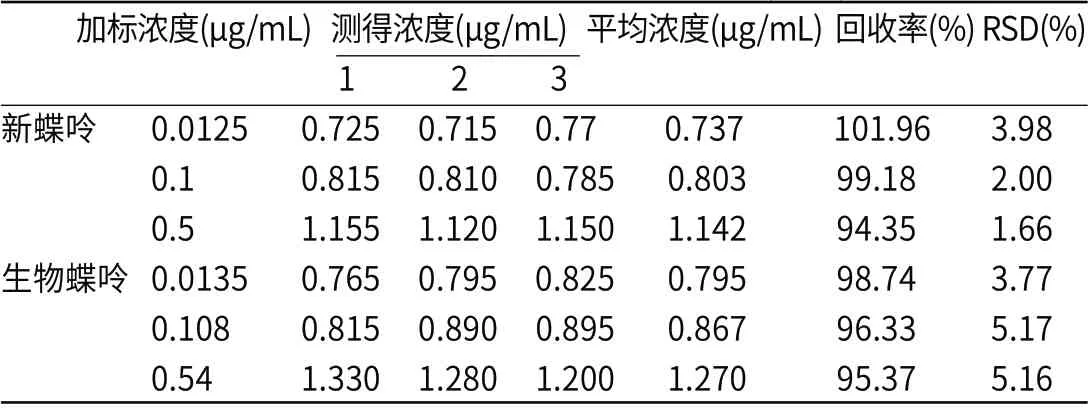
表1 新蝶呤和生物蝶呤批内精密度(n=3)
2.2.2 批间精密度 加入一定体积及浓度的混标,使新蝶呤的浓度分别为0.0125,0.1,0.5μg/mL,生物蝶呤的浓度分别为0.0135,0.108,0.54μg/mL,连续测试4day,考察批间精密度。
2.3 样品的稳定性按照样品前处理方法平行处理3份样本,置于15 ℃保存,连续进样5day,探究样品的稳定性。样品的稳定性结果如图1,新蝶呤和生物蝶呤峰面积随放置时间延长而下降,且这种下降关系并不是同步的。因此,当天处理的样本最好在当天完成目标物测定。
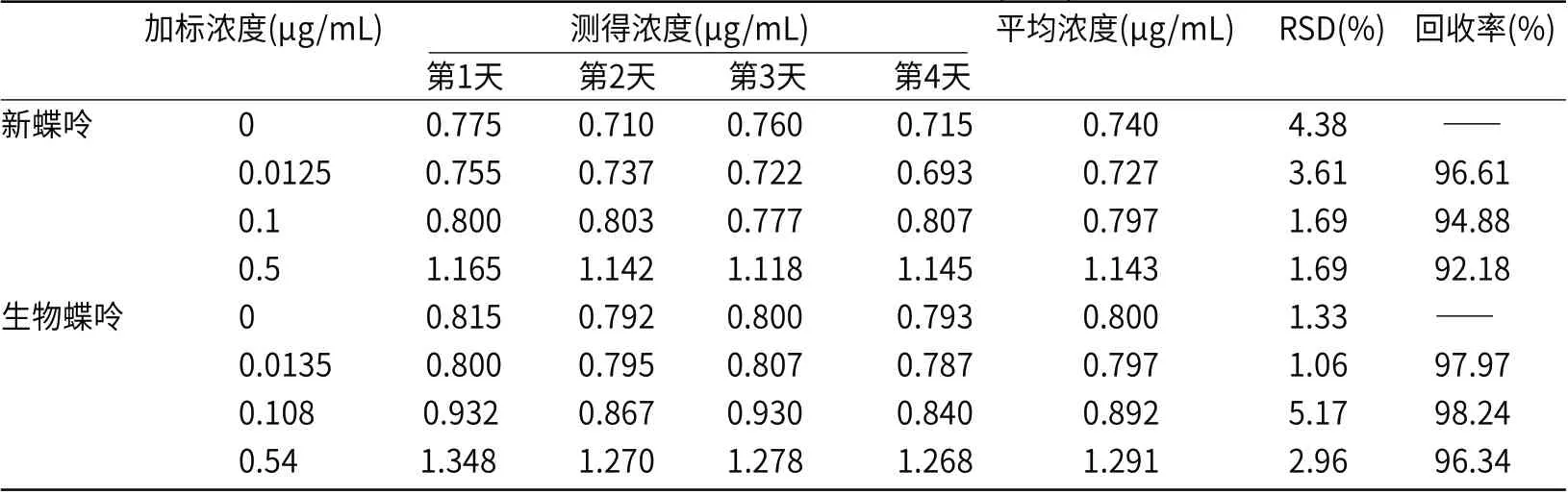
表2 新蝶呤和生物蝶呤批间精密度(n=3)
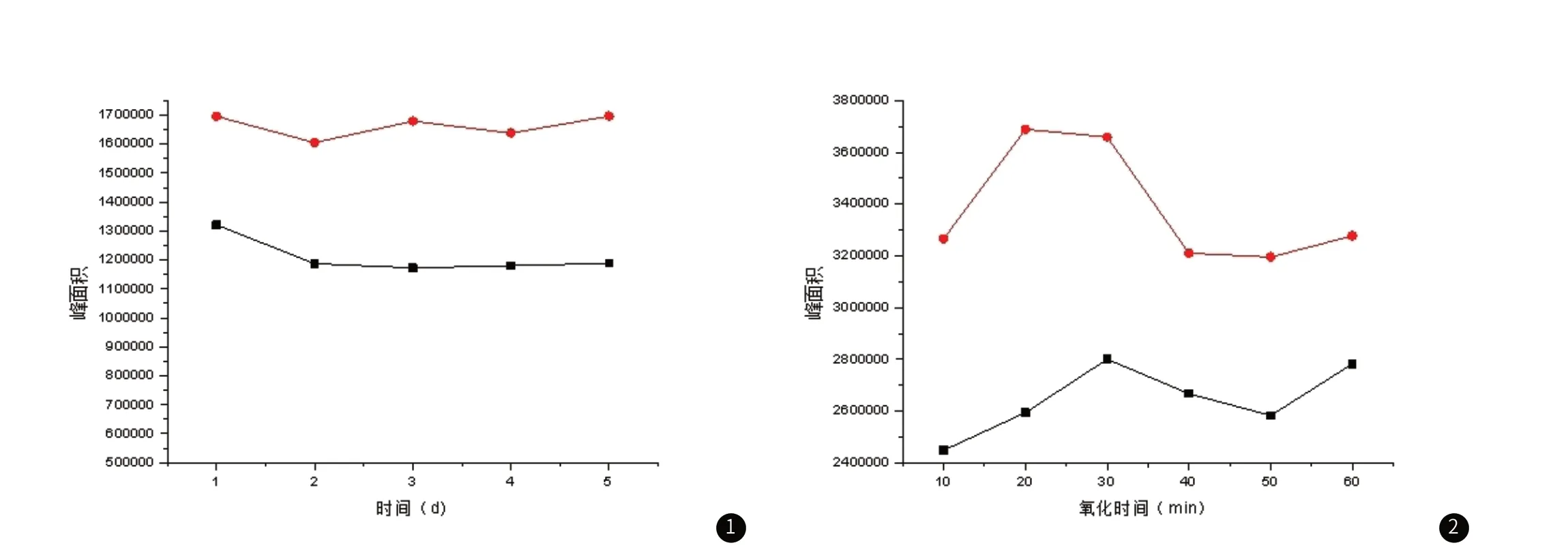
图1 样品稳定性的探究(a为新蝶呤,b为生物蝶呤)。图2 峰面积随氧化时间变化情况(a为新蝶呤,b为生物蝶呤)。
3 讨 论
3.1 液相方法的选择优化
3.1.1 流速的选择与优化 分别使用不同的流速进样探究最优方式。方法包括:恒流速0.6mL/min、0.7mL/min、0.8mL/min、0.9mL/min、1.0mL/min;变流速(流速为0.6mL/min,出峰位置流速为1.0mL/min)。比较各方法谱图显示采用变流速的方法进样,新蝶呤和生物蝶呤出峰效果最佳。
3.1.2 柱温的选择与优化 样品中目标物与杂质的分离度对物质的定量分析有很大影响。柱温影响分离度,故探究柱温对样品分离情况影响。方法包括:通过选择不同温度条件进行探究,对比各谱图中目标峰与杂质峰分离情况。发现在22℃时,样品中的新蝶呤及生物蝶呤与杂质峰能达到最好的分离效果,故柱温选择22℃。
3.2 样品前处理条件优化
3.2.1 前处理方法的比较 尿液中的成分相对复杂,实验中为了确保准确性,对尿液进行两种前处理:(1)取原尿样品1mL,置于10mL试管中,加入6mol/L盐酸75μL,使pH为1~2,加入0.05 mol/L I2-KI溶液1mL,暗处室温放置30min,滴加0.05mol/L抗坏血酸还原液1mL,用水定容至5mL,摇匀,过微孔滤器,取20μL进样分析。(2)取原尿样品500μL,加入50μL 1mol/L HCl,再加入10mg MnO2,离心过滤,测肌酐浓度,并以0.1mol/L HCl稀释,使肌酐浓度在20-30mg/L,取20μL进样分析。结果:与方法(2)相比,方法(1)的峰分离度较好、回收率高,且操作比较简单,故采用方法(1)进行样本前处理。
3.2.2 氧化时间的选择 实验探究 10min、20min、30min、40min、50min、60min的氧化时间对检测新蝶呤和生物蝶呤的影响。结果如图2,发现较其他时间相比,氧化时间在30min时,新蝶呤和生物蝶呤峰面积较大,氧化比较完全。
3.2.3 酸性的影响 新蝶呤和生物蝶呤通常以氧化态和还原态的形式存在,在酸性环境中比较稳定[6-7], Slazyk等[8]等报道,生物蝶呤在酸性条件下回收率会升高。故探究实验中加盐酸与不加盐酸对两种蝶呤的影响。对照组正常加入6mol/L的盐酸对尿液进行酸化,再进行氧化;而实验组则不加盐酸,直接进行氧化,结果显示,与加入了盐酸的对照组相比,未加盐酸条件下的新蝶呤和生物蝶呤含量降低一半左右。
3.2.4 光照的影响 新蝶呤、生物蝶呤在光照条件下易分解,孟英韬等[9]提出,取新蝶呤、生物蝶呤等样品混合液,用正午太阳光光照30 min,新蝶呤、生物蝶呤全消失,且新蝶呤前出现一大峰。为防止实验中光照对尿蝶呤中新蝶呤和生物蝶呤含量的影响。把实验分为两组,实验组放在实验室强光的地方氧化,对照组放置暗处氧化,测过结果显示两组测得的新蝶呤和生物蝶呤无明显的差异。故普通的实验光照对本实验无明显的影响。
4 结 论
本文建立了高效液相色谱-荧光检测法同时测定以尿滤纸片形式为检测样本中新喋呤和生物蝶呤的含量,并通过分别计算新喋呤、生物蝶呤与尿肌酐的浓度比值,以及B%,可有效的鉴别出BH4缺乏症患者。基于优化色谱条件和实验条件,该方法灵敏度高、选择性强、分析时间短,且稳定性、精密度和加标回收率都符合分析要求;此外,本实验的检测样本相对于原尿液来说,运输更方便,保存时间更长,制作简单,前处理简便,结果较好,可在短时间内测定大批量样品,适用于临床检测,为尿蝶呤谱分析提供了新的检测方法,形成一套能够在临床上应用的标准操作流程,对鉴别HPA分型和患儿的治疗及预防发病具有重要意义。
