电针联合跑轮训练缓解大脑中动脉栓塞大鼠脑神经损伤和认知功能障碍的机制研究
2023-03-02杨坤胡锋闵慧梅求安许明军
杨坤,胡锋,闵慧,梅求安,许明军
脑卒中是世界上第二大最常见的死因,每年有600万人死于卒中。急性缺血性卒中是最常见的卒中形式[1-2]。临床上,卒中的治疗仅限于恢复血流的干预措施-药物或机械溶栓。然而,实际上只有11%的卒中患者实际上接受了组织型纤溶酶原激活剂,而在这些患者中,有一半未能表现出临床改善。因此,迫切需要确定新的、更有效的缺血再灌注相关方法治疗神经元损伤[3-4]。tau是一种与微管组装相关的蛋白质,参与维持神经元形态以及轴突和树突状过程的形成[5],为了使tau正常发挥作用,它需要在特定残基处被磷酸化。在脑缺血和血管再灌注期间,tau倾向于过度磷酸化,从而导致其聚集,这种现象通常与神经变性和细胞死亡相关[6]。tau的病理性积累是一组被归类为tau病的神经退行性疾病的特征[7]。在神经元和神经胶质细胞中观察到tau病理学,这可能与缺血性卒中后的脑血管损伤有关,并且可能在卒中中发挥关键作用[8-10]。证据表明,电针通过各种信号通路减少细胞凋亡,对多器官系统的缺血性损伤发挥保护作用[11-12],电针通过改善神经退行性疾病的认知功能来提供神经保护作用[13],电针通过各种途径减轻炎症反应来治疗脑缺血性损伤[14]。众所周知,体育锻炼可能有助于预防和治疗卒中。啮齿动物的跑轮运动可以模仿人类的身体“活跃”生活方式。电针联合跑轮训练既可以发挥电针的穴位刺激效应,同时可以通过跑轮促进大脑机能恢复。因此,本课题研究电针联合跑轮训练对大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型大鼠海马对脑中动脉闭塞大鼠tau蛋白及磷酸化程度的影响。
1 材料与方法
1.1 实验动物 30只成年雄性SD大鼠(16周龄,质量350~450g)购自南京模型动物中心。大鼠都在标准的塑料笼子中饲养,在特定的无病原体条件下以12h的明暗循环。饲养室的温度保持在20~25°C,湿度稳定在50%~60%。MCAO模型:大鼠急性局灶性脑缺血是由腔内MCAO引起的。用于大鼠的4mm远端尼龙单丝(长30mm,直径0.16mm)部分涂有直径为0.21~0.22mm的硅树脂(澳大利亚),11mm远端单丝(长50mm,直径0.23mm)段涂有用于大鼠的0.28~0.30mm直径的硅胶。MCAO是通过将单丝通过颈总动脉插入左颈内动脉,在颈动脉分叉处前进20~21mm直到感觉到轻微的阻力。在假手术动物中,闭塞细丝仅插入颈动脉分叉上方5mm处。
1.2 方法 在适应1周后,大鼠被随机分为3组各10只,对照组进行了假手术处理,并安置于没有跑轮的消毒后的聚丙烯笼中;MCAO组如前所述进行MCAO手术处理后置于消毒后的聚丙烯笼中;观察组大鼠进行MCAO手术后的第7天,被饲养在带有直径12cm跑轮的聚丙烯笼中,每天使用跑轮12h,运动干预持续时间为10周,同时每天早上8点对该组大鼠进行电针治疗,将针直径0.3mm灸针插入大鼠右肢的外关和足三里穴位约3mm处,用电针治疗仪进行电刺激,型号为G6805-II。对大鼠施用连续波电针治疗(20Hz,1mA)30min,每天1次,连续3周。
1.3 评定指标
1.3.1 组织收集和保存 所有大鼠均采集样本,取材时间点为大鼠在行为测试后第2天,禁食过夜。将血样保存在冰上,直到将样品在4°C下以3000g离心10min。将大脑迅速从颅骨中取出并用冰冷的PBS清洗,立即将左侧海马和额叶、顶叶-颞叶皮层从全脑中分离出,并储存在-80℃冰箱。见图1。

图1 大鼠脑的大体病理图
1.3.2 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT-mediated dUTP nick-end labeling,TUNEL)染色 TUNEL用于原位染色DNA末端以检测基因组DNA片段。脑组织切片在暗室中用100μL末端脱氧转移酶反应混合物覆盖2h。在荧光显微镜(DM6000B,徕卡公司,德国)下检测到同侧丘脑的荧光信号。
1.3.3 莫里斯水迷宫(Morris water maze,MWM)测试 3组干预后进行MWM测试。3组在连续5d的定向导航测试中,将小鼠置于充满水(24±1°C)的圆形水池(直径:120cm,高度:40cm)中以找到一个隐藏的平台(水面以下1.0cm)。小鼠在80s内找到平台则试验终止,让小鼠在平台上休息10s。否则,如果80s后没有找到平台,则人工引导小鼠到平台20s进行学习。为了评估空间学习记忆功能,记录小鼠潜伏期时间及探测试验时间。
1.3.4 Nissl染色 腹腔注射10%水合氯醛后,从大鼠中分离脑组织并在4°C下在4% PFA中保存3d。将组织进行石蜡包埋并切成30μm厚的切片用于免疫荧光显微镜检查。脑切片用于尼氏染色和免疫荧光。Nissl染色切片经受0.1%甲酚紫(默克公司,美国)以评估缺血体积和完整神经元的数量。
1.3.5 蛋白质印迹 通过免疫印迹法测定丘脑中tau、p-Tauser396、p-Tause404和凋亡相关蛋白的水平。在深度麻醉下,用50ml冰冷的0.9%盐水对大鼠进行心内灌注。立即在冰上分离左侧丘脑并在细胞裂解缓冲液中匀浆。在10%十二烷基硫酸钠-聚丙烯酰胺凝胶上从每个样品中分离出相同数量的蛋白质,电泳转移到聚偏二氟乙烯膜(默克公司,美国)上。在室温下用5%脱脂牛奶的tris缓冲盐水和0.2% Tween 20 (TBST)封闭膜90min,与兔抗大鼠β-肌动蛋白多克隆抗体(1:1200,Sigma公司)在4°C下孵育过夜,小鼠抗大鼠tau抗体(1:1000,Millipore公司,美国)和 兔抗大鼠p-tau-396单克隆抗体、兔抗大鼠凋亡蛋白Bcl2相关X蛋白(Bcl2 Associated X Protein,Bax)多克隆抗体、兔抗大鼠B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)多克隆抗体和兔抗大鼠B细胞淋巴瘤/白血病-xl基因(B cell lymphoma/leukemia - XL gene,Bcl-xL)多克隆抗体(1:1000,Abcam 公司,美国)和 小鼠抗大鼠GAPDH单克隆抗体(1:1000)。二抗是抗小鼠 IgG(1:2000,上海碧云天公司)或抗兔 IgG(1:2000)。用 TBST 彻底洗涤后,将膜与 HRP 偶联的二抗(1:1000, 7042P2, CST,美国)一起孵育。使用增强的化学发光试剂盒在放射自显影胶片上观察免疫反应性。
1.3.6 免疫组织化学 切片用85℃ 0.01 M 柠檬酸盐缓冲液(pH 6.0)预处理3min,用3%过氧化氢处理15min,在0.1M PBS中冲洗3次。用5%正常山羊血清和1%牛血清白蛋白在室温下封闭2h后,将切片与一抗在4°C下孵育过夜,在相同的PBS中冲洗3次。使用小鼠-兔ABC试剂盒(PK-6200)检测信号。使用了以下一抗:小鼠抗NeuN(1:1000,Abcam 公司,美国)、小鼠抗tau(1:500,Abcam 公司,美国)、兔抗p-Tauser396 -p-Tause404(1:500,ab30665, 英国剑桥实验室)和兔抗 CD68(1:100,Abcam公司,美国)。在4°C下24h。使用荧光显微镜分析组织。
2 结果
2.1 TUNEL染色凋亡分析 通过TUNEL染色分析大鼠脑组织中神经细胞凋亡,MCAO组TUNEL染色阳性细胞凋亡率较对照组升高(P<0.05),观察组TUNEL染色阳性细胞凋亡率较MCAO组降低(P<0.05)。见图2,表1。
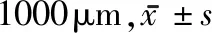
表1 3组大鼠丘脑中TUNEL阳性细胞凋亡情况比较
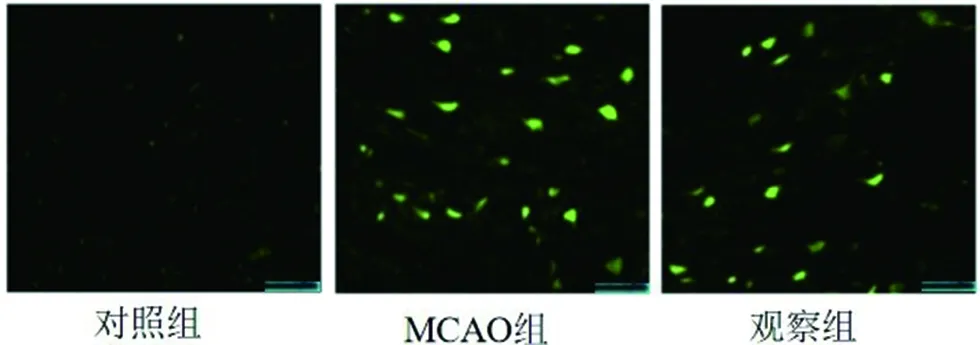
图2 TUNEL分析(注:标尺为绿色在右下侧,为100μm)
2.2 MWM行为测试 通过MWM测量大鼠的认知功能,MCAO组发现隐藏平台的潜伏期较对照组增加(P<0.05),探测试验时间减少(P<0.05),观察组发现隐藏平台的潜伏期时间较MCAO组减少(P<0.05),探测试验时间增加(P<0.05)。见表2。
表2 3组MWM行为测试结果比较
2.3 凋亡蛋白表达分析 MCAO组Bax蛋白表达较对照组升高(P<0.05),观察组Bax蛋白表达较MCAO组降低(P<0.05),MCAO组Bcl-2和Bcl-xL蛋白表达较对照组降低(P<0.05),观察组Bcl-2和Bcl-xL蛋白表达较MCAO组升高(P<0.05)。见图3,表3。
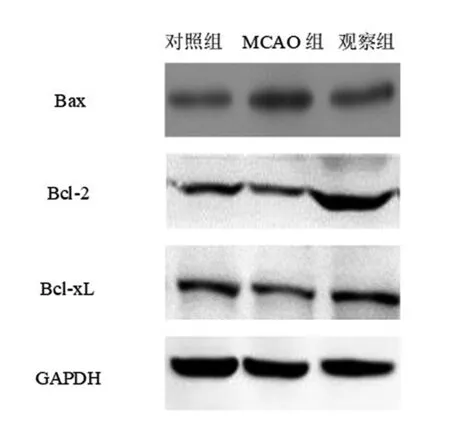
图3 3组蛋白印迹分析凋亡蛋白表达比较

表3 3组凋亡蛋白表达比较
2.4 大鼠神经损伤情况 通过尼氏染色和免疫荧光染色分析大鼠丘脑组织中神经元损伤情况,MCAO组完整神经元数量较对照组减少(P<0.05),观察组完整神经元数量较MCAO增多(P<0.05),MCAO组CD68的平均光密度较对照组升高(P<0.05),观察组CD68的平均光密度较MCAO组降低(P<0.05)。见图4,表4。
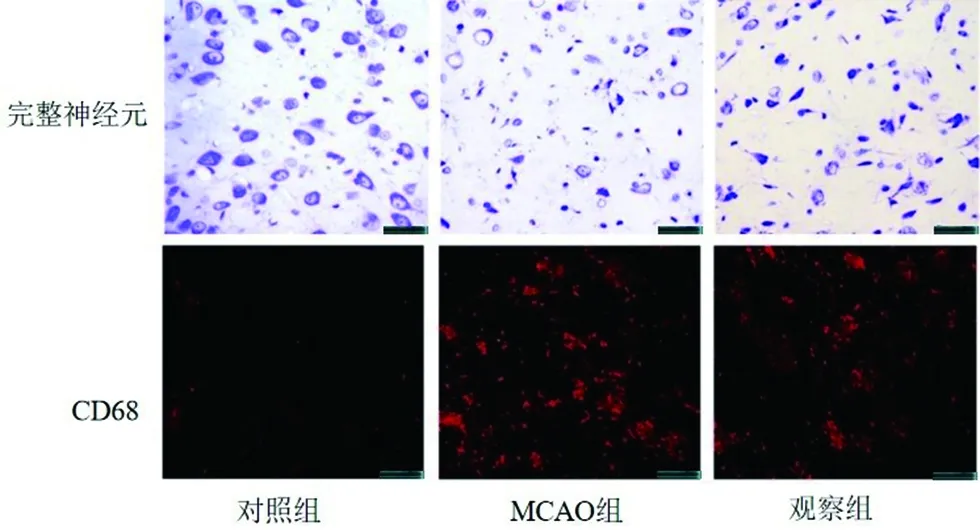
图4 3组尼氏和免疫荧光染色情况比较

表4 3组尼氏染色和免疫荧光染色结果比较
2.5 tau磷酸化水平 通过免疫组织化学检测大鼠海马中p-Tau丝氨酸396/404的磷酸化蛋白水平,MCAO组p-Tauser396和p-Tause404磷酸化表达较对照组升高(P<0.05),观察组p-Tauser396和p-Tause404磷酸化表达较MCAO组降低(P<0.05)。见图5,表5。
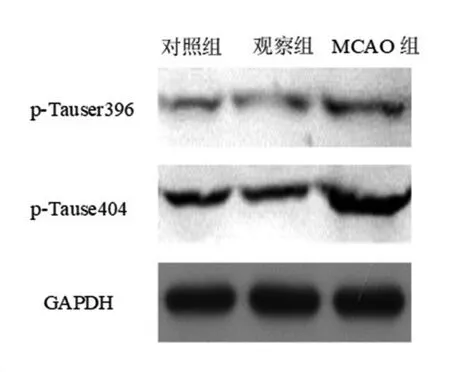
图5 3组p-Tau396/404磷酸化表达比较

表5 3组p-Tau396/404磷酸化水平比较
2.6 tau蛋白 通过蛋白印迹分析大鼠海马中tau蛋白的变化,MCAO组p-Tauser396、p-Tause404和总tau蛋白表达较对照组升高(P<0.05),观察组p-Tauser396、p-Tause404和总tau蛋白表达较MCAO组降低(P<0.05)。见图6,表6。
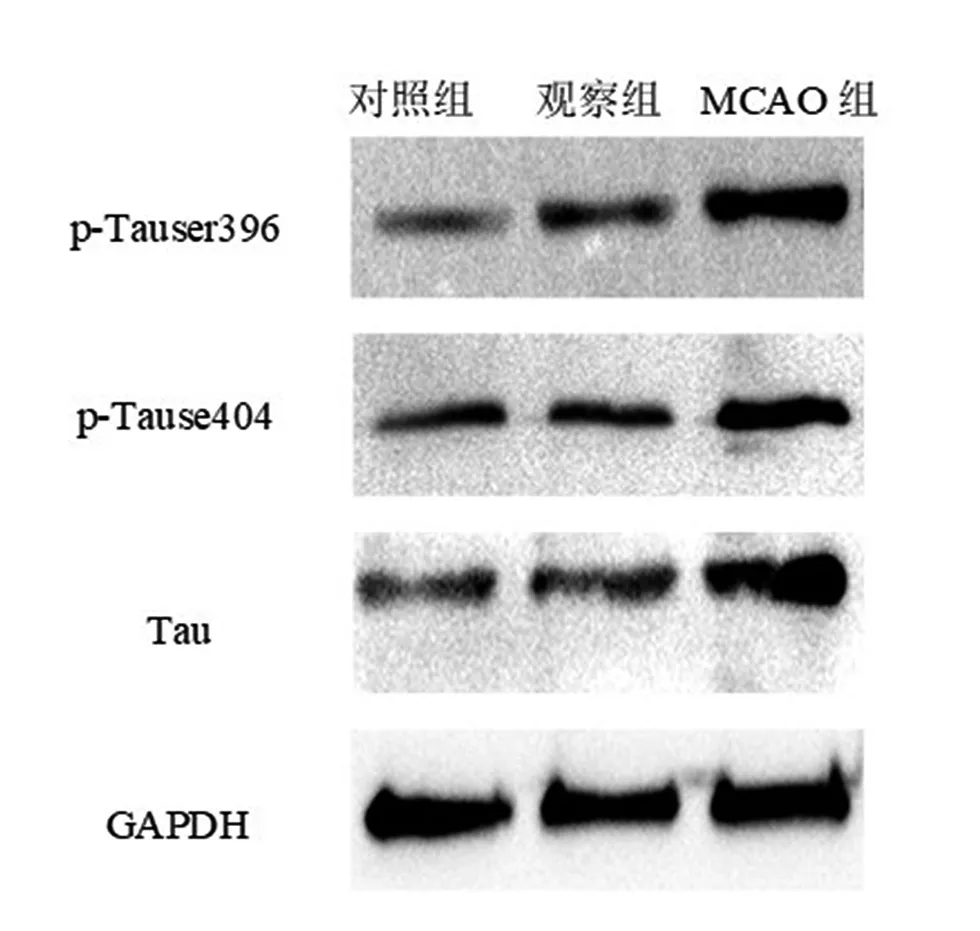
图6 3组蛋白印迹分析tau蛋白表达比较

表6 3组tau蛋白表达情况比较
3 讨论
tau蛋白是一种微管相关蛋白,是细胞骨架的重要组成部分,是确保微管系统完整性和稳定性的关键[15]。大脑皮层和海马中由过度磷酸化的tau蛋白组成的细胞外Aβ斑块和细胞内神经原纤维缠结(neurofibrillary tangles,NFTs)是卒中后脑部的典型病理变化。tau过度磷酸化导致的NFT沉积被认为是卒中后脑损伤的早期病理标志[16]。微管相关蛋白tau在中枢神经系统神经元的轴突中高度表达。其与微管的结合可以维持微管的稳定性,这对于维持正常的轴突质运输和突触可塑性具有重要意义[17]。过度磷酸化tau蛋白的聚集或其降解紊乱有助于NFT在神经元中的沉积。NFTs在神经元树突棘的沉积介导Aβ的神经毒性,导致树突棘的缺失和形态改变,直接导致神经元突触功能受损。随着全球老龄化的加速,卒中的患病率正在增加。因此,为这种破坏性疾病找到一种有效的治疗方法至关重要且紧迫。预防tau过度磷酸化和自噬降解缺陷导致的神经原纤维缠结积累可能是一种有前途的卒中后干预策略[18]。因此,本研究对tau蛋白和tau相关蛋白表达进行了测试。
电针是在传统针灸和电疗的基础上,作为预防和治疗卒中的工具[19]。电刺激针疗法能有效改善缺血性脑卒中患者上肢运动功能,与单纯手法针刺相比,效果更好。研究显示,缺血性卒中的电针治疗可能是从影响神经递质与基因表达,血流变、干预蛋白或其他超微结构等方面来体现其疗效的。此外,已有文献表明,其机制可能是通过抑制炎症反应,对血清蛋白的改变,改善脑血流,保护神经元等方面实现。临床上,电针治疗通常通过卒中患者的外关和足三里穴位进行。多项实验研究表明,在穴位外关或足三里处进行电针刺激可为脑缺血大鼠提供神经保护作用。在中枢神经系统中,星形胶质细胞和小胶质细胞在调节炎症反应中发挥重要的功能作用。星形胶质细胞和小胶质细胞的激活与神经损伤和神经退行性疾病引起的神经炎症密切相关。研究表明,针灸可通过多种途径对卒中产生保护作用,如减轻神经炎症、抑制Aβ蛋白沉积和tau过度磷酸化、增强葡萄糖脑代谢、减少氧化应激和抑制神经元凋亡[20]。来自临床试验和动物研究的越来越多的证据表明,针灸可能是治疗卒中后认知功能障碍的潜在方法。
本研究表明,如果在MCAO的早期和症状前阶段开始跑轮运动,可能会观察到跑轮运动对MCAO病理学的保护和有益作用。笔者分析认为,在卒中患者死后的大脑、血浆和脑脊液中存在不同程度的代谢紊乱。代谢特征受损与认知评分、海马体积和皮质厚度以及总tau和p-tau生物标志物相关,有氧运动对tau磷酸化和相关tau激酶具有保护作用。此外,运动可以改变参与多种代谢途径的代谢物的平均浓度。
本研究还表明,MCAO大鼠记忆缺陷会导致行为表现受损,这表明MCAO模型组中受损的空间记忆使使用标记点找到平台变得更加困难,并表明该模型是成功的。然而,大鼠进行电针联合跑轮训练后导致逃逸潜伏期显著降低,这表明电针联合跑台训练能够改善MCAO大鼠的认知能力并改善了记忆缺陷。同时,电针联合跑轮训练通过增强MCAO大鼠的学习和记忆能力有效地改善了MWM性能。笔者分析认为,电针联合跑轮训练治疗是可以减轻tau过度磷酸化导致的记忆缺陷和神经损伤,MCAO大鼠认知功能的改善可能与其tau磷酸化和tau蛋白水平有关,包括丝氨酸396和404在内的多个位点的异常磷酸化。因此,电针与跑台训练两种疗法联合应用能改善局灶性脑缺血后大鼠神经功能,同时减小脑梗死体积,减少细胞凋亡率,减轻局灶性脑缺血引起的内质网应激反应。电针联合跑轮运动导致MCAO大鼠海马和皮质中p-Tauser396和404的减少,即tau磷酸化的减少可能是MCAO大鼠认知功能改善的部分原因。
综上所述,本研究结果表明,电针联合跑轮训练可通过抑制tau过度磷酸化和tau蛋白表达减少MCAO大鼠脑神经损伤并改善学习和记忆能力。
