以黄白汤为例探讨中药袋装汤剂保存期限*
2023-03-02梁烜赫李飞龙
梁烜赫,李飞龙,程 钢
(安徽医科大学第一附属医院药剂科·国家中医药管理局中药化学三级实验室,安徽 合肥 230022)
汤剂是我国独特的临床用药剂型之一,随着中药现代化的不断发展,传统的煎药方式(砂锅煎煮法)正逐渐被先进的煎药设备取代,越来越多的医院和代煎机构采用中药煎药包装机代煎汤剂,不仅保证了有效成分的煎出率[1],还方便了患者,深受医患双方的欢迎。《医疗机构中药煎药室管理规范》《中药机器煎药规范》等规章制度和技术标准对中药汤剂煎药环境、饮片、器具及煎煮加水量、火候、时间、次数等作出了更全面、更严格的规定。由于中药方剂煎煮的复杂性,目前患者更倾向于选择由医院煎药室或煎药机构代煎,以期获得更好的煎药质量和临床疗效[2]。但袋装汤剂不添加任何防腐剂,包装后是否符合卫生学规定,保质期如何确定,尚无明确标准[3]。微生物污染是中药汤剂质量不合格的主要潜在原因[4-5],袋装汤剂在不同储存条件下微生物限度考察的相关报道较少[6-8]。在此,以某三甲综合医院常用的弱抑菌性中药汤剂黄白汤为研究对象,采用自动煎药机煎制灌装,并根据2020年版《中国药典(四部)》相关规定建立了微生物限度检查方法[9],连续考察4周并分析结果,以期为临床代煎中药汤剂的生产、质控和储存提供一定参考。现报道如下。
1 仪器、试药与菌株
1.1 仪器
YJD200-GL型十功能自动煎药机、YB50-250E型中药汤剂包装机(北京东华原医疗设备有限责任公司);BSC-1604ⅡA2型生物安全柜、SW-CJ-100型超洁净工作台(苏州安泰空气技术有限公司);SPL-150型生化培养箱、MJL-150型霉菌培养箱(天津市莱玻特瑞仪器设备有限公司);YQX-LS-75-SⅡ型立式压力蒸汽灭菌器、DH64型电热恒温干燥箱(上海博讯实业有限公司);101-3型干燥箱、XW-80A型涡旋混匀仪(上海实验仪器总厂)。
1.2 培养基与稀释液
胰酪大豆胨琼脂培养基(TSA,批号为20171221-00)、胰酪大豆胨液体培养基(批号为20171218-00)、沙氏葡萄糖琼脂培养基(SDA,批号为20180316-00)、沙氏葡萄糖液体培养基(批号为20171129-00)、麦康凯琼脂培养基(批号为20180112-00)、麦康凯液体培养基(批号为20171208-00),均购自杭州微生物试剂有限公司;pH 7.0无菌氯化钠-蛋白胨缓冲液(北京路桥技术有限责任公司,批号为20170910)。
1.3 菌种
金黄色葡萄球菌Staphylococcus aureus[CMCC(B)26003]、大肠埃希菌Escherichia coli[CMCC(B)44102]、铜 绿 假 单 胞 菌Pseudomonas aeruginosa[CMCC(F)10104]、枯 草 芽 孢 杆 菌Bacillus subtilis[CMCC(B)63501]、白 色 念 珠 菌Candida albicans[CMCC(F)98001]、黑曲霉Aspergillusniger[CMCC(F)98003],均由中国医学菌种保藏中心提供。
2 方法与结果
2.1 袋装汤剂样品制备
取15剂黄白汤剂量药材饮片(黄芪450 g,白芍150 g,甘草45 g),置自动煎药机煎煮锅中,加水没过药面浸泡30~40 min,按设定程序进行一煎、二煎(均100℃煎煮30 min),合并煎液,程序升温(最终升至115℃)灭菌10 min,灌封,即得袋装汤剂约30袋(每袋150 mL)。先用3台煎药机(A,B,C)分别制备批号依次为190320-1,190320-2,190320-3(简写为A1,B1,C1)的样品,5 d后再用此3台煎药机(经注水煮沸灭菌冲洗后)分别制备批号分别为190325-1,190325-2,190325-3(简写为A2,B2,C2)的样品。
2.2 微生物限度检查法的适用性试验
2.2.1 菌液制备
金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、大肠埃希菌:取4种菌的新鲜培养物,分别接种至胰酪大豆胨液体培养基,30~35℃培养24 h后,再用无菌生理盐水稀释成适宜浓度接种量的菌悬液。
白色念珠菌:取该菌新鲜培养物接种至沙氏葡萄糖液体培养基,20~25℃培养3 d后,再用无菌生理盐水制成适宜浓度接种量的菌悬液。
黑曲霉:取该菌新鲜培养物接种至SDA,20~25℃培养7 d后,加入无菌生理盐水(含0.05%聚山梨酯80)3~5 mL,洗脱孢子,并制成适宜浓度接种量的孢子悬液。
2.2.2 供试液制备
取B2样品2袋,每袋100 mL,混匀取10 mL,加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL,混匀,即得1∶10(V/V)供试液。
2.2.3 验证试验
需氧菌总数计数方法适用性试验:试验分为试验组、供试品对照组(供试液+培养基)、菌液对照组(菌液+培养基)。试验组,取供试液9.9 mL,共5份,分别置灭菌试管中,加2.2.1项下相应试验菌菌液各0.1 mL,使含菌量≤100 cfu/mL,混匀,从试管中各取1 mL注入平皿(规格为1 mL,下同),每种试验菌平行制备2个平皿,立即倾注40~45℃的TSA,混匀,待凝,35℃培养3 d,测定试验组菌落数。同法测定供试品对照组和菌液对照组的菌落数。
霉菌和酵母菌总数计数方法适用性试验:分组同上。试验组,取供试液9.9 mL,共2份,分别置灭菌试管中,加2.2.1项下相应试验菌菌液各0.1mL,使含菌量≤100cfu/mL,混匀,从试管中各取1 mL注入平皿,每种试验菌平行制备2个平皿,立即倾注40~45℃的SDA,混匀,待凝,25℃培养5 d,测定试验组菌落数。同法测定供试品对照组和菌液对照组的菌落数。
回收试验结果计算:回收比=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数。平行试验3次,结果均符合规定(根据2020年版《中国药典(四部)》,应介于0.5~2.0),见表1(黑曲霉与白色念珠菌列中,“/”前后数据分别为使用TSA/SDA培养基获得)。
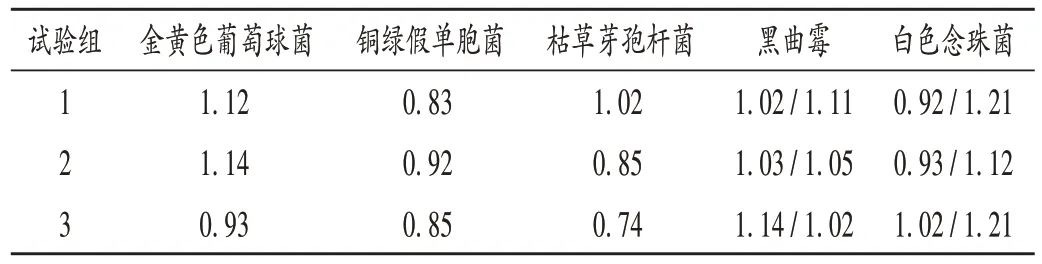
表1 各验证菌的回收比结果(n=3)Tab.1 Results of the recovery ratio of each validation bacteria(n=3)
控制菌检查方法适用性试验(常规法):试验组,取供试液10 mL,加入1 mL大肠埃希菌菌液(含菌量<100 cfu/mL),接种至胰酪大豆胨液体培养基100 mL;阴性对照组,取0.9%无菌氯化钠溶液10 mL接种至胰酪大豆胨液体培养基100 mL;阳性对照组,取1 mL大肠埃希菌菌液(含菌量<100 cfu/mL)接种至胰酪大豆胨液体培养基100 mL;供试品组,取供试液10 mL,接种至胰酪大豆胨液体培养基100 mL。以上各组在35℃培养24 h后,取1 mL培养物,分别加入100 mL麦康凯液体培养基,43℃培养24 h,然后将培养物划线接种于麦康凯琼脂培养基平板上,35℃培养3 d,结果仅试验组及阳性对照组检出大肠埃希菌。
验证试验:结果表明,黄白汤的需氧菌总数计数、霉菌酵母菌总数计数均可采用平皿法(1∶10供试液,1 mL/皿);控制菌检查可采用常规法。
2.3 不同储存条件下的样品微生物限度考察
样品储存:取2.1项下各批次样品,两等分,每份15袋,分别储存于冰箱冷藏室[(5±3)℃]和常温留样室[(25±2)℃]。
微生物限度检查:取以上各批次不同储存条件的留样品,平行2份,每周按以上已验证的方法进行微生物限度检查,结果见表2至表4。
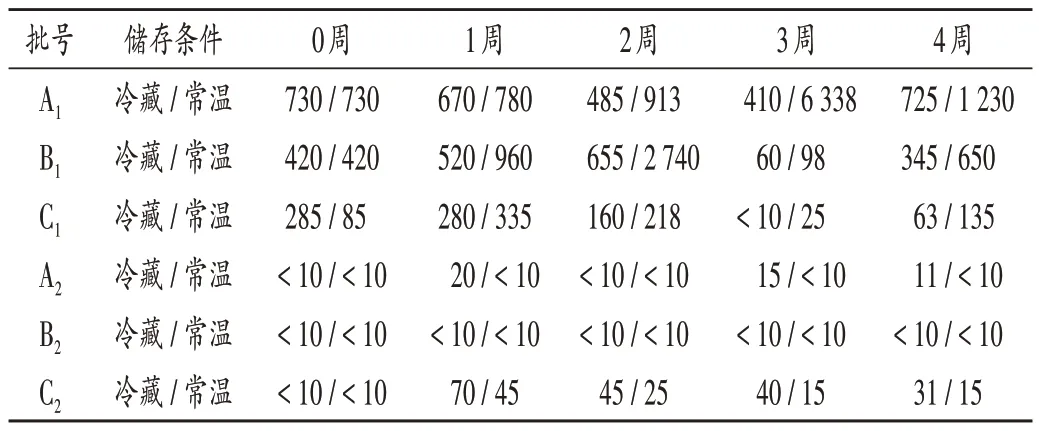
表2 需氧菌培养结果(cfu/mL,n=2)Tab.2 Culture results of aerobic bacteria(cfu/mL,n=2)

表3 霉菌和酵母菌培养结果(cfu/mL,n=2)Tab.3 Culture results of mold and yeast(cfu/mL,n=2)

表4 控制菌(大肠埃希菌)检出情况(n=2)Tab.4 Detection of control bacteria(Escherichia coli,n=2)
2.4 不同储存条件下的黄白汤性状和p H考察
取以上各批次不同储存条件的留样品,每周观察性状(溶液颜色与沉淀)变化并测定pH,结果见表5。

表5 性状观察及p H测定结果Tab.5 Results of character observation and p H measurement
3 讨论
3.1 卫生学标准与考察期限设定
中药袋装汤剂作为医疗机构药学服务的一种延伸产品,应有其相应的产品标准,结合2020年版《中国药典(四部)》通则1107和代煎汤剂的加工过程,更适用于口服给药液体制剂的微生物限度标准,即需氧菌总数≤10 cfu/mL,霉菌酵母菌总数≤10 cfu/mL,大肠埃希菌(控制菌)不得检出;医师给患者开的处方一般是1~2周用量,极少超过4周,故本试验中设定时间为4周。
3.2 研究对象选择
本试验中选用弱抑菌性的黄白汤作为研究对象,因为弱/非抑菌性的汤剂在制备过程中易被设备、空气中的细菌污染,储存过程中细菌繁殖不受干扰,能更真实地反映汤剂被细菌污染的情况和储存期内菌落数的变化规律。所得微生物考察结果可推及其他组成类似或弱/非抑菌性的中药汤剂,并可能扩展至有较强抑菌性的汤剂,有较大的涵盖范围。
3.3 三批样品初始菌落数不合格原因
按本试验中确定的汤剂微生物限度标准,A1,B1,C1样品需氧菌、霉菌和酵母菌初始菌落数均不合格,菌落数从大到小依次为A1>B1>C1。推测原因为,A煎药机和B煎药机较常用,煎药后有药液残留在煎药机储药桶与各连接管路中,导致细菌滋生,在本次煎药前未进行彻底有效的清洗灭菌;3批样品中,A1及B1为2台煎药机共用1台包装机经先后顺序灌装封口所得,A1批药液先通过灌装管道,起到了清洗作用,故B1批初始菌落数较A1批少;C1批药液为另一台不常用煎药机制备,可能因为机器内部细菌污染少,故初始菌落数最少。煎药机经清洗灭菌后所得3批样品的微生物限度检查初始值均合格,验证了上述推测。
3.4 结果分析
微生物污染药品具有随机性和分布不均匀性[10],因前3批样品初始菌落数不合格,难以确定每袋留样产品的初始染菌数,故在4周内冷藏和常温储存的样品微生物计数结果未呈现明显规律。但可见,5℃储存的A1,B1,C1样品,4周内菌落数一直稳定在同一个数量级范围内(<103),其中C1批样品的需氧菌总数在第3,4周呈下降趋势,且已不能检出霉菌和酵母菌。表明冷藏条件不利于微生物的生长繁殖,有利于袋装汤剂的储存。而常温(25℃)保存的A1,B1,C1样品均曾出现某个时间点菌落数骤增(超过初始值8~10倍)现象,说明常温条件不利于样品储存。A2、B2、C23批样品初始菌落数均合格,在4周内冷藏和常温储存微生物限度的检查结果也均合格,但冷藏的A2,C2批样品出现了需氧菌总数增加现象,结合pH测定结果推测原因为,A2,C2样品的初始pH均较低,低温可能利于某些适宜酸性环境的微生物生长繁殖,而这些微生物的生长或代谢产物促使药液pH再降低。但由于药液初始值合格,冷藏储存的菌落数始终未超过药典口服溶液剂规定限度。
随储存时间的延长,6批样品的pH总体呈下降趋势,下降程度与微生物限度检查结果呈一定程度正相关,pH下降越多,菌落数检出越多。B2样品常温和冷藏4周内始终未检出菌落,其pH降幅最小。
新配制样品溶液颜色为黄色,6批冷藏储存样品的颜色均无变化,未出现沉淀;6批常温储存的样品中除B2溶液颜色无变化外,其余5批的颜色均在4周内呈现不同程度加深,A1,B1,C1样品第2周后出现较多的絮状物沉淀。推测原因是微生物生长代谢使汤剂质量发生变化[11]。
3.5 反思
因此前未对医院中药代煎汤剂的微生物限度进行过考察和分析,对煎药机清洁消毒的必要性认识不足,在制备前3批样品前未对煎药机进行彻底清洗消毒,导致其不符合药典口服溶液剂微生物限度标准。经分析,染菌的主要原因有两点,一是煎药机下部储药桶煎药后未及时清洗及擦干,残留药液导致细菌滋生;二是包装机下部的灌装软管和灌封切口在前一天药液灌装后未彻底洗净并消毒,管道内残留药液导致细菌滋生致使第二天灌装的汤剂染菌[12-13]。随后做了煎药机清洗验证试验,结合文献[14-15]制订了煎药机标准清洁规程,包括每天煎药完成后彻底清理设备,对煎药机进行刷锅、煮水、排液(清理管道)和外部清理;对包装机内壁进行清理,管道内外冲刷,将灌装口的药渍内外清理干净。待清理完成后,打水袋,直至澄清。此外,还应重视影响微生物限度的其他因素,如人员卫生、物料卫生、煎药室环境卫生及空气消毒等[16],通过管理制度化、操作标准化来保证汤剂的质量。
袋装汤剂的染菌问题可能是各家医院及代煎机构普遍存在的共性问题,特别是煎药频次不高的代煎机构,由于机器闲置,不连续运行,煎药染菌概率更大。本研究中的前3批样品染菌现象对于缺少微生物限度检验条件的煎药机构有一定参考价值。
本研究也存在一定不足,如选方较单一,仅考察了弱/非抑菌性中药汤剂的保存期,以后还将继续考察动物类、蜜炙类、含油质种子类等易染菌中药汤剂的卫生学有效期,以补充完善代煎汤剂的储存期管理;另外,在汤剂稳定性的考察中,还应加入有效成分/指标性成分的含量测定,使储存期的确定更科学、更合理。
3.6 小结
综上所述,本试验中成功建立了黄白汤的微生物限度检查方法,并根据4周的考察结果暂定了代煎中药汤剂的储存条件和保存期限。对于菌落初始值合格的袋装汤剂,常温和冷藏储存均可保证4周内卫生学合格,冷藏更有利于维持汤剂的初始性状;对于菌落初始值不合格的袋装汤剂,冷藏储存明显优于常温储存,细菌生长缓慢,不易快速繁殖,可保证袋装汤剂质量。鉴于目前大多数医院和机构代煎中药汤剂并未开展微生物质控,煎药机的清洗效果不能有效验证,因而无法知晓袋装汤剂卫生学是否合格及被细菌污染的程度,建议袋装汤剂的储存方式以冷藏为主,时间不宜超过4周。
