儿童后肾腺瘤的MSCT影像表现
2023-03-01陈希文吴慧莹陈臻张笑春
陈希文 吴慧莹 陈臻 张笑春
广州市妇女儿童医疗中心医学影像部放射科(广东 广州 510623)
后肾腺瘤(metanephric adenoma,MA) 约占原发性肾脏肿瘤的0.2%[1],是一种罕见的肾上皮来源良性肿瘤,易误诊为肾母细胞瘤、非典型血管平滑肌脂肪瘤等。笔者回顾性分析我院经手术病理证实的6例儿童MA,结合临床症状、实验室检查与病理,总结其MSCT影像特点,提高对本病的认识与诊断水平。
1 资料与方法
1.1 一般资料收集2016年6月至2021年1月广州市妇女儿童医疗中心经手术病理证实的6例MA 患儿临床、病理及影像资料,女孩5例,男孩1例,年龄17个月~6岁,年龄中位数3岁。4例因腹部症状就诊发现,包括1例右侧腹股沟斜疝,1例尿频,1例间断排便费力,1例右下腹痛,2例无临床症状,行超声体检意外发现。所有病例均未合并先天畸形和疾病,无家族遗传史。实验室检查红细胞增高3例(范围4.69~4.92×1012/L,正常参考值范围4.0~4.5×1012/L)。6例患儿肿物切除术后常规随访2月~3年,未发现肿瘤复发、转移(见表1)。

表1 6例儿童MA临床资料
1.2 MSCT检查方法采用飞利浦Brilliance 64排或东芝Aquilion 16排螺旋CT机,管电压120kV,管电流自动条件,扫描层5mm,层间隔5mm,螺距1.0,矩阵512×512。检查前不配合患儿予以10%水合氯醛0.5mL/kg口服镇静。增强扫描采用非离子对比剂碘海醇1~3mL/kg,注射流率1~2mL/s。在注射对比剂30 s行皮质期、60 s行实质期、300 s行排泄期增强扫描。所有原始数据传输至CT设备后处理工作站进行处理。
1.3 图像分析所有CT图像由2名放射科副主任医师在不知道临床及病理结果情况下独立阅片,重点分析肿瘤位置、大小、形态、密度、强化方式、与邻近组织关系、是否转移,当意见不一致时经讨论达成一致。
1.4 病理分析手术肿物标本置入10%福尔马林溶液中固定,先大体观察,后常规石蜡切片,苏木精-伊红(HE)染色,再显微镜下观察肿瘤病理学特点,并行免疫组化检查,包括CD57、Vim、CK7、EMA、WT-1。
2 结 果
2.1 6例儿童MA肿瘤部位、形态、大小6例MA均为单肾单发,左肾4例(4/6;66.7%),右肾2例(2/6;33.3%),外生突出肾轮廓5例,位于肾中上部与中下部各2例,肾上、下极各1例。形态规则5例,其中类圆形3例,卵圆形2例,不规则分叶1例,均边缘清晰。肿瘤最大直径2.7~8.1 cm,最大直径中位数3.65cm。
2.2 6例儿童MA特点与CT表现实性3例(图1),囊实性3例(图2),后者伴斑点状钙化1例。本组MA实性成分平扫密度高于肾实质(图1A,图2A),CT值43~56HU,增强扫描皮质期CT值52~67HU,实质期CT值79~97HU,排泄期CT值89~119HU。囊性成分平扫CT值12~19HU,呈条片状(图2A),增强各期未见强化。所有MA与周围组织分界清晰。2例因肿瘤压迫集合系统继发轻度肾积水,均未见转移。

图1 女,6岁,右肾实性MA。图1A:CT平扫轴位,右肾下极类圆形稍高密度实性肿物,突出于肾轮廓,病灶密度稍高于肾实质,CT值50HU;图1B~图1D)CT增强扫描轴位,肿物与正常肾实质分界清晰,呈渐进性强化,各期增强肿瘤强化程度均低于肾实质;图1E:大体标本示肿物呈实性均质,切面灰白;图1F:病理示大小形态较一致的肿瘤细胞形成小腺泡状或小管状,胞质稀少,细胞排列紧密,可见小灶钙化(HE×100)。图2 女,2岁1个月,左肾囊实性MA。图2A:CT平扫轴位,左肾中下部不规则囊实性肿物,突出于肾轮廓,病灶密度不均匀,可见囊变坏死(白箭);图2B~图2D)CT增强扫描轴位,肿物与正常肾实质分界清晰,实性成分呈渐进性强化,囊变坏死未见强化,各期增强肿瘤强化程度均低于肾实质;图2E:大体标本示肿物不均质,可见条片状坏死,切面偏红;图2F:镜下病理示大小较一致性的肿瘤细胞形成小腺泡、小管样结构,胞质稀少,细胞排列疏松,局部间质纤维化或水肿,可见小灶钙化(HE×100)。
2.3 6例儿童MA病理表现大体标本3例为均质实性肿物,3例为囊实性,内可见坏死。显微镜下可见大小一致肿瘤细胞形成小腺泡、小管样结构,胞质稀少,伴少量砂砾体样钙化,新生毛细血管稀少。免疫组化:6例 CD57(+),5例Vim(+),3例CK7 (+),3例EMA(-),2例WT-1(+)。
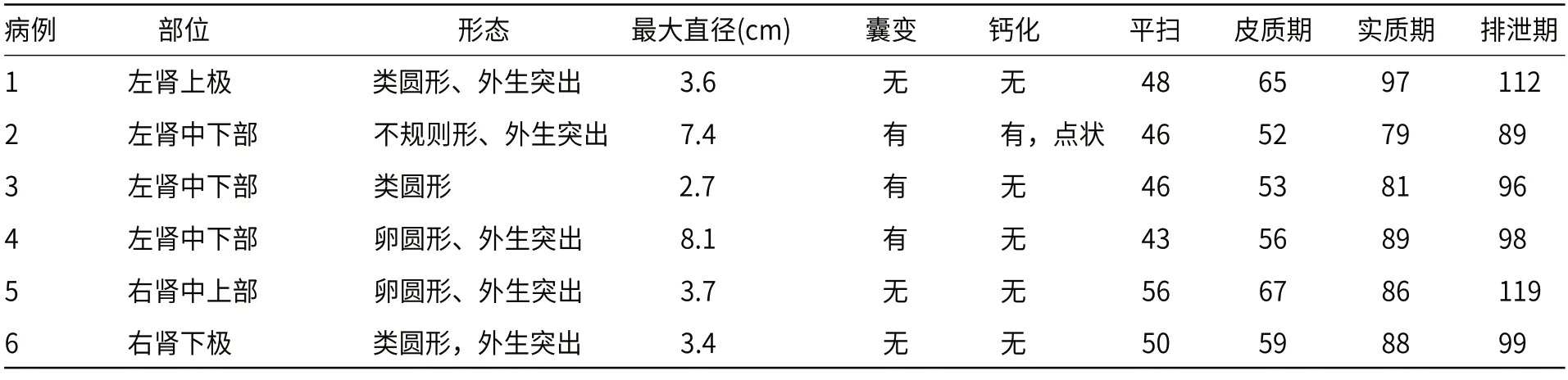
表2 6例儿童MA特点与CT表现
3 讨 论
MA是一种罕见的具特殊组织病理学特性的良性肾肿瘤[1],1979年由Bove首次报道[2],1992年由Brisigotti正式命名[3]。MA的组织学起源仍具争议,但大多数学者认为其起源于后Wilms瘤。2004年WHO把MA列为后肾性肿瘤的一种亚型[4]。MA可发生在任何年龄,年龄范围为15个月~83岁,高峰年龄为50-69岁[5]。女性发病率较男性高,约2.6:1,成年女性更多见,儿童病例较少[4]。本组病例均为儿童,年龄中位数3岁,女性发病率较以往报道高,与样本量较少有关。
大多数MA患者无明显临床症状与体征,多体检偶然发现,少数患者因扪及腹部肿块、腹痛、血尿发现。大约10%~12%的MA患者伴有红细胞增多症[5],其发生率高于其他肾脏肿瘤。据Yoshioka 报道这可能与MA产生促红细胞生成素与多种细胞因子相关[6],当肿瘤切除后红细胞增多亦随之消失。本研究中有3例患儿出现红细胞增多症,术后复查血常规红细胞水平恢复正常。最新研究表明,大约80%~90%的MA与BRAF V600E基因突变相关,这种突变以及BRAF VE1抗体有助于肿瘤的诊断[7]。尽管MA被认为是良性肿瘤,仍有恶变个案报道,因此术后对MA患者进行定期影像学随访具有重要意义。本组6例患儿,肿物切除术后常规随访2月~3年,尚未发现肿瘤复发、转移。
MA多为发生于一侧肾的单发肿瘤,亦可出现单肾多发病灶甚至双肾同时受累[8,9]。本组6例MA均为单发。MA直径差异较大,最大直径可达7.7cm[6],本组肿瘤最大直径范围2.7~8.1 cm,最大直径中位数3.65cm。83.3%的MA位于肾皮质边缘,发生部位浅表肿瘤易向外突出于肾脏成为MA的主要特征之一[8]。本组5例MA外生突出于肾轮廓,笔者认为除发生部位浅表之外,肿瘤直径较大亦成为向外生长的原因之一。
与肿瘤周围肾实质相比,CT平扫MA呈等密度或均匀稍高密度,这种密度差异被认为是MA的特征影像学表现之一[10,11],20%的肿瘤可伴有钙化[11]。Fielding等[12]指出MA高密度改变与透明基质钙化、沙粒样钙化以及肿瘤细胞高核浆比有关。本组6例CT平扫实性成分密度均高于肾实质,术后病理证实肿瘤内含砂砾体样钙化灶。病理上MA囊变可能与肿瘤间质相关,当间质较少肿瘤细胞排列紧密时,表现为密度均匀的实性肿物,当间质水肿明显肿瘤细胞排列疏松时,表现为不均匀的囊实性肿物(肿瘤的囊变在位置、大小是否有特点,如果有可以在结果中单列)。CT增强MA表现为轻中度渐进性强化,各期强化程度均低于肾实质,更能凸显肿瘤与周围组织清晰分界。MA乏血供肿瘤特征与病理组织学改变相关,显微镜下MA表现为小腺泡状、小管状排列的肿瘤细胞,间质局部纤维化或水肿,新生毛细血管稀少。但MA中乳头状细胞增生且富含更多新生毛细血管时,则肿物可明显强化[11]。
儿童MA主要与以下肾肿瘤鉴别,包括肾母细胞瘤、横纹肌样瘤、透明细胞肉瘤、血管平滑肌脂肪瘤:(1)肾母细胞瘤:临床发病高峰为2~3岁,多发生于一侧肾上极,瘤体直径在4cm以上,多为圆形,有假包膜,CT平扫肿瘤密度不均匀,易发生坏死、出血、囊变,钙化少见,增强扫描呈不均匀强化,假包膜可见强化,残余肾强化呈新月形、半环形的“边缘征”,可合并癌栓与远隔转移[13];(2)横纹肌样瘤:男孩多见,80%患儿小于2岁,临床表现为血尿和高钙血症,瘤体直径在9~11cm以上,中心常有出血、坏死呈融冰状,70%病例肿瘤包膜下有新月形出血(积液),增强扫描不均匀强化,实性成分中度强化,可合并远隔转移[14];(3)透明细胞肉瘤:男女发病比例为2:1,以7月~6岁儿童多见,高峰年龄为2岁,40%早期可发生骨转移,临床上最具特征性,瘤体大,25%病例发生钙化,CT增强扫描肿瘤实性成分明显,与坏死灶形成虎斑状条纹具有特征性[15];(4)血管平滑肌脂肪瘤:80%儿童合并结节性硬化,多为双肾多发小结节灶,边界清晰,CT平扫呈等低混合密度,可见脂肪成分,肿瘤早期强化表现快进快出一过性明显强化特点[16]。
综上所述,儿童MA的MSCT影像表现具有以下特点:单发,位于肾皮质,易突出于肾轮廓,可为实性或囊实性,平扫实性成分密度高于周围肾实质,增强扫描呈轻中度渐进性强化,合并红细胞增多症,可提高诊断效能,最终确诊需病理支持。
