急性缺血性脑卒中合并糖尿病患者胰高血糖素样肽-1、瘦素水平与其预后的关系
2023-03-01沈俊明党怀辉
沈俊明,党怀辉
河南省周口市商水县中医院脑病一科,河南周口 466100
急性缺血性脑卒中(AIS)和糖尿病均为临床常见病,糖尿病与AIS的发生存在密切联系,二者同时发病风险较高。AIS合并糖尿病患者具有病情重且复杂、预后差等特点,其诊断、治疗一直是临床研究的重点。探寻可评估AIS合并糖尿病患者预后的相关指标对指导临床治疗、评估患者预后有重要意义。胰高血糖素样肽-1(GLP-1)是由肠道细胞分泌的一种激素,具有调节血糖、改善胰岛素抵抗、通过减少促炎性因子保护神经中枢等作用[1]。瘦素(LEP)是一种调节机体能量平衡和代谢稳态的多肽,其与糖尿病及诸多心脑血管疾病的发生有密切联系[2]。GLP-1、LEP与AIS及糖尿病的发生、病情进展均存在密切联系,但目前有关GLP-1、LEP水平与AIS合并糖尿病患者预后关系的研究尚少。基于此,本研究探讨了GLP-1、LEP水平与AIS合并糖尿病患者预后的相关性,以期为临床治疗、预后评估提供指导,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2018年1月至2020年6月本院收治的82例AIS合并糖尿病患者作为研究对象,均持续随访6个月,使用改良Rankin量表(mRS)评估患者神经功能恢复状况,根据mRS评分将其分为预后良好组(mRS评分≤2分,50例)和预后不良组(mRS评分>2分,32例)。预后良好组中男27例,女23例;年龄47~68岁,平均(59.14±3.85)岁。预后不良组中男18例,女14例;年龄45~69岁,平均(59.22±3.97)岁。另选取同期就诊于本院的40例单纯AIS且预后良好患者为对照组,其中男22例,女18例;年龄44~68岁,平均(59.09±3.77)岁。3组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。(1)纳入标准:①临床资料完整;②AIS诊断符合《中国急性缺血性脑卒中诊治指南2018》[3]中的相关标准;③糖尿病诊断符合《中国2型糖尿病防治指南(2017年版)》[4]中的相关诊断标准;④首发AIS,且发病24 h内入院就诊;⑤发病前不存在认知功能障碍,生活可自理;⑥不存在影响患者预后的其他因素;⑦对照组入院后血糖检查未见异常。(2)排除标准:①伴有严重糖尿病并发症;②伴有其他脑血管疾病、颅脑创伤史、颅脑手术史;③1型糖尿病;④合并恶性肿瘤;⑤合并严重感染;⑥合并精神障碍;⑦合并免疫功能障碍或近期服用过免疫抑制剂;⑧合并甲状腺疾病;⑨合并凝血功能障碍;⑩出现影响患者康复的相关疾病或患者因其他原因死亡。所有患者均自愿参与本研究,并签署知情同意书,本研究已获本院医学伦理委员会批准。
1.2仪器与试剂 GLP-1、LEP水平检测所需酶联免疫吸附试验(ELISA)试剂盒均购自合肥莱尔生物科技有限公司。检测所需酶标仪购自安图实验仪器(郑州)有限公司,注册证编号:豫械注准20192220576。
1.3方法 (1)所有患者入院后,由神经内科医生使用美国国立卫生研究院卒中量表(NIHSS)评估患者神经功能缺损情况,该量表共包含12个问题,评分0~42分,评分越高表明患者神经功能缺损越严重;(2)入院后,采集所有患者空腹静脉血,采用ELISA检测GLP-1、LEP水平。
1.4观察指标 (1)比较3组患者NIHSS评分和GLP-1、LEP水平;(2)分析AIS合并糖尿病患者GLP-1、LEP水平与NIHSS评分的相关性;(3)分析GLP-1、LEP水平在评估AIS合并糖尿病患者预后中的价值。
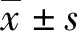
2 结 果
2.13组患者NIHSS评分和GLP-1、LEP水平比较 预后良好组和预后不良组的NIHSS评分、LEP水平高于对照组,GLP-1水平低于对照组,且预后不良组的NIHSS评分、LEP水平高于预后良好组,GLP-1水平低于预后良好组,差异均有统计学意义(P<0.05)。见表1。
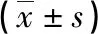
表1 3组患者NIHSS评分和GLP-1、LEP水平比较
2.2AIS合并糖尿病患者GLP-1、LEP水平与NIHSS评分相关性分析 AIS合并糖尿病患者GLP-1水平与NIHSS评分呈负相关(r=-0.637,P<0.001);LEP水平与NIHSS评分呈正相关(r=0.695,P<0.001)。
2.3GLP-1、LEP水平评估AIS合并糖尿病患者预后的ROC曲线 绘制GLP-1水平评估AIS合并糖尿病患者预后的ROC曲线,曲线下面积(AUC)为0.810(95%CI:0.711~0.909),GLP-1水平的最佳临界值为1.485 pmol/L,此时约登指数最大(0.586),灵敏度为90.6%,特异度为68.0%;绘制LEP水平评估AIS合并糖尿病患者预后的ROC曲线,AUC为0.870(95%CI:0.791~0.948),LEP水平的最佳临界值为7.830 ng/L,此时约登指数最大(0.675),灵敏度为87.5%,特异度为80.0%。见图1、2。
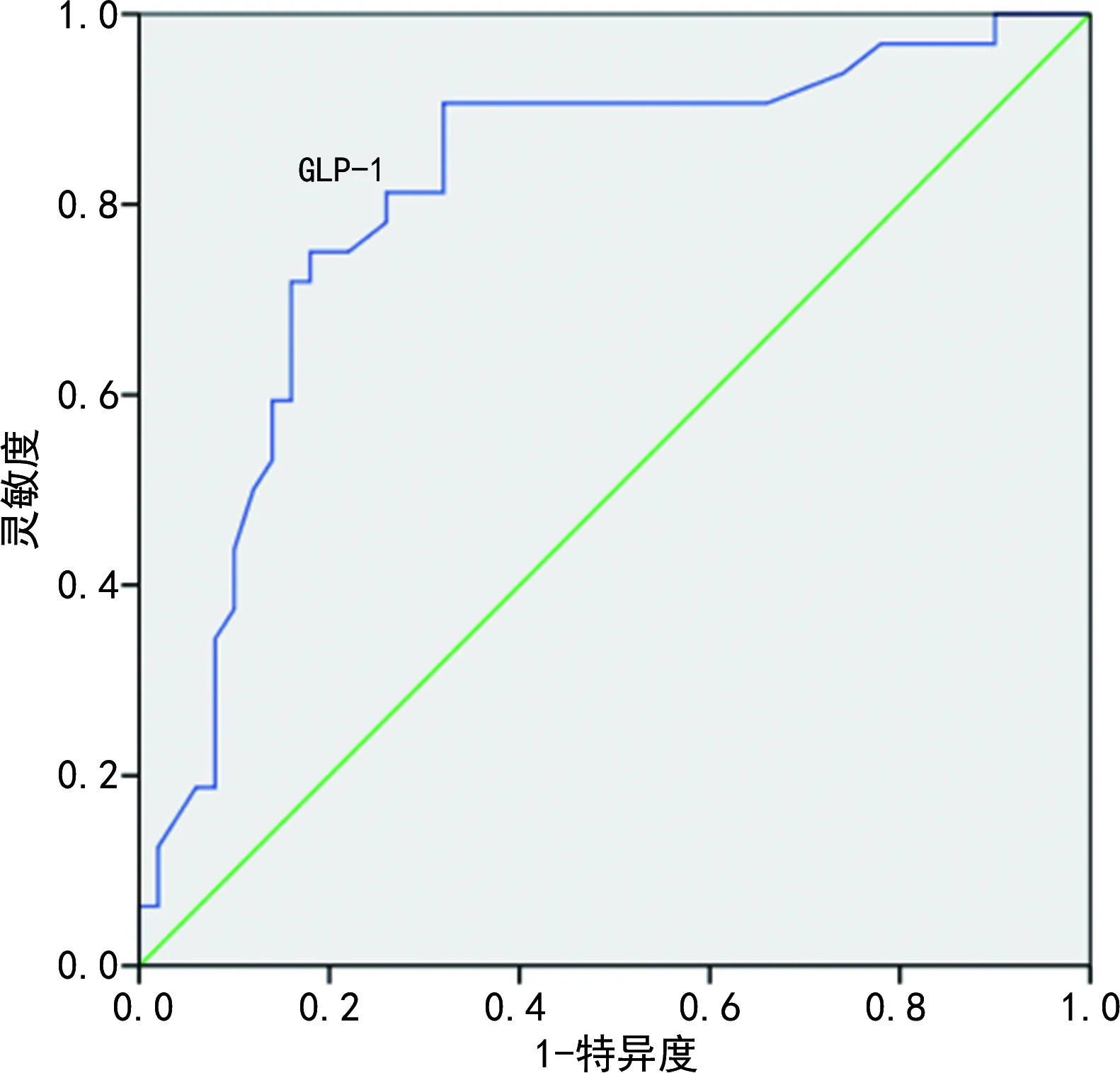
图1 GLP-1水平评估AIS合并糖尿病患者预后的ROC曲线

图2 LEP水平评估AIS合并糖尿病患者预后的ROC曲线
3 讨 论
目前研究已证实,糖尿病是导致AIS发生的独立危险因素,糖尿病患者机体长期处于高血糖状态,高血糖会导致血管内皮细胞损伤,细胞间黏附分子-1(ICAM-1)表达上升,血管内皮细胞进行无氧呼吸产生过多乳酸,大量乳酸积累会破坏血管内皮细胞的正常内环境及生理代谢,导致细胞凋亡、坏死,最终导致AIS发生及病情恶化,而AIS会导致下丘脑调节功能受损,大量炎症因子释放,皮质醇、胰高血糖素水平上升,而胰岛素合成能力和胰岛素灵敏度均下降,进一步加重血糖代谢紊乱,最终形成恶性循环,导致患者病情快速恶化[5]。随着基础研究的不断深入,细胞因子与AIS合并糖尿病发生、病情进展、预后之间的关系越来越受到临床研究人员关注,但目前尚缺乏评估AIS合并糖尿病患者预后的明确指标。
本研究探讨了AIS合并糖尿病患者GLP-1、LEP水平与其预后的关系,结果显示,预后良好组和预后不良组的NIHSS评分、LEP水平高于对照组,而GLP-1水平低于对照组,且预后不良组的NIHSS评分、LEP水平高于预后良好组,GLP-1水平低于预后良好组,这表明GLP-1、LEP水平与AIS合并糖尿病患者预后存在密切联系,GLP-1水平越低,LEP水平越高,AIS合并糖尿病患者的预后越差,残疾、死亡风险越高。不仅如此, GLP-1、LEP水平与AIS合并糖尿病患者神经功能损伤也存在密切联系,GLP-1水平与NIHSS评分呈负相关(P<0.05),而LEP水平与NIHSS评分呈正相关(P<0.05)。GLP-1是由肠道L细胞分泌的一种胃肠激素,有促进胰岛素分泌、抑制胰高血糖素分泌的作用,可有效调节糖脂代谢,保护胰岛β细胞。王爱国等[6]研究结果显示,GLP-1在2型糖尿病合并代谢综合征患者中呈低表达,且患者血糖、血脂水平越高,GLP-1水平越低。不仅如此,GLP-1与脑血管疾病也存在密切关系,张军艳等[7]研究结果显示,GLP-1可通过激活p38丝裂原活化蛋白激酶通路减轻小鼠大脑缺血再灌注损伤。AIS合并糖尿病患者由于存在中枢神经损伤,GLP-1合成受到影响,GLP-1水平下降又会引发血糖代谢紊乱,导致患者血糖水平上升,而高血糖可引发血管内皮损伤,导致AIS患者神经功能损伤加重,最终形成恶性循环,导致不良预后发生[8]。LEP是由脂肪细胞分泌的一种激素,具有改善糖脂代谢、抑制机体进食的作用,可通过减少脂肪合成,减轻患者体质量。2型糖尿病患者LEP水平较健康人有明显上升,这主要与患者存在胰岛素抵抗有关,高胰岛素水平会刺激脂肪组织合成、分泌LEP,且糖尿病患者还多存在LEP抵抗,LEP并不能发挥其正常生理作用,这会导致LEP水平持续上升[9]。而高水平LEP会导致大量炎性介质释放、血小板聚集,引发血管内皮损伤,故心脑血管疾病患者也存在LEP高表达,且LEP 水平越高表明心脑血管疾病患者病情越严重,预后越差[10]。本研究还探讨了GLP-1、LEP水平在评估AIS合并糖尿病患者预后中的作用,ROC曲线分析结果显示,GLP-1、LEP水平的最佳临界值分别为1.485 pmol/L、7.830 ng/L,灵敏度分别为90.6%、87.5%,特异度分别为68.0%、80.0%,这表明GLP-1、LEP水平可作为评估AIS合并糖尿病患者预后的相关指标。但此次研究纳入样本数量较少,GLP-1、LEP水平的最佳临界值仍需大规模数据验证。
综上所述,不同预后AIS合并糖尿病患者GLP-1、LEP水平存在明显差异,GLP-1、LEP可作为评估患者不良预后的重要指标。
