基于炎症指标和肿瘤标志物的肺癌治疗前远处转移预测模型的构建和验证
2023-03-01牛英豪郭秀娟冯军花张金艳
颜 晰,牛英豪,郭秀娟,冯军花,李 燕,张金艳△
1.河北医科大学第四医院检验科,河北石家庄 050011;2.河北医科大学第一医院临床生物样本库,河北石家庄 050031
肺癌是世界范围内最常见的恶性肿瘤[1],其侵袭性强,易发生远处转移,导致病死率居高不下[2-3]。研究表明,肺癌患者在诊断阶段的转移率达75%,尽早识别转移对肺癌患者临床治疗方案的选择及改善预后具有重要意义[4]。目前,临床评估实体肿瘤转移通常依赖于CT、MRI和PET-CT等影像学技术,但这些项目价格昂贵且不能频繁检查,在一定程度上限制了其应用。此外,基因检测、液体活检等有很大应用前景,但检测技术要求较高,且这方面的研究主要集中于肺癌与对照之间的差异或与临床病理特征的关系,而对于肺癌转移方面的研究较少。基于血液标本的生物标志物检测作为一种无创、快速的检查手段,已广泛用于肿瘤的诊断及疗效评估[5-6]。有研究发现,炎症可通过多种机制促进肿瘤的发生和转移,是目前癌症治疗研究的靶点和热点[7-9]。本研究通过对肺癌患者临床资料、外周血炎症因子及肿瘤标志物进行对比分析,建立多项指标联合预测模型,探讨其在肺癌发生远处转移中的应用价值,以期为肺癌的临床诊疗提供一定依据。
1 资料与方法
1.1一般资料 选取2019年3月至2021年5月确诊为肺癌的初治患者231例为研究对象,其中河北医科大学第四医院收治的133例肺癌患者作为研究组,河北医科大学第一医院收治的98例肺癌患者作为验证组。纳入标准:所有患者经组织病理学或细胞学检查诊断为肺癌,无其他恶性肿瘤病史,且未接受过抗肿瘤治疗。排除标准:既往诊断为肺癌且已接受过肺癌相关药物或手术治疗者;发生严重感染,或使用免疫抑制剂等药物者;有其他系统恶性肿瘤史者;病历信息不完整者。根据美国癌症联合委员会第8版指南明确患者是否发生远处转移,将研究组患者分为转移组和未转移组。转移组为在首次就诊期间确诊为肺癌且已有远处转移的患者,包括脑转移、骨转移、肝转移、肾转移、多发转移等;未转移组为在首次就诊期间确诊为肺癌但未发现远处转移的患者。研究组和验证组性别、年龄、病理类型、临床分期比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经河北医科大学第四医院和河北医科大学第一医院医学伦理委员会批准,所有研究对象均知情同意。
1.2方法
1.2.1标本采集 所有患者在接受治疗前空腹采集静脉血约2 mL,注入含乙二胺四乙酸二钾(EDTA-K2)的抗凝管中,用于血常规检测,约4 mL注入生化促凝管中,静置凝固后,以4 000 r/min离心10 min,用于肿瘤标志物及细胞因子检测。
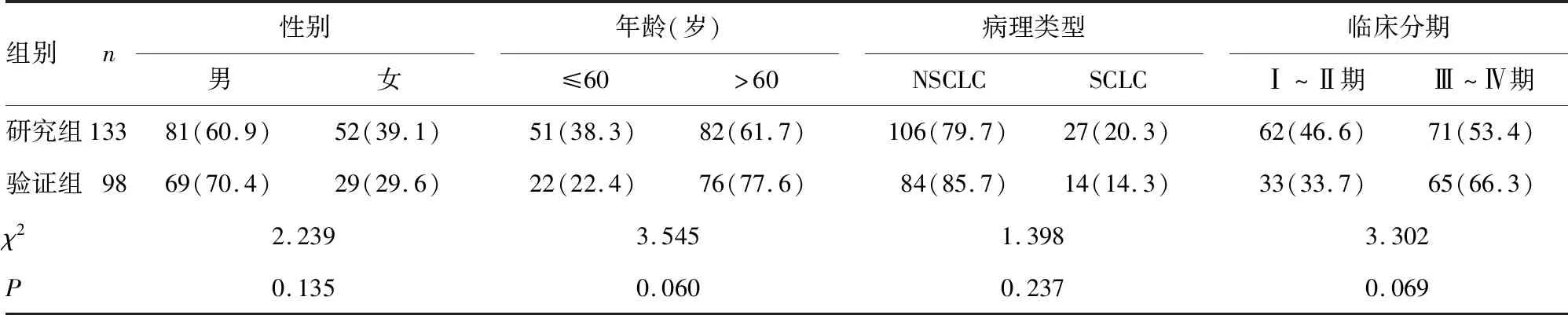
表1 研究组与验证组肺癌临床、病理特征比较[n(%)]
1.2.2检测方法 采用美国贝克曼库尔特公司LH750全自动血细胞分析仪进行血常规分析并计算中性粒细胞/淋巴细胞比值(NLR)(NLR=外周血中性粒细胞计数/淋巴细胞计数);采用德国罗氏公司Cobase 602全自动电化学发光分析仪及相应配套试剂(电化学发光法)检测血清癌胚抗原(CEA)、细胞角蛋白19片段(CYFRA21-1)、神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(ProGRP)、鳞状细胞癌抗原(SCC)水平;采用美国贝克曼库尔特公司Navios流式细胞仪和青岛瑞斯凯尔生物科技有限公司细胞因子试剂盒检测白细胞介素(IL)-1β、IL-6和IL-8水平。所有检测严格按照标准操作规程及相应试剂说明书执行,检测仪器状态稳定,室内质控在控。各项检测结果参考区间按照卫生行业标准或试剂盒说明书执行。
1.3统计学处理 采用SPSS25.0统计软件进行数据处理及统计分析。呈非正态分布的计量资料以M(P25,P75)表示,组间比较采用两独立样本Mann-WhitneyU检验;计数资料以例数或百分率表示,组间比较采用χ2检验;将两组比较差异有统计学意义的指标纳入多因素Logistic回归分析,筛选出肺癌远处转移的独立危险因子建立联合预测模型,并分别绘制各指标及预测模型的受试者工作特征(ROC)曲线,以Youden指数最大时的阈值作为最佳截断值,计算相应灵敏度、特异度、准确率,分析检测指标及模型对肺癌发生转移的预测价值,最后在验证组中验证模型效能。以P<0.05为差异有统计学意义。
2 结 果
2.1转移组和未转移组基线资料和实验室检查指标比较 转移组与未转移组年龄分布比较,差异有统计学意义(P<0.05);转移组与未转移组性别、病理类型分布比较,差异无统计学意义(P>0.05)。转移组NLR、IL-8、CEA、NSE及CYFRA21-1水平均明显高于未转移组,差异有统计学意义(P<0.05);而未转移组与转移组IL-1β、IL-6、ProGRP及SCC水平比较,差异无统计学意义(P>0.05)。见表2。
2.2肺癌远处转移的危险因素分析 将患者年龄、NLR、IL-8、CEA、NSE、CYFRA21-1纳入多因素Logistic回归分析,结果显示,IL-8、CYFRA21-1水平升高是肺癌发生远处转移的独立危险因素(P<0.05)。见表3。
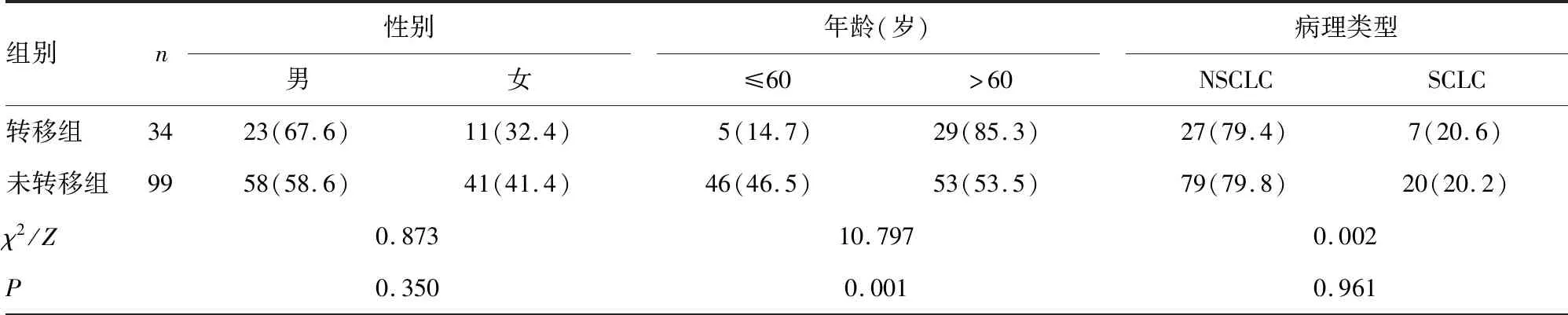
表2 转移组和未转移组基线资料和实验室检查指标比较[n(%)或M(P25,P75)]
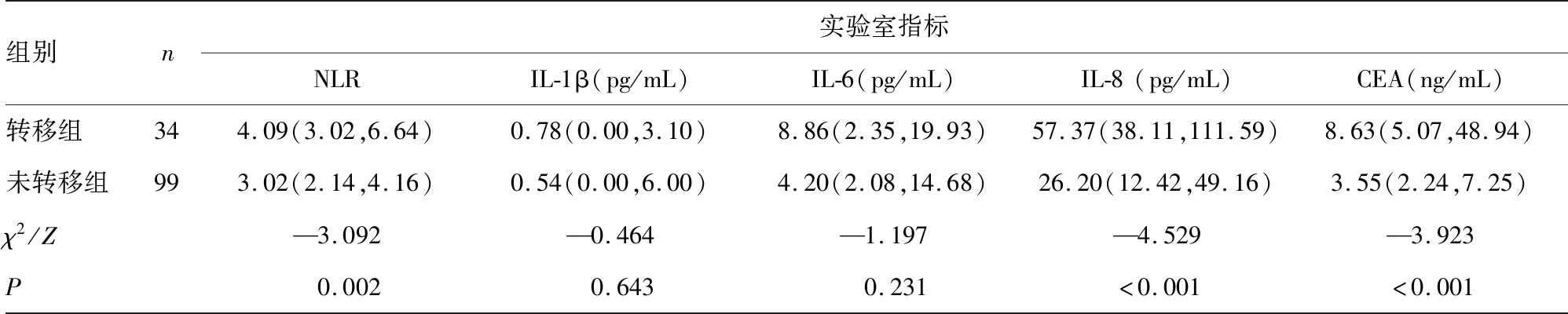
组别n实验室指标NLRIL-1β(pg/mL)IL-6(pg/mL)IL-8(pg/mL)CEA(ng/mL)转移组344.09(3.02,6.64)0.78(0.00,3.10)8.86(2.35,19.93)57.37(38.11,111.59)8.63(5.07,48.94)未转移组993.02(2.14,4.16)0.54(0.00,6.00)4.20(2.08,14.68)26.20(12.42,49.16)3.55(2.24,7.25)χ2/Z—3.092—0.464—1.197—4.529—3.923P0.0020.6430.231<0.001<0.001
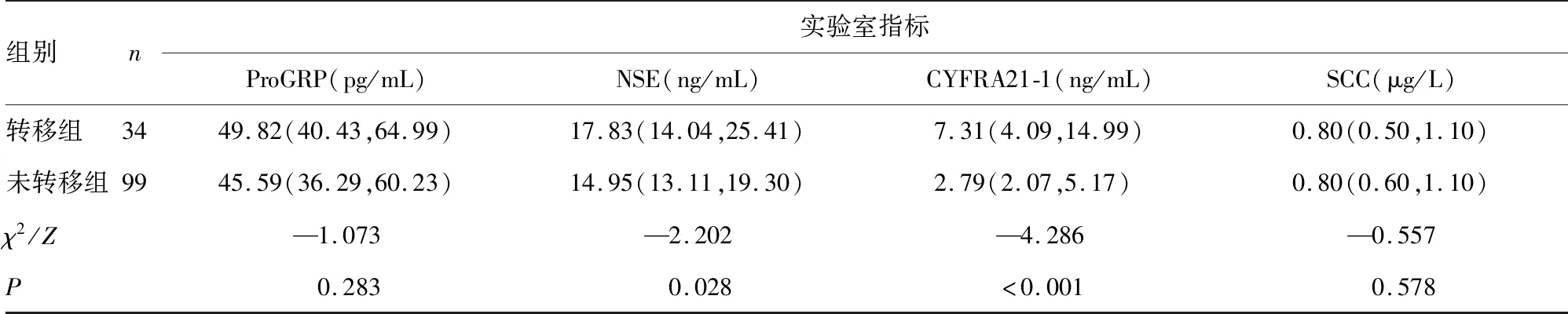
组别n实验室指标ProGRP(pg/mL)NSE(ng/mL)CYFRA21-1(ng/mL)SCC(μg/L)转移组3449.82(40.43,64.99)17.83(14.04,25.41)7.31(4.09,14.99)0.80(0.50,1.10)未转移组9945.59(36.29,60.23)14.95(13.11,19.30)2.79(2.07,5.17)0.80(0.60,1.10)χ2/Z—1.073—2.202—4.286—0.557P0.2830.028<0.0010.578
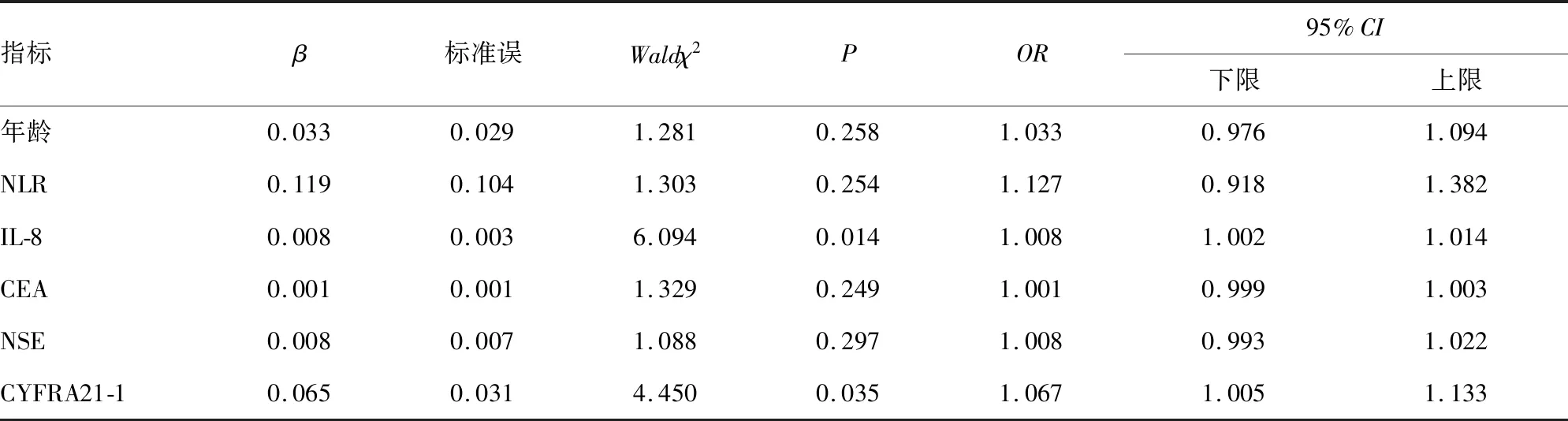
表3 肺癌远处转移的多因素Logistic回归分析
2.3肺癌远处转移预测模型的建立及验证 将研究组IL-8、CYFRA21-1两个变量纳入二元Logistic回归方程,建立肺癌远处转移回归模型,Logit(P)=-2.217+0.008XIL-8+0.081XCYFRA21-1,Hosmer-Lemeshow统计量为14.371,P=0.073,认为此模型拟合优度较高。此外,分别以IL-8、CYFRA21-1及二者联合模型预测肺癌远处转移的概率值绘制ROC曲线,以Youden指数最大时的阈值作为最佳截断值,计算相应灵敏度、特异度、准确率。研究组IL-8、CYFRA21-1的最佳截断值分别为30.76 pg/mL和4.00 ng/mL,单项指标及二者联合的预测模型对肺癌远处转移均有统计学意义(P<0.05),且AUC均在0.70以上,诊断价值较高,在验证组中观察到了与研究组相似的结果;IL-8、CYFRA21-1联合模型在研究组和验证组中的AUC分别为0.820和0.744,准确率分别为78.9%和72.4%,均高于IL-8、CYFRA21-1单项检测,见表4及图1、2。
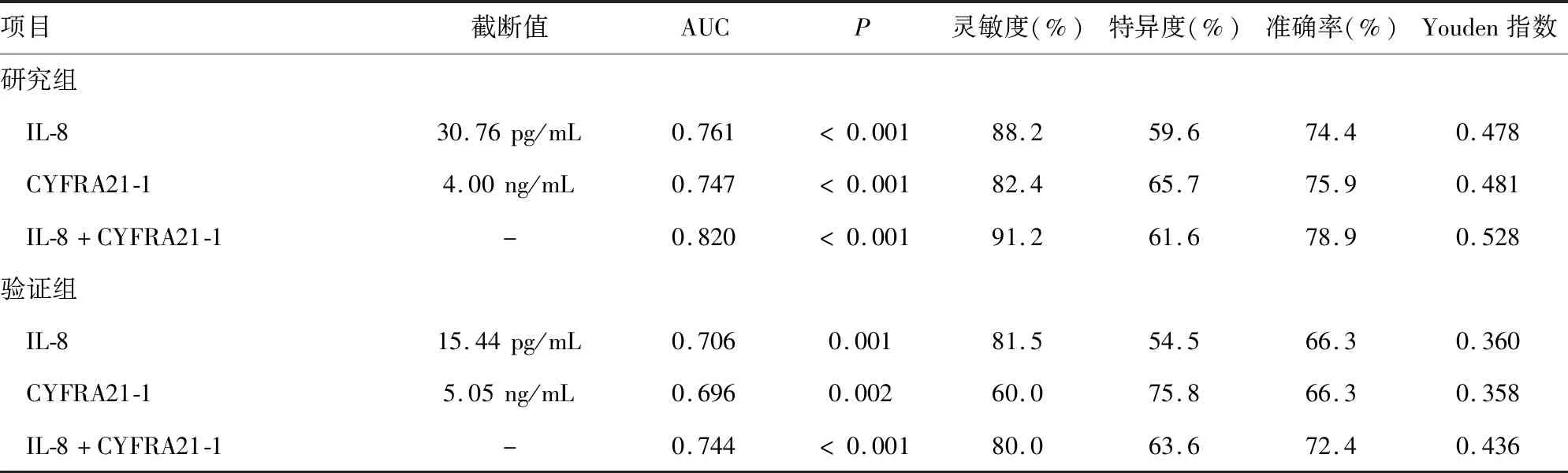
表4 血清IL-8、CYFRA21-1及二者联合检测预测肺癌远处转移的效能
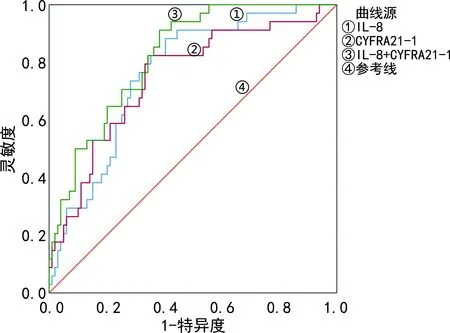
图1 研究组血清IL-8、CYFRA21-1单独及联合检测预测肺癌远处转移的ROC曲线
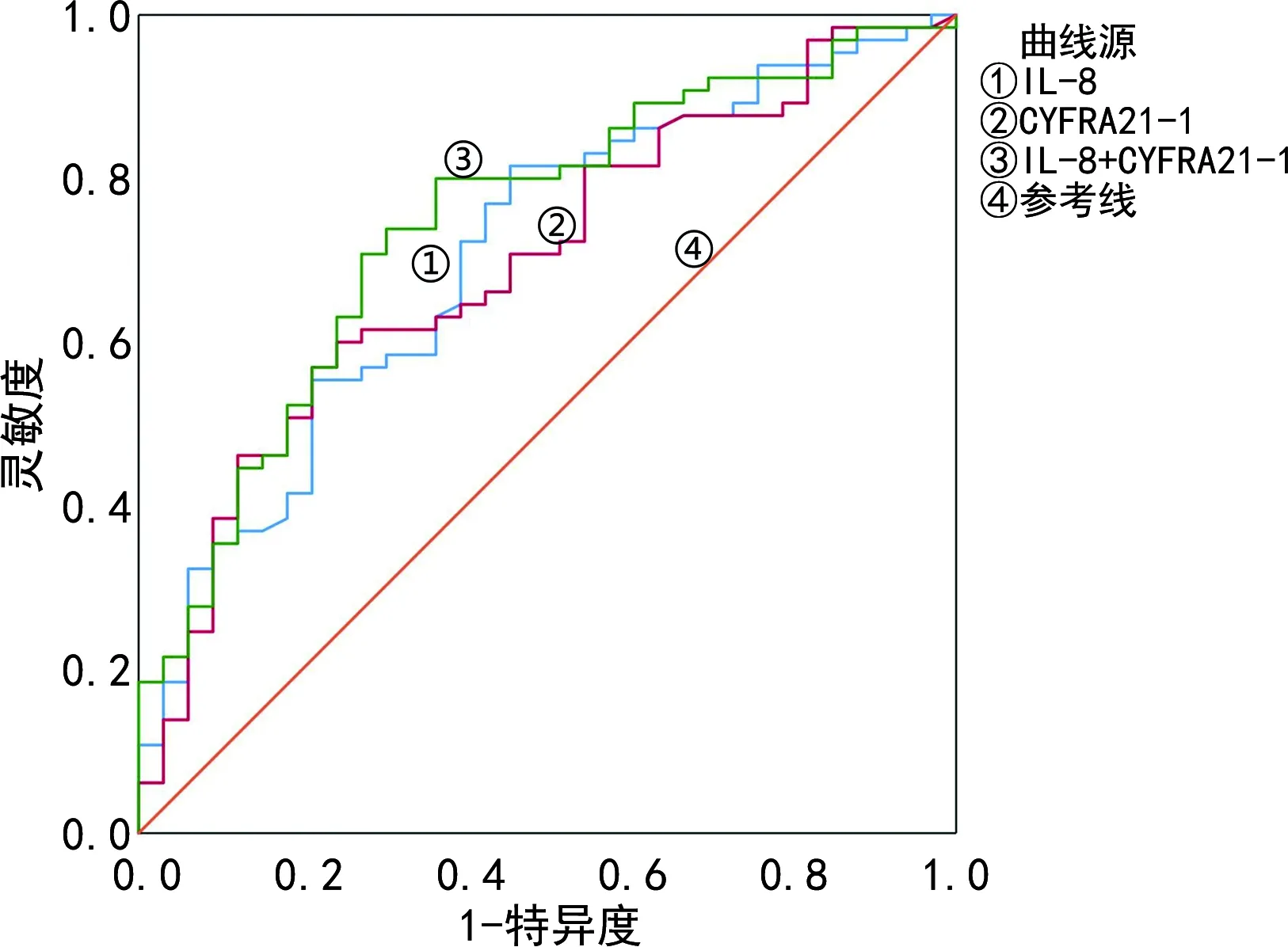
图2 验证组血清IL-8、CYFRA21-1单独及联合检测预测肺癌远处转移的ROC曲线
3 讨 论
近年来,不断发展的综合治疗方式使肺癌治疗效果明显提升,但其生存率依然很低,复发和转移增加了肺癌患者的死亡风险[10]。因此,探索肺癌发生远处转移的影响因素及预测模型对改善肺癌预后至关重要。本研究通过分析炎症、肿瘤相关实验室检查结果,进一步发掘炎症指标和肿瘤标志物对肺癌远处转移的预测价值。本研究比较了转移组与未转移组患者的基线资料和实验室检查指标,结果发现两组患者年龄分布存在明显差异,转移组85.3%的患者年龄>60岁,而未转移组>60岁患者比例仅为53.5%,但多因素Logistic回归分析结果显示年龄并不是发生远处转移的独立危险因素,这可能与本研究样本量较小有关,因此在将来的研究中应扩大样本量,并进行多中心研究进一步探讨。未转移组与转移组的性别、病理类型比较,差异无统计学意义(P>0.05),因此在后续研究中统一分析所有肺癌病例,并未区分病理类型。
肿瘤标志物检测是用于肺癌患者早期诊断、治疗监测及预后评估的一种简单、快速而经济的方法[11-12]。研究发现,CEA是一种非特异性的肿瘤相关抗原,在多种类型肿瘤中均有表达[13]。CYFRA21-1、SCC被认为可以作为NSCLC诊断和预后判断的指标[14],而NSE被认为可以作为SCLC诊断和预后判断的指标[15],ProGRP是近年来发现的一种新的SCLC肿瘤标志物[16]。本研究比较了转移组与未转移组肿瘤标志物水平,发现转移组血清CEA、NSE及CYFRA21-1水平均明显高于未转移组(P<0.05),而ProGRP在未转移组与转移组间比较,差异无统计学意义(P>0.05)。进一步多因素Logistic回归分析结果显示,CYFRA21-1水平升高是肺癌远处转移的独立危险因素(P<0.05),这与TANG等[17]研究一致。有研究证实,炎症因子和肿瘤标志物联合检测在胰腺癌、结直肠癌辅助诊断及预后评估中有较高价值[18-19]。因此,本研究同时分析了炎症相关指标对肺癌远处转移的预测价值。
IL-6、IL-8和IL-1β是IL家族中具有广泛生物学活性的炎症相关细胞因子,参与了包括肺癌在内的多种肿瘤的发生和转移。CHENG等[20]发现,肿瘤细胞通过自分泌IL-6激活IL-6/JAK2/STAT3信号,增强上皮间质转化(EMT)和细胞运动性,从而促进癌细胞的恶性转化。CURY等[21]在肺癌中观察到IL-8的高表达与预后较差有关。LILIS等[22]在小鼠模型中发现肥大细胞分泌的IL-1β可能诱导KRAS,导致突变肺腺癌的发生。此外,NLR作为常用的炎症指标,在肿瘤诊断及预后中的作用逐渐突显[23-24],但主要集中于肺癌预后评估的研究,对于肺癌转移方面的研究较少。本研究结果显示,转移组NLR、IL-8水平明显高于未转移组,IL-8水平升高是预测肺癌发生远处转移的独立危险因素。有研究指出,多项标志物联合检测比单项检测的预测效能更高[25],因此本研究进一步对具有独立预测意义的CYFRA21-1、IL-8及二者联合预测模型进行ROC曲线分析,发现研究组中CYFRA21-1与IL-8联合检测预测肺癌远处转移的AUC为0.820,高于IL-8、CYFRA21-1单项检测,且其预测肺癌远处转移的准确率与单项检测相比,均有明显提高,这一结果在验证组中(AUC=0.744)已得到验证,说明此模型预测肺癌远处转移具有一定可靠性。
综上所述,IL-8和CYFRA21-1水平升高是肺癌远处转移的独立危险因素,二者联合检测具有良好的预测肺癌远处转移的能力,是评估肺癌远处转移有效、可靠的方法,对临床评估肺癌预后具有一定指导价值。然而,由于本研究样本量相对较少,研究结果可能具有一定局限性,并且没有将不同肺癌转移部位的患者分别进行研究,未来需要进行多中心大样本量的队列研究,提高预测模型的普适性。
