老年患者营养诊疗专家共识
2023-03-01浙江省医学会肿瘤营养与治疗学分会浙江省医师协会营养医师专业委员会浙江省医学会肠外肠内营养学分会浙江省康复医学会营养专业委员会全国卫生产业企业管理协会医学营养产业分会浙江省嘉速营养科技促进中心
浙江省医学会肿瘤营养与治疗学分会 浙江省医师协会营养医师专业委员会 浙江省医学会肠外肠内营养学分会 浙江省康复医学会营养专业委员会 全国卫生产业企业管理协会医学营养产业分会 浙江省嘉速营养科技促进中心
据2021年国家统计局发布的第七次全国人口普查数据显示,我国60岁及以上人口26 402万人,占总人口比例18.70%,其中,65岁及以上人口19 064万人,占13.50%。与2010年相比,60岁及以上人口的比重上升了5.44%,我国人口老龄化程度进一步加重。机体老化与各种不良健康后果密切相关,可导致出现不同程度的老年综合征。常见的老年综合征包括多重共病、认知障碍、虚弱、残疾、肌少症、营养不良、生理异常、慢性炎症[1]。引发老年人营养不良的主要原因有:疾病因素导致身体对能量及蛋白质等营养素需要量的增加;正常老化导致蛋白质和能量摄入减少;某些特殊疾病和肌少症引发吞咽障碍导致摄入减少。调查显示65岁以上人群中患肌少症的人群比例为5%~13%,85岁以上人群中这一比例则升高到11%~50%[2]。欧洲调查结果显示独居老年人吞咽障碍发生率为30%~40%,养老或医养机构老年人群发生率为51%[3]。老年人群中肌少症和吞咽障碍与营养不良密切互为因果,严重影响到老年人的生活质量。为此,浙江省医学会肿瘤营养与治疗学分会牵头制定了《老年患者营养诊疗专家共识》。本共识旨在提供特殊营养素和特殊医学用途配方食品(food for special medical purpose,FSMP)在老年肌少症和吞咽障碍患者的应用建议及依据,以提高和改善老年患者的营养状况及生活质量。
1 老年患者营养评估与营养治疗
1.1 老年患者的营养筛查与评估 欧洲临床营养和代谢学会专家共识认为:无计划的体重丢失达>5%/6个月或者>10%/超过6个月;BMI<20 kg/m2;明显的肌肉质量减少;出现以上任意一种情况都是营养不良的表征[4],需尽快查明原因并进行治疗。
社区老年人营养筛查可选择国家卫生健康委员会发布的《老年人营养不良风险评估》(WS/T 552—2017)或者已经过国际认可的微型营养评估(mini-nutritional assessment,MNA)进行营养风险筛查和评估。鉴于MNA评量项目较多,可使用基于MNA发展的微型营养评估简表(short-form mini-nutritional assessment,MNA-SF)进行筛查,MNA-SF有6个条目,其信息来源可通过自述、护理人员及相关医疗记录。
住院的老年患者建议在入院后24 h内完成营养风险筛查,可结合MNA及营养风险筛查工具(Nutritional Risk Screening 2002,NRS 2002)进行定期营养风险筛查,合并肿瘤疾病的患者则由营养师使用主观整体评估(subjective global assessment,SGA)或患者主观整体评估(patients generated subjective global assessment,PG-SGA)结合NRS 2002进行筛查。见表1。

表1 营养风险筛查与评估工具的评分标准与治疗措施
全球领导人营养不良倡议(global leadership initiative on malnutrition,GLIM)是在营养风险筛查的基础上,分别利用表现型和病因型指标对患者进行营养不良评定和营养不良程度分级[5-6]。GLIM标准是国际上最新的营养不良诊断方法,旨在统一目前成人住院患者营养不良诊断标准,同样适用于老年患者。见表2。

表2 GLIM营养不良诊断标准
1.2 老年患者营养不良的营养治疗 经过营养风险筛查与评估,有营养不良风险的患者需要营养师或医师进一步进行营养评估及诊断,同时制定出个性化的营养治疗方案。营养治疗可遵循阶梯治疗原则,依次进行营养教育、口服营养补充(oral nutritional supplements,ONS)、肠内营养、部分肠外营养+肠内营养和全肠外营养。
1.2.1 院内营养治疗 老年住院患者是营养不良高发人群,一是由于疾病因素,身体处于高代谢状态消耗增加;其次由于衰弱或吞咽障碍、认知障碍等原因导致营养摄取减少。建议老年人摄取能量目标为20~30 kcal/(kg·d),根据个人活动量、疾病、食量耐受等进行差异性评估[7]。
临床上需要重点关注蛋白质营养不良问题,建议老年患者应摄取蛋白质至少1 g/(kg·d),建议摄入量随个体差异调整,疾病、伤口、感染都会增加需求。老年患者常因摄食减少导致蛋白质摄入不足,且蛋白质利用能力下降,或同时伴有肿瘤、慢性疾病、创伤等疾病因素导致蛋白质需求增加,导致血清白蛋白、前白蛋白、Hb等营养相关的蛋白质指标快速下降[8]。创伤需要手术的老年患者同样适用于快速康复外科路径,围术期缩短禁饮、禁食时间,术后尽早进食,补充充足的营养是术后康复的关键[9]。肌少症或者有慢性病的老年患者蛋白质摄入量建议为1.2~1.5 g/(kg·d)[8]。严重营养不良的创伤老年患者可以上限到2.0 g/(kg·d),同时监测肝肾功能。对于慢性肾病患者非替代治疗期,摄入的蛋白质目标量在0.6~0.8 g/(kg·d)[10]。此外,老年患者对膳食蛋白质种类有更高的要求,建议优质蛋白质供应占总蛋白质摄入量的50%。
所有的院内老年患者都可能具有饮水不足的风险,在住院期间需关注、记录喝水的总量并鼓励饮水,在没有临床特殊疾病等情况下,老年女性饮水量应至少1.6 L/d,老年男性饮水量应至少2.0 L/d。对于特定疾病如心力衰竭和肾功能衰竭的患者,可能需要限制液体的摄入量。
1.2.2 家庭营养治疗 老年患者出院时应该进行营养状况的评估,存在营养不良风险者出院后,给予家庭营养治疗,遵循阶梯营养治疗原则,进行营养指导。需针对患者的个性化定制营养治疗处方,实施从院内到院外的全程营养管理[11]。对经口膳食营养不足患者,应继续用ONS来改善营养和维持体重,预防身体功能下降,建议给予老年患者ONS至少400 kcal/d,蛋白质30 g/d[7]。老年患者通过ONS营养改善后必须再维持服用至少1个月,并且每月进行1次营养评估。老年患者正餐中应包括25~30 g高生物价蛋白质,每餐提供≥15 g必需氨基酸。在营养不良高风险老年人群中,蛋白质供能占比达到20%更有利于改善营养状况[12]。研究表明蛋白质消化吸收率和食物蛋白质的氨基酸组成都会影响蛋白质的合成。在促进肌肉合成效果方面,乳清蛋白优于酪蛋白,同时,水解蛋白由于消化吸收率高,能更好地发挥作用[13]。
老年患者可适当补充益生菌和膳食纤维以维持肠道微生态平衡,改善肠道功能,促进肠道蠕动减轻便秘,并且可减少多胺、甲酚和吲哚等有害物质的产生。老年人肠道微生物种群的生物多样性减少、致病有机体的过度表达,与机体老化导致的骨骼肌质量和功能的减退可能具有相关性[14]。现有研究表明,肠道菌群可能通过调节氨基酸的可利用性对肌肉的合成代谢产生影响[14]。另有研究显示微生物群的组成和肌肉功能参数(如力量、步态、速度等)之间的相关性[15]。
在具有营养不良风险的老年患者中,除了营养治疗外,还应鼓励其进行身体锻炼来维持和改善肌肉含量和功能,并根据健康状况和身体功能增减运动强度。在运动干预时应同时提供充足的能量和蛋白质补充[16],避免老年患者减轻体重并保持肌肉含量。
1.2.3 FSMP应用建议 FSMP是指满足进食受限、消化吸收障碍、代谢紊乱或特定及疾病人群对营养素或者膳食的特殊需要,专门配制而成的配方食品。老年患者应根据不同的疾病和营养状态,合理选用不同配方的FSMP。老年肿瘤患者可选择高蛋白、高脂肪、同时添加抗炎因子n-3多不饱和脂肪酸的肿瘤全营养配方食品;糖尿病患者可选择对血糖影响较小的糖尿病全营养配方食品;慢性肾病患者可选择高脂肪、低蛋白慢性肾病全营养配方食品,富含优质蛋白质和维生素,同时限制钠、钾、磷等含量;合并肝昏迷或肝昏迷倾向的患者,推荐使用支链氨基酸强化的肝病全营养配方食品。
2 老年患者肌少症的筛查评估与营养治疗
2.1 肌少症简介
2.1.1 定义 肌少症为一种增龄相关的肌肉量减少、肌肉力量下降和(或)躯体功能减退的老年综合征[17]。
2.1.2 临床表现 肌少症最主要的表现为四肢骨骼肌质量与功能的下降,还可增加患者跌倒与骨折风险、降低体力活动表现、提高入院率与次数、加重护理负担,甚至增加死亡风险等。
2.1.3 肌少症分类 主要分为四类,第一类为年龄增长老化导致的,除了衰老之外无其他明显原因;第二类为营养相关的肌少症,主要原因有能量和蛋白质摄入不足,尤其是蛋白质摄入不足,胃肠道功能失调导致营养吸收障碍,多重用药导致食欲缺乏,过度营养或肥胖;第三类为活动性相关的肌少症,诱因为长期久坐或卧床,缺乏身体锻炼;第四类为疾病相关的肌少症,慢性疾病如慢性阻塞性肺疾病、糖尿病、恶性肿瘤及神经障碍疾病导致的肌少症。老年住院患者肌少症的患病率较高,根据GLISTEN研究,394例患者中有14.5%在住院期间出现肌少症[18]。
2.1.4 肌少症诊断与评估 欧洲老年肌少症工作组建议将肌少症分为前肌少症、肌少症和严重肌少症。前肌少症阶段的特点是低肌肉而不影响肌肉力量或物理性能,而肌少症和严重肌少症存在的阶段是低肌肉与肌肉力量较低或低物理性能[19]。亚洲老年肌少症工作组则更进一步制定了符合亚洲人的诊断标准[20-21]。中华医学会老年医学分会老年康复学组同样提出了适合我国人群的肌少症的定义,建议诊断肌少症需结合肌肉质量、肌肉力量及体能状况3者情况,具体诊断流程见图1[22],诊断标准见表3[23]。此外,CT或MRI可用来测量特定区域的肌肉横截面积。国内有学者曾提出CT诊断肌少症的标准,使用身高校正的第三腰椎平面骨骼肌指数:男<40.8 cm2/m2,女<34.9 cm2/m2[24]。

表3 肌少症诊断评估标准
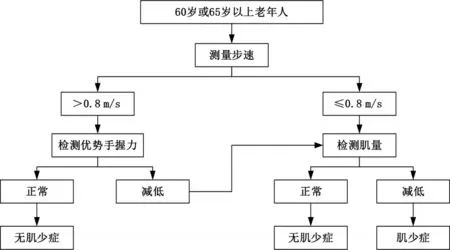
图1 肌少症筛查和诊断流程
2.2 肌少症的营养治疗
2.2.1 营养治疗原则 推荐老年肌少症患者蛋白质摄入量为1.2~1.5 g/(kg·d),优质蛋白质占50%以上,并平均分配到三餐[25]。充足的蛋白质摄入及合理的膳食模式有助于减缓肌少症的发生、发展。
对具有营养风险和确诊营养不良的患者,建议在日常饮食和运动基础上额外补充ONS全营养制剂。近年来研究发现,一些特殊的营养素包括支链氨基酸、β-羟基β-甲基丁酸酯(β-hydroxy-β-methylbutyrate,HMB)、n-3多不饱和脂肪酸、维生素D等也对预防和治疗肌少症患者有良好的作用。
2.2.2 特殊营养素的应用
2.2.2.1 支链氨基酸 饮食中合理的蛋白质摄入可以更大程度地刺激肌肉合成蛋白质。必需氨基酸在蛋白质营养中起到核心作用,特别是必需氨基酸中的支链氨基酸,尤其是亮氨酸能够通过多种途径影响肌肉蛋白质合成[8]。每日10~15 g的支链氨基酸或者3 g的亮氨酸能够增加肌肉蛋白质的合成,预防肌少症的发生[26]。
2.2.2.2 HMB 研究证据表明,亮氨酸的一种代谢产物HMB能够有效促进肌肉蛋白质的合成,并改善肌肉强度。饮食中只有大约5%的亮氨酸在体内会被转化成HMB[27],这些少量的身体合成的HMB能够有效刺激蛋白质合成。此外,饮食中直接添加HMB还可能抑制高分解代谢疾病造成的肌肉损失[28]。
2.2.2.3 n-3多不饱和脂肪酸 n-3多不饱和脂肪酸具有抗炎特性和维持神经功能的作用[29],补充n-3多不饱和脂肪酸能够通过mTOR-p70S6k信号直接影响肌肉蛋白质的合成,减弱年龄造成的合成代谢抗性,加强肌肉蛋白质的合成[30-31]。众多研究表明,无论老年人是否有在体育运动,每天补充n-3多不脂肪酸能够显著提高老年人的步行速度和肌肉强度及功能[30,32]。
2.2.2.4 维生素D 维生素D缺乏症常与骨软化、骨质减少、骨质疏松等疾病相关,并增加骨折风险[33]。老年人群中肌肉萎缩和维生素D缺乏通常是同时发生的,与临床预后如衰弱、易摔倒等具有关联性[34]。肌肉中存在的维生素D受体与维生素D结合,通过调节钙内流、成肌细胞分化和肌肉的胰岛素敏感性来促进肌肉收缩[35]。随着年龄增加,人体肌肉组织中维生素D受体表达量逐渐降低[36],老年人更应注意每日摄入充足的维生素D维持受体的敏感性。每日维生素D的建议摄入量为600~800 U,维持血清25羟维生素D浓度>50 nmol/L(>20 ng/ml),并维持1 000 mg钙摄入。在无肌少症和骨质疏松的老年人群中,补充维生素D也可减少跌倒的风险[37]。
综上研究,单独摄入支链氨基酸、亮氨酸、HMB、n-3多不饱和脂肪酸、维生素D等营养补充剂有助于肌肉质量的增加和肌肉功能的增强;这些营养素的组合有利于预防和治疗肌少症。
2.2.3 肌少症FSMP应用建议 当老年肌少症患者和肌少症前期人群进食量不足目标量80%时,建议每日ONS补充2次,时间可选为餐间或运动后,每次摄入15~20 g富含必需氨基酸的优质蛋白质及200 kcal左右的能量,有助于克服年龄及某些疾病造成的肌肉蛋白质合成抗性,促进肌肉蛋白质合成[22]。
老年肌少症患者应考虑首先补充富含必需氨基酸尤其是亮氨酸的蛋白质补充剂。乳清蛋白生物价高、富含亮氨酸且能够快速被消化吸收,推荐为优先选用的蛋白质补充剂。肌少症的营养配方中乳清蛋白比例应占60%或以上。同时根据食物中获取的营养素评估和血液生化检查,考虑添加维生素D、n-3多不饱和脂肪酸、HMB等组件的营养补充剂。
2.3 肌少症的运动干预 运动训练可以改善老年人的身体活动能力、提高肌肉含量。有氧运动、耐力运动、抗阻力运动已经被证明能够显著增加肌少症患者的肌肉质量和力量[38],尤其是抗阻力运动可以诱导蛋白质多种合成代谢通路,还有助于减少肌肉蛋白质的分解[39]。
老年肌少症患者合理的运动建议是每周至少150 min中等强度有氧运动,即每天进行累计40~60 min中-高强度运动(如快走、慢跑等),同时每周至少3次抗阻力运动,锻炼主要的骨骼肌肉群[40]。但是,老年人不适当的运动训练也可能导致肌肉骨骼疾病等不良后果。目前尚未对规定的运动内容和最理想的频率和强度达成一致意见,主要以自体对运动的舒适度为主,逐渐增加运动量。抗阻力运动可选择坐位抬腿、静力靠墙蹲、举哑铃、拉弹力带等,有效改善肌肉力量和身体功能,并且刺激肌肉蛋白质合成,有利于提高骨骼肌的质量、力量及功能,运动中或运动后可补充必需氨基酸、优质蛋白质或n-3多不饱和脂肪酸,能使老年人肌力和肌肉蛋白合成能力显著提高,延缓肌少症发生。
3 老年患者吞咽障碍的筛查评估与营养治疗
3.1 吞咽障碍简介
3.1.1 定义 吞咽障碍是临床上多学科常见的症状,易导致误吸、吸入性肺炎、营养不良等严重后果,指由于下颌、双唇、舌、软腭、咽喉、食管等器官和(或)功能受损,不能安全有效地将食物输送到胃内的过程,易引起患者营养吸收不良、脱水,同时也会增加患者误吸风险和不良反应发生率。
3.1.2 吞咽障碍的分类、筛查和评估 吞咽障碍主要分为肌少症型吞咽障碍及特殊疾病如脑卒中、脑损伤、神经性肌肉疾病、头颈癌放化疗等引起的吞咽障碍。吞咽障碍在进食方面造成的问题主要有饮水呛咳、进食哽噎、吞咽后口腔残留食物以及频繁的清嗓动作。临床上吞咽障碍筛查方法主要有洼田饮水实验和进食评估问卷[41],分别见表4、5。洼田饮水实验方法为:患者取坐位,先用茶匙试验喝水,尝试两三口,无问题后像平常一样喝30 ml温水,观察所需要的时间和呛咳情况。进食评估问卷调查表总分在3分及以上视为吞咽效率和安全方面存在问题。

表4 洼田饮水试验
经过筛查,如果有风险则作进一步临床功能评估和(或)仪器检查,其中仪器检测包括吞咽造影检查或软式喉内镜吞咽功能检查,仪器检查结果可以作为直接诊断吞咽障碍程度的标准。
3.1.3 肌少症型吞咽障碍 肌少症型吞咽障碍常发生在老年群体,由于全身骨骼肌和吞咽肌群质量和功能减退引起的吞咽功能紊乱[42-43]。Zhao等[44]通过荟萃分析研究得出老年群体中,肌少症与吞咽障碍在定性和定量上分析均呈正相关。肌少症可能是发生在吞咽障碍之前,Maeda等[45]研究发现,在吞咽障碍人群中,95.5%的人群患有肌少症。

表5 进食评估问卷调查表
肌少症型吞咽障碍诊断标准[46]:(1)存在全身性肌少症(肌肉质量和力量明显丧失);(2)影像学检查验证与吞咽肌肉质量减少相一致(X线断层摄影术、MRI、超声波扫描);(3)除肌少症外不包括其他导致吞咽障碍的原因;(4)有易引起吞咽障碍的其他疾病存在时,肌少症被认为是造成吞咽障碍的主要原因。符合(1)(2)(3)(4)即可被诊断为肌少症型吞咽障碍,符合(1)(2)(4)或(1)(2)(5)的视为可疑肌少症型吞咽障碍。
3.1.4 疾病引起吞咽障碍 脑神经病变、神经肌肉病变、头颈部肿瘤放化疗等疾病均会引起吞咽过程中感觉和肌肉运动的异常,引起吞咽障碍。吞咽困难直接导致营养摄入不足,长时间会出现肌肉流失、体重下降,并影响治疗预后。吞咽功能异常时易导致误吸,对于神经系统受损较严重的患者,误吸的风险显著增加,吸入性肺炎或慢性呼吸道疾病也可能发生。头颈部肿瘤放化疗会导致神经肌肉和感觉功能受损,在吞咽过程中则出现吞咽困难、干渴及味觉改变、厌食和吞咽时疼痛,从而导致饮食摄入减少[47]。
3.2 吞咽障碍的营养治疗 吞咽障碍治疗包括多个方面,包括饮食质地调整、代偿性方法、康复方法、营养支持、进食途径、护理及药物给予途径等[48],需要建立多学科团队模式,包括临床营养师、医师、护士、康复治疗师等,共同配合进行吞咽障碍的治疗及康复。
吞咽障碍的营养治疗方式应根据患者的营养评估指标及功能状况,选择经口进食或选用人工肠内营养如鼻胃管、鼻肠管等,需要综合考虑营养的量、供给方式、食物性状、膳食合理配制等。调整食物质地和液体稠度是最常见的营养治疗措施。进食阶段通常选用软质的食物,通过少量咀嚼即可吞咽;流质食物使用增稠剂组件以减缓流动速度,使吞咽障碍患者有足够的时间协调吞咽肌肉的收缩,避免呛咳。研究证据表明营养丰富、质地改良过的食物(泥状或糊状)和浓稠的液体(蜂蜜和布丁稠度)会增加老年患者的能量摄入,降低误吸的风险[49]。预计恢复时间较长时,可选择造瘘进行营养治疗。如果有肠内营养不能满足营养需求或有肠内营养禁忌证,则联合肠外营养进行营养治疗。
我国专家借鉴日本吞咽障碍家庭营养管理的经验,提出了适用于我国的吞咽障碍家庭营养管理措施的“阶段性”家庭营养管理方案,及与吞咽功能分级对应的具体营养管理策略[50]。在吞咽障碍早期阶段,可通过营养教育选择合适的食物,采用改善食物性状、调整进食姿势和速度及一口量等代偿性方法;随着病情进展,当经口进食存在误吸风险时,可根据患者功能情况选择适宜的肠内营养治疗途径,必要时行肠外营养治疗。
3.3 吞咽障碍FSMP应用建议 吞咽障碍患者容易误吸稀薄液体,需在稀液内加入增稠剂以增加黏度,改变食物质地,可减少误吸,增加营养素的摄入量。推荐使用增稠剂配方组件,增加食物黏稠度,并根据吞咽障碍阶段性病情变化,调整食物质地和构成以适应逐渐减退的咀嚼和吞咽能力。必要时使用人工营养方式补充所需营养。
4 推荐意见
老年患者营养不良发生率高,应常规进行营养风险筛查和评估。(B,强推荐)
有营养不良风险的老年患者应制定个性化的营养干预方案,以保证能量和营养素充足。(A,强推荐)
老年住院患者应摄取蛋白质至少1 g/(kg·d)。肌少症或者有慢性病的老年患者蛋白质摄入量建议为1.2~1.5 g/(kg·d);慢性肾脏病患者非替代治疗期老年患者蛋白质摄入目标量为0.6~0.8 g/(kg·d)。(B,强推荐)
营养不良的老年患者出院后,应继续坚持用ONS至少400 kcal/d,蛋白质30 g/d。(A,强推荐)
在无需特殊限制液体量的情况下,老年女性饮水量建议≥1.6 L/d,老年男性饮水量建议≥2.0 L/d。(B,强推荐)
老年患者可适当补充益生菌和膳食纤维以维持肠道微生态平衡。(B,弱推荐)
老年患者应根据不同的疾病和营养状态,合理选用不同配方的FSMP。(B,强推荐)
特殊的营养素包括支链氨基酸、HMB、n-3多不饱和脂肪酸、维生素D,有利于预防和治疗肌少症。(B,弱推荐)
推荐老年肌少症患者用ONS 2次/d,餐间或运动后服用,每次摄入15~20 g富含必需氨基酸的优质蛋白质及200 kcal能量。(B,弱推荐)
老年肌少症患者应考虑首先补充富含必需氨基酸尤其是亮氨酸的蛋白质补充剂,并同时进行运动干预。(B,弱推荐)
老年患者吞咽障碍发生率高,易导致营养不良、脱水,增加误吸风险,应及时进行筛查和评估。(A,强推荐)
吞咽障碍患者的营养治疗方式应综合考虑患者的营养评估指标及功能状况,制定阶段性营养管理方案。(A,强推荐)
调整食物质地和液体稠度有利于增加吞咽障碍患者的能量和营养素摄入,减少误吸的风险。(A,强推荐)
推荐吞咽障碍患者使用增稠剂组件,根据吞咽障碍阶段性病情变化,调整食物质地和构成以适应逐渐减退的咀嚼和吞咽能力。(B,弱推荐)
共识执笔人:张片红(浙江大学医学院附属第二医院)、郭惠兰(浙江大学医学院附属第二医院)
共识制定专家组成员(按姓氏笔画数排序):于吉人(浙江大学医学院附属第一医院)、叶世伟(丽水市第二人民医院)、朱明炜(北京医院)、刘英华(解放军总医院第一医学中心)、孙建琴(复旦大学附属华东医院)、孙新(吉林省人民医院)、李天瑯(浙江大学医学院附属第二医院)、何晓琴(浙江省台州医院)、沈贤(温州医科大学附属第一医院)、张片红(浙江大学医学院附属第二医院)、张勤(浙江大学医学院附属第一医院)、张静芬(全国卫生产业企业管理协会医学营养产业分会)、陈伟(中国医学科学院北京协和医院)、陈怀红(浙江医院)、陈改云(郑州大学附属第一医院)、陈秋霞(浙江中医药大学附属第二医院)、郑培奋(浙江医院)、胡雯(四川大学华西医院)、胡桂芬(金华市中心医院)、姚颖(华中科技大学同济医学院附属同济医院)、徐斌斌(中国科学院大学宁波华美医院)、黄晓旭(浙江大学医学院附属第二医院)、蔡缨(空军杭州特勤疗养中心)、戴福仁(温州医科大学附属第三医院)
利益冲突 所有作者均声明不存在利益冲突
