人参皂苷Rh2通过激活Akt和Erk通路促进神经分化
2023-02-28何俊桓徐浩仁文献学童美玲陈晓勇李姝祺唐根云
何俊桓,徐浩仁,文献学,童美玲,陈晓勇,李姝祺,李 彬,唐根云,2,3
(1.湖南医药学院,怀化 418000;2.脑与神经内分泌疾病湖南省高等学校重点实验室,怀化 418000;3.中药合成生物学研究湖南省重点实验室,怀化 418000)
神经分化是一个复杂的过程,一般经过几个阶段,包括轴突生长、树突发生和突触形成、塑造和重塑等分化过程[1],其在维持神经系统正常生理功能有着很重要的作用。神经元萎缩、死亡是神经退行性疾病、缺血性脑卒中的主要病理变化,这导致神经信息网络不能交织成网,阻碍信息的传递,神经网络受损,从而造成患者神经功能上的病变。因此促进神经细胞存活、神经突起再生或延长是治疗这些疾病的一种较好的策略。人参皂苷是中药人参干燥根的主要有效成分,对中枢神经[2]、心血管[3]、抗氧化[4]和抗肿瘤[5]具有较好的药理作用,现代药理学实验及临床应用等研究证明,人参皂苷对神经组织的生长和神经网络的建立具有促进作用[6],抗肿瘤活性作用强的Rh2是人参皂苷的单体,与其他类似分子相比,其对神经分化的作用鲜有报道,现已证实人参皂苷Rh2通过阻止神经元凋亡和神经炎症来保护三甲基锡诱导的神经毒性[7],并促进海马胆碱能系统,显著抑制氧化应激和激活ERK-CREB-BDNF信号通路,对东崀宕碱、tg2576阿尔茨海默症模型小鼠的认知和记忆缺陷具有改善作用。阿尔茨海默症(Alzheimer’s disease,AD)是最常见的老年性中枢神经退行性疾病[8],阿尔茨海默症的主要特征是淀粉样斑块和神经纤维缠结,导致神经元变性死亡,神经突起损伤,而后出现认知障碍的表现,迄今为止还没有找到能够根治AD的手段以及药物,如今研究治疗阿尔兹海默症效果显著的药物已刻不容缓[9]。神经营养因子多年来一直被认为是神经退行性疾病的潜在治疗选择之一,但是其半衰期短,不稳定,脂溶性差,外周给药进入神经中枢的途径也非常有限,在临床试验中也遭遇失败,开发具有类似活性的小分子药物具有广阔的应用前景,目前大多数神经营养药物通过一些经典的信号转导途径作用于大脑,激活关键信号通路如:有丝分裂活化蛋白激酶(MAPK)途径、磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(也称为Akt)途径等[10],促进神经突起生长。因此,本研究评估人参皂苷Rh2对神经细胞分化的促进作用,为其具有神经营养作用阐明药效和作用机制,为人参皂苷Rh2在临床开发和治疗神经退行性疾病提供药理学依据。
2 实验材料与方法
2.1 实验材料
人参皂苷Rh2(纯度>98%)购买于阿拉丁试剂公司;MEM(EBSS,含L-谷氨酰胺)购自上海羽圣生物科技;胎牛血清购自Gibco;蛋白定量测定试剂盒(PierceTMBCA Protein Assay Reagent A)购自Thermo Scientifc公司;C0201胰酶细胞消化液、PBS缓冲液、二甲基亚砜、蛋白酶磷酸酶抑制剂混合物(通用型,50×)、细胞裂解液、p-Akt、p-Erk1/2、β-actin抗体、HRP标记的二抗、PI3K/Akt抑制剂LY294002、MAPK/ERK1/2抑制剂PD98059、极超敏ECL化学发光试剂盒均购自碧云天生物技术有限公司;阳性对照视黄酸(Retinoic acid,RA)购于Sigma公司;中分子量神经丝蛋白抗体(Neurofilament M,简称NF)购于Cell Signaling Technology。
2.2 细胞培养
小鼠来源神经瘤母细胞(Mouse neuroblastoma N2a Cell,又称Neuro-2a,简称N2a),购自于美国模式菌种收集中心 (American type culture collection,ATCC)细胞库。本实验中小鼠神经母细胞瘤N2a细胞用含10%胎牛血清以及1%双抗(青霉素和链霉素)的MEM培养基作为培养体系,放置于二氧化碳培养箱(37℃、5%CO2)中培养,隔天换液,平均3~4天传代。
2.3 MTT法检测药物对细胞毒性的影响
取对数期N2a细胞,将细胞按5×103个/孔的密度接种于96孔板,培养至48 h后每孔加入20μL的MTT(5 mg/mL)(空白对照组不加,MTT避光-20℃保存),放置细胞培养箱充分反应4 h后,吸去原细胞培养液,每孔加入100μL的分析纯DMSO溶解,轻轻拍打板身,避光,放置摇床,50~100 rpm/min,15 min后停止。使用酶标仪在490 nm检测细胞各孔OD值。
细胞存活率=(实验组平均OD值/对照组平均OD值)×100%
2.4 细胞突起生长实验
取对数期N2a细胞进行传代和种板,将细胞按3×104个/皿的密度接种于6孔板中,培养生长24 h后,加10μL RA或不同浓度Rh2于分化培养基(含0.5%FBS和1%青霉素/链霉素的MEM)诱导分化48 h。化合物人参皂苷Rh2设置的浓度为4μM和6μM,并且设置阴性对照组DMSO组和阳性对照组RA组。
2.5 神经细胞分化的定义及量化统计
诱导分化48 h后,在相差显微镜下拍照并计数N2a细胞。使用Image-J软件对照片进行分析细胞分化率和神经突起长度。突起长度大于胞体两倍长的细胞为分化细胞,分化细胞的神经突起长度将会被定量统计。主要分析细胞分化率和分化细胞总神经突起的平均长度。
2.6 蛋白免疫印迹技术
将N2a细胞接种在密度为3×105个/孔的6孔板中,用药物预处理后,用PBS洗涤细胞,并用RIPA联合蛋白磷酸酶抑制剂配制的裂解液在冰上裂解30 min,裂解后在4℃12000 rpm/min下离心15 min收集蛋白上清液,经BCA蛋白质定量试剂盒进行定量,样品制备后在95℃下变性15min。蛋白样品用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,并转移至聚偏二氟乙烯膜(PVDF)上,用5%脱脂牛奶在室温下封闭60 min,将膜与特异性一抗(1∶1000稀释)在4℃孵育过夜,TBST洗涤后在室温下用相应的辣根过氧化物酶(HRP)偶联的二抗(1∶1500稀释)孵育60 min,用ECL化学发光液孵育蛋白条带,并用凝胶成像系统仪检测分析。
2.7 数据处理
采用GraphPad Prism8处理数据,数据处理值表示为平均值±标准误。数据分析使用单因素方差分析(ANOVA),然后进行Dunnett’s多重比较,将相关对照组和各实验组之间进行比较,P<0.05视为具有统计学差异。
3 结果
3.1 人参皂苷Rh2对细胞活力的影响
探究不同浓度的人参皂苷Rh2对细胞毒性的影响,如图1所示,4μM与6μM的人参皂苷Rh2与对照组细胞活力基本一致,表明该药物浓度对细胞活力无毒性作用。
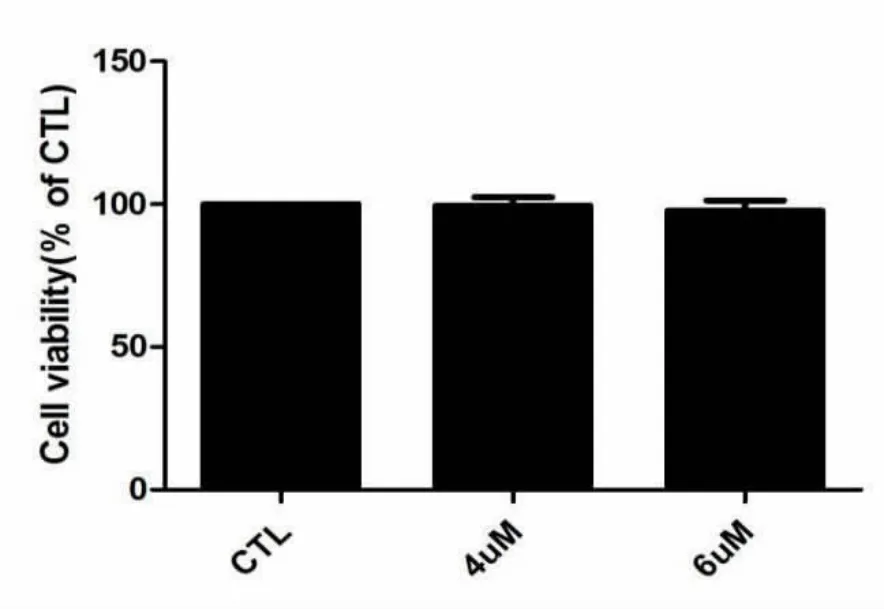
图1.不同浓度Rh2对细胞活力的影响Fig1.Effects of different concentrations of Rh2 on cell viability
3.2 人参皂苷Rh2对N2a细胞分化的影响
为了探究人参皂苷Rh2对N2a细胞分化的影响,我们将N2a细胞在低血清(0.5%FBS)培养基中诱导分化,并用4μM和6μM的Rh2分别处理48 h和72 h,对诱导分化的细胞用神经突起专一性抗体βtublinIII进行免疫荧光染色,并用荧光显微镜进行拍照。与DMSO组相比,Rh2组细胞的分化率和神经突起长度都有了很大的提高,且与RA组细胞形态非常相似(图2A)。经过统计分析发现,随着时间和浓度的提高,神经突起长度和细胞的分化率呈依赖性增加(图3A,B),其中6μM的Rh2在48 h促神经分化的效果最为显著。同时Rh2可以增加中分子量神经丝蛋白NF的表达,与对照组相比具有浓度依赖性(图2B)。
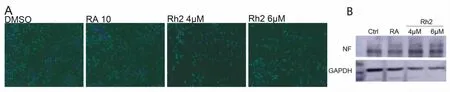
图2.Rh2诱导N2a细胞分化的形态图和蛋白表达变化Fig2.Morphological pattern and protein expression changes of N2a cell differentiation induced by Rh2
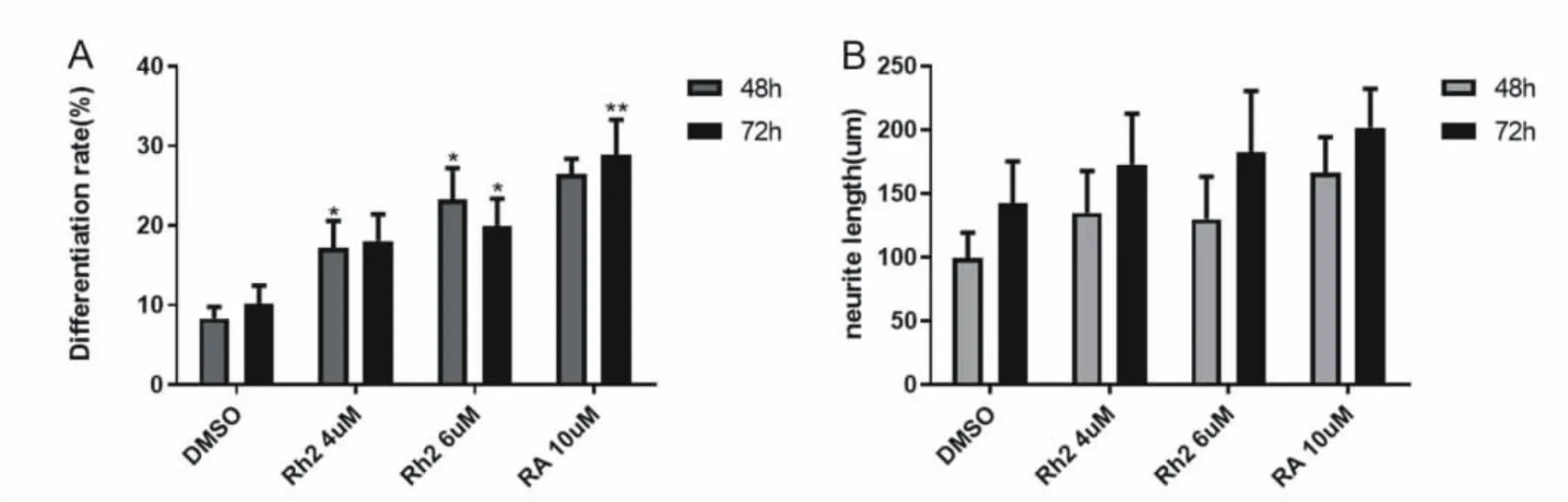
图3.Rh2诱导N2a细胞的分化率和神经突起长度Fig3.Rh2 induces differentiation rate and neurite length in N2a cells
3.3 人参皂苷Rh2对PI3K/Akt、MEK/Erk通路的影响
为了确定Rh2激活这些信号通路的时间,用Rh26μM作用不同时间(0~90min)后提取蛋白进行检测,随着Rh2处理时间的延长,p-Akt和p-Erk表达增加(图4),在处理30min后Akt和Erk的磷酸化最明显,随后呈现出逐级递减的趋势。表明人参皂苷Rh2可能通过快速激活MEK/Erk、PI3K/Akt通路促进神经分化。
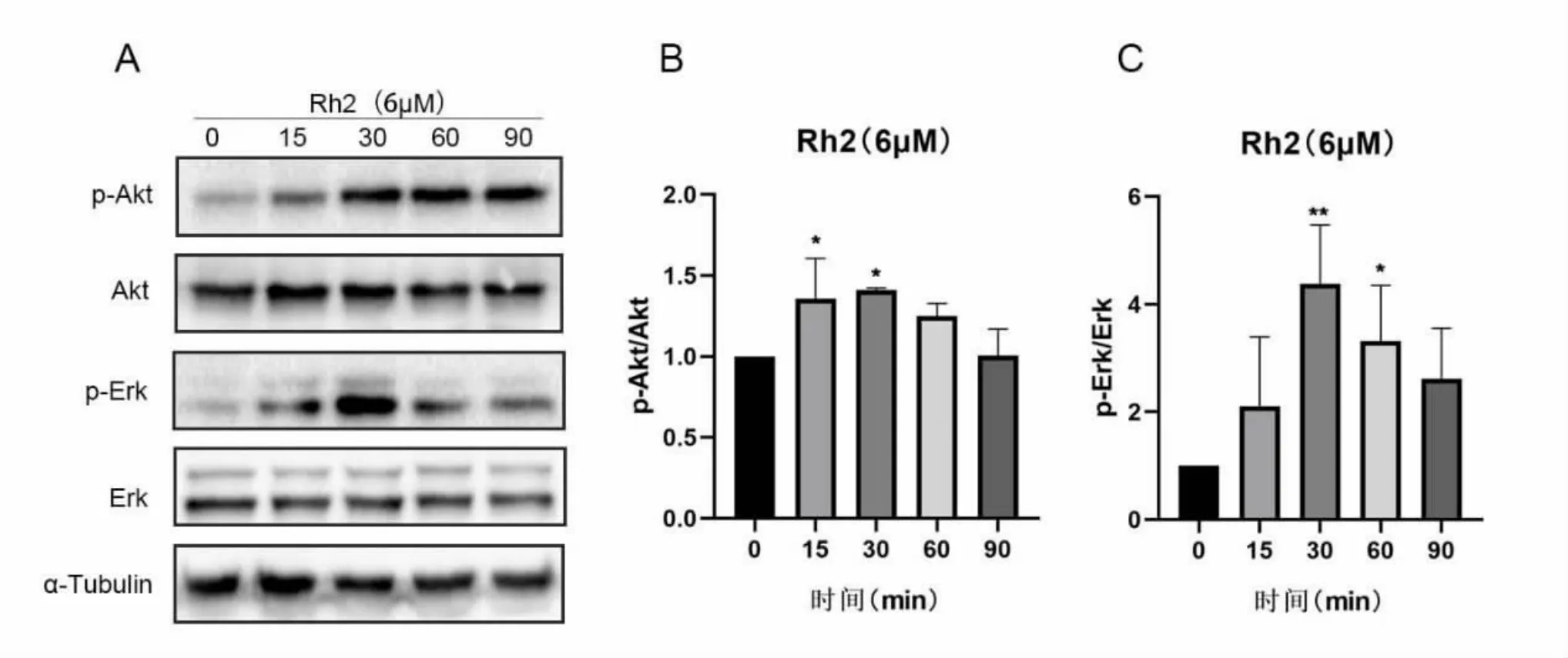
图4.Rh2不同时间点对Akt和Erk信号通路的影响Fig4.Effects of Rh2 on Akt and Erk signaling pathways at different time points
3.4 人参皂苷Rh2不同浓度对PI3K/Akt、MEK/Erk通路的影响
为了确定不同浓度Rh2对Akt和Erk表达的影响,用人参皂苷Rh2(2、4、6μM)作用30 min提取蛋白进行检测。随着人参皂苷Rh2浓度增高p-Akt和p-Erk的表达呈现递增趋势(图5)。
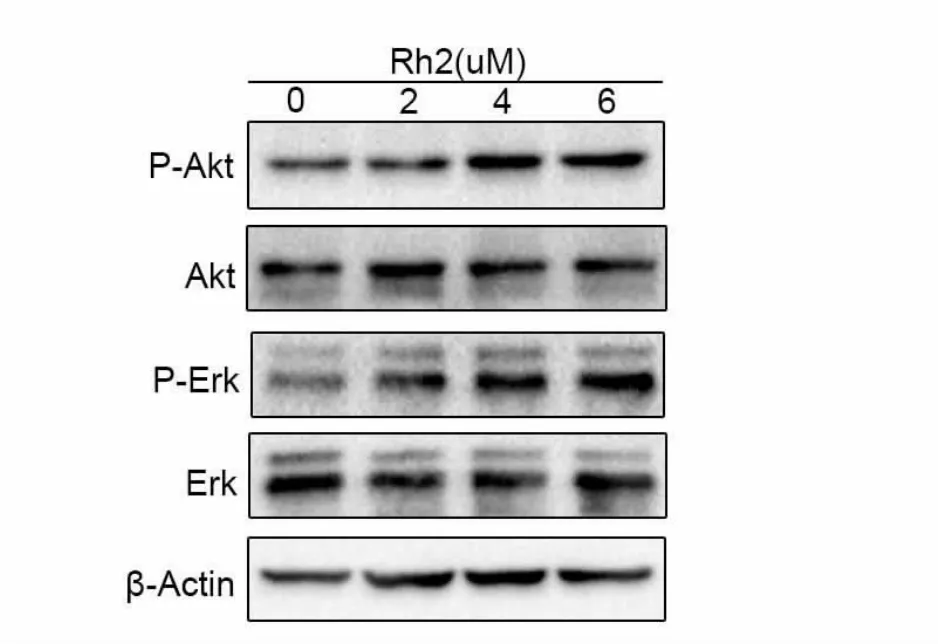
图5.Rh2不同浓度对Akt和Erk信号通路的影响Fig5.Effects of different concentrations of Rh2 on Akt
3.5 PI3K和MEK抑制剂对人参皂苷Rh2促神经分化的影响
为了进一步验证激活的信号通路对人参皂苷Rh2促进神经分化和神经突起生长的影响,我们利用信号通路关键蛋白的药理抑制剂LY294002和PD98059对Rh2处理组进行干预。结果表明LY294002和PD98059能够显著抑制Rh2诱导N2a细胞分化形成神经突起(图6A),通过统计分析可以发现抑制剂组的分化率明显低于Rh2组,具有统计学意义(图6B)。Western Blotting检测蛋白表达显示,用PI3K和MEK抑制剂处理后,p-Akt、p-Erk的表达水平受到明显抑制(图7A,B),而用相应抑制剂加上Rh2共同处理后p-Akt、p-Erk的表达有所增加。这些结果表明LY294002和PD98059能够抑制Rh2诱导的N2a细胞分化,进一步证明了PI3K/Akt和MEK/Erk参与了人参皂苷Rh2诱导N2a细胞分化的过程。
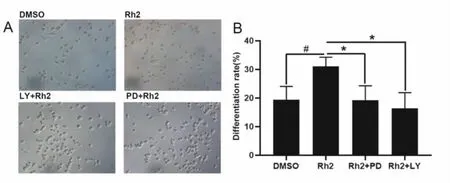
图6.Rh2诱导N2a细胞分化需要激活PI3K/Akt和MEK/Erk信号通路Fig6.Rh2 induces N2a cell differentiation by activating PI3K/Akt and MEK/Erk signaling pathways
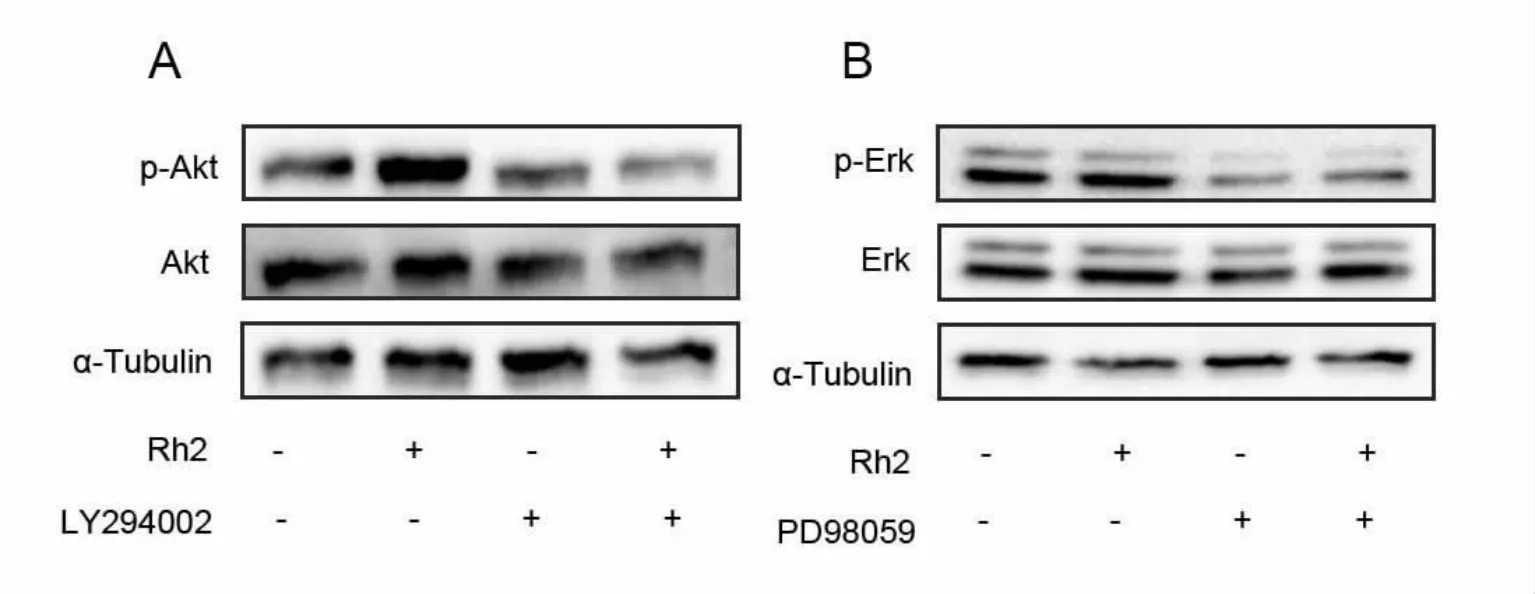
图7.抑制剂预处理后Rh2对p-Akt和p-Erk信号通路的影响Fig7.Effect of Rh2 on Akt and Erk signaling pathways after inhibitor pretreatment
4 讨论
Neuro-2a细胞是研究神经分化机制[11,12]的最佳模型之一。人参一直被认为具有增强记忆、促进大脑发育的作用,而人参皂苷Rh2有文献报道其可以减轻由于睡眠剥夺或者阿尔茨海默症模型小鼠引起的行为缺陷以及记忆障碍[13-15]。本研究中人参皂苷Rh2在2~6μM浓度下不影响细胞的活力,人参皂苷Rh2能够促进中分子量神经丝蛋白的表达实现神经分化和神经突起的生长,有利于维持神经系统功能结构的稳定,对重建损伤的神经网络结构、恢复信息传递和记忆的储存有一定的作用,其中6μM的人参皂苷Rh2在48 h促神经分化效果最为显著,在72 h后神经分化率有所降低,故不推荐作用时间太长。在促神经分化的作用中,人参皂苷Rh2对p-Akt和p-Erk的表达具有剂量依赖性,6μM效果最为显著,Akt和Erk的磷酸化在30~60 min激活最为明显,之后随时间延长而递减,这说明Akt和Erk的磷酸化在短时间被激活,Rh2的起效时间较快。利用LY294002和PD98059处理细胞后,神经分化率和神经突起长度降低,p-Akt、p-Erk的表达受到明显抑制,而使用Rh2可以增加p-Akt、p-Erk的表达。这些结果进一步证实了人参皂苷Rh2促神经分化和轴突延伸依赖PI3K/Akt、MEK/Erk信号通路。人参皂苷Rh2可以通过激活PI3K/Akt、MEK/Erk信号通路促进神经细胞分化和神经突起生长,具有很好的神经营养作用,为其在临床应用于治疗神经退行性疾病提供了药理学依据。
