二十二碳六烯酸对人胰腺癌细胞生长抑制作用的分析
2023-02-28黎文涛伍小琼王正根
黎文涛,伍小琼,王正根
(1. 南华大学附属第二医院消化内科,湖南 衡阳 421000;2. 岳阳市人民医院,湖南师范大学附属岳阳医院消化内科,湖南 岳阳 414000)
二十二碳六烯酸(DHA)是一种人体必需脂肪酸,属于w-3 多不饱和脂肪酸[1]。近年来,有研究表明,w-3 多不饱和脂肪酸能够对前列腺癌、结肠癌等多种肿瘤细胞的增殖进行抑制,对肿瘤细胞的凋亡进行诱导,还能够增强药物抑制肿瘤细胞生长的效果[2]。本研究分析了DHA 对人胰腺癌细胞生长的抑制作用。
1 材料与方法
1.1 材料
购买上海长海医院的人胰腺癌细胞株SW1990、Patu8988,上海西唐生物科技有限公司的兔抗人Bcl-2、COX-2,Beckman Coulter Company 的羊抗兔荧光二抗,Hyclone 公司的RPMI1640 培养基,美国Sigma公司的DHA(纯度为98%)。将DHA 用无水乙醇稀释至100 mg/mL,充氮,避光储存在-80℃的温度下备用。用RPMI1640 培养液稀释DHA 为不同浓度。
1.2 方法
1.2.1 细胞培养 在RPMI1640 培养基(链霉素100 IU/mL+ 青霉素100 IU/mL+ 丙酮酸钠1 mmol/L+ 谷氨酰胺2 mmol/L+10% 新生牛血清)中常规培养人胰腺癌细胞株SW1990、Patu8988,培养于37℃细胞培养箱(5%CO2)中,待细胞生长到70% ~80% 融合时进行传代培养,在此过程中充分利用0.25% 胰酶消化细胞,在实验中应用指数生长期的细胞。
1.2.2 胰腺癌细胞增殖检测 运用MTT 法进行检测,将指数生长期的SW1990、Patu8988 细胞收集起来,计数后适当稀释,将细胞悬液制作出来,细胞数为1×105/mL,在96 孔培养板中接种,每孔100 μL,培养24 h,待细胞贴壁后将浓度为0 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的DHA 培养液更换过来。将0.05% 无水乙醇+ 等量培养液加入浓度为0 μg/mL 的DHA 培养液中。在37℃孵育箱(5%CO2)中分别培养24 h、48 h、72 h,然后将20 μL MTT(5 mg/mL)加入各孔,继续孵育4 h,将上清液弃去,将130 μL 二甲基亚砜加入,微震荡5 ~10 min,充分溶解孔底的结晶物,采用酶标仪对每孔吸光度值(A490)进行测定,每个浓度设定6 个平行孔。
1.2.3 胰腺癌细胞凋亡检测 采用流式细胞术进行检测,将指数生长期的SW1990、Patu8988 细胞收集起来,在培养瓶中接种,细胞数为1×106/mL,培养24 h,待细胞贴壁后,将0 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL 的DHA 培养液更换过来,分别作用24 h、48 h、72 h 后,将细胞收集起来,PBS 洗涤2 次,将2 mL 70%乙醇(预冷)加入其中,在4℃的温度下固定过夜。离心后将固定液除去,用PBS 洗涤,室温下用碘化丙啶溶液(碘化丙啶胺50 mg/L+RNA ase A 50 mg/L+EDTA 0.1 mmol/L+0.1% Triton X-100+PBS)避光染色所得细胞30 min,采用流式细胞仪对细胞凋亡率、细胞周期分布进行分析,激发、检测光波长分别为488 nm、610 nm。
1.2.4 Bcl-2、COX-2 表达检测 采用流式细胞术进行检测,将指数生长期的SW1990、Patu8988 细胞收集起来,在培养瓶中接种,细胞数为1×106/mL,培养24 h,待细胞贴壁后,将0 μg/mL、50 μg/mL 的DHA 培养液更换过来。作用24 h 后,将细胞收集起来,PBS 洗涤,将4% 多聚甲醛加入,室温下静置15 min ;PBS 洗 涤,将0.1% Triton X-100 加 入,悬浮15 min ;PBS 洗涤,分测定管、同型管,将兔抗人Bcl-2、COX-2 一抗加入测定管中,室温下静置15 min ;PBS 洗涤,将一抗洗去,将羊抗兔荧光二抗加入测定管、同型管中,室温下避光染色15 min ;PBS洗涤,将二抗洗去,在PBS 中悬浮细胞,采用流式细胞仪对Bcl-2、COX-2 表达水平、蛋白荧光值的变化进行测定,激发、检测波长分别为492 nm、520 nm,每组设立3 个复孔。
1.3 统计学分析
采用SPSS 21.0 软件进行统计学分析,计数资料用百分比(%)表示,用χ²检验;计量资料用±s表示,用t检验。P<0.05 表示差异存在统计学意义。
2 结果
2.1 不同浓度DHA 培养液培养24h、48h、72h人胰腺癌细胞存活率的比较
0 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL 的DHA 培养液培养24 h、48 h、72 h 人胰腺癌SW1990、Patu8988 细胞的存活率均随DHA 培养液浓度的升高而逐渐降低(P<0.05)。见表1。
表1 不同浓度DHA 培养液培养24 h、48 h、72 h 人胰腺癌细胞存活率的比较(%,±s)
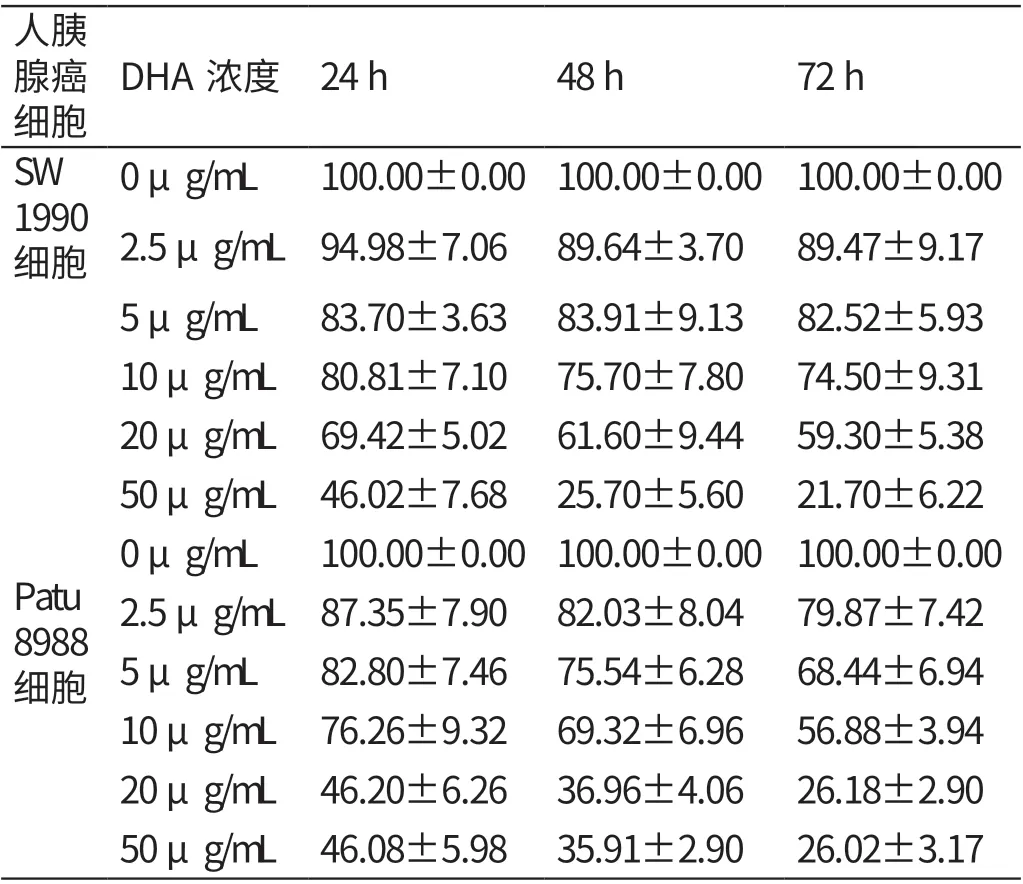
表1 不同浓度DHA 培养液培养24 h、48 h、72 h 人胰腺癌细胞存活率的比较(%,±s)
人胰腺癌细胞DHA浓度 24 h 48 h 72 h SW 1990细胞0 μg/mL 100.00±0.00 100.00±0.00 100.00±0.00 2.5 μg/mL 94.98±7.06 89.64±3.70 89.47±9.17 5 μg/mL 83.70±3.63 83.91±9.13 82.52±5.93 10 μg/mL 80.81±7.10 75.70±7.80 74.50±9.31 20 μg/mL 69.42±5.02 61.60±9.44 59.30±5.38 50 μg/mL 46.02±7.68 25.70±5.60 21.70±6.22 Patu 8988细胞0 μg/mL 100.00±0.00 100.00±0.00 100.00±0.00 2.5 μg/mL 87.35±7.90 82.03±8.04 79.87±7.42 5 μg/mL 82.80±7.46 75.54±6.28 68.44±6.94 10 μg/mL 76.26±9.32 69.32±6.96 56.88±3.94 20 μg/mL 46.20±6.26 36.96±4.06 26.18±2.90 50 μg/mL 46.08±5.98 35.91±2.90 26.02±3.17
2.2 不同浓度DHA 培养液培养24h、48h、72h人胰腺癌细胞凋亡率的比较
0 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的DHA 培 养 液 培 养24 h、48 h、72 h 人 胰 腺 癌SW1990、Patu8988 细胞的凋亡率均随DHA 培养液浓度的升高而逐渐升高(P<0.05)。见表2。
表2 不同浓度DHA 培养液培养24 h、48 h、72 h 人胰腺癌细胞凋亡率的比较(%,±s)
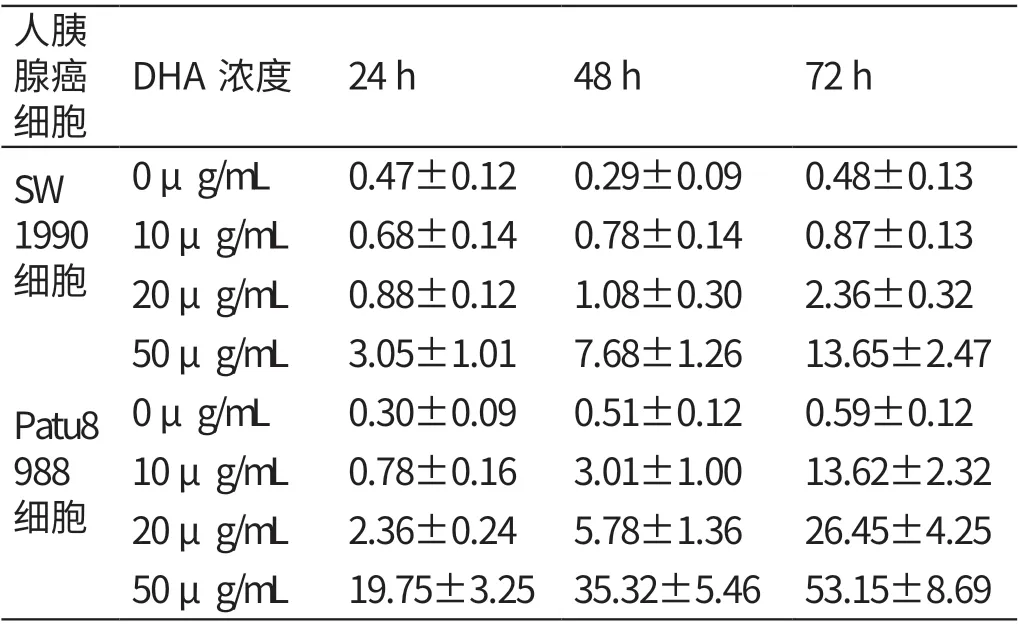
表2 不同浓度DHA 培养液培养24 h、48 h、72 h 人胰腺癌细胞凋亡率的比较(%,±s)
人胰腺癌细胞DHA浓度 24 h 48 h 72 h SW 1990细胞0 μg/mL 0.47±0.12 0.29±0.09 0.48±0.13 10 μg/mL 0.68±0.14 0.78±0.14 0.87±0.13 20 μg/mL 0.88±0.12 1.08±0.30 2.36±0.32 50 μg/mL 3.05±1.01 7.68±1.26 13.65±2.47 0 μg/mL 0.30±0.09 0.51±0.12 0.59±0.12 10 μg/mL 0.78±0.16 3.01±1.00 13.62±2.32 20 μg/mL 2.36±0.24 5.78±1.36 26.45±4.25 50 μg/mL 19.75±3.25 35.32±5.46 53.15±8.69 Patu8 988细胞
2.3 不同浓度DHA 培养液培养48h 人胰腺癌细胞周期分布的比较
0 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的DHA 培 养 液 培 养48 h 人 胰 腺 癌SW1990、Patu8988 细胞的G0~G1期、G2~M 期细胞占比均随DHA 培养液浓度的升高而逐渐升高(P<0.05),S 期细胞占比均随DHA 培养液浓度的升高而逐渐降低(P<0.05)。见表3。
表3 不同浓度DHA 培养液培养48 h 人胰腺癌细胞周期分布的比较(%,±s)
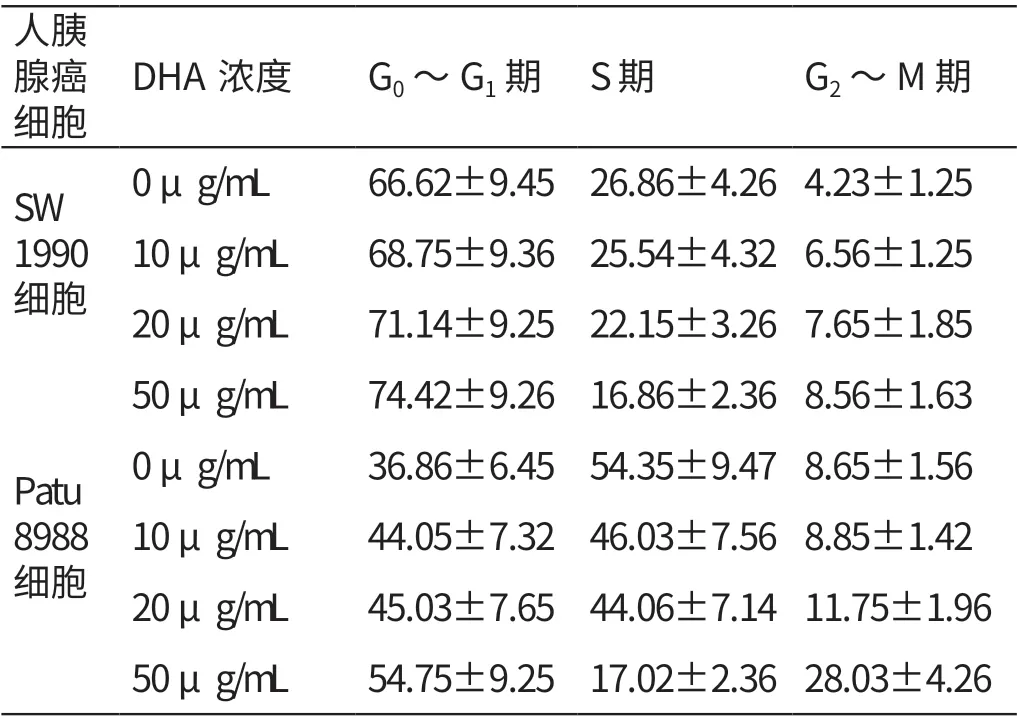
表3 不同浓度DHA 培养液培养48 h 人胰腺癌细胞周期分布的比较(%,±s)
人胰腺癌细胞DHA浓度 G0~G1期 S期 G2~M期SW 1990细胞0 μg/mL 66.62±9.45 26.86±4.26 4.23±1.25 10 μg/mL 68.75±9.36 25.54±4.32 6.56±1.25 20 μg/mL 71.14±9.25 22.15±3.26 7.65±1.85 50 μg/mL 74.42±9.26 16.86±2.36 8.56±1.63 0 μg/mL 36.86±6.45 54.35±9.47 8.65±1.56 10 μg/mL 44.05±7.32 46.03±7.56 8.85±1.42 20 μg/mL 45.03±7.65 44.06±7.14 11.75±1.96 50 μg/mL 54.75±9.25 17.02±2.36 28.03±4.26 Patu 8988细胞
2.4 不同浓度DHA 培养液培养24h 人胰腺癌细胞Bcl-2、COX-2 表达的比较
0 μg/mL 的DHA 培 养 液 培 养24 h 人 胰 腺 癌SW1990、Patu8988 细胞Bcl-2、COX-2 的表达水平、蛋白荧光值均高于50 μg/mL(P<0.05)。见表4。
表4 不同浓度DHA 培养液培养24 h 人胰腺癌细胞Bcl-2、COX-2 表达的比较(±s)
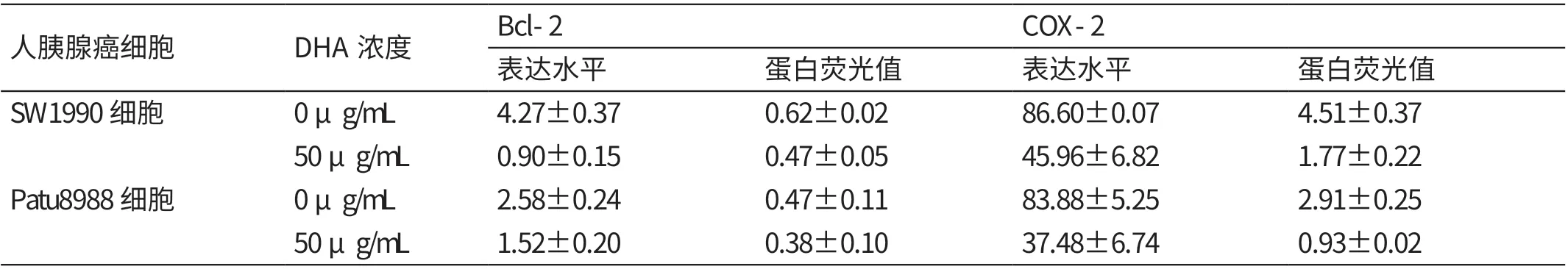
表4 不同浓度DHA 培养液培养24 h 人胰腺癌细胞Bcl-2、COX-2 表达的比较(±s)
人胰腺癌细胞 DHA浓度 Bcl-2 COX-2表达水平 蛋白荧光值 表达水平 蛋白荧光值SW1990细胞 0 μg/mL 4.27±0.37 0.62±0.02 86.60±0.07 4.51±0.37 50 μg/mL 0.90±0.15 0.47±0.05 45.96±6.82 1.77±0.22 Patu8988细胞 0 μg/mL 2.58±0.24 0.47±0.11 83.88±5.25 2.91±0.25 50 μg/mL 1.52±0.20 0.38±0.10 37.48±6.74 0.93±0.02
3 讨论
有研究[3]表明,DHA 会显著抑制人胰腺癌细胞株SW1990、Patu8988 的增殖,同时还会对胰腺癌细胞的凋亡进行诱导,途径可能为下调Bcl-2、COX-2 表达。本研究的结果表明,0 μg/mL、2.5 μg/mL、5 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL 的DHA 培 养 液 培 养24 h、48 h、72 h人胰腺癌SW1990、Patu8988 细胞的存活率均随DHA 培养液浓度的升高而逐渐降低(P<0.05),0 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL的DHA 培 养 液 培 养24 h、48 h、72 h 人 胰 腺 癌SW1990、Patu8988 细胞的凋亡率均随DHA 培养液浓度的升高而逐渐升高(P<0.05)。这说明,DHA 等w-3 多不饱和脂肪酸能够对肿瘤细胞生长进行抑制,DHA 可对SW1990、Patu8988 两种胰腺癌细胞的凋亡进行诱导,同时呈时间- 剂量依赖性,原因可能为DHA 等w-3 多不饱和脂肪酸能够增加肿瘤细胞膜结构的脂质过氧化水平,促进更多活性基团、脂质过氧化产物的形成,引发核酸变性、膜穿孔等,从而造成肿瘤细胞坏死[4]。本研究的结果还表明,0 μg/mL、10 μg/mL、20 μg/mL、50 μg/mL 的DHA 培 养 液 培 养48 h 人 胰 腺 癌SW1990、Patu8988 细 胞 的G0~G1期、G2~M期细胞占比均随DHA 培养液浓度的升高而逐渐升高(P<0.05),S 期细胞占比均随DHA 培养液浓度的升高而逐渐降低(P<0.05)。这说明,DHA会对胰腺癌细胞周期分布造成影响,DHA 会使胰腺癌细胞周期在G0~G1期停滞,这可能会在一定程度上抑制细胞增殖,最终诱导细胞凋亡。
在肿瘤细胞永生化的过程中,Bcl-2 基因家族成员在正常细胞恶性转变的抑制凋亡与促凋亡失衡中发挥着重要作用。有研究[5]表明,肿瘤的早期表现包括Bcl-2 基因表达过度,其会使染色体受损,逃避凋亡进程,从而永生化,并在癌基因的协同作用下向肿瘤发展。胰腺癌早期在胰腺上皮内瘤样变(PanIN)1 ~3 期进展到浸润型时,已经无法在PanIN 1、2 期病变中检测到凋亡细胞,说明在胰腺癌早期,抗凋亡机制发挥了极为重要的作用[6]。在胰腺癌患者术后生存时间的影响因素中,Bcl-2 表达是一项独立危险因素[7]。肿瘤细胞具有极为复杂的凋亡机制,COX-2 可能在其中发挥着重要作用。COX-2 是一种诱导型酶,其在对花生四烯酸向前列腺素转化进行调节的过程中发挥着重要作用,通常极低或不表达于正常组织中,高表达于细胞恶性转化、组织损伤中[8]。本研究的结果表明,0 μg/mL 的DHA 培养液培养24 h 人胰腺癌SW1990、Patu8988 细胞Bcl-2、COX-2 的表达水平、蛋白荧光值均高于50 μg/mL(P<0.05),说明DHA下调Bcl-2、COX-2 的表达可能是其对肿瘤细胞凋亡进行诱导的途径。
综上所述,DHA 可抑制人胰腺癌细胞的生长,途径可能为下调人胰腺癌细胞中的Bcl-2、COX-2 表达。
