基于“项目式学习”的“物质结构与性质”全模块教学案例
2023-02-27陈思明
陈思明

一、项目的选择与教学目标的确定
高三复习课教学中对知识的整合以及形成解决问题的认识模型至关重要。在新能源的社会背景之下,磷酸铁锂电池因不含贵金属元素,且具有耐高温、循环次数高、安全性高、来源广泛、价格便宜等优势而备受关注。本文以“磷酸铁锂电池的材料”为载体,从不同维度分析其结构特征和优良性能,突出认识物质结构角度在解决前沿问题中的价值。基于以上分析,确定如下教学目标。
(1)通过分析磷酸铁锂电池的宏观性质,探析各组成部分的微观结构,建立结构决定性质的化学观念。
(2)通过探析磷酸铁锂电池微观结构,复习原子结构元素性质、分子结构与分子的性质、晶体相关基础知识,建立结构化认知模型。
(3)通过探析磷酸铁锂电池微观结构,感受化学在人类发展过程中作出的巨大贡献,增强社会责任感。
二、项目的实施
创设情境:认识磷酸铁锂电池。
教师展示材料和图片:工信部发布的第10批《新能源汽车推广应用推荐车型目录》其中近八成车型搭载磷酸铁锂电池。这种电池具有能量密度高、安全性能好、原材料来源广泛等优点。磷酸铁锂电池由正极材料(LiFePO4)、负极材料(石墨)、电解质(LiPF5、溶剂)以及隔膜等部分构成。
学生阅读材料,从宏观上了解磷酸铁锂电池的组成。
学生疑惑:磷酸铁锂电池为什么具有良好的性能?它是如何工作的呢?
教师过渡:物质结构决定物质的性质,我们下面从结构入手找出答案。
(设计意图:以磷酸铁锂电池为切入口,感受电池为社会发展作出的贡献,激发学生的求知欲,引出复习任务。)
[▲]任务1:认识正极材料——锂离子供体
师:磷酸铁锂电池在充电过程中有一部分Fe2+被氧化为Fe3+,正极材料LiFePO4发生如下电极反应:LiFePO4-xe-=Li1-xFePO4+xLi+。Fe2+转化为Fe3+时失去了哪个电子?请用价电子排布图加以说明。同学们可以从微观角度分析和理解这一变化。
生:基态Fe2+的价电子排布式为:3d6,电子排布图为 [3d][↑↓][↑][↑][↑][↑];基态Fe3+的价电子排布式为:3d5,电子排布图为 [3d][↑][↑][↑][↑][↑],Fe2+转化为Fe3+时失去的是3d轨道上的一个电子,使3d轨道成为半充满的结构。
教师总结:多电子原子的电子填充顺序一般符合构造原理,电子填充次序为1s→2s→2p→3s→3p→4s→3d→4p。同学们应当熟练掌握1~36号元素基态原子的核外电子排布,基态原子核外电子排布应遵循能量最低原理、泡利原理和洪特规则,尤其要注意Cr、Cu等元素基态原子的核外电子排布特殊性。
师:科学家青睐锂电池的重要原因是锂的密度较低。锂是一种活泼金属,试从原子结构角度分析Li、Na和Li、Be、B的第一电离能差异的原因。参考数据:I1/(kJ·mol-1)Li520 Be900 B801 Na496 Mg738 Al578。
生:Na与Li同主族,Na的电子层数更多,原子半径更大,故第一电离能更小;Li、Be和B为同周期元素,同周期元素从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级轨道处于全充满状态,能量更低更稳定,故其第一电离能大于B的。
教师总结:Li~Ne和Na~Ar的第一电离能曲线呈现锯齿状变化的原因与基态原子的核外电子排布有关,提示我们要透过现象看到结构上的本质特征。
师:磷酸根的空间构型如何判断,试总结利用VSEPR模型预测AXn型简单分子或离子空间构型的一般方法。
学生活动:完成利用VSEPR模型预测AXn型简单分子或离子空间构型的方法建模,如图1所示。
学生活动:利用以上方法填充表格(“VP”为中心原子价层电子对数,“BP”为中心原子成σ键电子对数,“LP”为中心原子孤电子对数)
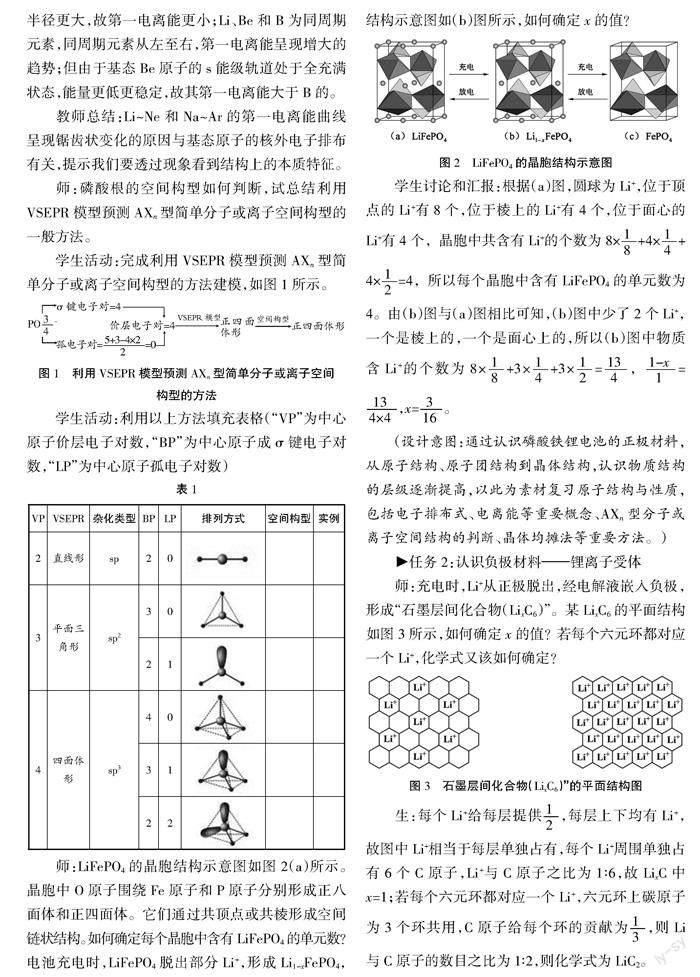
师:LiFePO4的晶胞结构示意图如图2(a)所示。晶胞中O原子围绕Fe原子和P原子分别形成正八面体和正四面体。它们通过共顶点或共棱形成空间链状结构。如何确定每个晶胞中含有LiFePO4的单元数?电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)图所示,如何确定x的值?
学生讨论和汇报:根据(a)图,圆球为Li+,位于顶点的Li+有8个,位于棱上的Li+有4个,位于面心的Li+有4个,晶胞中共含有Li+的个数为8×+4×+4×=4,所以每个晶胞中含有LiFePO4的单元数为4。由(b)图与(a)图相比可知,(b)图中少了2个Li+,一个是棱上的,一个是面心上的,所以(b)图中物质含Li+的个数为8×+3×+3×=,=,x=。
(设计意图:通过认识磷酸铁锂电池的正极材料,从原子结构、原子团结构到晶体结构,认识物质结构的层级逐渐提高,以此为素材复习原子结构与性质,包括电子排布式、电离能等重要概念、AXn型分子或离子空间结构的判断、晶体均摊法等重要方法。)
[▲]任务2:认识负极材料——锂离子受体
师:充电时,Li+从正极脱出,经电解液嵌入负极,形成“石墨层间化合物(LixC6)”。某LixC6的平面結构如图3所示,如何确定x的值?若每个六元环都对应一个Li+,化学式又该如何确定?
生:每个Li+给每层提供,每层上下均有Li+,故图中Li+相当于每层单独占有,每个Li+周围单独占有6个C原子,Li+与C原子之比为1∶6,故LixC中x=1;若每个六元环都对应一个Li+,六元环上碳原子为3个环共用,C原子给每个环的贡献为,则Li与C原子的数目之比为1∶2,则化学式为LiC2。
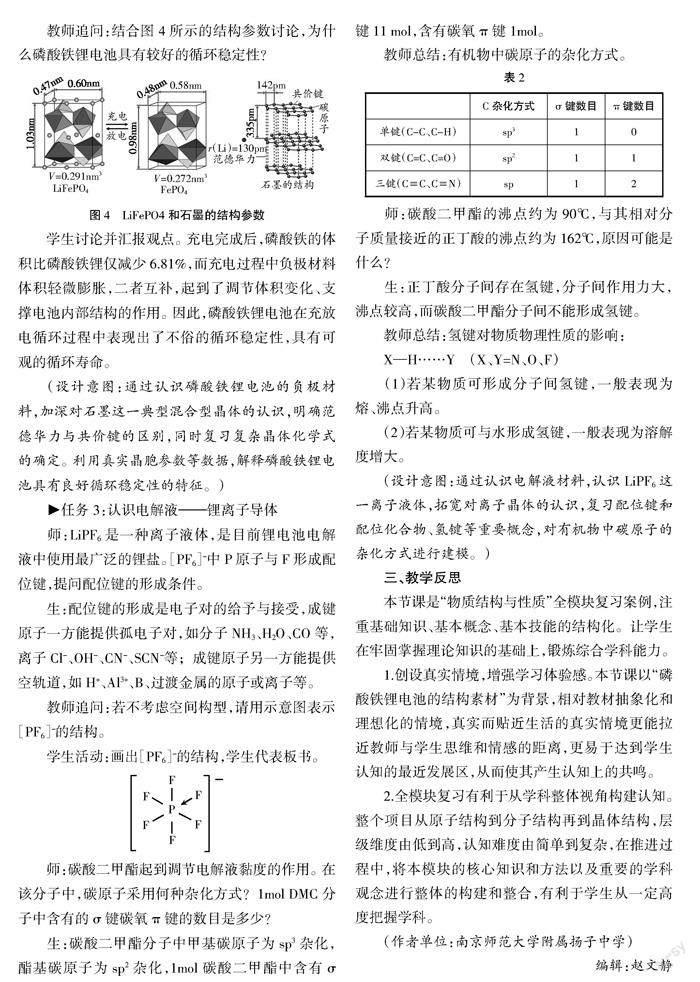
教师追问:结合图4所示的结构参数讨论,为什么磷酸铁锂电池具有较好的循环稳定性?
学生讨论并汇报观点。充电完成后,磷酸铁的体积比磷酸铁锂仅减少6.81%,而充电过程中负极材料体积轻微膨胀,二者互补,起到了调节体积变化、支撑电池内部结构的作用。因此,磷酸铁锂电池在充放电循环过程中表现出了不俗的循环稳定性,具有可观的循环寿命。
(设计意图:通过认识磷酸铁锂电池的负极材料,加深对石墨这一典型混合型晶体的认识,明确范德华力与共价键的区别,同时复习复杂晶体化学式的确定。利用真实晶胞参数等数据,解释磷酸铁锂电池具有良好循环稳定性的特征。)
[▲]任务3:认识电解液——锂离子导体
师:LiPF6是一种离子液体,是目前锂电池电解液中使用最广泛的锂盐。[PF6]-中P原子与F形成配位键,提问配位键的形成条件。
生:配位键的形成是电子对的給予与接受,成键原子一方能提供孤电子对,如分子NH3、H2O、CO等,离子Cl-、OH-、CN-、SCN-等;成键原子另一方能提供空轨道,如H+、Al3+、B、过渡金属的原子或离子等。
教师追问:若不考虑空间构型,请用示意图表示[PF6]-的结构。
学生活动:画出[PF6]-的结构,学生代表板书。
师:碳酸二甲酯起到调节电解液黏度的作用。在该分子中,碳原子采用何种杂化方式?1mol DMC分子中含有的σ键碳氧π键的数目是多少?
生:碳酸二甲酯分子中甲基碳原子为sp3杂化,酯基碳原子为sp2杂化,1mol碳酸二甲酯中含有σ键11 mol,含有碳氧π键1mol。
教师总结:有机物中碳原子的杂化方式。
师:碳酸二甲酯的沸点约为90℃,与其相对分子质量接近的正丁酸的沸点约为162℃,原因可能是什么?
生:正丁酸分子间存在氢键,分子间作用力大,沸点较高,而碳酸二甲酯分子间不能形成氢键。
教师总结:氢键对物质物理性质的影响:
X—H……Y (X、Y=N、O、F)
(1)若某物质可形成分子间氢键,一般表现为熔、沸点升高。
(2)若某物质可与水形成氢键,一般表现为溶解度增大。
(设计意图:通过认识电解液材料,认识LiPF6这一离子液体,拓宽对离子晶体的认识,复习配位键和配位化合物、氢键等重要概念,对有机物中碳原子的杂化方式进行建模。)
三、教学反思
本节课是“物质结构与性质”全模块复习案例,注重基础知识、基本概念、基本技能的结构化。让学生在牢固掌握理论知识的基础上,锻炼综合学科能力。
1.创设真实情境,增强学习体验感。本节课以“磷酸铁锂电池的结构素材”为背景,相对教材抽象化和理想化的情境,真实而贴近生活的真实情境更能拉近教师与学生思维和情感的距离,更易于达到学生认知的最近发展区,从而使其产生认知上的共鸣。
2.全模块复习有利于从学科整体视角构建认知。整个项目从原子结构到分子结构再到晶体结构,层级维度由低到高,认知难度由简单到复杂,在推进过程中,将本模块的核心知识和方法以及重要的学科观念进行整体的构建和整合,有利于学生从一定高度把握学科。
(作者单位:南京师范大学附属扬子中学)
编辑:赵文静
