免疫检查点抑制剂治疗转移性结直肠癌疗效与安全性的Meta分析
2023-02-27陈威陈嘉怡李铃余俊先首都医科大学附属北京友谊医院药学部北京00050首都医科大学护理学院北京00069
陈威 ,陈嘉怡 ,李铃 ,余俊先 (.首都医科大学附属北京友谊医院药学部,北京 00050;.首都医科大学护理学院,北京 00069)
在全球范围内,结直肠癌(colorectal carcinoma,CRC)已成为第三大常见恶性肿瘤,是癌症相关死亡的第二大原因,每年约有90万人死于该疾病(仅次于肺癌),我国CRC新发病例数高居全球癌症总数的第二位,死亡病例数同样位于第二位[1]。在新诊断的CRC患者中,20%的患者被诊断为转移性结直肠癌(metastatic colorectal carcinoma,mCRC);25%的患者被诊断为早期CRC,但随着疾病进展肿瘤会发生转移;在mCRC患者中,70%~75%患者的生存期超过1年,30%~35%患者的生存期超过3年,不到20%患者的生存期超过5年[2]。
传统化疗是mCRC的主要治疗方法,但其存在全身毒性、疾病缓解率低、疗效欠佳等不足,因此寻找具有更好肿瘤特异性的治疗方案就显得尤为重要[3―4]。近年来,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)因具有显著的抗肿瘤作用而受到越来越多的关注,这为mCRC患者带来了新希望。ICIs包括程序性细胞死亡蛋白1(programmed death-1,PD-1)抑制剂、程序性细胞死亡蛋白配体1(programmed death ligand-1,PDL1)抑制剂及细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte antigen-4,CTLA-4)抑制剂。ICIs通过抑制PD-1、PD-L1以及CTLA-4之间的相互作用,来激活T淋巴细胞的抗肿瘤活性,清除肿瘤细胞和肿瘤组织,从而达到抗肿瘤的作用[5―7]。此外,ICIs主要针对癌症抗原,可防止正常细胞受到攻击[8―9]。根据突变模式,CRC分为错配修复缺陷且高水平微卫星不稳定(dMMR-MSIH)和错配修复熟练且低水平微卫星不稳定(pMMRMSS)两种类型[10―11]。有临床试验证明,ICIs治疗dMMR-MSI-H CRC更为有效[12―13]。美国国立综合癌症网络也推荐ICIs为dMMR-MSI-H CRC的辅助治疗方法[14]。除了传统化疗方案,ICIs单药、多种ICIs联用、ICIs与化疗药联用都给mCRC治疗指明了新的方向,但这些治疗方案的疗效和安全性尚不明确[15―16]。因此,本研究采用Meta分析的方法评价了ICIs治疗mCRC的疗效和安全性,旨在为临床用药提供循证参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 本研究纳入的文献为Ⅱ、Ⅲ或Ⅳ期随机对照试验(randomized controlled trial,RCT)。语种限定为中文和英文。
1.1.2 研究对象 本研究纳入的患者均经组织学确诊为Ⅳ期mCRC患者;按《实体肿瘤临床疗效评估标准1.1版(RECIST v1.1)》评估为不可切除和可测量的mCRC患者[17];患者年龄大于18岁;种族、国籍、性别均不限。
1.1.3 干预措施 试验组患者给予ICIs单药、多种ICIs联用、ICIs联合化疗;对照组患者给予传统化疗或最佳支持治疗。两组患者的剂量和疗程均不限。
1.1.4 结局指标 本研究的结局指标包括:(1)总生存期(overall survival,OS);(2)无进展生存期(progressionfree survival,PFS);(3)3级及以上不良事件发生率。
1.1.5 排除标准 本研究的排除标准为:(1)重复发表的文献;(2)没有足够数据去计算mCRC患者OS和PFS风险比(hazard ratio,HR)的文献;(3)综述、病例报告。
1.2 文献检索策略
遵循《系统综述和Meta分析优先报告的条目声明》推荐的Meta分析报告项目[18]。计算机检索PubMed、the Cochrane Library、Web of Science、Embase、中国知网、万方数据、维普网。英文检索词为“immune check-point inhibitors”“PD-1 inhibitor”“PD-L1 inhibitor”“CTLA-4 inhibitor” “nivolumab”“atezolizumab”“durvalumab”“tremelimumab”“pembrolizumab”“colorectal cancer”“colorectal carcinoma”“colorectal tumours”;中文检索词为“结直肠癌”“转移性结直肠癌”“免疫检查点抑制剂”“PD-1抑制剂”“PD-L1抑制剂”“纳武利尤单抗”“帕博利珠单抗”“阿替利珠单抗”“度伐利尤单抗”“曲美木单抗”。检索时限均为各数据库建库起至2022年6月1日。采用主题词和自由词相结合的方式进行检索。
1.3 文献筛选与资料提取
由两位研究者独立按照纳入与排除标准筛选文献,如遇分歧则与第三位研究者讨论解决。提取资料包括:第一作者及发表年份、试验编号、国家、患者例数、年龄、病理类型、干预措施、结局指标等。
1.4 纳入文献质量评价
根据Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具对纳入文献质量进行评价,具体包括:分配隐藏,随机序列产生,对受试者和研究者施盲,研究结局的盲法评价,数据完整性、选择性报告结果,其他偏倚。每个条目分为“高偏倚”“低偏倚”和“不清楚”[19]。
1.5 统计学方法
采用RevMan 5.4软件进行Meta分析。计数资料以相对危险度(risk ratio,RR)、HR及其95%置信区间(confidence interval,CI)表示。采用χ2检验和I2分析各研究间的异质性。若各研究间无统计学异质性(P>0.1,I2<50%),采用固定效应模型进行Meta分析;反之则采用随机效应模型进行Meta分析。检验水准α=0.05。
2 结果
2.1 文献筛选结果
初筛共获得相关文献427篇,经阅读标题、摘要和全文后,最终纳入4篇文献[13,20―22],涉及4项RCT,合计833例患者,其中试验组499例,对照组334例。文献筛选流程见图1,纳入研究基本信息见表1。
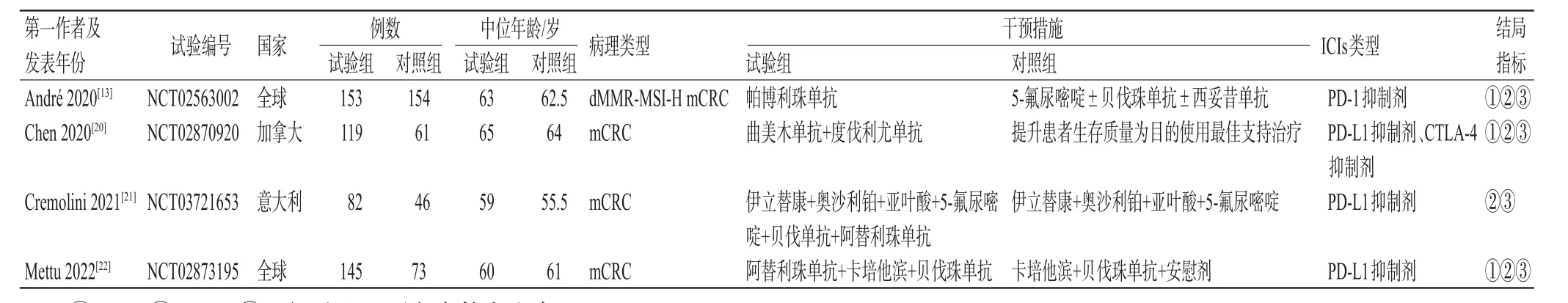
表1 纳入研究基本信息
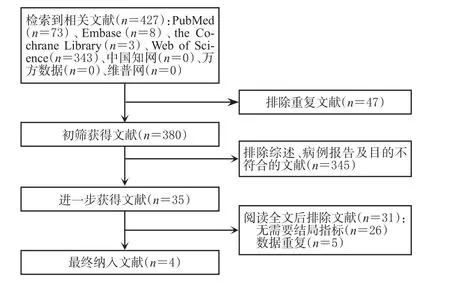
图1 文献筛选流程
2.2 纳入文献的质量评价结果
所有研究均为合理产生分配序列,结局数据均完整,对研究结局均进行了盲法评价,均未选择性报告结果[13,20―22];1项研究分配隐藏情况不详[21];1项研究未对研究者施盲[20];均不清楚是否存在其他偏倚来源。结果见图2、图3。

图2 偏倚风险总图

图3 偏倚风险条形图
2.3 Meta分析结果
2.3.1 OS 3 项研究报道了 OS[13,20,22]。各研究间无统计学异质性(P=0.50,I2=0),采用固定效应模型进行Meta分析。结果显示,试验组患者的OS显著高于对照组[HR=0.77,95%CI(0.64,0.94),P=0.01]。结果见图4。
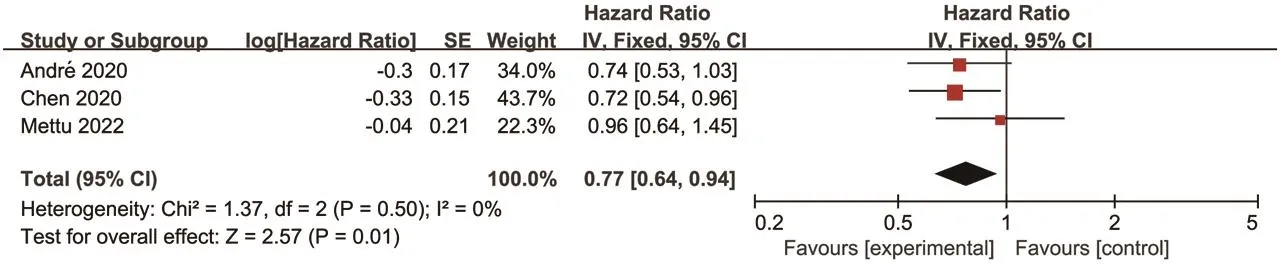
图4 两组患者OS的Meta分析森林图
2.3.2 PFS 3项研究报道了PFS[13,21―22]。各研究间无统计学异质性(P=0.62,I2=0),采用固定效应模型进行Meta分析。结果显示,试验组患者的PFS显著高于对照组[HR=0.67,95%CI(0.57,0.79),P<0.000 01]。结果见图5(因文献[20]仅报道了pMMR-MSS mCRC患者的PFS,故未纳入)。

图5 两组患者PFS的Meta分析森林图
按突变模式进行亚组分析。3项研究报道了pMMR-MSS mCRC患者的PFS[20―22]。各研究间无统计学异质性(P=0.59,I2=0),采用固定效应模型进行Meta分析。结果显示,试验组中pMMR-MSS mCRC患者的PFS显著高于对照组[HR=0.72,95%CI(0.61,0.85),P<0.000 1]。结果见图6。
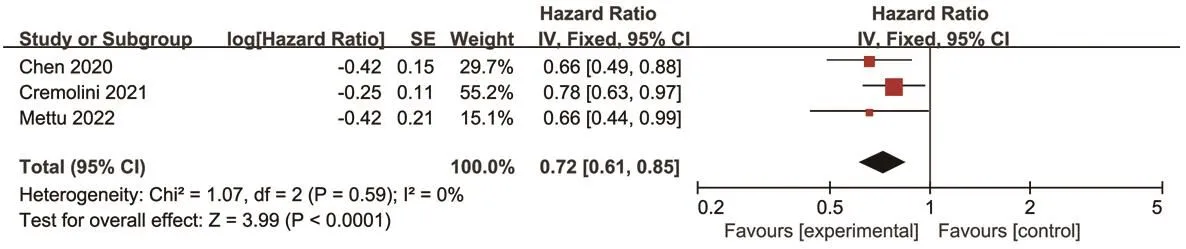
图6 两组pMMR-MSS mCRC患者PFS的Meta分析森林图
2.3.3 3级及以上不良事件发生率 4项研究报道了3级及以上不良事件发生率[13,20―22]。各研究间有统计学异质性(P<0.000 01,I2=92%),采用随机效应模型进行Meta分析。结果显示,两组患者3级及以上不良事件发生率比较,差异无统计学意义[RR=1.22,95%CI(0.77,1.94),P=0.39]。结果见图7。
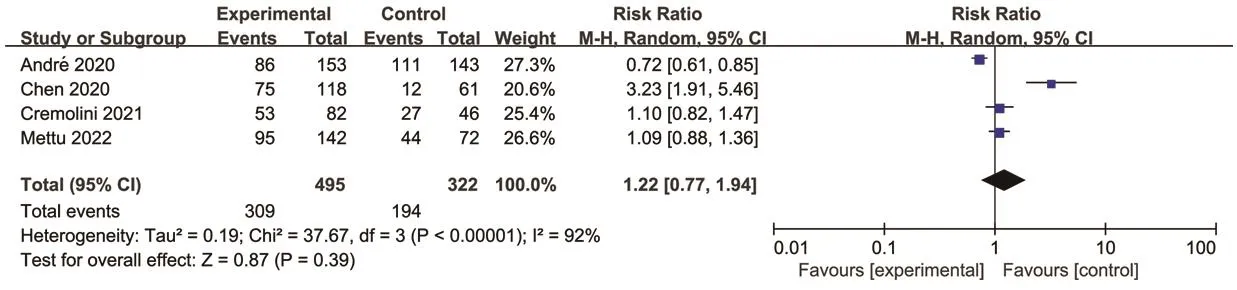
图7 两组患者3级及以上不良事件发生率的Meta分析森林图
由于试验组单用ICIs和ICIs联合化疗这两种方案的安全性存在显著差异,因此纳入试验组干预措施均为ICIs联合化疗,对照组均为传统化疗或最佳支持治疗的研究进行Meta分析。结果显示,各研究间无统计学异质性(P=0.97,I2=0),采用固定效应模型进行Meta分析。结果显示,两组患者3级及以上不良事件发生率比较,差异无统计学意义[RR=1.10,95%CI(0.92,1.31),P=0.30]。结果见图8。

图8 两组患者3级及以上不良事件发生率异质性分析的Meta分析森林图
2.4 敏感性分析
以3级及以上不良事件发生率为指标进行敏感性分析。在逐一剔除文献后,结果发现剔除后异质性较剔除前并未显著降低。这提示,本研究所得结果稳健。
3 讨论
虽然氟尿嘧啶、亚叶酸钙、奥沙利铂和伊立替康联合贝伐单抗是mCRC患者的一线治疗方案,但该方案的全身毒性较大、生存期欠佳[4]。加之《NCCN结肠癌临床实践指南》推荐使用ICIs治疗dMMR-MSI-H mCRC[14],这使得ICIs在近几年CRC领域陆续开展了临床试验,这也为本研究提供了数据支持。
本研究结果显示,mCRC患者使用ICIs治疗较传统化疗或最佳支持治疗在OS和PFS方面均有显著的获益。几项大型临床试验结果表明,PD-1单药治疗pMMR-MSS mCRC患者的临床效果较差[5,23―24]。这可能与pMMR-MSS mCRC患者对ICIs存在的3种潜在原发免疫抵抗机制有关[25―27]:第一,由于pMMR-MSS mCRC肿瘤突变低负荷导致肿瘤特异性抗原的表达降低,进而使pMMR-MSS mCRC的肿瘤细胞对CD8+T细胞的免疫原性较低[28―29];第二,CRC细胞抗原提呈的机制存在缺陷,其抗原提呈机制中的任何一个表达缺失或突变都将导致肿瘤特异性抗原的呈递功能失调,从而使肿瘤细胞逃避CD8+T细胞监视[30];第三,CRC的Wnt/β-catenin信号通路调节异常,这可能引起肿瘤细胞免疫逃逸,同时Wnt/β-catenin信号通路的调节异常也与CRC中CD8+T细胞的减少密切相关[31―32]。而本研究结果显示,pMMRMSS mCRC患者选择多种ICIs联用、ICIs联合化疗药较传统化疗或最佳支持治疗或许是一个更好的选择。其原因可能为多种ICIs联用、ICIs联合化疗可以在一定程度上避免pMMR-MSS mCRC肿瘤细胞对ICIs的免疫逃逸[33]。本研究中,两组患者3级及以上不良事件发生率比较差异无统计学意义,但由于纳入研究的样本量较小,此结果尚需更多临床数据进一步支持。此外,本研究中3级及以上不良事件发生率存在异质性的原因可能为:(1)患者接受的治疗方案不同,单用ICIs的安全性优于传统化疗或最佳支持治疗,多种ICIs联用或ICIs联合化疗的安全性并不优于传统化疗或最佳支持治疗;(2)不同的患者对于ICIs和传统化疗的耐受性不同;(3)纳入人群特征分布存在差异。敏感性分析结果显示,本研究所得结果稳健。
综上所述,与传统化疗或最佳支持治疗比较,ICIs可延长mCRC患者的OS和PFS,且在pMMR-MSS mCRC患者中可能更具优势;ICIs与传统化疗或最佳支持治疗的安全性相当。本研究的局限性为:(1)临床上应用ICIs治疗mCRC患者的RCT主要集中在近3年,较多的RCT未达到试验终点,故纳入的研究极其有限;(2)纳入pMMR-MSS mCRC患者的样本量较小,所得结果需谨慎对待;(3)由于纳入研究的数量较少,未进行发表偏倚分析。故本研究所得结论尚需更多大样本研究进一步证实。
