铝纳米粉末活化树突状细胞的作用
2023-02-25李知涵孙天盟
朱 歌, 李知涵, 刘 堃, 孙天盟
(1. 吉林大学第一医院, 长春 130000;2. 吉林大学化学学院, 超分子结构与材料国家重点实验室, 长春 130012)
疫苗作为一种主动免疫制剂, 是人类公共卫生事业的重要组成部分, 已经成为应对全球公共卫生问题的主要手段. 随着疫苗的广泛应用, 天花、 小儿麻痹及麻疹等多种疾病的发病率显著降低, 甚至被根除[1]. 癌症是以自身细胞基因突变、 异常分化无限增殖、 逃避机体免疫监视、 高浸润性和转移性为特征的一类疾病. 通常情况下, 肿瘤抗原的免疫原性差, 难以有效激活机体免疫系统对肿瘤细胞进行识别和清除. 此外, 肿瘤的异质性和免疫微环境的特殊性使肿瘤疫苗的有效性受到极大的限制[2~4]. 佐剂是一类非特异性免疫增强剂, 是疫苗的重要组成部分, 能够诱导机体对低免疫原性抗原产生免疫应答, 从而解决抗原自身免疫原性差难以诱导免疫反应的问题[5]. 肿瘤相关抗原被体内抗原提呈细胞(APCs)识别、 加工处理后, 通过APCs表面主要组织相容性复合体(MHC-Ⅰ/Ⅱ)-抗原复合物的形式, 将抗原信息提呈给T/B淋巴细胞, 启动适应性免疫反应. 研究表明, 预防肿瘤发生需要体液免疫和细胞免疫反应共同作用, 其中抗体介导的体液免疫发挥主要作用, 而控制肿瘤的生长则更依赖于细胞毒性T细胞介导的细胞免疫应答. 因此, 肿瘤疫苗对疫苗佐剂的性能提出了更高要求, 在增强机体免疫反应强度的同时, 要根据不同需求对机体免疫应答类型进行调控, 从而实现肿瘤精准预防和治疗[6~8].
从1926年明矾作为佐剂投入使用开始, 铝盐佐剂(主要包括磷酸铝和氢氧化铝), 已成为目前应用最为广泛的疫苗佐剂, 用于预防多种疾病的发生[9], 包括为应对近年来全球新型冠状病毒疫情而开发的多种疫苗也是以铝盐佐剂为主[10~13]. 在接近一个世纪的研究和临床应用中, 铝盐佐剂的安全性已经得到广泛认可, 也是首个被美国食品和药品管理局(FDA)批准用于人体的金属佐剂[14~16].
尽管历史悠久、 应用广泛, 但铝盐佐剂仍具有局限性. 铝盐佐剂是公认的体液免疫反应诱导剂[17], 其诱导细胞毒性T淋巴细胞介导的细胞免疫应答的效率非常低, 只适用于体液免疫反应可治疗疾病的疫苗开发[18]. 近年来, 纳米技术的发展为开发适用于肿瘤疫苗的新型铝佐剂提供了思路[19~22].金属铝不同于金、 银等传统贵金属元素, 具有易加工、 导热性强、 热膨胀系数小及介电性能好等特性[23]. 金属铝纳米粉末的合成方法主要包括电爆炸法[24]、 电子束光刻法[25]、 热分解法和催化分解法[26]. 热分解法和催化分解法属于化学合成法, 制得的金属纳米粒子具有形貌均一及分散性好等优势, 但因金属铝具有高还原电位很难被一般的还原剂还原, 同时缺少合适的表面配体, 化学合成法在铝纳米粉末制备工程中发展相对缓慢. 电爆炸法和电子束光刻法属于物理合成法, 电子束光刻法是将高速的电子打在光刻胶表面, 改变光刻胶的化学性质, 该方法制备的金属铝纳米粉末粒度均匀、 纯度高, 但对仪器要求高、 产量小[25]. 电爆炸法是指当强脉冲电流通过金属导体丝时, 电阻的加热作用迅速将电能转化为热能, 使导体丝物理状态发生变化, 经过固态加热、 熔化汽化、 爆炸、 电弧击穿及冷凝阶段, 得到高纯度纳米粒子的方法, 具有产量高、 通用性强及污染小等优点[24], 但传统电爆炸法没有提供外加配体, 制备的金属铝纳米粉末表面能很高, 通常表现为尺寸在微米级的聚集体形式, 如何实现分散聚集态粒子是目前面临的主要挑战.
本文利用金属丝电爆炸法制备形貌均一、 分散性良好的金属铝纳米粉末(ALEX), 建立了ALEX与抗原蛋白(OVA)和抗原多肽(Peptide)的复合方法, 验证了其增强抗原特异性免疫反应的能力. 在小鼠黑色素瘤模型中可有效预防肿瘤的发生, 为肿瘤疫苗的开发提供了有效策略.
1 实验部分
1.1 试剂与仪器
羧基端基聚苯乙烯, 分析纯, 加拿大Polymer Source公司; 甲苯溶剂及N,N-二甲基甲酰胺(DMF),分析纯, 上海安耐吉试剂公司; 铝金属丝, 直径0.2 nm, 纯度≥99%, 深圳鸿金泰公司; 磷酸盐缓冲液(PBS), 上海龙田技术有限公司; 抗原卵清蛋白(OVA), 美国Sigma Aldrich公司; 抗原多肽(Peptide),上海吉尔生化有限公司; 铝凝胶佐剂[Al(OH)3], 美国Thermo Fisher Scientific公司; 粒细胞-巨噬细胞集落刺激因子(GM-CSF), 美国Pepro Tech公司; 白介素-4(IL-4), 美国Pepro Tech公司; RPMI1640培养基, 美国Thermo Fisher Scientific公司; Anti-CD11c-APC/Cy7和H-2Kb-APC抗体, 美国Biolegend公司;OVA特异性IgG1及IgG2a抗体酶联免疫吸附(ELISA)检测试剂盒, 美国Alpha Diagnostic Intl公司. 雌性SPF级别C57BL/6小鼠, 6~8周, 体重16~18 g, 北京维通利华实验动物技术有限公司, 动物许可证号SCXK(京)-2016-0016. B16F10-OVA黑色素瘤细胞系为本实验室细胞库提供.
RPR-100型光化学反应器, 美国Rayonet公司; Hitachi-800型透射电子显微镜(TEM), 日本日立公司; Vertex 80V型傅里叶变换红外光谱仪(FTIR), 美国Bruker公司, 4000~400 cm-1; Nano-S90型动态光散射仪(DLS), 英国Malvern公司; PerkinElmer Lambda 950型紫外-可见(UV-Vis)分光光度计, 美国PerkinElmer公司; Eppendorf F-45-12-11型离心机, 德国Eppendorf公司. 多功能微孔板检测仪, 瑞士TECAN公司; LSR Fortessa型流式细胞仪, 美国Becton Dickinson Biosciences公司.
1.2 实验过程
1.2.1 铝纳米粉末的合成 在氩气环境中, 将铝金属丝固定在高压电极之间(所用供电器储存电容为96 μF, 电极的预放电电压为4.0~4.4 kV), 在100 kA的电流强度下, 铝丝被加热并发生径向膨胀, 迅速汽化形成铝蒸汽, 随后冷凝形成ALEX, 在充满氩气的收集器中收集样品. 后续反应在氮气环境及800 r/min搅拌条件下进行, 将1 mg ALEX和5 mg羧基端基的聚苯乙烯(数均分子量为4700, 分散度1.09)分别加入含有2 mL甲苯的Slank瓶中, 在液氮条件下反复冻融3次, 在80 ℃下反应24 h, 反应溶液逐渐变成黑色均匀液体, 以10000 r/min的速度离心15 min后用等体积甲苯反复洗涤5次, 得到分散性良好的ALEX.
1.2.2 铝纳米粉末与抗原的复合物(ALEX-OVA)制备 超声条件下将5 mL浓度为2 mg/mL的ALEX的DMF溶液和5 mL浓度为3 mg/mL的OVA/Peptide抗原的PBS溶液加入10 mL样品瓶中, 超声5 min后分装至1.5 mL EP管中, 用封口膜密封后置于25 ℃水浴锅中反应12 h, 以10000 r/min的速度离心10 min收集产物, 在25 ℃下真空干燥12 h, 将得到的样品在4 ℃条件下保存.
1.2.3 铝纳米粉末增强抗原提呈效果 无菌分离C57BL/6小鼠双侧股骨和胫骨, 使用无菌注射器反复冲洗骨髓腔, 所得细胞悬液以1650 r/min的速度离心5 min后, 加入红细胞裂解液于冰上处理15 min,用含有20 ng/mL GM-CSF和10 ng/mL IL-4的RPMI1640完全培养基调整细胞浓度为5×105cell/mL, 24孔板铺板(5×105cell/孔), 置于细胞培养箱中诱导分化骨髓来源的树突状细胞(BMDCs), 分别于体外诱导第2天和第4天每孔除去500 μL培养基, 再加入500 μL含有20 ng/mL GM-CSF 和10 ng/mL IL-4的RPMI1640完全培养基, 体外诱导第6天向培养基中分别加入PBS, OVA溶液, Al(OH)3-OVA溶液或ALEX-OVA溶液, 各组OVA蛋白的终浓度为10 μg/mL, 置于细胞培养箱中继续培养24 h. 消化并以1650 r/min的速度离心5 min收集BMDCs, 用anti-CD11c-APC/Cy7和H-2Kb-APC抗体进行标记, 于4 ℃避光染色30 min, 并用PBS洗涤3次, 得到的BMDCs用流式细胞仪进行检测.
1.2.4 铝纳米粉末提高特异性抗体水平测试 检测前的第14和7天, 在C57BL/6小鼠右侧腹股沟部位皮内注射PBS, OVA溶液, Al(OH)3-OVA溶液或ALEX-OVA溶液. 利用下颌静脉采血方式取小鼠外周血, 室温下静置4 h后, 以3000 r/min的速度离心15 min收集上层血清. 采用ELISA法检测血清中OVA特异性IgG1及IgG2a抗体水平.
1.2.5 铝纳米粉末疫苗的肿瘤预防实验 检测前的第14和7天, 在C57BL/6小鼠右侧腹股沟部位皮内注射PBS, OVA/Peptide溶液, Al(OH)3-OVA/Peptide溶液或ALEX-OVA/Peptide溶液, 建立小鼠黑色素瘤模型, 右侧背部皮下接种B16F10-OVA细胞(5×105cell/只). 监测肿瘤大小及小鼠生存期, 肿瘤的体积按下式计算: 肿瘤体积(mm3)=1/2×肿瘤长径(mm)×肿瘤短径(mm)×肿瘤短径(mm).
2 结果与讨论
2.1 铝纳米粉末的合成
利用电爆炸法, 使铝金属丝经过固态加热、 汽化、 爆炸、 电弧击穿及冷凝5个阶段, 得到高纯度、 聚合态的ALEX. 利用聚苯乙烯的羧基端基“刻蚀”粒子表面的部分氧化铝, 实现稳定、分散聚集态粒子的目的, 制备了分散性良好的ALEX[27]. 利用DLS和TEM对其尺寸和形貌进行了表征. 由图1可见, 制得的ALEX形貌为近球形的菱方八面体, 粒子间未发生聚集现象, 分散性良好. 根据检测结果发现,ALEX的尺寸为(139.7±42.8) nm, 表面电势为(-34.0±1.1) mV.
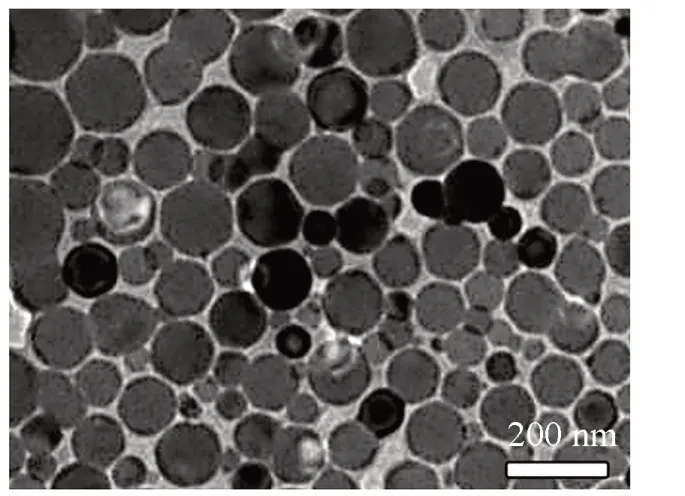
Fig.1 TEM image of ALEX
2.2 铝纳米粉末与抗原的复合
在分散性良好的ALEX基础上, 通过静电物理吸附的方法将OVA和Peptide接枝于ALEX表面.FTIR检测结果(图2)显示, 与OVA共孵育后的ALEX表面存在OVA蛋白的特征信号峰, 表明抗原蛋白OVA已吸附于ALEX表面, 应用二辛可宁酸(BCA)法测得ALEX表面OVA蛋白的质量比为7∶1, 即1 mg ALEX能够结合0.143 mg OVA蛋白, 表明建立了稳定的抗原与ALEX的复合方法.利用DLS对ALEX-OVA的尺寸形貌进行了表征,ALEX-OVA的尺寸为(297.4±37.8) nm, 表面电势为(-36.5±2.3) mV, 其尺寸较未结合抗原蛋白的ALEX有所增加, 进一步证明ALEX表面已吸附上OVA, 且依然保持良好的分散性.
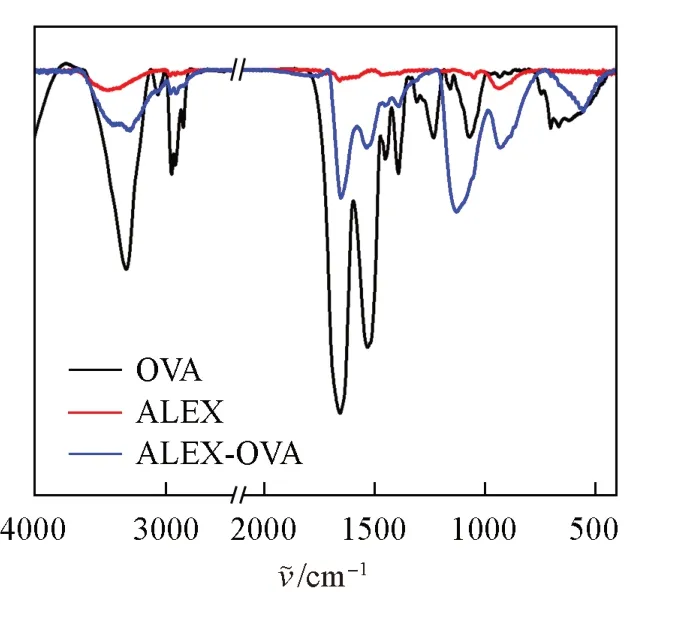
Fig.2 Infrared spectra of ALEX-OVA
2.3 铝纳米粉末增强抗原提呈效果
树突状细胞(DCs)是目前所知功能最强大的抗原提呈细胞(APCs), 在各种疾病的预防和治疗过程中发挥着重要作用, 其通过对抗原的识别、 加工处理及提呈等, 成为连接抗原信号和机体免疫反应的“桥梁”, 是激活机体免疫反应的重要环节之一[28~31].
为了明确ALEX能否诱导抗原特异性免疫反应, 对与ALEX-OVA共孵育后的BMDCs表面抗原特异性MHC-Ⅰ类分子复合物的表达水平进行了检测. 流式细胞术检测结果[图3(A)和(B)]显示, 与OVA蛋白组相比, ALEX-OVA显著提高了BMDCs表面抗原特异性MHC-Ⅰ类分子复合物的表达水平. 在相同Al和OVA剂量的条件下, Al(OH)3-OVA仅在一定范围内促进BMDCs表面抗原特异性MHC-Ⅰ类分子复合物的表达, 其作用显著低于ALEX-OVA. 这一结果表明, ALEX-OVA具有显著增强DCs抗原提呈的作用.
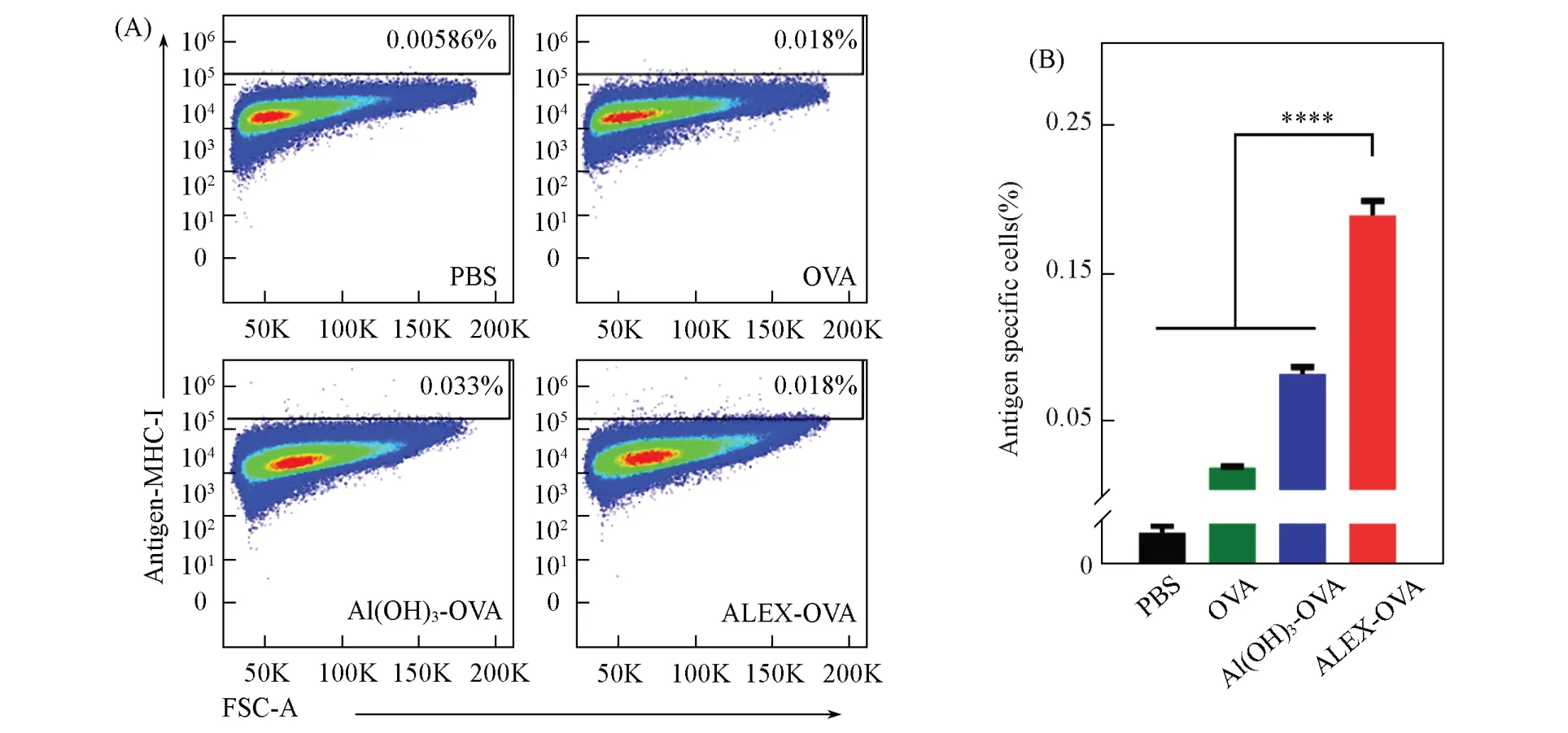
Fig.3 Representative flow cytometry results(A) and quantitative evaluation(B) of antigen-MHC-I presentation of BMDCs co-cultured with PBS, OVA, Al(OH)3-OVA and ALEX-OVA in vitro
2.4 铝纳米粉末提高特异性抗体水平
疫苗接种后能诱导机体产生抗原特异性抗体是评价疫苗有效性的重要指标之一, 体内B细胞接收到APCs所提呈的抗原信息后, 开始增殖分化, 形成浆细胞或记忆B细胞, 浆细胞产生的抗体具有中和、 清除病原微生物及其致病毒素的作用[32,33]. 免疫球蛋白(IgG)是血清中抗体的主要成分, 是机体免疫系统的重要组成部分. IgG1是含量最多的一种IgG亚型, 在机体免疫治疗中具有重要意义, 主要介导2型辅助性T细胞(Th2)型体液免疫应答, 但无补体激活功能. IgG2a主要介导细胞免疫应答, 同时可通过经典途径活化补体, 发挥免疫应答功能. 对疫苗免疫后血清抗原特异性IgG水平进行检测是衡量特异性免疫反应最常用的方法[34,35].
为了验证ALEX提高体内抗原特异性抗体水平的效果, 应用酶联免疫吸附(ELISA)法对皮内注射免疫后的小鼠血清进行了抗原特异性IgG1及IgG2a抗体水平的定量检测. 由图4(A)和(B)可见, 与PBS和OVA蛋白对照组相比, 传统Al(OH)3佐剂能够提高小鼠血清中抗原特异性IgG1及IgG2a抗体的水平. 在相同剂量Al和OVA条件下, ALEX-OVA免疫后小鼠血清中OVA特异性IgG1及IgG2a抗体水平进一步显著提高, 证明ALEX可以诱导机体产生抗原特异性免疫应答, 且优于传统Al(OH)3佐剂, 为ALEX增强抗原特异性免疫反应提供了理论支撑.
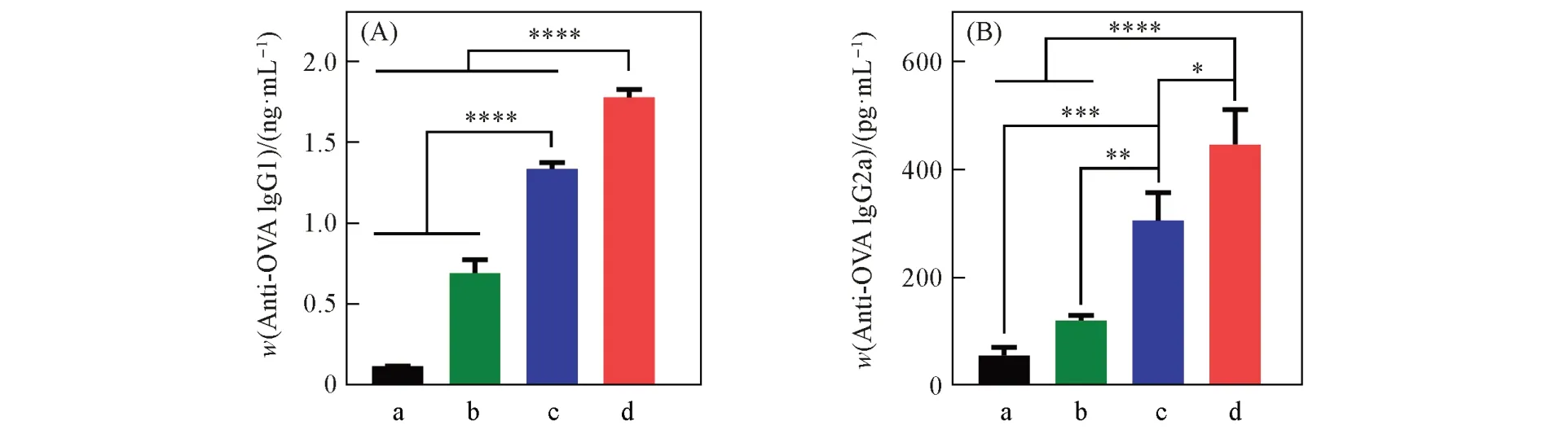
Fig.4 Levels of antigen-specific IgG1(A) and IgG2a(B) antibodies enhanced by ALEX in vivo
2.5 铝纳米粉末疫苗有效预防黑色素瘤
在验证了ALEX能够增强抗原特性免疫反应的基础上, 应用小鼠黑色素瘤模型对含ALEX的疫苗的肿瘤预防作用进行了验证. 图5(A)结果显示, 与PBS组相比, 用OVA蛋白对小鼠进行处理, 对黑色素瘤肿瘤生长具有较轻的抑制作用, 但所有接种肿瘤细胞的小鼠均能成瘤, 说明单纯的OVA蛋白抗原无法刺激机体产生足够强度的特异性抗肿瘤免疫反应, 不能有效预防肿瘤的发生. 在传统Al(OH)3佐剂存在的条件下, 联合OVA蛋白共同应用, 与抗原蛋白单独处理相比, 显示出抑制肿瘤细胞在小鼠体内成瘤的效果, 且延缓肿瘤生长的作用也有所提高, 但并不能完全预防肿瘤的发生, 证明传统Al(OH)3佐剂在诱发机体特异性抗肿瘤免疫应答方面仍有欠缺, 并不能刺激机体产生足够有效的抗肿瘤免疫反应. 应用合成的ALEX与OVA蛋白复合物对小鼠进行处理, 所有进行肿瘤细胞接种的小鼠均未形成肿瘤, 说明ALEX具有显著增强体内特异性抗肿瘤免疫反应的效果, 完全预防了小鼠黑色素瘤的形成, 发挥了强大的肿瘤预防作用.

Fig.5 Tumor growth curves of tumor-bearing mice prevented by PBS, OVA, Al(OH)3-OVA and ALEX-OVA(A) and PBS, Peptide, Al(OH)3-Peptide and ALEX-Peptide(B)
图5(B)结果显示, 当抗原为多肽(Peptide)时, 应用单纯的Peptide处理小鼠, 同样无法有效预防肿瘤的发生. 联合传统Al(OH)3佐剂对小鼠进行处理后, 并不能提高对黑色素瘤的预防和抑制作用. 多肽抗原联合ALEX共同应用可显著抑制小鼠黑色素瘤的生长. 综上可见, 合成的ALEX可以增强体内特异性抗肿瘤免疫反应, 有效预防和控制肿瘤的发生和发展, 在Al剂量和负载抗原相同的条件下, 克服了传统Al(OH)3凝胶佐剂难以诱导抗肿瘤免疫应答的缺点, 有望为肿瘤疫苗开发提供策略.
3 结 论
应用金属丝电爆炸法合成了ALEX, 在此基础上应用羧基端基聚合物配体与ALEX表面反应, 达到稳定、 分散ALEX的目的, 克服了传统电爆炸法制备铝纳米粉末聚集的缺陷, 得到分散性良好的ALEX. 然后, 利用静电物理吸附的方法将抗原蛋白(OVA)和抗原多肽(Peptide)结合于ALEX表面, 通过FTIR检测确定了这种抗原结合方法的可行性, 建立了稳定的抗原与ALEX的复合方法. 为验证ALEX增强特异性免疫反应的效果, 分别进行了体外及体内实验. 体外实验结果证明, ALEX-OVA复合物可提高BMDCs表面MHC-Ⅰ类分子-抗原复合物的表达水平, 增强其抗原提呈效果; 体内实验结果证明, ALEX-OVA复合物可显著增加小鼠体内抗原特异性抗体的水平. 上述结果均为ALEX增强机体特异性免疫反应提供了理论基础. 最后, 应用小鼠黑色素瘤模型, 进一步证实了ALEX-抗原复合物良好的肿瘤预防抑制效果. 因此, 合成的ALEX是有望为肿瘤等多种疾病疫苗的开发提供策略.
