对二氯苯和N-甲基-4-氨基丁酸钠的反应动力学
2023-02-24陈志荣袁慎峰贾艳宇李沃源贾锦波邓杭军周银娟
尹 红, 申 尧, 陈志荣, 袁慎峰, 贾艳宇, 蒋 杰, 李沃源,贾锦波, 邓杭军, 李 鹏, 竹 弘, 周银娟
(1. 浙江大学 化学工程与生物工程学院, 浙江 杭州 310058;2. 浙江省智能生物材料重点实验室, 浙江 杭州 310058;3. 浙江新和成特种材料有限公司, 浙江 上虞 312369; 4. 浙江新和成研究院, 浙江 新昌 312599)
1 前 言
聚苯硫醚(PPS)因优异的耐热性和耐化学腐蚀性而广泛应用[1-3]。PPS 通过硫化钠法生产,即硫化钠和对二氯苯(DCB)在极性非质子溶剂N-甲基-2-吡咯烷酮(NMP)中于高温高压下聚合[4]。聚合前的脱水过程中硫化钠水解生成硫氢化钠和氢氧化钠,后者和NMP 反应生成N-甲基-4-氨基丁酸钠(SMAB),SMAB与硫氢化钠形成复合物SMAB-NaSH,该复合物在高温下能溶解于NMP、使得含硫单体溶解、进而聚合反应在均相体系中进行[5]。然而SMAB 会和DCB 中的氯原子或者PPS 分子链的氯端基发生取代反应,导致 DCB 转化率降低、PPS 链增长终止[5]。Gies 等[6]用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)分析PPS端基,检测到端基为SMAB的PPS分子链。Fahey等[7]采用高效液相色谱(HPLC)在PPS 滤液中检测到SMAB 与DCB 的取代反应产物N-甲基-N-(4-氯苯基)-4-氨基丁酸钠(p-SCMAB)。此外,Fahey 等[5,8]通过小分子反应模拟和计算机模拟研究PPS 链增长和环化反应的动力学,测得SMAB 与DCB 取代反应的活化能为167.43 kJ·mol-1。然而,Fahey 等人仅用气相色谱追踪了DCB 浓度随反应时间的变化,没有研究反应产物组成,也没有涉及DCB 的水解及其他副反应。
DCB 与SMAB 的反应[9]过程比较复杂,包括两类反应:SMAB 取代DCB 氯原子的相关反应,DCB水解的相关反应;涉及的反应机理也有两种:芳香亲核加成-消除(SN2Ar)机理和芳香炔中间体机理。基于反应过程分析,作者研究了反应产物N,N'-二甲基-N,N'-(1,4-亚苯基)-4,4'-二氨基二丁酸钠(para-d-SPMAB)和N,N'-二甲基-N,N'-(1,3-亚苯基)-4,4'-二氨基二丁酸钠 (meta-d-SPMAB)(一对位置异构体,本研究视为同一类产物,记为d-SPMAB)、N-甲基-N-(3-氯苯基)-4-氨基丁酸钠(m-SCMAB)、N-甲基-N-(4-氯苯基)-4-氨基丁酸钠(p-SCMAB)和对氯苯酚钠(p-SCP) 的生成反应动力学。
2 实验部分
2.1 材料
NMP(阿拉丁公司,质量分数w=99.5%);DCB(麦克林试剂,w=99%),DCB 标准样品(麦克林试剂,w=99.9%),对氯苯酚标准样品(麦克林试剂,w=99.5%),水(麦克林试剂,HPLC 级);氢氧化钠(国药集团,w=96%);SMAB 通过NMP 与氢氧化钠水溶液反应制备[9];甲醇(HPLC 级)。
2.2 实验
将0.1 mol DCB、一定量的SMAB 以及600 g NMP-H2O(水物质的量nH2O=0~1.5 mol)投入1 L 高压反应釜,向釜内鼓泡通氮气20 min 以置换釜内空气[10]。升温到设定温度(PPS 聚合反应温度范围)后开始计时,保温反应12 h 以上,每隔1 h 取样,准确称取约0.2 g 样品、加入HPLC 甲醇定容至10 mL,然后用于HPLC 检测。
2.3 分析方法
SMAB 的浓度计算详见3.1,其余含苯环物质采用HPLC 检测并用外标法计算浓度。DCB 和p-SCP的标准物质可通过商业购买获得;4,4'-二氯二苯醚(p-CPE)的标准物质根据Maiti 等[11]报道的方法制备。p-SCMAB 的标准物质根据Chen 等[12]、Dombrowski 等[13]报道的方法制备;m-SCMAB 和d-SPMAB 的标准物质从DCB 和SMAB 的反应产物中分离得到[9]。
HPLC 分析仪器及条件[9]如下:
仪器:岛津Prominence LC-20A,配备SPD-M20A 二极管阵列检测器;色谱柱:岛津Shim-pack VP-ODS,260 mm×4.6 mm;流动相:甲醇和0.01 mol·L-1的磷酸二氢钾缓冲溶液(用磷酸调节pH=2.6);洗脱方法:梯度洗脱;进样量:10 μL;柱温:40 ℃;检测波长:265 nm。数据处理软件:LCsolution。
通过标准曲线计算得到稀释样品中物质i的浓度ci,根据式(2)计算得到反应器中物质i的实际浓度Ric。
式中:ci为稀释样品中任一芳氯物质i的浓度,mol·L-1;Mw,i为物质i的摩尔质量,g·mol-1;Vi为稀释后样品的体积,Vi=0.01 L;V为反应溶液体积,L;m为用于稀释的样品质量,g;mt为加入反应器的物料总质量,g。
3 动力学模型与动力学方程
3.1 SMAB 的定量
DCB 与SMAB 反应过程中SMAB 取代氯原子的反应和DCB 的水解反应都释放质子氢,而质子氢无法稳定存在于碱性反应环境。Fahey 等[5]认为SMAB 不仅是亲核反应底物,也是质子捕捉剂,但他们没有提及SMAB 与质子氢作用的机理。SMAB 捕获质子后转变为共轭酸N-甲基-4-氨基丁酸(MABA),由于氨基具有较强的亲核性,MABA 容易环化[14],生成溶剂NMP,同时将高反应性的质子转化为水,推动DCB 的亲核反应正向进行。因此,反应体系中取代1 个氯原子消耗2 分子SMAB。忽略体系中的微量反应,得时间t=0 时SMAB 的浓度cSMAB,0:
式中:cSMAB,input为SMAB 的投料浓度,mol·L-1;cp-SCP,0、cd-SPMAB,0、cp-SCMAB,0、cm-SCMAB,0分别为t=0 时p-SCP、d-SPMAB、p-SCMAB、m-SCMAB 的浓度,mol·L-1。
再根据DCB 的消耗量,得到反应过程中时间t=j(j=1,2,3……) h 时SMAB 浓度cSMAB,j:
式中:cDCB,0为t=0 时DCB 的浓度,mol·L-1;cDCB,j为t=j(j=1,2,3……) h 时DCB 的浓度,mol·L-1。
3.2 动力学模型
鉴于DCB 与SMAB 反应过程和产物组成比较复杂,研究发现产物如三聚醚和脱氯产物的生成量非常低[9],故动力学模型中不予考虑,仅考察d-SPMAB、m-SCMAB、p-SCMAB 和p-SCP 的生成反应动力学。
DeWit 等[15]发现含有MABA 结构片段的物质在室温、中性溶液中环化反应的半衰期小于10 s,可以推测,高于200 ℃、碱性环境中,SMAB 捕获质子氢转变为MABA 后环化生成NMP 和水的反应极快,不是DCB 和SMAB 反应过程的速率控制步骤。建立动力学模型时忽略SMAB 与质子氢的反应。同样DCB 水解产物对氯苯酚和SMAB 反应生成p-SCP 的速率也非常快,建立动力学模型时对氯苯酚的浓度视为零、p-SCP 视为DCB 水解反应的直接产物。
DCB 与SMAB 反应过程中存在SN2Ar 机理和芳香炔中间体机理[9]。按SN2Ar 机理进行的反应中芳氯和亲核底物碰撞形成σ络合物的过程是速率控制步骤[16],之后的质子转移等步骤可忽略。故建立动力学模型时,将芳氯的SN2Ar 亲核取代简化为一步碰撞反应。
芳香炔的生成过程包括SMAB 夺取苯环上与氯相邻的质子氢形成碳负离子、碳负离子上的氯携带负电荷离去生成芳香炔,这两步都可能成为速率控制步骤[17]。然而,SMAB 的碱性不强,故将其夺取芳氯质子的过程视为芳香炔中间体生成反应的速率控制步骤,在动力学模型中将芳香炔的生成简化为芳氯和SMAB 的一步碰撞反应。
产物d-SPMAB 可能是p-SCMAB 或者m-SCMAB 由芳香炔中间体生成。由于反应体系中p-SCMAB的量远高于m-SCMAB,p-SCMAB 只生成一种芳香炔中间体Aryne2(结构见图1),SMAB 在Aryne2 的a、b两个位点发生加成反应的概率几乎相同[18],如果d-SPMAB主要由p-SCMAB生成,则最终对位d-SPMAB即para-d-SPMAB 和间位d-SPMAB 即meta-d-SPMAB 物质的量比应该接近1:1。然而体系产物的LC-MS分析结果表明para-d-SPMAB 和meta-d-SPMAB 物质的量比为1:1.6,说明d-SPMAB 主要源自m-SCMAB。建立动力学模型时忽略p-SCMAB 生成d-SPMAB 的反应、d-SPMAB 视为仅由m-SCMAB 反应生成。
图1 DCB 与SMAB 反应动力学模型Fig.1 Kinetic models for reaction of DCB with SMAB
基于上述分析与简化,得到图1 所示的DCB 与SMAB 反应动力学模型,图中k1、k2、k3……k13分别表示对应反应的反应速率常数。
3.3 动力学方程
首先推导d-SPMAB 的生成速率方程。HPLC 检测发现d-SPMAB 的对位和间位异构体无法分离,d-SPMAB 的生成速率是para-d-SPMAB 和meta-d-SPMAB 的生成速率之和,即
式中:cd-SPMAB为d-SPMAB 的浓度,mol·L-1;cpara-d-SPMAB为para-d-SPMAB 的浓度,mol·L-1;cmeta-d-SPMAB为meta-d-SPMAB 的浓度,mol·L-1。
根据质量作用定律,para-d-SPMAB 和meta-d-SPMAB 的生成速率分别为
式中:cSMAB为SMAB 的浓度,mol·L-1;cAryne2为中间体Aryne2 的浓度,mol·L-1;cAryne3为中间体Aryne3的浓度,mol·L-1。
将式(6)和 (7)代入式(5),得
芳香炔中间体Aryne2 和Aryne3 的生成速率分别为
式中:cm-SCMAB为m-SCMAB 的浓度,mol·L-1。
由于芳香炔中间体反应活性高[17],根据稳态假设,分别令式(9)和 (10)等于零,得
将式(11)和(12)代入式(8),得到d-SPMAB 的生成速率:
对式(13)积分得
令
式中:Yd表示d-SPMAB 浓度随反应时间t的积分值,mol·L-1;Xd表示m-SCMAB 与SMAB 浓度乘积随反应时间t的积分值,mol2·L-2·h;kd为d-SPMAB 生成反应的表观反应速率常数,L·mol-1·h-1。将Yd对Xd作图,可得斜率为kd的直线。
根据质量作用定律,m-SCMAB 和p-SCMAB 的生成速率可表示为
式中:cDCB为DCB 的浓度,mol·L-1。
芳香炔中间体Aryne1 的生成速率可表示为
式中:cH2O为水的浓度,mol·L-1;cAryne1为中间体Aryne1 的浓度,mol·L-1。
根据稳态假设,令式(17)等于零;Aryne1 的2 个加成位点的反应速率相同[18],即k4=k5,k6=k7;得
由于SMAB 的亲核性远大于水,m-SCMAB 的生成量远大于间氯苯酚钠,这意味着,忽略这一项、令并代入式(18),得到Aryne1 的浓度:
式中:kAr为DCB 生成中间体Aryne1 的表观反应速率常数。
将式(13)和(19)代入式(15),得
令
得
式中:cm-SCMAB,all为所有由芳香炔中间体机理生成的m-SCMAB 的浓度,mol·L-1。对式(21)积分得
令:
式中:Ym表示cm-SCMAB,all随反应时间t的积分值,mol·L-1;Xm表示DCB 与SMAB 浓度乘积随反应时间t的积分值,mol2·L-2·h;km为m-SCMAB 生成反应的表观反应速率常数,L·mol-1·h-1。用Ym对Xm作图,可得斜率为km的直线。
将式(19)、(20)和k4=k5代入式(16),有
令
代入式(23)得
式中:cp-SCMAB,SN2Ar为所有由SN2Ar 机理生成的p-SCMAB 的浓度,mol·L-1。对式(24)积分得
令:
式中:Yp表示cp-SCMAB,SN2Ar随反应时间t的积分值,mol·L-1;kp表示p-SCMAB 生成反应的表观反应速率常数,L·mol-1·h-1。将Yp对Xp作图,可得斜率为kp的直线。
根据质量作用定律,p-SCP 的生成速率可表示为
忽略低浓度产物,则4,4’-二氯二苯醚(p-CPE)的生成速率可表示为
式中:cp-CPE为p-CPE 的浓度,mol·L-1;cp-SCP为p-SCP 的浓度,mol·L-1。
将式(19)和(27)代入式(26),令
得
式中:cp-SCP,all为所有p-SCP(包括转化为p-CPE 的部分)的浓度。对式(28)进行积分得
通常反应生成的水的量远小于反应前加入的水的量,式(29)中cH2O可视为常数,令
式中:YSCP表示cp-SCP,all随反应时间t的积分值,mol·L-1;XSCP表示DCB浓度随反应时间t的积分值,mol·L-1·h;kSCP表示p-SCP 生成反应的表观反应速率常数,h-1。将YSCP对XSCP作图,可得斜率为kSCP的直线。
4 结果与讨论
本研究建立动力学模型后通过质量作用定律和稳态假设得到了主产物d-SPMAB、m-SCMAB、p-SCMAB 以及p-SCP的生成速率及其浓度随时间的变化表达式。运用实验数据进行线性拟合获得相关动力学模型参数,并探讨反应温度、SMAB 与DCB 物质的量比nSMAB:nDCB、体系水含量nH2O对反应的影响。0.1 mol DCB 与 0.2 mol SMAB 在 600 g NMP-H2O(nH2O=1 mol)中于260 ℃下反应,测得典型的浓度-时间曲线如图 2 所示,图中cproduct为产物d-SPMAB、m-SCMAB、p-SCMAB、p-SCP 的浓度。

图2 典型的浓度-时间曲线Fig.2 Typical concentration-time curves
4.1 反应温度
0.1 mol DCB 与0.2 mol SMAB 在600 g NMP-H2O(nH2O=1 mol)中分别于240、260、270、280 ℃下反应,主要产物d-SPMAB、m-SCMAB、p-SCMAB 和p-SCP 的生成反应动力学方程的拟合结果如图3 所示。反应初期,Yα(α= d,m,p 和SCP)和Xα呈良好线性关系,表明动力学模型和动力学方程很好地描述了反应过程。反应温度较高时,反应后期因副反应大大增多而使得反应偏离动力学模型和动力学方程的描述对象与范围,Yα和Xα逐渐偏离线性关系。拟合直线斜率为相应的表观反应速率常数,表1 显示了不同温度下各产物生成反应的表观反应速率常数。如图 4 所示,采用阿伦尼乌斯方程进行数据处理,得到各反应的表观活化能(见表2)。表中,δ为拟合直线的斜率,;A为指前因子,h-1;Ea为活化能,kJ·mol-1;T为热力学温度,K;R为理想气体常数,8.314 J·mol-1·K-1;R2为相关系数。
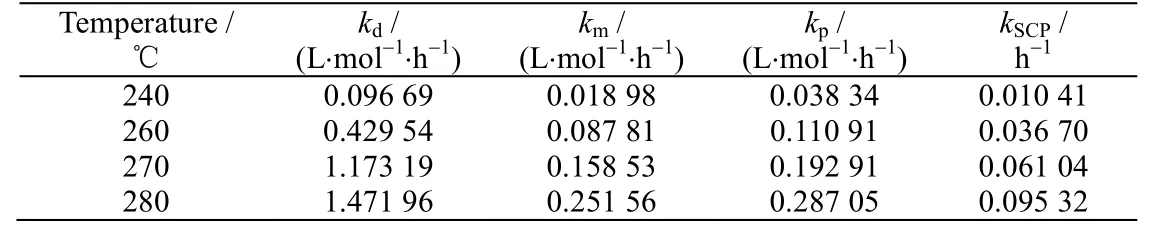
表1 不同温度下的表观反应速率常数Table 1 Apparent reaction rate constants at different temperatures

图3 不同反应温度下动力学方程的拟合结果Fig.3 Fitting results by kinetic integral equations at different reaction temperatures
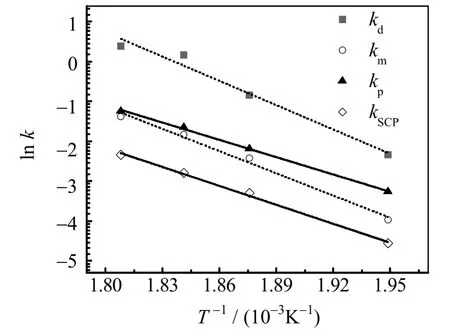
图4 ln k-1/T 图Fig.4 ln k-1/T plot

表2 各生成反应表观活化能Table 2 Apparent activation energies of different product formation reactions
表2 的表观活化能从高到低依次为DCB 与SMAB 经由芳香炔中间体反应的反应活化能、DCB 经由SN2Ar 机理水解的活化能、DCB 与SMAB 经由SN2Ar 机理反应的活化能,由此可推知聚合制备PPS 时SMAB 与PPS 氯端基经由芳香炔中间体机理反应的活化能大于经由SN2Ar 机理反应的活化能。Fahey 等[5]已证明PPS 链增长反应活化能远低于SMAB 与PPS 氯端基经由SN2Ar 机理反应的活化能。因此,相比于PPS 链增长反应,聚合反应过程中PPS 氯端基通过芳香炔中间体机理发生反应的概率非常低、可忽略不计。但是,正如表1 所示,DCB 与SMAB 经由芳香炔中间体机理反应的表观反应速率常数随温度的变化速率较大,如果反应温度过高,这个反应发生的概率将大大增加。此外,DCB 水解反应活化能高于DCB与SMAB 经由SN2Ar 机理反应的活化能,说明PPS 氯端基更容易被SMAB 取代而不是水解生成酚端基。如果聚合反应温度过高,更多的PPS 氯端基将被SMAB 取代或者水解生成酚端基,导致PPS 的氮含量和氧含量升高。
4.2 SMAB 与DCB 物质的量比
研究发现SMAB 与DCB 物质的量比nSMAB:nDCB越大,反应越快[9],但nSMAB:nDCB对反应机理的影响未知。0.1 mol DCB 分别与0.1、0.15 或0.2 mol 的SMAB 在600 g NMP-H2O(nH2O=1 mol)中于260 ℃下反应,主要产物生成反应动力学拟合结果如图5 所示。对于d-SPMAB、m-SCMAB 和p-SCMAB 的生成反应,nSMAB:nDCB对直线斜率的影响不显著、反应速率常数几乎相同,表明nSMAB:nDCB对这些反应机理的影响不显著。对于DCB 水解生成p-SCP 的反应,nSMAB:nDCB较小时,YSCP和XSCP仅在反应初期呈线性关系。随着反应进行,YSCP随XSCP的增长变慢甚至停止。随着SMAB 的消耗,体系碱性逐渐降低,DCB 水解反应逐渐变慢,直至体系碱性不足以催化DCB 水解。由于反应动力学模型没有考虑SMAB 的催化作用,因此YSCP对XSCP的拟合直线的斜率不同。
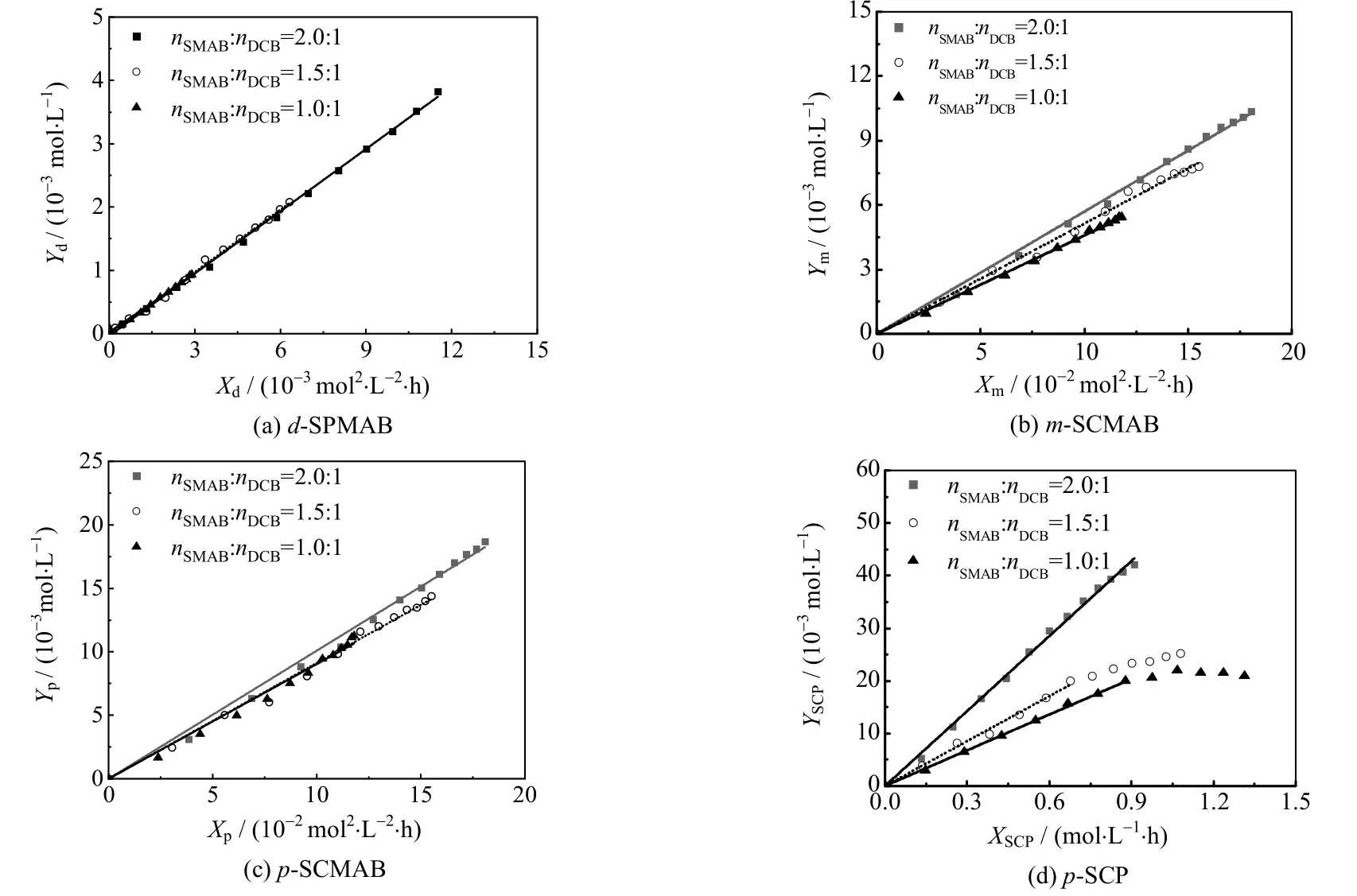
图5 不同SMAB 与DCB 物质的量比下动力学方程的拟合结果Fig.5 Fitting results by kinetic integral equations at different molar ratios of SMAB to DCB
4.3 水含量
0.1 mol DCB 与0.2 mol SMAB 在600 g NMP-H2O(nH2O分别为0、0.5、1、1.5 mol)中于260 ℃下反应,拟合结果如图6 所示。反应初期Yα与Xα呈良好线性关系。当nH2O较小时,DCB 与SMAB 反应较快,反应后期因初始反应物浓度大大降低、产物相关的副反应大大增多使得反应偏离了动力学模型和动力学方程的描述对象与范围,导致Yα与Xα逐渐偏离线性关系。
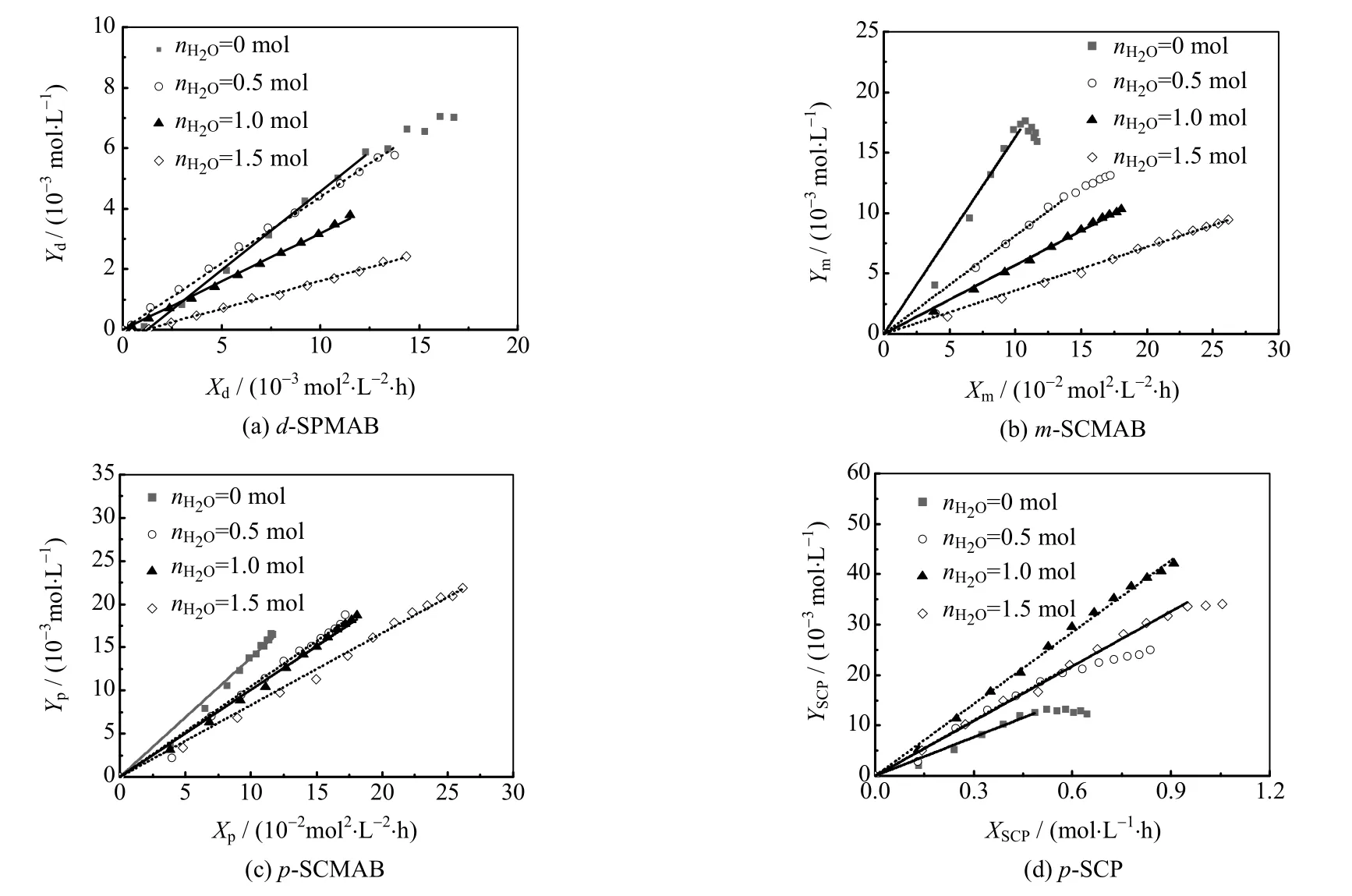
图6 不同加水量条件下动力学方程的拟合结果Fig.6 Fitting results by kinetic integral equations under different water contents
水对SMAB 的溶剂化作用使SMAB 亲核性降低,本研究动力学模型忽略了水的溶剂化作用,由于动力学方程导出的Xα包含SMAB 浓度项,因此水的溶剂化作用通过表观速率常数表现出来。d-SPMAB、m-SCMAB 和p-SCMAB 相关拟合结果显示体系中水含量越高拟合直线斜率越小,即表观反应速率常数越小。
p-SCP 是DCB 和水在SMAB 催化下生成,水作为亲核底物、含量越高越有利于p-SCP 生成,同时水的溶剂化作用降低SMAB 碱性,不利于其发挥催化作用。nH2O=0~1.0 mol 时水作为亲核底物发挥主导作用,nH2O越大p-SCP 的表观生成速率越大;nH2O=1.0~1.5 mol 时水的溶剂化起主导作用,nH2O越大p-SCP的表观生成速率越小。
由于DCB 与SMAB 的反应是在与PPS 聚合相类似的条件下进行的,可推知制备PPS 时体系中适量的水可以抑制SMAB 取代PPS 氯端基的副反应,但水含量过高则会导致氯端基水解反应增加,因此PPS的聚合制备应在适当含水量下进行[19]。
5 结 论
基于对DCB 与SMAB 反应过程的分析与简化,本研究建立了主要产物d-SPMAB、m-SCMAB、p-SCMAB 和p-SCP 的生成反应动力学模型并推导了相应的动力学方程,对实验数据进行线性拟合得到了各反应的表观速率常数和活化能,结合拟合结果考察了SMAB 与DCB 物质的量比和水含量对反应的影响。研究表明:
(1) SMAB 对DCB 物质的量比越大,反应越快,但不改变反应机理;
(2) 一定范围内水对DCB 的水解反应有利,但其溶剂化作用会降低SMAB 的亲核性;
(3) 与DCB 和SMAB 经由芳香炔中间体机理反应或者DCB 经由SN2Ar 机理水解相比,DCB 与SMAB更容易通过SN2Ar 机理反应。
