负载贵金属催化剂在甲醛低温氧化消除反应中的应用研究进展
2023-02-24常婷婷王志苗王延吉
常婷婷, 孙 雪, 王志苗,2, 李 芳,2, 薛 伟,2, 王延吉,2
(1. 河北工业大学 化工学院, 河北省绿色化工与高效节能重点实验室, 天津 300130;2. 天津市本质安全化工技术重点实验室, 天津 300130)
1 前 言
甲醛(HCHO)是常见的挥发性有机化合物之一,给室内环境造成非常严重的污染,对人体健康产生严重的危害[1-2]。甲醛毒性较强,即便低浓度也会对人体产生刺激,引发呼吸道疾病,甚至会引起白血病与癌症[3-5]。室内甲醛污染物主要来自家具、建筑和装饰材料、厨房燃料燃烧及香烟燃烧等[6-8]。有资料统计,人类一生有超过80% 的时间会停留在相对封闭的空间环境中,比如家庭住宅、写字楼和旅馆等[9],因此室内甲醛的消除对人体健康至关重要。
近年来,随着生活水平的提高以及环保意识的加强,室内环境污染问题受到越来越多的关注。在低温甚至室温条件下消除甲醛是室内空气净化领域的一个重要课题。常用的甲醛消除方法有吸附[10-12]、等离子体净化[13]、光催化[14-16]和催化氧化[17-20]等。在这些方法中,催化氧化法具有明显的优势[21-22]。该方法可在低温甚至室温条件下实现甲醛完全催化氧化,生成无毒害的二氧化碳和水,且反应过程没有二次污染、能耗低、操作简单、易于实现,受到研究者广泛关注。催化氧化法的关键是高活性催化剂的开发。目前采用的催化剂主要是各类金属催化剂,可分为贵金属催化剂与非贵金属催化剂。常用的非贵金属催化剂有MnO2、Co3O4和复合金属氧化物等[6,23-25]。相对于非贵金属催化剂,贵金属催化剂往往具有更高的反应活性,可在较低温度下实现甲醛完全氧化。由于成本等原因,大多将贵金属负载到载体上使用,如负载型铂(Pt)、金(Au)、钯(Pd)、银(Ag)、铱(Ir)和铑(Rh)等贵金属催化剂[26-28]。本文总结不同种类负载型贵金属催化剂在甲醛催化氧化反应中的应用,希望为设计低成本、高效和稳定的贵金属催化剂提供有价值的指导,以用于室内甲醛消除。
2 贵金属催化剂
贵金属属于过渡金属,具有未填满的d 电子轨道,表面容易吸附反应物,有利于“活性化合物”的形成。负载型贵金属催化剂在甲醛催化氧化反应中表现出优异的活性,可以在低温甚至室温将甲醛完全氧化成二氧化碳和水。对近年来报道的负载型贵金属催化剂在甲醛催化氧化反应中的应用进行了总结,如表1 所示。表中,a-TiO2为锐钛矿型TiO2;R、rod 为纳米棒;Beta-Si 为硅质沸石;m 为微乳液法;FeA为采用分散-沉淀法制备的氧化铁;Ag/i-300 为采用浸渍法将Ag 负载在TiO2载体上,并在300 ℃焙烧3 h 制备的催化剂;TiO2-NS 为具有缺陷的TiO2纳米片;HAP 为羟基磷灰石;LDH 为层状双氢氧化物;CD为改进的胶体沉积法。
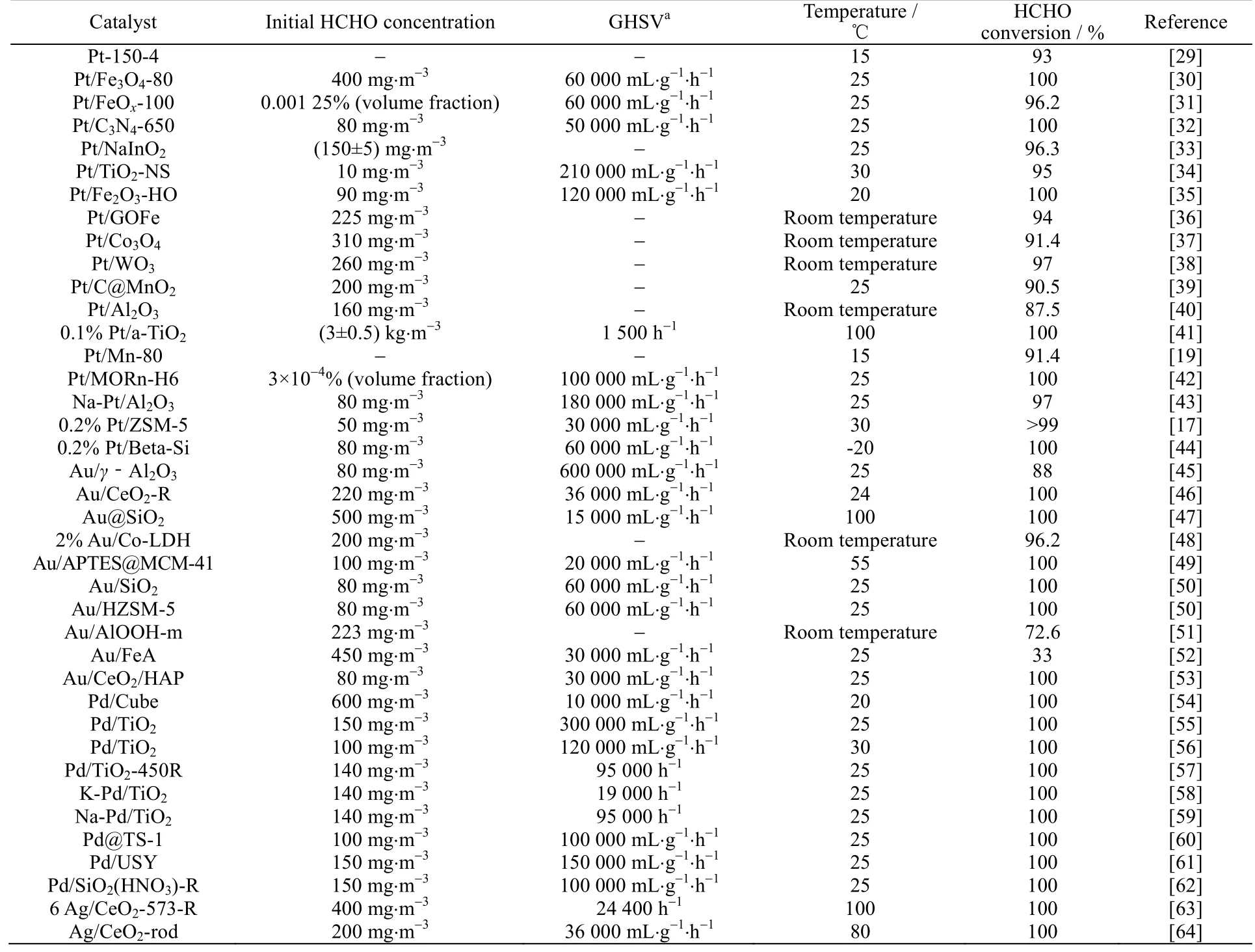
表1 负载型贵金属催化剂在甲醛氧化中的催化活性Table 1 Catalytic activities of supported noble metal catalysts for HCHO oxidation
2.1 Pt 基催化剂
在负载型贵金属催化剂中,Pt 基催化剂在室温下对甲醛催化氧化具有优异的活性,被认为是一类具有广阔应用前景的催化剂。Pt 基催化剂的催化性能受Pt 纳米颗粒的粒径、化学价态、分散性及载体的微观形貌和氧空位等因素的影响。
催化剂的制备方法影响催化剂微观结构以及活性位点等,进而影响催化剂的催化性能。Huang 等[29]制备了Pt/NiMo4催化剂,用于甲醛催化氧化反应。采用水热温度150 ℃,反应4 h 制得的催化剂(Pt-150-4)在15 ℃,甲醛转化率即可达到93%。Pt-150-4 具有良好的催化活性,主要是由于其多孔结构、丰富的表面羟基/水和活性氧。Cui 等[30]采用共沉淀法,在80 ℃热处理制备的以八面体Fe3O4为载体的Pt 催化剂(Pt/Fe3O4-80)在甲醛氧化反应中表现出高活性,能在室温条件下将甲醛完全氧化。Pt/Fe3O4-80 催化剂在制备过程中更容易形成界面活性位点Pt-O-FeOx,界面活性位点对催化剂的催化活性具有重要影响。崔维怡等[31]还将Fe(OH)3以不同温度T处理得到载体FeOx-T,采用胶体沉积法制备一系列Pt/FeOx-T催化剂,用于甲醛氧化反应。以100 ℃热处理的FeOx为载体,制备的Pt/FeOx-100 催化剂具有较高的催化活性,在25 ℃、相对湿度为55% 的条件下,甲醛的转化率可达到96.2%。热处理温度影响FeOx载体的比表面积、氧化还原性质和Pt/FeOx-T表面羟基的数量,以及Pt 和FeOx载体之间的相互作用。Liu 等[32]发现随着C3N4载体制备温度的升高,其晶体结构发生变化,导致C3N4上吡啶氮含量的增加。C3N4中的吡啶氮有利于产生路易斯碱位点,其在吸附和活化O2分子中起重要的作用。Pt/C3N4-650 表现出最佳的催化性能,在25~105 ℃,甲醛转化率保持在100%。
氧空位也影响催化剂对甲醛氧化的催化活性。Liu 等[33]制备了不同氧空位含量的Pt/NaInO2催化剂,用于甲醛氧化反应,并提出了甲醛在Pt/NaInO2催化剂上的反应机理,如图1 所示。具有丰富氧空位的Pt/NaInO2催化剂表现出优异的催化性能,在室温下,甲醛转化率为96.1%。他们认为由氧分子产生的高活性超氧化物(O2·-)是甲醛氧化的有效物种。 氧空位可以将O2·-从Pt纳米颗粒迁移到载体表面,进而为甲醛氧化提供更多的活性位点,因此氧空位丰富的Pt/NaInO2催化剂对甲醛转化率更高。研究结果解释了氧空位在甲醛氧化反应中的作用,通过诱导氧空位可以提高催化剂的催化性能。Sun 等[34]制备的Pt/TiO2-NS 催化剂在室温下显示出 >95% 的甲醛转化率,这比以TiO2为载体制备的商用Pt/TiO2-P25 催化剂高约50%。Pt/TiO2-NS 催化剂上丰富的氧空位和Pt 纳米团簇是其在甲醛氧化反应中具有优异活性的重要原因。氧空位可以通过与周围的O 原子键合,有效捕获Pt原子,形成Pt 纳米团簇。氧空位的存在也可以增强Pt 向TiO2的电子转移,从而增强金属与载体之间的相互作用。
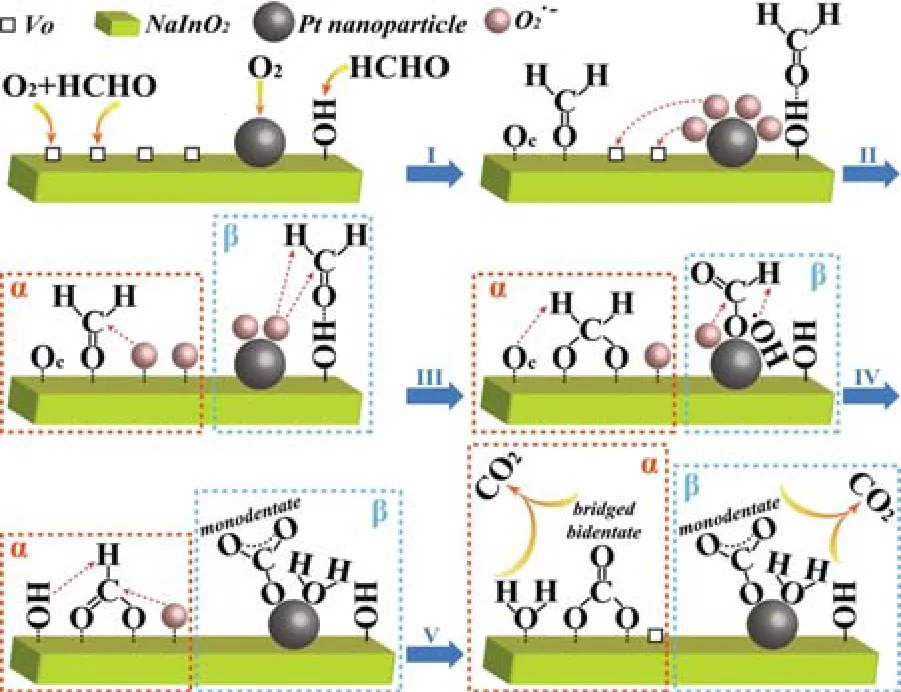
图1 Pt/NaInO2 催化甲醛氧化的反应机理[33]Fig.1 Reaction mechanism of HCHO oxidation on Pt/NaInO2[33]
与一般催化剂相比,具有特殊形貌的催化剂在低温催化甲醛氧化反应活性更高。Chen 等[35]制备了具有(113)和(104)晶面的空心十八面体α-Fe2O3负载Pt 催化剂(Pt/Fe2O3-HO),并将其用于甲醛催化氧化反应。在20 ℃时,甲醛转化率为100%。Pt/Fe2O3-HO 催化剂在室温下对甲醛催化氧化反应表现出高活性和稳定性,比商用Pt/α-Fe2O3催化剂高5 倍。热力学不稳定的高指数(113)和(104)晶面有利于氧空位的形成,氧空位在促进水解离生成羟基物种起着重要作用。Yan 等[36]制备了氧化石墨烯(GO)/Fe2O3纳米片负载Pt催化剂(Pt/GOFe),用于室温甲醛催化氧化反应。在室温下,甲醛转化率为94%。GO/Fe2O3的二维片状结构有利于Pt 纳米颗粒的高度分散,并且由于纳米尺度上的紧密接触,Pt 与GO/Fe2O3之间产生了强烈的相互作用,以及GO 纳米片的氧官能团增强了甲醛在催化剂表面的吸附,π-π 键的共轭效应有利于生成的活性氧的迁移,这是Pt/GOFe 催化剂具有优异的催化性能的原因。Yan 等[37]制备的Pt/Co3O4纳米棒催化剂在室温下甲醛转化率为91.4%,其催化甲醛氧化活性明显优于商用Pt/Co3O4。这是由于催化剂的形貌影响活性位点的数量以及贵金属与载体之间的相互作用,进而影响催化剂的催化性能。
除了催化剂的形貌,孔结构对催化剂的催化性能同样具有显著的影响,多孔结构使催化剂具有更大的比表面积,有利于反应物的吸附和产物的解吸,从而提高甲醛催化氧化的活性。Le 等[38]制备了中空结构的Pt/WO3催化剂,并提出了在Pt/WO3催化剂上甲醛氧化反应机理,如图2 所示。Pt/WO3由纳米片聚集形成,具有明显的空心结构。中空结构赋予了Pt/WO3较大的比表面积和多孔结构,使其暴露更多的活性位点,促进了甲醛在Pt/WO3上的扩散和吸附。在室温条件下,甲醛的转化率为97%。Sun 等[39]以空心碳球为模板,制备了Pt/C@MnO2催化剂。与MnO2微球负载Pt 和商用MnO2负载Pt 相比,Pt/C@MnO2催化剂在室温下对甲醛转化率更高,在25 ℃,甲醛转化率为90.5%。MnO2纳米片组装的分层结构使Pt/C@MnO2具有较大的比表面积和多孔结构,促进了Pt 纳米颗粒的高分散以及甲醛在催化剂表面的扩散和吸附。Pt/C@MnO2催化剂的表面吸附氧具有较强的还原能力,这也有利于提高其催化甲醛氧化活性。Zhu 等[40]以花朵状γ-Al2O3微球为载体制备了Pt/Al2O3催化剂。与商用γ-Al2O3负载Pt 相比,花朵状Pt/Al2O3在室温下对甲醛催化氧化具有更高的活性,甲醛转化率为87.5%。Pt/Al2O3优异的催化性能归因于其较大的比表面积和分级孔结构。催化剂特定的形貌以及多孔结构使其具有较大的比表面积,有利于贵金属纳米颗粒的高分散,增加活性位点的数量。催化剂不同的形貌暴露不同的晶面,高指数晶面有利于氧空位的形成,氧空位有利于甲醛分子的吸附以及促进活性位点的形成。适宜的孔结构也有利于反应物的吸附和产物的解吸,进而有利于提高甲醛氧化活性。

图2 Pt/WO3 扫描电子显微镜(SEM)图片及其催化甲醛氧化反应机理[38]Fig.2 SEM images of Pt/WO3 and reaction mechanism of HCHO oxidation on Pt/WO3[38]
Su 等[41]研究了Pt 负载量和TiO2晶型对甲醛催化氧化反应的影响。当Pt 负载量为0.1%(文中所有负载量均为质量分数),锐钛矿型TiO2负载Pt 催化剂(Pt/a-TiO2)具有更优异的催化性能。反应温度为100 ℃时,甲醛转化率达到100%,催化剂稳定性超过140 h。随着Pt 含量的增加,活性位点数量和氧空位增加,有利于催化剂反应性能的提高。但是,当Pt 含量进一步增加时,催化剂的比表面积下降,孔道堵塞,限制了催化剂的催化性能。Xu 等[19]通过水热法制备MnO2,并采用NaBH4溶液在载体上原位还原Pt 前驱体,得到了Pt/MnOx催化剂。水热时间为80 min 制备的Pt/MnOx(Pt/Mn-80)催化剂在15 ℃时对甲醛的去除率最高。这是由于Pt/Mn-80 催化剂具有大量的零价Pt 和活性氧,零价Pt 是甲醛氧化反应的重要影响因素。除Pt 的负载量和化学价态外,碱金属的掺杂也能提高Pt 基催化剂室温催化甲醛氧化活性。何德东等[42]以6 mol·L-1硝酸预处理的丝光沸石为载体制备了Pt/MORn-H6 催化剂。采用质量分数为2.0% 的Na+作为Pt/MORn-H6 的添加剂时,其对甲醛氧化活性较Pt/MORn-H6 具有明显的提升,甲醛转化率为100%。Wang 等[43]制备了Pt 负载量为0.2%、Na 掺杂量为0~6%(质量分数) 的Na-Pt/Al2O3催化剂,评价了室温条件下甲醛催化氧化活性。Na 掺杂量为2% 时,Na-Pt/Al2O3活性和稳定性较Pt/Al2O3催化剂有显著提高。掺杂的Na 促进吸附的水活化解离形成表面羟基,但同时会降低Pt 的分散性。因此选择适量Na对提高催化剂活性和稳定性很有必要。
Ding 等[17]发现以适量NaOH 改性的0.2% Pt/ZSM-5(Pt 的质量分数为0.2%)在30 ℃可获得超过99%的甲醛转化率和1 000 h 的稳定性。这主要是由于NaOH 处理可以改善催化剂的孔结构和表面羟基含量,同时增强甲醛的吸附、储存和氧化过程。Zhang 等[44]制备了硅质沸石负载Pt(Pt/Beta-Si)催化剂,在-20 ℃,甲醛就可以完全氧化为二氧化碳和水。这是由于硅质沸石具有强疏水性,有利于产物水的解吸,促进反应的进行。
由此可见,Pt 基催化剂在室温甲醛催化氧化反应已经取得了很大的进展。Pt 基催化剂的负载量、Pt粒径、载体的类型、氧空位以及表面活性氧的含量等对甲醛催化氧化活性均具有较大的影响。
2.2 Au 基催化剂
由于Au 的电子结构稳定,被认为作为多相催化剂的活性不大。Haruta 等[87]发现负载Au 纳米颗粒催化剂对一氧化碳低温氧化具有优异活性,自此Au 基催化剂引起了人们的广泛关注,近年来,Au 基催化剂用于甲醛催化氧化反应的研究迅速发展。
贵金属负载于不同类型的载体上,对甲醛的消除效果存在显著差异。Chen 等[45]制备了Au/CeO2、Au/FeOx、Au/γ-Al2O3、Au/SiO2和Au/HZSM-5 催化剂,并在室温测试了甲醛催化氧化性能。具有较高Au 分散度和较小Au 粒径的Au/γ-Al2O3催化剂具有最佳的甲醛氧化活性,在25 ℃时,甲醛转化率为88%。
探究金属与载体之间的相互作用对催化剂活性的影响,对开发用于甲醛催化氧化反应的高活性Au基催化剂具有重要的意义。Bu 等[46]以商用CeO2(CeO2-C)和CeO2纳米棒(CeO2-R)以及相应的Au/CeO2作为催化剂,探究Au-CeO2界面对甲醛催化氧化反应的影响。Au/CeO2-R 在室温下就可以将甲醛完全氧化,其活性远高于在120 °C 将甲醛完全转化的Au/CeO2-C。他们认为这是由于Au 与CeO2-R 之间的强相互作用极大地促进了氧空位以及Au3+的生成,Au3+与氧空位共存有利于中间产物甲酸盐的进一步转化。Chen等[47]采用软模板法制备了核壳结构的Au@SiO2催化剂。Au@SiO2催化剂表现出优异的甲醛反应活性,在100 ℃,甲醛的转化率为100%。由于核壳结构中金属与载体之间的强相互作用,促进了氧化态Au(Au+和Au3+)的形成,氧化态Au 是甲醛催化氧化反应的活性中心。
Li 等[48]制备的Co 掺杂Mg/Al 层状双氢氧化物负载Au2% Au/Co-LDH(Au 质量分数为2%)催化剂在室温可以将甲醛氧化为CO2和H2O,并提出了在2% Au/Co-LDH 催化剂上甲醛氧化的反应机理,如图3 所示。首先甲醛分子通过氢键与羟基结合,氧分子吸附在Au 纳米颗粒上。然后,晶格氧攻击吸附的甲醛分子,产生亚甲二氧基(DOM)中间体;吸附的氧分子在Au 纳米颗粒上分解为2 个活化的O 原子。随后,在表面羟基的作用下,形成的DOM 中间体进一步转化为甲酸盐,甲酸盐的Ce-H 键受到Au 纳米颗粒上活化的O 原子攻击形成碳酸盐,生成的碳酸盐极其不稳定,迅速分解为二氧化碳和水。晶格氧被甲醛氧化过程消耗后,会形成一个氧空位,氧空位随后被Au 纳米颗粒上的O 原子补充。

图3 2% Au/Co-LDH 催化甲醛氧化的反应机理[48]Fig.3 Reaction mechanism of HCHO oxidation on 2 %Au/Co-LDH[48]
Xu 等[49]报道了胺基修饰的Au/MCM-41(Au/APTES@MCM-41)催化剂,在55 ℃实现甲醛完全消除。胺基修饰的MCM-41 具有有序、开放的孔结构,有助于Au 纳米颗粒的分散以及甲醛分子的吸附和扩散,提高催化剂的催化性能。Chen 等[50]发现采用H2处理的Au/HZSM-5 和Au/SiO2催化剂在室温可以将甲醛完全氧化。而在空气气氛中处理的Au/HZSM-5 和Au/SiO2催化剂,在室温下甲醛转化率仅为40%~50%。这是由于H2处理的催化剂使得Au 纳米颗粒具有较好的分散性和更小的粒径。Yan 等[51]采用微乳液法制备的Au/AlOOH-m 催化剂在室温条件下甲醛的转化率为72.6%,其催化甲醛活性优于水热法和微波水热法制备的Au/AlOOH。Au/AlOOH-m 具有较小的Au 纳米颗粒、丰富的表面羟基以及较好的吸附性能等特点,使其在甲醛氧化反应中具有优异的催化性能。Tang 等[52]采用分散-沉淀法制备了纳米Fe2O3负载Au(Au/FeA)和采用传统方法制备了Fe2O3负载Au(Au/FeB)催化剂,并分别评价其低温催化甲醛氧化反应的活性。在室温条件下,Au/FeA 对甲醛的转化率为33%,Au/FeB 对甲醛的转化率为23%。Au 纳米颗粒在载体上的分散性差异可能导致了Au/FeA 与Au/FeB 对甲醛氧化活性的差异。Wang 等[53]发现制备的CeO2掺杂羟基磷灰石负载Au(Au/CeO2/HAP)催化剂对甲醛氧化具有很高的活性和稳定性,在室温即可实现甲醛的完全氧化。这归因于羟基磷灰石有利于Au 纳米颗粒的稳定,防止其烧结。综上所述,Au 纳米颗粒的粒径和分散性对催化剂的活性有较大的影响。
2.3 Pd 基催化剂
与Pt 和Au 基催化剂相比较,Pd 基催化剂用于甲醛催化氧化反应的研究较少。Tan 等[54]发现Pd/Cube(CeO2纳米立方体)比Pd/Rod(CeO2纳米棒)和Pd/Oct(CeO2纳米八面体)在甲醛催化氧化反应中显示出更高的活性。在室温,当GHSV 为10 000 h-1时,甲醛可以在Pd/Cube 上完全转化为二氧化碳和水。通常,金属Pd 比氧化态Pd 在甲醛氧化反应中具有更高的活性,CeO2纳米立方体暴露的(100)晶面可以促使Pd 以金属态存在,促进了甲醛催化氧化反应的进行。Wang 等[55]以高温氢气预处理后的TiO2为载体制备了一系列Pd/TiO2催化剂,并进行甲醛催化氧化反应。经600 ℃预处理的Pd/TiO2-600 催化剂在25 ℃时,甲醛转化率为100%。高温氢气预处理过程中在TiO2上产生的Ti3+缺陷有利于通过强金属-载体相互作用稳定Pd 纳米颗粒。随着Pd 分散度的增加,Pd/TiO2催化剂表面的氢溢出导致了更多的氧空位,从而进一步增加了Pd 的电子密度,增强了氧物种的活化,有利于催化甲醛氧化反应。He 等[56]制备了具有丰富氧空位的TiO2,并负载Pd 催化剂,用于室温催化氧化甲醛。氧空位的存在有利于形成高度分散和金属态 Pd,促进甲醛完全氧化。Li 等[57]制备了 Pd/TiO2催化剂,分别在 300 ℃(Pd/TiO2-300R)和450 °C(Pd/TiO2-450R)下用H2对其进行还原,并评价了室温下甲醛催化氧化活性。当GHSV 为95 000 h-1时,Pd/TiO2-450R 催化剂在室温可获得100% 的甲醛转化率,优于Pd/TiO2-300R 催化剂。这是由于高温还原能诱导金属与载体之间的相互作用,减小催化剂表面Pd 颗粒粒径,并且有利于O2的活化和表面羟基的形成。
与Pt 催化剂相似,碱金属的掺杂有利于提高甲醛催化氧化活性。Li 等[58]制备了一系列碱金属(Li、Na、K、Cs)掺杂Pd/TiO2催化剂,并对其室温催化甲醛氧化反应进行了测试。结果表明,掺杂碱金属对Pd/TiO2催化剂室温催化甲醛氧化性能有促进作用,顺序为K > Cs > Na > Li。碱金属掺杂有利于Pd 的分散,促进化学吸附氧的活化,从而提高了Pd/TiO2催化剂的甲醛催化氧化活性。K-Pd/TiO2催化剂在25 ℃时,甲醛转化率为100%。Li 等[59]还考察了不同Na 含量的Pd/TiO2(Na-Pd/TiO2)催化剂对甲醛催化氧化反应的影响。Na 的加入对Pd/TiO2催化剂在甲醛氧化反应中有显著的促进作用,Na-Pd/TiO2催化剂较Pd/TiO2具有更多的活性位点和表面羟基,使其在室温下即可实现甲醛的完全消除。
沸石的疏水性在催化氧化反应中发挥了重要的作用,其作为催化剂载体被广泛用于甲醛催化氧化反应。Chen 等[60]采用一锅水热法合成了TS-1 沸石包覆Pd 催化剂(Pd@TS-1),Pd@TS-1 催化剂在室温即可实现甲醛的完全氧化。该制备方法可以有效地减小Pd 纳米颗粒粒径以及提高Pd 颗粒的分散。载体的酸预处理对用于甲醛氧化反应的催化剂具有显著的促进作用。Liu 等[61]发现当Pd/USY 催化剂的载体用浓度为0.20 mol·L-1的盐酸预处理时,在25 ℃时,甲醛可以被完全转化为二氧化碳和水。酸处理产生的活性羟基在甲醛氧化反应中起关键作用。Liu 等[62]还对SiO2进行酸预处理,制备了Pd/SiO2(HNO3)-R 催化剂。Pd/SiO2(HNO3)-R 催化剂显示出比Pd/SiO2-R 催化剂更好的甲醛氧化活性。在25 ℃,相对较低的Pd 负载量(0.5%)的Pd/SiO2(HNO3)-R 催化剂上实现了甲醛的完全氧化。酸预处理SiO2产生的羟基有利于Pd 颗粒的锚定并增加其分散性。Pd 分散度的增加有助于提高催化剂的甲醛氧化活性。
2.4 Ag 基催化剂
由于Ag 在自然界中储量丰富,且在所有贵金属中价格低廉,对甲醛氧化反应具有较好的催化活性。因此很多研究者都致力于研究Ag 基催化剂用于甲醛催化氧化反应。
CeO2是一种重要的稀土金属氧化物,拥有氧化还原离子对(Ce3+/Ce4+),具有优异的储存与释放氧的能力,被广泛用于甲醛催化氧化反应。Chang 等[88]采用水热法制备了一种具有大比表面积的类球形CeO2纳米颗粒聚集体(CeO2-S),并评价了其催化甲醛氧化反应能力。CeO2-S 具有较优异的活性,当GHSV 为10 000 mL·g-1·h-1(g 为催化剂质量)时,在120 ℃时甲醛转化率达到87%,在甲醛氧化反应中,CeO2既可以直接作为催化剂使用,又可以作为其他金属的载体,Ag/CeO2催化剂被广泛用于甲醛氧化反应。Ou 等[63]发现Ag/CeO2催化剂在甲醛氧化反应中的活性受焙烧温度和H2预处理的影响。6% Ag/CeO2(Ag 质量分数为6%)催化剂在573 K 焙烧,再在473 K 用10% H2/N2(H2体积分数为6%)还原6Ag/CeO2-573-R 后,其在373 K时甲醛转化率为100%。6Ag/CeO2-573-R 催化剂具有较小的Ag 颗粒和丰富的表面羟基,这是其在低温甲醛氧化中展现优异性能的两个关键因素。Jiang 等[64]制备的Ag/CeO2纳米棒(Ag/CeO2-rod)催化剂在80 ℃就可以将甲醛完全氧化,反应机理如图4 所示。CeO2-rod 具有更多的氧空位和表面活性氧,并且Ag-CeO2界面可以进一步促进氧空位和表面活性氧的生成,有利于提高甲醛氧化反应活性。Yu 等[65]制备了纳米棒Ag/CeO2(Ag/r-CeO2)、纳米颗粒Ag/CeO2(Ag/p-CeO2)和纳米立方体Ag/CeO2(Ag/c-CeO2) 催化剂,并将其用于低温甲醛催化氧化反应。Ag/r-CeO2在110 ℃左右能够将甲醛完全氧化,低于 Ag/p-CeO2和Ag/c-CeO2实现甲醛完全转化的温度。Ma 等[66]发现Na 掺杂的Ag/CeO2纳米球催化剂具有较高的催化活性。掺杂的Na 导致CeO2纳米球表面羟基浓度显著增加,表面羟基可直接与甲酸盐中间体反应生成二氧化碳和水。

图4 Ag/CeO2 催化甲醛氧化的反应机理[64]Fig.4 Reaction mechanism of HCHO oxidation on 2%Au/Co-LDH[64]
掺杂过渡金属元素有利于提高Ag 基催化剂的甲醛氧化催化活性。Huang 等[67]制备了Ag/MnCeOx复合氧化物用于甲醛催化氧化反应,在室温条件下甲醛的转化率为90%。Ag 与MnCeOx之间的强相互作用影响催化剂的催化性能。Zhang 等[68]制备的10% Ag 8% Mn/Beta-Si(Ag、Mn 质量分数分别为10%、8%)催化剂在45 ℃实现甲醛的完全转化。使用质量分数为10% 的Ag 可使Ag 位点的暴露量达到最大值,使用质量分数为8% 的Mn 可平衡催化剂中活性氧的密度和迁移率。Li 等[69]采用一锅法制备了Ag/Fe-MnOx催化剂。Ag/Fe0.1-MnOx催化剂在室温下甲醛转化率为100%,而Ag/MnOx催化剂在室温下甲醛转化率为76%。Ag、Fe 和MnOx之间的协同作用改变了Ag 纳米颗粒的电子密度,增加了表面氧含量,这是Ag/Fe-MnOx具有较高催化活性的重要原因。Lu 等[70]通过Co-Mn-MOFs 热分解制备了具有不同Co、Mn 物质的量比(9:1 和 7:3)的 Co3O4-MnO2,并采用浸渍法制备了 Ag/Co3O4-MnO2催化剂。发现Ag/Co3O4-MnO2(Co、Mn 物质的量比为9:1)催化剂对甲醛氧化具有显著的催化活性,在80 ℃时可以完全氧化甲醛。Ag、Co3O4和MnO2之间的强相互作用可以提高催化剂的还原性能并增加表面活性氧的数量,这在甲醛氧化反应中起着重要作用。
Chen 等[71]以不同晶型TiO2为载体,制备了Ag/TiO2催化剂,并评价了其在甲醛氧化中的催化性能。锐钛矿型Ag/TiO2(Ag/A)比金红石型Ag/TiO2(Ag/R)表现出更好的活性,Ag/A 催化剂在125 ℃下甲醛转化率为100%。表面氧、Ag2O 和金属Ag 的相对含量以及金属Ag 的分散性,共同导致了Ag/A 和Ag/R 在甲醛氧化反应中催化性能的差异。Fang 等[72]制备了Ag/TiO2催化剂,研究Ag 的价态对Ag/TiO2催化剂催化甲醛活性的影响。在300 ℃焙烧后的 Ag/TiO2催化剂(Ag-i-300)具有部分氧化态Agδ+(0<δ<1),表现出优越的催化活性,在室温就可以将甲醛完全转化。在Ag/TiO2催化剂上,Ag 的高度分散有利于甲醛氧化反应,并提出了在Ag-i-300 催化剂上甲醛氧化的反应途径,如图5 所示。甲醛首先吸附在Agδ+表面,O2和H2O 在催化剂表面形成活性氧。然后,被吸附的甲醛分子被活性氧氧化成甲酸盐或碳酸盐中间体,生成的中间体进一步分解为二氧化碳和水。
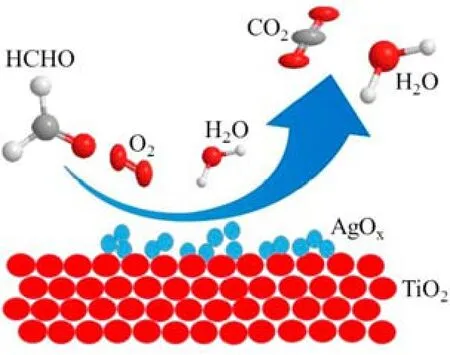
图5 Ag/TiO2 催化甲醛氧化的反应机理[72]Fig.5 Reaction mechanism of HCHO oxidation on Ag/CeO2[72]
目前,已有大量关于Ag 基催化剂用于甲醛氧化反应的研究报道,但大多数Ag 基催化剂还不能实现室温甲醛完全转化。
2.5 贵金属价态的影响
不同贵金属的价态对催化甲醛氧化性能的影响不同。Pt 的化学价态对催化甲醛氧化活性起着重要作用,通常金属Pt 有利于甲醛氧化反应。Kim 等[89]系统研究了Pt 的化学价态对Pt/TiO2催化剂催化甲醛氧化活性的影响,发现金属Pt 与总Pt 物质的量比nPt/nPt,t与催化剂的耗氧速率和甲醛氧化活性均呈正相关。金属Pt 有利于氧的吸附,nPt/nPt,t值高的催化剂表面具有更多的吸附氧的位点。对于Au基催化剂,氧化态 Au 有利于甲醛分子的吸附,从而提高催化剂的催化活性。Li 等[90]发现3.0Au/CeO2-270 催化剂上甲醛的化学吸附强度远高于2.5Au/CeO2-37 催化剂上的化学吸附强度,这是由于3.0Au/CeO2-270 比2.5Au/CeO2-37 含有更多的Au+和Au3+,甲醛分子在氧化态Au 上的化学吸附比在金属态Au 上的化学吸附更强。与Pt 基催化剂相似,通常金属Pd 比氧化态Pd 具有更高的甲醛氧化活性。Huang 等[91]发现NaBH4还原Pd/TiO2催化剂具有较高的甲醛氧化性能。金属Pd 纳米颗粒具有较强的氧活化能力,有利于催化甲醛氧化反应。Ag 的化学价态也会影响催化甲醛氧化活性。Chen等[92]研究了不同气氛预处理Ag/MCM-41 催化剂的甲醛氧化机理,发现O2预处理Ag 催化剂的活性高于H2预处理Ag 催化剂的活性。Fang 等[72]发现Agδ+是甲醛分子的吸附位点,Agδ+有利于Ag/TiO2催化甲醛氧化。
2.6 其他贵金属催化剂
Li 等[73]制备的掺杂Na 的Ir/TiO2(Na-Ir/TiO2)催化剂在25 ℃下甲醛转化率即可达到100%。Na 的加入可以促进靠近TiO2表面Ir 的还原,提高O2和H2O 分子的活化能力,使Na-Ir/TiO2在甲醛氧化反应中具有优异的催化性能。Chan 等[74]用NaBH4还原的以TiO2为载体负载Ir(Ir-H-TiO2)催化剂在150 ℃,甲醛转化率达到100%。Ir-H-TiO2具有丰富的表面羟基及Ir 与H-TiO2载体之间强烈的相互作用,这是促进甲醛氧化的显著原因。H-TiO2上丰富的羟基有助于增强甲醛的化学吸附,从而促进中间产物甲酸盐的生成。金属载体之间相互作用的增强有利于中间产物的进一步转化。Sun 等[75]通过改进的胶体沉积法制备了负载在商用γ-Al2O3上一种新型的Ir 基催化剂(IrAl-CD),在20 ℃实现了甲醛完全转化,IrAl-CD 催化甲醛活性明显优于采用传统沉积-沉淀法制备的IrAl-DP 催化剂。IrAl-DP 和IrAl-CD 催化剂上甲醛吸附随时间变化的原位漫反射红外谱图如图6 所示。IrAl-DP 上Ir 为氧化态,甲醛氧化反应遵循生成甲酸盐中间体的反应途径。而IrAl-CD 上含有较高含量的Ir0,有利于甲醛直接脱氢形成CO 中间体,CO 易被氧化为CO2。综上所述,Ir 的价态影响甲醛催化氧化反应的活性和反应途径。

图6 IrAl-DP 和IrAl-CD 上甲醛吸附随时间变化的原位漫反射红外谱图[75]Fig.6 Reaction mechanism of HCHO oxidation on Ag/TiO2[75]
Sun 等[76]发现TiO2负载亚纳米颗粒Rh(Rh/TiO2)催化剂在室温可以实现甲醛完全氧化,并具有良好的稳定性。Rh 亚纳米粒子在TiO2载体上高度分散,使催化剂在室温下对HCHO 氧化展现较高的催化活性。Rh 有利于O2解离成O 原子,这些O 原子可以促进甲醛转化成中间产物。
3 双金属催化剂
与单金属催化剂相比,双金属催化剂由于其独特的协同效应,在催化氧化领域展现出良好的催化活性。Xu 等[77]制备了AuAg/SBA-15 催化剂,并考察了Au-Ag 双金属纳米合金的粒径和羟基对甲醛催化氧化反应的影响。Au-Ag 双金属纳米合金的粒径为5.3 nm、羟基含量较高的AuAg/SBA-15 具有最佳的甲醛催化性能,在120 ℃下甲醛转化率达到100%。AuAg/SBA-15 上的羟基可以促进甲醛的吸附以及中间体的生成,中间体的进一步分解与Au-Ag 纳米合金的粒径密切相关。Ammar 等[78]制备了氧化铌(Nb2O5)负载双金属纳米催化剂(IrxPt1-x/Nb2O5)用于低温甲醛催化氧化。Ir 与Pt 物质的量比对催化剂的活性有很大影响,其中Ir0.5Pt0.5/Nb2O5的催化活性最高,甲醛完全氧化温度低至30 ℃。Ir0.5Pt0.5/Nb2O5纳米催化剂经过4 次反应后,仍具有良好的催化活性。Ir 可以提高Pt 的表面活性和结构性能,双金属催化剂的构建可以调节Ir 和Pt 之间的电子相互作用,这种协同效应在Ir0.5Pt0.5/Nb2O5样品中表现明显。此外,IrxPt1-x纳米颗粒与Nb2O5载体的协同作用也有助于提高催化剂的催化活性。Meng 等[79]采用CO 还原法制备的Pd0.7Ag0.3/Al2O3-CO 催化剂在60 ℃的甲醛转化率达到100%。CO 预处理使PdAg 粒径变小,活性氧含量增加,这是Pd0.7Ag0.3/Al2O3-CO 具有优异催化活性的重要原因。
4 单原子催化剂
由于单原子催化剂的高原子利用率,尤其是负载型贵金属催化剂可以显著降低成本,单原子催化剂的发展受到了越来越多的关注。近年来,单原子催化剂在催化甲醛氧化方面也取得了一定的进展。
Sun 等[80]制备的Pt 负载量为0.01% 的单原子Pt/TiO2催化剂,在80 ℃时甲醛转化率为5%。Chen等[81]制备了Mn 掺杂TiO2负载单原子Pt 催化剂(0.5% Pt/Mn-TiO2)具有良好的甲醛催化氧化活性,在15 ℃时甲醛即可实现完全转化。Zhang 等[82]发现单原子Pt/CeO2催化剂在15 ℃也能完全消除甲醛。Chen 等[83]制备了α-MnO2负载单原子Au 催化剂,用于甲醛催化氧化反应。甲醛的质量浓度约为500 mg·m-3时,0.25%Au/α-MnO2催化剂在75 ℃即可实现甲醛完全消除。甲醛的质量浓度约为1 cm3·m-3时,在25 ℃下甲醛的转化率为95%。Chen 等[84]制备的CeO2纳米棒负载单原子Au(Au/r-CeO2)催化剂在85 ℃实现甲醛的完全氧化。Chen 等[85]制备的空心锰氧化物负载单原子Ag 催化剂(Ag/HMO)在130 ℃时,甲醛的转化率达到100%。Peng 等[86]制备的单原子Ir-N-C 催化剂在15 ℃时甲醛转化率达到97%。
单原子催化剂用于甲醛氧化反应的研究相对较少,且大多数催化剂室温催化甲醛氧化的效果并不理想。这可能是由于单原子催化剂一般负载量低,导致其活性位点少。
5 反应机理
如上所述,负载型贵金属催化剂对甲醛催化氧化反应的活性已得到广泛研究。此外,研究人员对甲醛氧化反应机理也进行了探索研究。不同催化剂表现出的催化活性不尽相同,其甲醛氧化反应机理也存在差异。
负载型贵金属催化剂催化甲醛氧化反应机理通常为:甲醛首先吸附在催化剂表面,然后吸附的甲醛分子与活性氧反应生成DOM,DOM 不稳定被氧化成甲酸盐,生成的甲酸盐被进一步氧化成CO2和H2O,消耗的活性氧和羟基可通过吸附的O2和H2O 得以再生[39,62,80-81]。
负载贵金属催化剂表面吸附甲醛分子有几种方式:(1)甲醛与表面羟基形成氢键吸附在催化剂表面[29,35,40,48,51,56,63,74,76]。(2)甲醛分子的O 原子插入催化剂的氧空位中[33-34,46,64]。(3)活性氧捕获甲醛分子[36]。(4)甲醛分子吸附在贵金属上[66,72,75,90]。(5)甲醛分子吸附在相邻路易斯碱基(N 原子)上[86]。生成的甲酸盐中间体最终转化为CO2和H2O 主要有以下方式:(1)甲酸盐被活性氧直接氧化成CO2和H2O[62,66]。(2)甲酸盐被表面羟基氧化成CO2和H2O[29,35,39,44,62,66,76,80]。(3)甲酸盐被活性氧氧化成碳酸盐,碳酸盐分解成CO2和H2O[33-34,48]。(4)甲酸盐首先生成H2O 和CO,CO 进一步氧化成CO2[32,35,39,57,74]。
Sun 等[75]制备的IrAl-CD 催化剂含有较高含量的Ir0,他们认为甲醛分子首先吸附在Ir0上,吸附的甲醛分子可直接脱氢生成CO 中间体,随后CO 迅速被氧化成最终产物CO2。
6 总结与展望
本文综述了近年来负载型贵金属催化剂在低温甲醛催化氧化方面的研究进展,已报道的多种负载型贵金属催化剂可以在室温的条件下实现甲醛完全氧化,特别是Pt 基催化剂以较低的贵金属负载量即可实现甲醛高效氧化。为了提高原子利用率并降低贵金属催化剂成本,对单原子催化剂用于甲醛催化氧化反应进行了一些研究,但是单原子催化剂催化氧化甲醛效果并不理想,开发用于甲醛催化氧化的高效单原子催化剂仍是一个挑战。
在今后的研究中不仅要关注催化剂的催化活性,还需重视催化剂的成本和稳定性,可从以下方面开展工作:(1)寻找合适的载体,促进金属与载体之间的相互作用提高催化剂的催化性能;(2)将贵金属与非贵金属复合,负载于合适的载体上,在降低成本的同时提高催化剂去除甲醛效率;(3)借助原位表征和密度泛函理论,进一步研究甲醛催化氧化的反应机理,为催化剂的制备提供理论指导。
