基于表面等离子共振传感器的COVID-19检测与药物评价
2023-02-24苏荣欣车津晶黄仁亮
苏荣欣,刘 晓,车津晶,黄仁亮,齐 崴
基于表面等离子共振传感器的COVID-19检测与药物评价
苏荣欣1, 2, 3,刘 晓1, 2,车津晶4,黄仁亮3,齐 崴1, 2
(1. 天津大学化工学院,天津 300072;2. 天津大学化学工程联合国家重点实验室,天津 300072;3. 天津大学海洋科学与技术学院,天津 300072;4. 军事医学研究院毒物药物研究所,北京 100850)
自新冠病毒发现以来,新冠肺炎在社会内引起广泛关注,其传播能力相较于其他冠状病毒具有更高的传染性和致病性,在世界范围内对人类的生命财产安全造成了巨大的危害.灵敏检测和早期诊断是实现新冠病毒COVID-19有效阻隔和治疗的关键环节,传统的PCR等技术目前已被应用于COVID-19的诊断与检测当中,但其仍存在着定量困难、耗时长、成本昂贵等缺点.表面等离子共振(SPR)传感器是一种高灵敏、无标记和快速的实时分析工具,可用于特定蛋白质、核酸和病毒粒子的定量检测,在COVID-19检测中发挥着重要作用.本文综述了基于不同检测方法,包括直接法、间接法、夹心法在内的SPR传感器对COVID-19的定量检测与诊断研究进展,对固定配体进行分类,研究目标分子包括COVID-19的核酸分子、抗原、抗体及病毒粒子.同时,也从传感器设计、表面修饰、检测性能等方面对SPR传感器进行了介绍,总结了SPR传感器针对COVID-19检测的开发方向、目前存在的问题及可以采取的措施.另外,SPR传感器可以通过其独特的亲和力动力学分析实现分子间 KD值的计算,对SPR传感器在COVID-19潜在药物评价方面的应用及作用机制进行了概述和展望.上述研究成果有助于构建和开发新冠病毒的高灵敏检测方法,并为相关治疗药物的设计和作用机制研究提供基础和指导.
新冠病毒;表面等离子共振;定量检测;药物评价
截至2022年3月,全球范围内已向世界卫生组织报告COVID-19确诊病例超4.5亿例,超过600万例患者在此次疫情中失去生命.2020年2月11日,世界卫生组织正式将这种由新型冠状病毒引起的肺炎命名为COVID-19(2019冠状病毒病),并将引起该新冠肺炎的病毒命名为SARS-CoV-2[1].该病毒具有高度传染性[2]和变异性,多种变异株在世界内广泛传播,潜伏期不定(4~24d),可导致从轻微咳嗽到严重肺炎等呼吸道疾病[3]和其他症状.
COVID-19新冠病毒(SARS-CoV-2)是一种具有包膜结构的阳性单链RNA病毒[4],由基因组(含256pb)及外部包裹的刺突蛋白组成.病毒基因组可以编码成4种结构蛋白[5],分别是刺突蛋白(spike protein)、包膜蛋白(envelope protein)、膜蛋白(membrane protein)和核衣壳蛋白(nucleocapsid protein),新冠病毒主要结构如图1所示.
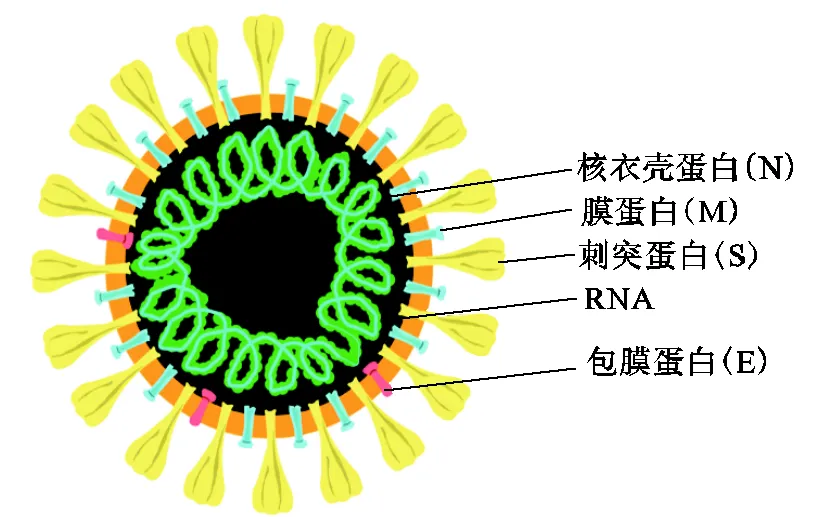
图1 新冠病毒SARS-CoV-2的结构示意[6]
COVID-19刺突蛋白与人体血管紧张素转换酶(ACE2)高度亲和,使其具有比其他病毒更高的传染性,并可对分布着ACE2的器官[7]如心脏、肺部、肾脏等造成严重危害[8].因此,寻找一种快速、简便的检测方法对COVID-19的早期感染进行诊断及定量分析对阻断疾病传播具有重要意义.
目前,COVID-19最常用的检测方式为聚酶链式反应[9](PCR),该技术通过分析特定核酸序列确定病毒种类,由于其无法区分活跃与既往感染病毒,在诊断时容易造成假阴性或假阳性[10]的结果.除PCR检测之外,采用酶联免疫吸附法(ELISA)、侧流免疫分析法[11](LFA)、电化学[12]等方法均可实现COVID-19的灵敏检测,但常存在操作复杂、耗时长或成本昂贵等缺点.
表面等离子体共振(SPR)技术[13]是一种高灵敏、无标记和快速的实时分析工具,可用于特定蛋白质、核酸和病毒等分子的定量检测[14].SPR传感器检测灵敏度可达到皮摩尔至飞摩尔级.跟其他传感器相比,如电化学传感器检测范围从皮克级至微克级,能够实现对蛋白、核酸、细胞、微生物的定性和定量检测及分子间亲和力动力学分析,不足之处在于在检测COVID-19时采用的唾液样中分析物不稳定,易导致结果的不准确性.场效应晶体管(FET)生物传感器可达到飞克摩尔级至亚皮摩尔级,其局限性在于分析时所出现的电荷屏蔽效应(德拜长度)极大限制了分析物的尺寸大小,很难实现在真实环境中对分析物的检测.表1汇总了不同传感器对COVID-19的检测限.
表1 COVID-19检测常用分析技术
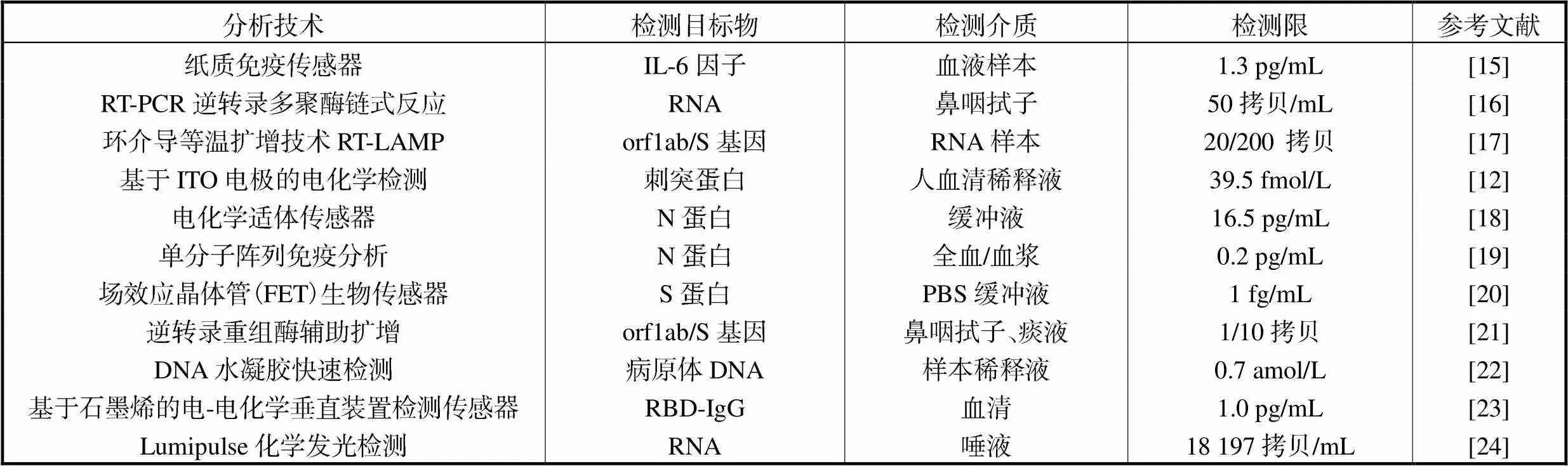
Tab.1 Common analysis techniques for COVID-19 detection
本文综述了SPR技术在COVID-19检测和潜在药物评价方面的研究进展,为新冠肺炎的早期诊断及有效治疗提供基础和指导.
1 SPR检测的工作原理
基于表面等离子共振(SPR)技术的生物传感技术,无需对目标物进行标记[25],即可实现特定蛋白 质[26]、核酸[27]、病毒及小分子物质[28]的快速、灵敏和实时检测,应用范围广泛.除常见的抗体[29]、抗原和半抗原检测以外,还可以将生物素标记的PCR引物作为配体来进行检测,目标物与链霉亲和素特异性结合提高检测灵敏度.同时,SPR作为一种高特异性的检测技术,可检测复杂环境中的特异性目标物,例如血液样本中的IgM和IgG抗体.
SPR工作原理如图2所示,SPR传感器作为一种光学传感器,主要由光源、棱镜、传感芯片(微流道系统)及检测器构成[26].入射光按特定角度进入棱镜后,光疏介质中产生倏逝波,同时金属表面产生表面等离子体波.当入射光到达某一临界值时,倏逝波与金属表面的等离子体波发生共振,此时检测器中检测为能量最低值,即为共振峰.共振峰主要以共振角及共振波长两种形式存在,当分子间发生相互作用时,传感芯片表面的配体与待测目标物发生结合,导致芯片表面的折射率发生变化[30],从而引起共振峰位置(SPR信号)的改变.该变化与结合在芯片上的分析物浓度成正比关系,因此,分析物浓度可以通过SPR信号变化的强弱进行计算检测.
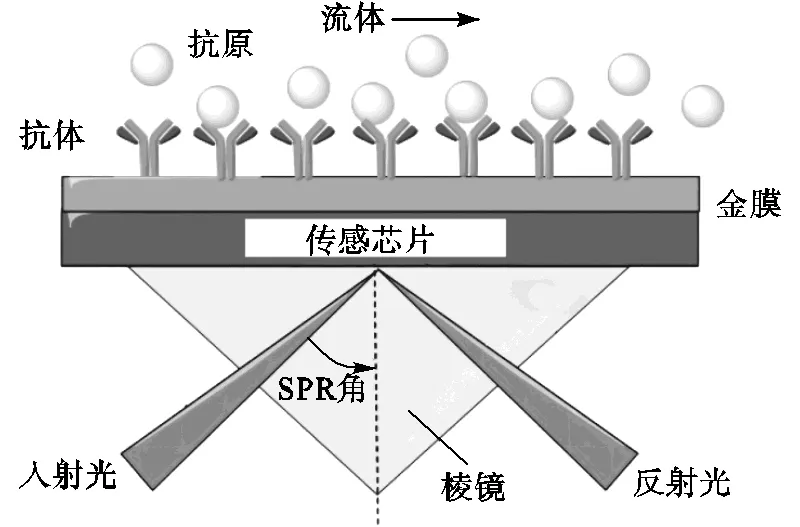
图2 SPR原理示意[26]
在SPR检测中,传感器表面常修饰抗原或抗体(含包被抗原/抗体),分析物溶液流经传感器表面后,经抗原-抗体识别结合,传感器表面折射率发生变化,引起SPR共振角/波长的变化,进而对分析物进行定量分析.同时,SPR可以实时地记录分析物与配体的结合速率与解离速率,因此在药物评价作用中可以通过拟合分子间相互作用直至达到整个动态平衡过程,计算活性分子与受体间的结合/解离常数判断该分子间亲和力大小,继而研究是否能和相关受体进行有效结合,推断潜在药物的作用机制.
2 SPR在COVID-19定量检测中的应用
目前,基于SPR技术的检测主要包括直接法、间接法、夹心法和竞争法[31],从而实现对目标分子的定量分析.其中,采用竞争法对COVID-19进行诊断的相关报道较少.因此,本节主要综述采用直接法、间接法和夹心法对COVID-19抗原、抗体和病毒的检测与诊断研究进展,并对传感器设计、表面修饰和检测性能进行介绍,相关检测结果汇总于表2.
如图3所示,在SPR直接法检测中,商用化芯片或自组装芯片经活化后偶联特异性抗体或抗原[32],样品流经芯片后,芯片上偶联配体会与目标物结合并产生SPR光学信号,该信号的增强与目标物浓度成正比关系.直接法一般应用于作用环境简单或分子量较大(大于10kDa)的生物分子,因此,一般选择在芯片中偶联目标物的特异性抗体、抗原或核酸适配体等进行直接法检测.
表2 基于表面等离子共振传感器的COVID-19定量检测

Tab.2 Quantitative detection of COVID-19 based on the surface plasmon resonance sensor
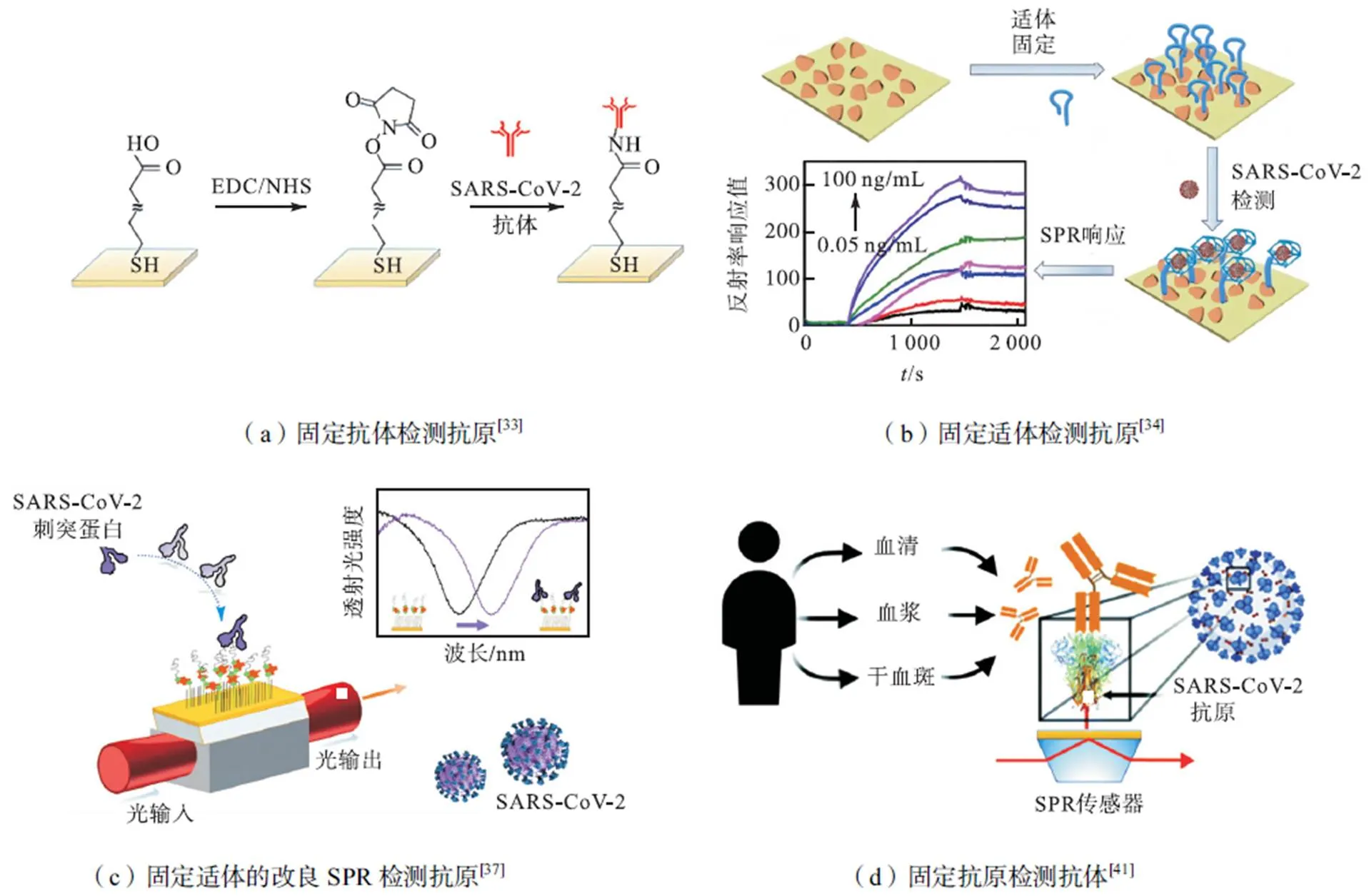
图3 基于表面等离子共振传感器直接法检测新冠病毒
在间接法检测中,如图4(a)所示,传感芯片固定抗原后,目标物抗体与抗原发生特异性结合并在SPR检测器中显示出信号增强.实际检测中往往面临检测环境复杂、基质干扰物过多的问题,为进一步降低检测限,提高灵敏度,再次流入可以与目标物抗体特异性结合的二抗,该抗体多为特异性单克隆抗体(mAb)或多克隆抗体(pAb).另外,若进一步在抗体上修饰金属粒子,由于金属粒子自由电子和金膜表面发生共振耦合,可以进一步实现信号放大.此外,若在芯片中修饰PCR引物,目标物结合后流入与其特异性结合的链霉亲和素,也是一种通过间接法实现分析物检测的方法.
夹心法,也称三明治法,是提高SPR检测信号降低基质干扰的常用方式,如图4(b)所示,在直接法检测基础上,加入另一种可与目标物(抗原)结合的特异性分子(目标物的另一种特异性抗体).同时,如前所述在抗体中偶联金纳米粒子或金纳米棒[44]可进一步降低SARS-CoV-2 的检测限[45].
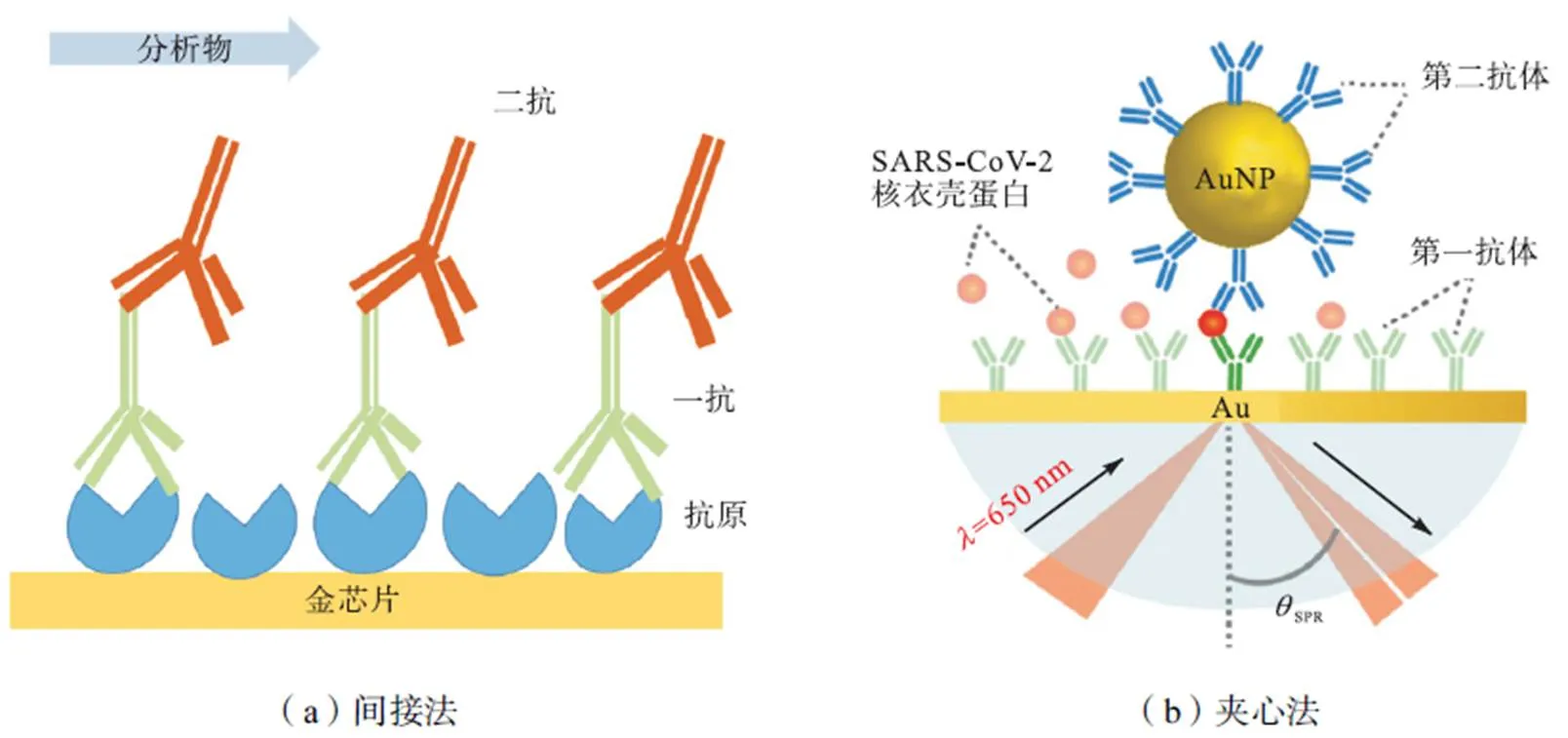
图4 间接法检测和夹心法检测[42]示意
2.1 直接法检测COVID-19
2.1.1 固定抗体检测抗原
直接法作为最常见的病毒检测方法,在COVID-19诊断中具有广泛应用.例如,Bong等[33]通过免疫猪血清获得新冠病毒的抗核衣壳蛋白抗体,并采用上述抗体使用SPR传感器对核衣壳蛋白抗原(NP)进行了定量测定,检测原理如图3(a)展示.通过共价偶联将抗体结合在经巯基十一烷酸改性后的金芯片上,随后注入浓度梯度的核衣壳抗原样品,SPR检测限低至1.02pmol/L.在此基础上注入含有中东呼吸系统综合征冠状病毒(MERS-CoV)、冠状病毒(CoV)和SARS-CoV-2病毒的培养液检测抗体的选择性和特异性,结果证明具有特异性的抗核衣壳抗体在COVID-19的SPR检测中表现出高选择性和高灵敏度.SPR在COVID-19诊断中具有广阔的应用潜力和优势,且操作简便,用时短,可以应用于复杂检测环境,为其在复杂样品中的COVID-19的定量检测提供了可能.
2.1.2 固定核酸适配体检测抗原
在SPR技术的直接法检测中,除以抗体、抗原等生物大分子作为配体应用广泛外,采用核酸适配体作为识别分子在COVID-19的早期诊断中也发挥重要的作用.核酸适配体是一类对靶标具有高亲和力[46]、稳定且易储存的识别分子,它不仅具有类似抗体的强特异性、强亲和力特点,且合成快速、偶联过程简单,大大降低了实验成本.此外,基于DNA反应的特征能够实现信号放大,使它在体内及体外诊断与检测中显示出强大的竞争力.
目前用于病毒诊断的SPR适配体传感器较为普遍,芯片材料主要聚焦于石墨烯、MXene纳米片、MoS2[47]及纳米颗粒[48]等.Chen等[34]设计并构建了一种以碳化铌量子点为基础的生物适配体SPR传感器,实验方法如图3(b)所示.该研究采用溶剂热法从碳化铌纳米片中制备的零维量子点,突破了纳米片厚度的限制从而使其应用于SPR技术中.具体地,经硫醇修饰后的SH-QDs通过自组装结合于金膜表面,通过静电吸附、氢键结合、π-π堆积等方式大量结合N58适配体以实现对N基因的检测,检测范围在0.05~100ng/mL,检测限达到4.9pg/mL(85fmol/L).在10倍稀释的人血清、海水等不同分析样品中定性验证,表现出高灵敏度和高选择性.因此,该工作构建了用于复杂环境中定量检测SARS-CoV-2的适配体SPR传感器,为COVID-19的便携式诊断提供了一种解决方案.
其他新型SPR技术,如局域表面等离子共振[49](LSPR)传感器、塑料光纤SPR传感器在SARS-CoV-2检测中也得到了发展.Lewis等[38]设计并开发了一种双通道微流道系统的便携式LSPR技术用以检测COVID-19S1刺突蛋白.该方法采用生物素-链霉亲和素方法固定适配体,并使用双通道传感器技术对刺突蛋白进行了直接检测,减少对抗体或其他酶的使用,降低成本、简化操作,同时提高了适配体与传感器之间的稳定性和亲和力.实验堆S1刺突蛋白的检测范围为1~100nmol/L,检测限为0.26nmol/L,具有高选择性,在人血清白蛋白、人工唾液实验中回收率高达95%,具有广阔的潜在应用前景.
Cennamo等[37]设计的一种塑料光纤SPR传感器如图3(c)所示,将特定的适配体沉积在金膜上的短聚乙二醇(PEG)表面,可以检测COVID-19RBD蛋白,检测范围为25~1000nmol/L,检测限为37nmol/L.同时,也在人血清环境中进行了测试.与其他SPR传感器相比,该技术具有更低的检测限和更高灵敏度.
金、银等贵金属具有优越的检测灵敏度,尤以银表现出突出的特点.但由于其不稳定和易氧化等特点,传感芯片的涂层往往选择更稳定的金膜作为可以产生SPR的载体.Kumar等[35]提出了一种基于适配体固定的SPR传感器改性方法,将银、氮化硅、黑磷作为传感基底,由于沉积在银表面的碳化硅具有良好的稳定性,可以显著提高SPR检测稳定性和准确性,延长仪器使用寿命.而以硫醇修饰的ssDNA 作为配体具有高亲和力,可以作为快速诊断 SARS-CoV-2病毒的受体,灵敏度高达152°/RIU,为COVID-19传感检测提供了新的思路.
介电材料的选择主要聚焦在几个特性中,如对棱镜的检测灵敏度、精度和质量参数.石墨烯作为一种优良的导电材料,进入了生物传感器设计的视野当中.Akib等[40]设计了一种石墨烯基结构的SPR传感器,经过对上述参数的不断优化,完善并设计了BK7-Au-PtSe2-石墨烯的芯片结构,采用RBD蛋白的单克隆抗体、抗原、特异性探针等作为配体,分别对相应目标物(抗原、抗体、RNA)进行检测,该方法显示出明显的高灵敏度,检测限分别为1.74nmol/L、1.95nmol/L和150nmol/L.
2.1.3 固定抗原检测抗体
SRAS-CoV-2感染人体后,在一段时期内人体的免疫系统会产生大量抗体,这个过程可能持续几天到几十天不等.过去研究证实,非典(SARS-CoV)爆发时患者感染后的抗体水平可以在较长时间内保持较高水平,甚至数月后仍可在体内检出,这为定期评估COVID-19感染后群体免疫力的持续时间提供了方向,表明COVID-19抗体阳性检测对COVID-19的早期诊断具有重大意义.
Basso等[39]验证SPR技术是否可以对患者的血清进行阳性诊断.首先通过免疫色谱法及ELISA方法对患者血清进行筛查,确定样本IgG滴度.刺突蛋白及核衣壳蛋白通过单层自组装方式分别固定在金芯片,COVID-19阳性患者的血清流经表面与之结合引起SPR信号响应.优化后S抗原和N抗原固定最佳质量浓度均为8mg/mL,连续注射不同稀释倍数的单一患者血清以确定抗体吸附于芯片表面的质量浓度范围,选用0.1mol/L的甘氨酸缓冲液进行芯片再生.结果显示N抗体和S抗体阳性检出率均高达95%,N抗体阳性样品范围为1.34~5.47ng/mm2,S抗体阳性样品范围为1.04~9.45ng/mm2.该方法简单快速,测定时间不到10min,芯片再生性好.不足之处在于所用样本量较少,对于实际诊断COVID-19仍需进一步验证.
2.1.4 固定抗原检测病毒
Cennamo等[37]设计了一种新型的表面等离子传感器-塑料光纤-分析印记聚合物(SPR-POF-MIP)传感器原型,用于测定水溶液中的SARS-CoV-2病毒粒子,病毒与传感器金膜的MIP纳米膜结合后产生光折射率的变化,该方法能够进行复杂样本中的COVID-19检测,但其检测限尚鲜见报道,此外仍需要通过RT-PCR等技术手段对检测可靠性进一步 验证.
2.2 间接法检测COVID-19
间接法SPR检测原理如图4(a)所示,由于不同的抗原对抗体的结合响应程度不同,这一定程度上取决于表达抗原的结构及化学特性,Djaileb等[41]开发了一种涂有单层肽的SPR 传感器,该SPR传感器将来源于不同细胞系表达的SARS-CoV-2重组蛋白进行功能化,用以检测临床样本中的SARS-CoV-2IgG 抗体.核衣壳蛋白分别由CHO(Chinese hamster ovary)细胞系及大肠杆菌表达产生,刺突蛋白由CHO细胞系、HEK(human embryonic kidney)细胞及毕赤酵母细胞表达.实验中核衣壳蛋白没有表现出预期的灵敏度,而使用 CHO 细胞系表达的刺突蛋白特异性优越,SPR可以在30min内测量4个生物样品,芯片再生至少9次.此外,由于检测因基质效应(折射率、蛋白质浓度、pH)在临床中受到干扰,阻碍 SPR对抗体的诊断.进一步,该研究使用山羊抗小鼠 IgG(H+L)实施了抗核衣壳蛋白抗体的二次检测步骤.在测试临床样本血清时,直接测定的抗体检测限为3nmol/L,方法如图3(d)所示.流入山羊抗鼠抗体后,原理如图4(a)所示,检测限由3nmol/L降低到2nmol/L.芯片活性可以在4℃环境中保存一周,并应用于各类基于血液的产品如血清、血浆和干血斑,扩展了SPR传感器在SARS-CoV-2抗体检测中的应用范围.
2.3 夹心法检测COVID-19
夹心法是提高检测灵敏度十分重要的方法,如图4(b)所示,Yano等[42]采用夹心法,使用直径为150nm的超大金纳米粒子(AuNPs)偶联于第二抗体中进行放大信号,实现了SARS-CoV-2N蛋白的SPR超灵敏检测.超大金纳米粒子(150nm)灵敏度相比于粒径在几十纳米左右的AuNPs高出一个数量级.这个结论首先在癌胚抗原检测中得到验证,而后应用于SARS-CoV-2N蛋白的检测,检测限约为85fmol/L(4pg/mL),实现了磷酸盐缓冲液中SARS-CoV-2N抗原的高灵敏检测.此外,Qu等[43]将His6标记的RBD蛋白固定于涂覆金膜的FO(无标记光纤)探针上,采用夹心法检测全血样品中的抗体.该方法适用于复杂的样品环境中,解决了检测血液样本时易发生的微流道系统堵塞问题.
上述提出的两种夹心法检测COVID-19,均使用了金纳米粒子进行了信号放大.不同的是Yano等突破了传统金纳米颗粒粒径,采用更高灵敏响应的金纳米粒子进行信号放大,Qu等[43]则开发了一种His6标记的RBD蛋白实现生物受体的定向固定,这有利于抗体与抗原表位的结合.此外,二者均比传统 ELISA夹心法检测时间更短,在几十分钟之内即可完成检测.
3 SPR在COVID-19潜在药物评价的应用
新冠肺炎是一种由新型冠状病毒引起的高度传染性疾病,世界范围仍然缺少可以有效治疗 COVID-19的药物,因此更多地将视线放于研究与评估COVID-19疫苗中.在COVID-19大流行期间,具有中国特色的中西药结合疗法有效抑制了病人严重发病,在治疗中取得了巨大的成功,而进一步揭示其中的原理,对新冠潜在药物进行评价成为了SPR新冠研究的另一新兴课题.
已有的研究结果显示在影响和治疗COVID-19的因素中,SARS-CoV-2的3CL水解酶、RdRP、ACE2、IL-6和S蛋白是治疗COVID-19的关键酶[50].图5根据Ye等[51]的研究重新绘制了流程图,它显示了一般的药物评价路线,经数据库检索药物的活性成分和潜在靶点,使用网络药理学进一步筛选关键化合物,将筛选出的化合物靶点与COVID-19疾病靶点相交的核心靶点进行功能富集分析,采用分子对接模拟酶与化合物的相互作用,并以SPR技术进行验证是其在药物评价中发挥的主要功能.
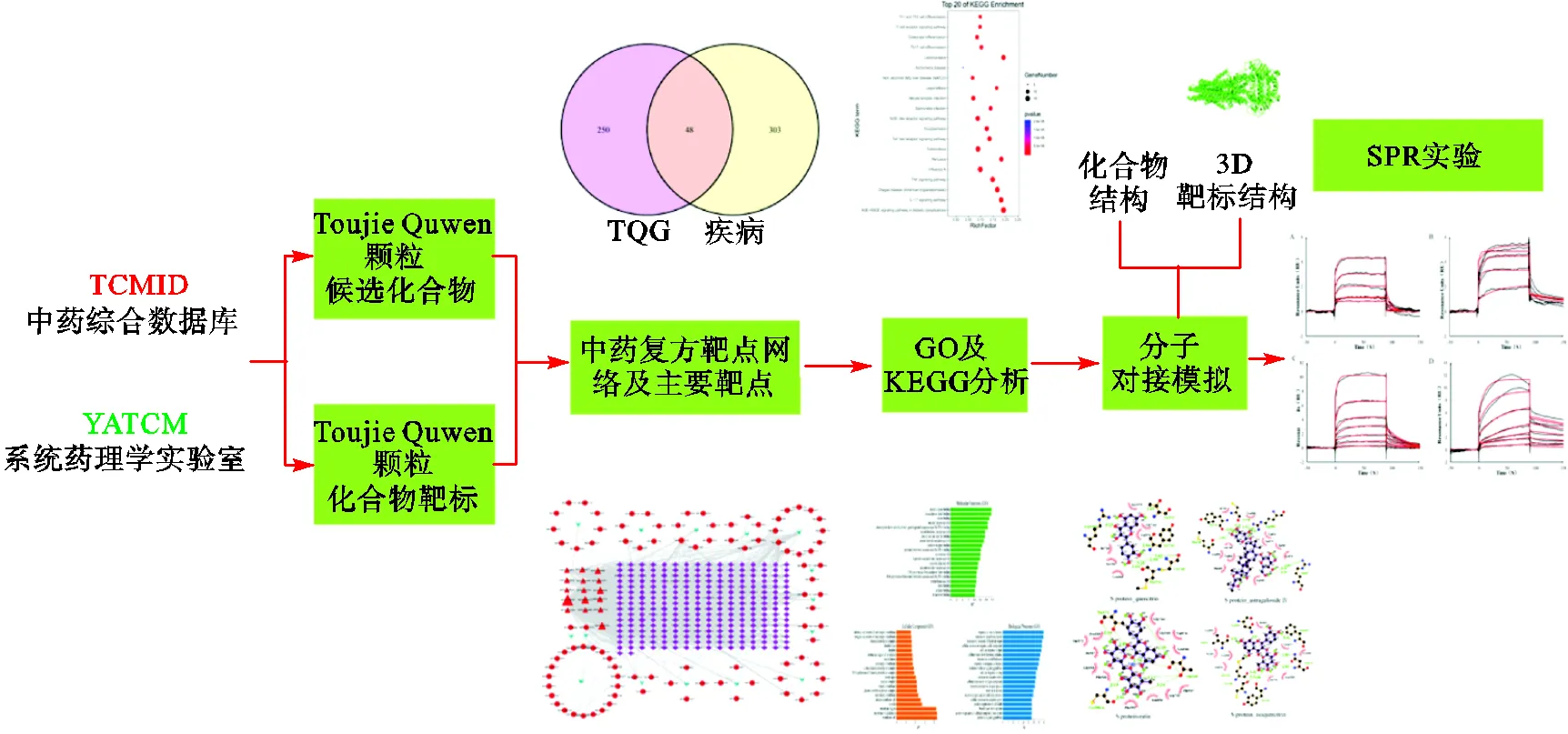
图5 包含SPR分析的药物评价路线图[51]
Ye等[51]选择槲皮素、黄芪甲苷等4种具有生物活性的药物分子进行了体外亲和力动力学检测,药物分子分别流过固定有ACE2和S蛋白的芯片表面,SPR结果显示芦丁和黄芪甲苷结合ACE2、槲皮素和异槲皮苷结合S蛋白的KD值均小于1×10-5mol/L,而不与另一种受体结合.从而可以推测槲皮素和异槲皮苷是通过与S-RBD区域高亲和力结合占据病毒结合表位使其失活,进而阻断病毒对人体ACE2受体的结合;黄芪甲苷和芦丁则能够通过与病毒竞争结合ACE2受体,占据受体结合表位从而阻断人体感染病毒.通过SPR的亲和力动力学测定,不仅可以验证药物对COVID-19的治疗效应,进一步地,可以通过分子结合的机制、结合常数和解离常数的计算对其进行相应的解释.
此外,3CL Pro蛋白酶也是研究中的热点靶标,它可以阻止SARS-CoV-2的病毒复制.Tripathi等[52]通过筛选针对SARS-CoV-2的3CL Pro蛋白酶的已批准分子,并对3CL Pro蛋白酶分子的生化活性和生物物理特性进行分析,发现替考拉宁是SARS-CoV-2 3CL Pro蛋白酶的有效抑制剂.采用SPR实时监测3CL Pro和已识别的配体分子之间的分子相互作用,包括药物分子与靶蛋白之间的结合和解离速率,结果表明分子间响应信号随剂量依赖性增强.
4 结 语
基于表面等离子共振(SPR)的生物传感器在新冠病毒的定量检测及潜在药物评价方面中均发挥着重要的作用,检测方法多种多样.SPR直接法检测的主要优点在于思路简单、操作便利、用时更短、成本更低,弊端在于对于复杂基质的检测存在较多的困难.降低非特异性吸附、选择合适的再生条件、提高检测信号成为COVID-19检测中亟待解决的问题.目前针对COVID-19的SPR检测大多采用直接法,可以保证高灵敏度及优异的重复性,但在实际样本和复杂环境中的应用较少,这主要是由于血液、血清样本或拭子中存在过多干扰性抗体和其他核酸类物质.间接法及夹心法通过采用不同的试剂样品,都可以在一定程度上增大分析物与配体结合的响应信号.检测抗体中所携带的金属粒子由于可以和金膜之间的自由电子共振耦合从而可以增强响应信号.此外,多通道共检测及复杂样本的前处理不善易导致通道堵塞及芯片的重复再生利用均是SPR检测COVID-19时需要考虑的因素.
目前,SPR传感器仍不能立即用于诊断临床样本中的 COVID-19,一些优化改进需要进一步研究以确保SPR检测新冠技术将来成为一种临床诊断的可能.优化主要包括以下几个方面:①筛选具有更高结合亲和力和稳定性的抗体或适配体,更高的特异性在一定程度上可以降低非特异性吸附的影响;②传感器表面修饰如自组装及硫醇修饰提高配体固定的稳定性,寻找更合适的棱镜、更高SPR比率的包覆金属及基底材料等提高传感灵敏度;③选择更合适分子结合方式,带有标签或生物素配体的有序排列有助于提高分子的结构稳定性和亲和活性,增大配体有效固定量有利于更多的分子结合;④优化缓冲液成分、封闭方式或超低污染修饰,最大限度减少复杂基质中的非特异性结合;⑤开发多种信号放大方法.通过上述研究,有望推进SPR技术在新冠病毒检测中的即时检测应用,实现对COVID-19的早期诊断与治疗.
在药物评价方面,除了根据结合/解离常数推断潜在药物的作用机制之外,还可以根据药物与蛋白间的亲和力动力学分析进行药物的高通量筛选,找出合适的抑制剂及治疗药物用以阻断COVID-19的传播,因此,SPR技术有望在COVID-19药物评价及筛选中发挥重要作用.
[1] Hu B,Guo H,Zhou P,et al. Characteristics of SARS-CoV-2 and COVID-19[J]. Nature Reviews Microbiology,2021,19(3):141-154.
[2] Klompas M,Baker M A,Rhee C. Airborne transmis-sion of SARS-CoV-2:Theoretical considerations and available evidence[J]. JAMA,2020,324(5):441-442.
[3] Koyama A K,Siegel D A,Oyegun E,et al. Symptoms reported with new onset of loss of taste or smell in individuals with and without SARS-CoV-2 infection[J]. JAMA Otolaryngology—Head & Neck Surgery,2021,147(10):911-914.
[4] Orooji Y,Sohrabi H,Hemmat N,et al. An overview on SARS-CoV-2(COVID-19) and other human coro-naviruses and their detection capability via amplification assay,chemical sensing,biosensing,immunosens-ing,and clinical assays[J]. Nano-Micro Letters,2020,13(1):18-47.
[5] Kannan S,Ali P S S,Sheeza A,et al. COVID-19 (novel coronavirus 2019)—Recent trends[J]. European Review for Medical and Pharmacological Sciences,2020,24(4):2006-2011.
[6] Udugama B,Kadhiresan P,Kozlowski H N,et al. Diagnosing COVID-19:The disease and tools for detec-tion[J]. ACS Nano,2020,14(4):3822-3835.
[7] Shang J,Ye G,Shi K,et al. Structural basis of receptor recognition by SARS-CoV-2[J]. Nature,2020,581(7807):221-224.
[8] Yoshimoto F K. The proteins of severe acute respiratory syndrome coronavirus-2 (SARS CoV-2 or n-COV19),the cause of COVID-19[J]. Protein Journal,2020,39(3):198-216.
[9] Yip C C Y,Ho C C,Chan J F W,et al. Development of a novel,genome subtraction-derived,SARS-CoV-2-specific COVID-19-nsp2 real-time RT-PCR assay and its evaluation using clinical specimens[J]. International Journal of Molecular Sciences,2020,21(7):2574-2584.
[10] Ren L Z,Li C. Recent progress on the diagnosis of 2019 novel coronavirus[J]. Transboundary and Emerging Dis-eases,2020,67(4):1485-1491.
[11] Srivastav S,Dankov A,Adanalic M,et al. Rapid and sensitive SERS-based lateral flow test for SARS-CoV2-specific IgM/IgG antibodies[J]. Analytical Chemistry,2021,93(36):12391-12399.
[12] El-Said W A,Al-Bogami A S,Alshitari W. Synthesis of gold nanoparticles@reduced porous graphene-modified ITO electrode for spectroelectrochemical detec-tion of SARS-CoV-2 spike protein[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectros-copy,2022,264:120237.
[13] Singh P. SPR biosensors:Historical perspectives and current challenges[J]. Sensors and Actuators B:Chemical,2016,229:110-130.
[14] Phillips K S,Cheng Q. Recent advances in surface plasmon resonance based techniques for bioanalysis[J]. Analytical and Bioanalytical Chemistry,2007,387(5):1831-1840.
[15] Adrover-Jaume C,Alba-Patio A,Clemente A,et al. Paper biosensors for detecting elevated IL-6 levels in blood and respiratory samples from COVID-19 patients [J]. Sensors and Actuators B:Chemical,2020,330:129333.
[16] Chung H Y,Jian M Jr,Chang C K,et al. Novel dual multiplex real-time RT-PCR assays for the rapid detection of SARS-CoV-2,influenza A/B,and respiratory syncytial virus using the BD MAX open system[J]. Emerging Microbes & Infections,2021,10(1):161-166.
[17] Yan C,Cui J,Huang L,et al. Rapid and visual detec-tion of 2019 novel coronavirus (SARS-CoV-2)by a re-verse transcription loop-mediated isothermal amplifica-tion assay[J]. Clinical Microbiology and Infection,2020,26(6):773-779.
[18] Han C,Li W,Li Q,et al. CRISPR/Cas12a-derived electrochemical aptasensor for ultrasensitive detection of COVID-19 nucleocapsid protein[J]. Biosensors and Bio-electronics,2022,200:113922.
[19] Shan D,Johnson J M,Fernandes S C,et al. SARS-Coronavirus-2 nucleocapsid protein measured in blood using a Simoa ultra-sensitive immunoassay differentiates COVID-19 infection with high clinical sensitivity[J]. medRxiv,2020,DOI:http://doi.org/10.1101/2020.08. 14.20175356.
[20] Seo G,Lee G,Kim M J,et al. Rapid detection of COVID-19 causative virus (SARS-CoV-2)in human na-sopharyngeal swab specimens using field-effect transis-tor-based biosensor[J]. ACS Nano,2020,14(4):5135-5142.
[21] Xue G,Li S,Zhang W,et al. Reverse-transcription recombinase-aided amplification assay for rapid detection of the 2019 novel coronavirus (SARS-CoV-2)[J]. Ana-lytical Chemistry,2020,92(14):9699-9705.
[22] Kim H S,Abbas N,Shin S. A rapid diagnosis of SARS-CoV-2 using DNA hydrogel formation on micro-fluidic pores[J]. Biosensors and Bioelectronics,2021,177:113005.
[23] Mattioli I A,Castro K R,Macedo L J A,et al. Gra-phene-based hybrid electrical-electrochemical point-of-care device for serologic COVID-19 diagnosis[J]. Bio-sensors and Bioelectronics,2022,199:113866.
[24] Amendola A,Sberna G,Lalle E,et al. Saliva is a valid alternative to nasopharyngeal swab in chemilumi-nescence-based assay for detection of SARS-CoV-2 anti-gen[J]. Journal of Clinical Medicine,2021,10(7):1471-1481.
[25] 石 婷,刘 瑾,张婉洁,等. 基于SPR生物传感器的抗生素残留检测及影响因素分析[J]. 天津大学学报,2010,43(3):255-261.
Shi Ting,Liu Jin,Zhang Wanjie,et al. Analysis of influencing factors on detection of antibiotics residues based on surface plasmon resonance biosensor[J]. Jour-nal of Tianjin University,2010,43(3):255-261(in Chinese).
[26] 徐 霞,叶尊忠,吴 坚,等. 表面等离子体共振免疫传感器在蛋白质检测中的应用及其研究进展[J]. 分析化学,2010,38(7):1052-1059.
Xu Xia,Ye Zunzhong,Wu Jian,et al. Application and research development of surface plasmon resonance-based immunosensors for protein detection[J]. Chinese Journal of Analytical Chemistry,2010,38(7):1052-1059(in Chinese).
[27] Chen S,Liu Y,Yu Q,et al. Self-referencing SPR biosensing with an ultralow limit-of-detection using long-wavelength excitation[J]. Sensors and Actuators B:Chemical,2021,327:128935.
[28] 黄福祥,栗大超,伍 鹏,等. 表面等离子共振检测葡萄糖浓度的数据处理方法[J]. 天津大学学报,2011,44(1):69-72.
Huang Fuxiang,Li Dachao,Wu Peng,et al. Data analysis method for glucose detection based on surface plasmon resonance[J]. Journal of Tianjin University,2011,44(1):69-72(in Chinese).
[29] 常 亮,刘晓志,赵 伟,等. 利用表面等离子体共振技术检测重组抗体NM57免疫原性[J]. 药学学报,2013,48(4):532-535 .
Chang Liang,Liu Xiaozhi,Zhao Wei,et al. Testing im-munogenicity of recombinant antibody by surface plasmon resonance[J]. Acta Pharmaceutica Sinica,2013,48(4):532-535(in Chinese).
[30] Hoang H N,Park J,Kang S,et al. Surface plasmon resonance:A versatile technique for biosensor applica-tions[J]. Sensors,2015,15(5):10481-10510.
[31] Wang S,Zhao S,Wei X,et al. An improved label-free indirect competitive SPR immunosensor and its compari-son with conventional ELISA for ractopamine detection in Swine Urine[J]. Sensors,2017,17(3):604-613.
[32] Mauriz E,Fernández M,Lechuga L M. Towards the design of universal immunosurfaces for SPR-based as-says:A review[J]. TrAC Trends in Analytical Chemistry,2016,79(1):191-198.
[33] Bong J H,Kim T H,Jung J,et al. Pig sera-derived anti-SARS-CoV-2 antibodies in surface plasmon reso-nance biosensors[J]. Biochip Journal,2020,14(4):358-368.
[34] Chen R,Kan L,Duan F,et al. Surface plasmon reso-nance aptasensor based on niobium carbide MXene quan-tum dots for nucleocapsid of SARS-CoV-2 detection[J]. Microchimica Acta,2021,188(10):316-325.
[35] Kumar Awadhesh,Kumar Anil,Srivastava Sanjay Kumar. Silicon nitride-BP-based surface plasmon reso-nance highly sensitive biosensor for virus SARS-CoV-2 detection[J]. Plasmonics,2022,17(3):1065-1077.
[36] Moznuzzaman M,Khan I,Islam M. Nano-layered surface plasmon resonance-based highly sensitive biosen-sor for virus detection:A theoretical approach to detect SARS-CoV-2[J]. AIP Advances,2021,11(6):065023.
[37] Cennamo N,Pasquardini L,Arcadio F,et al. SARS-CoV-2 spike protein detection through a plasmonic D-shaped plastic optical fiber aptasensor[J]. Talanta,2021,233:122532.
[38] Lewis T,Giroux E,Jovic M,et al. Localized surface plasmon resonance aptasensor for selective detection of SARS-CoV-2 S1 protein[J]. Analyst,2021,146(23):7207-7217.
[39] Basso C R,Malossi C D,Haisi A,et al. Fast and reli-able detection of SARS-CoV-2 antibodies based on sur-face plasmon resonance[J]. Analytical Methods,2021,13(29):3297-3306.
[40] Akib T B A,Mou S F,Rahman M M,et al. Design and numerical analysis of a graphene-coated SPR biosen-sor for rapid detection of the novel coronavirus[J]. Sen-sors,2021,21(10):3491-3511.
[41] Djaileb A,Hojjat J M,Coutu J,et al. Cross-validation of ELISA and a portable surface plasmon resonance in-strument for IgG antibody serology with SARS-CoV-2 positive individuals[J]. Analyst,2021,146(15):4905-4917.
[42] Yano T A,Kajisa T,Ono M,et al. Ultrasensitive de-tection of SARS-CoV-2 nucleocapsid protein using large gold nanoparticle-enhanced surface plasmon resonance [J]. Scientific Reports,2022,12(1):1060-1067.
[43] Qu J H,Leirs K,Maes W,et al. Innovative FO-SPR label-free strategy for detecting anti-RBD antibodies in COVID-19 patient serum and whole blood[J]. ACS Sensors,2022,7(2):477-487.
[44] Das C M,Guo Y,Yang G,et al. Gold nanorod as-sisted enhanced plasmonic detection scheme of COVID-19 SARS-CoV-2 spike protein[J]. Advanced Theory and Simulations,2020,3(11):2000185.
[45] Wang Q,Zou L,Yang X,et al. Direct quantification of cancerous exosomes via surface plasmon resonance with dual gold nanoparticle-assisted signal amplification [J]. Biosensors and Bioelectronics,2019,135:129-136.
[46] Sun D,Wu Y,Chang S J,et al. Investigation of the recognition interaction between glycated hemoglobin and its aptamer by using surface plasmon resonance[J]. Ta-lanta,2021,222:121466.
[47] Duan F,Zhang S,Yang L,et al. Bifunctional aptasen-sor based on novel two-dimensional nanocomposite of MoS2quantum dots and g-C3N4nanosheets decorated with chitosan-stabilized Au nanoparticles for selectively detecting prostate specific antigen[J]. Analytica Chimica Acta,2018,1036:121-132.
[48] Dursun A D,Borsa B A,Bayramoglu G,et al. Surface plasmon resonance aptasensor for brucella detection in milk[J]. Talanta,2022,239:123074.
[49] 苏荣欣,唐艺文,尹慧廷,等. 基于枝角金纳米颗粒的LSPR传感器制备与免疫检测[J]. 天津大学学报(自然科学与工程技术版),2020,53(5):441-449.
Su Rongxin,Tang Yiwen,Yin Huiting,et al. Fabrica-tion of LSPR sensors based on branched gold nanoparti-cles for immunoassays[J]. Journal of Tianjin University (Science and Technology),2020,53(5):441-449(in Chinese).
[50] Mauriz E,Lechuga L M. Current trends in SPR biosens-ing of SARS-CoV-2 entry inhibitors[J]. Chemosensors,2021,9(12):330-354.
[51] Ye M,Luo G,Ye D,et al. Network pharmacology,molecular docking integrated surface plasmon resonance technology reveals the mechanism of Toujie Quwen Granules against coronavirus disease 2019 pneumonia [J]. Phytomedicine,2021,85:153401.
[52] Tripathi Neetu,Tripathi Neeraj,Goshisht Manoj Kumar. COVID-19:Inflammatory responses,structure-based drug design and potential therapeutics[J]. Molecu-lar Diversity,2021,26:629-645.
Detection of COVID-19 and Drug Evaluation Based on Surface Plasmon Resonance Sensors
Su Rongxin1, 2, 3,Liu Xiao1, 2,Che Jinjing4,Huang Renliang3,Qi Wei1, 2
(1. School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2. State Key Laboratory of Chemical Engineering,Tianjin University,Tianjin 300072,China;3. School of Marine Science and Technology,Tianjin University,Tianjin 300072,China;4. Beijing Institute of Pharmacology and Toxicology,Beijing 100850,China)
Since the discovery of the novel coronavirus, COVID-19 has caused widespread concern in the community. Compared with other coronavirus strains, its transmission capacity, infectivity, and pathogenicity are higher, causing great harm to human health, life, and the economy globally. Highly accurate detection and early diagnosis are the key tools to combat COVID-19. Polymerase chain reaction (PCR) is a common method used for COVID-19 detection; however, it has several drawbacks, including its non-quantitative nature, long evaluation time, and high cost. The surface plasmon resonance(SPR) sensor is a highly sensitive, labeling-free, and rapid real-time analytical tool that can be used to quantitatively detect specific proteins, nucleic acids, and virions and could play a critical role in COVID-19 detection. This paper reviews the research progress in the quantitative detection of COVID-19 using SPR sensor based on different detection methods, including direct, indirect, and sandwich methods. The fixed ligand is classified, and the targets include nucleic acid molecules, antigens, antibodies, and virus particles. Simultaneously, SPR sensor is also introduced in terms of sensor design, surface modification, and detection performance. Then, the development direction of SPR sensor for COVID-19 detection is summarized, along with the existing issues and the necessary measures. Additionally, SPR sensor can realize the calculation of intermolecular KD values through its unique affinity kinetic analysis, and the application and mechanism of SPR in the evaluation of potential drugs for COVID-19 are summarized and prospected. The above research results contribute to the construction and development of highly sensitive detection methods for novel coronavirus and provide the basis and guidance for the design and mechanism of action of related therapeutic drugs.
novel coronavirus;surface plasmon resonance(SPR);quantitative detection;drug evaluation
TP212.3
A
0493-2137(2023)01-0001-10
10.11784/tdxbz202203019
2022-03-10;
2022-04-25.
苏荣欣(1980— ),男,博士,教授,surx@tju.edu.cn.
黄仁亮,tjuhrl@tju.edu.cn.
国家重点研发计划资助项目(2020YFC0811102).
Supported by the National Key Research and Development Program of China(No. 2020YFC0811102).
苏荣欣,天津大学教授,博士生导师,国家重点研发计划项目负责人,入选教育部新世纪优秀人才、天津市中青年科技创新领军人才.主要从事环境污染物检测与治理、表面防污技术研究,重点围绕高灵敏和高特异性表面等离子共振传感器研制、表面协同防污材料设计开发等方向开展工作,主持国家重点研发计划项目、国家自然科学基金、国家重大科学仪器专项任务、国家科技支撑计划子课题、国家863计划子课题等国家级和省部级项目,作为第一或通信作者在Angew Chem、Environ Sci Technol、Biosens Bioelectron、Biotechnol Bioeng、Chem Eng Sci、Ind Eng Chem Res、Chem Eng J、J Agric Food Chem、Langmuir、ACS Appl Mater Interfaces、ACS Sustain Chem Eng等发表SCI论文100余篇,担任Frontiers in Energy Research副主编,Renewable and Sustainable Energy Reviews和Journal of Cleaner Production客座编辑,获得2017年侯德榜化工科技奖青年奖、2019年中国分析测试协会BCEIA金奖、2017年教育部自然科学奖二等奖、2013年天津市自然科学奖二等奖.

(责任编辑:田 军)
