临床、病理、MRI特征及IVIM参数联合模型预测宫颈癌程序性细胞死亡蛋白1及其配体(PD-1/PD-L1)表达
2023-02-23刘开惠田海萍张治宁李云霞何剑莉
刘开惠,杨 蔚,田海萍,张治宁,李云霞,何剑莉
(1.宁夏医科大学临床医学院,宁夏 银川 750004;2.宁夏医科大学总医院放射科,3.病理科,4.妇瘤外科,5.肿瘤内科,6.放疗科,宁夏 银川 750004)
宫颈癌是女性常见恶性肿瘤之一[1]。免疫疗法在治疗宫颈癌、黑色素瘤等恶性肿瘤中具有巨大潜能,以程序性细胞死亡蛋白-1(programmed cell death protein 1,PD-1)及其配体(PD-1 ligand,PD-L1)为主的免疫检查点[2-3]备受关注。基于MR弥散加权成像(diffusion weighted imaging,DWI)的体素内不相干运动(intravoxel incoherent motion,IVIM)成像以双指数模型提取组织真实弥散系数(D)、灌注相关弥散系数(D*)及灌注分数(f),用于宫颈癌分期、分级及评估疗效具有较高应用价值[4]。SHAP法[5]广泛用于数据分析。本研究以SHAP法观察基于宫颈癌临床、病理、MRI特征及IVIM定量参数构建的联合模型预测其PD-1/PD-L1表达的价值。
1 资料与方法
1.1 一般资料 前瞻性纳入2021年1月—2022年8月宁夏医科大学总医院63例首诊宫颈癌(病灶均单发)患者,年龄28~75岁、平均(53.8±11.6)岁;经手术或穿刺活检病理证实宫颈癌,且于病理检查前2周内接受盆腔MR检查;宫颈鳞癌52例、腺癌9例、腺鳞癌2例,FIGO分期Ⅰ期34例、Ⅱ期9例、Ⅲ期14例、Ⅳ期6例。纳入标准:无手术、放射及化学治疗等宫颈癌治疗史,可耐受盆腔MR检查,且影像学及病理学资料完整。本研究获院伦理委员会批准(2018-062),检查前患者及家属均签署知情同意书。
1.2 仪器与方法 嘱患者检查前禁食、禁水至少6 h,保持膀胱半充盈状态。采用Philips Achieva 3.0T MR仪,嘱患者仰卧,采集盆腔MRI;参数:轴位T2WI,TR 4 200 ms,TE 95 ms,矩阵300 × 400,FOV 240 mm ×360 mm,层厚5 mm,层间距1 mm,NEX 1;轴位IVIM,TR 4 800 ms,TE 76 ms,FOV 240 mm×240 mm,矩阵122×155,层厚4.0 mm,层间距2 mm,NEX 6,b值=0、25、50、75、100、150、300、500、1 000、1 500 s/mm2。
1.3 图像分析 将原始图像导入MITK软件(2014.10.02),由分别具有3年及21年工作经验的住院及主任医师各1名以双盲法阅片。基于常规MR T2WI评估宫颈癌病灶大小、浸润深度、有无宫旁浸润及淋巴结转移(针对穿刺活检患者)。参考T2WI于轴位IVIM(b值为1 000 s/mm2)连续层面避开出血、囊变及坏死沿病灶边缘手动勾画ROI,测量其D、D*、f值,获得相应伪彩图像,以各层面病灶D、D*、f值的均值为最后结果。
1.4 免疫组织化学染色 对术后或活检标本行免疫组织化学检查,检测PD-1/PD-L1蛋白表达水平,并行CD34和(或)D2-40、S-100及Ki-67染色。采用鼠抗人PD-1及PD-L1单克隆抗体,以免疫反应评分(immunoreactivity score,IRS)为标准[6],IRS=0为阴性,>0为阳性;CD34和(或)D2-40染色阳性提示脉管侵犯(lymphovascular invasion,LVI)阳性;S-100染色阳性提示神经侵犯。
1.5 统计学分析 采用SPSS 26.0及R(4.1.1)统计分析软件。以组内相关系数(intra-class correlation coefficient,ICC)分析观察者间测量IVIM参数的一致性:ICC≤0.40为一致性差,0.40
2 结果
63例宫颈癌中,33例PD-1表达为阳性、30例PD-1表达阴性;34例PD-L1表达阳性、29例PD-L1表达阴性。
2.1 不同PD-1/PD-L1状态宫颈癌临床、病理、MRI特征及IVIM参数比较 观察者间测量D [ICC=0.97,95%CI(0.95,0.98)]、D*[ICC=0.87,95%CI(0.78,0.92)]、f [ICC=0.86,95%CI(0.81,0.93)]值的一致性极好(P均<0.05),故取其中1名的测量结果进行统计分析。PD-1阳性、阴性组间,PD-L1阳性、阴性组间肿瘤病理分级、宫旁浸润、淋巴结转移及D值差异均有统计学意义(P均<0.05),其余参数差异均无统计学意义(P均>0.05)。见表1。

表1 不同PD-1/PD-L1表达宫颈癌临床、病理、MRI特征及IVIM参数比较
2.2 logistic回归及诊断效能分析 宫颈癌FIGO分期、病理分级、宫旁浸润、淋巴结转移及D值均为其PD-1/PD-L1表达阳性的独立影响因素(P均<0.05),见表2。据此建立临床-病理模型(包含FIGO分期及病理分级)及联合模型(5个参数联合),联合模型预测宫颈癌PD-1/PD-L1表达阳性的AUC分别为0.85及0.89,均高于临床-病理模型及任一单一独立影响因素(Z=2.10~3.77,P均<0.05),见表3及图1。SHAP分析(图2、3)显示,宫颈癌FIGO分期及病理分级对联合模型的贡献较大,而D值为重要补充。

图1 临床-病理模型及联合模型预测宫颈癌PD-1表达阳性(A)和PD-L1表达阳性(B)的ROC曲线
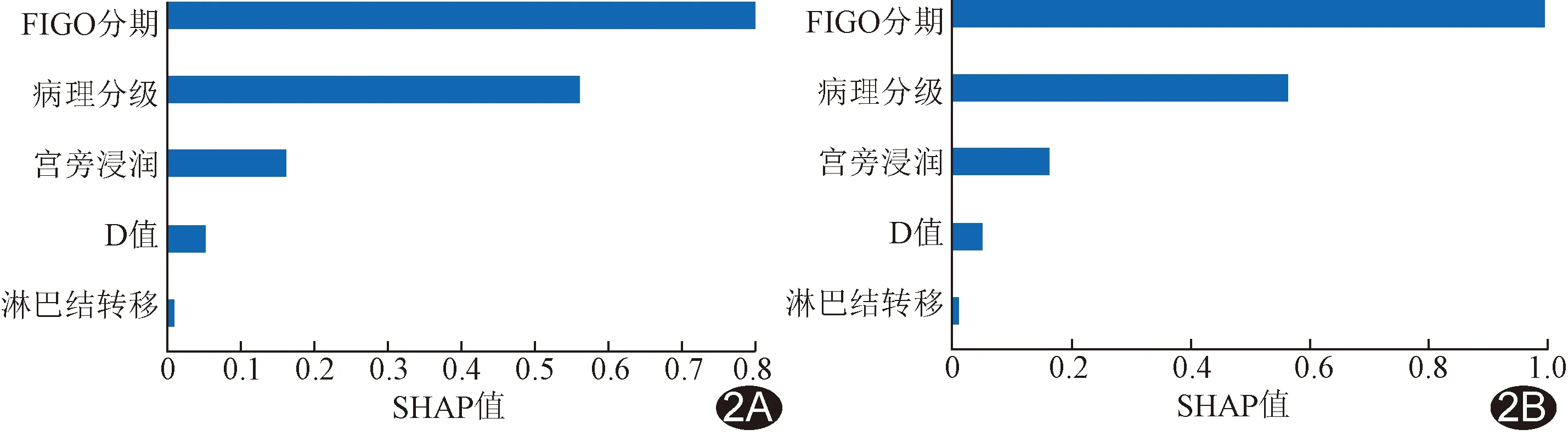
图2 基于SHAP法解释联合模型各参数预测宫颈癌PD-1表达阳性(A)和PD-L1表达阳性(B)重要性(按降序排列)的经典直方图
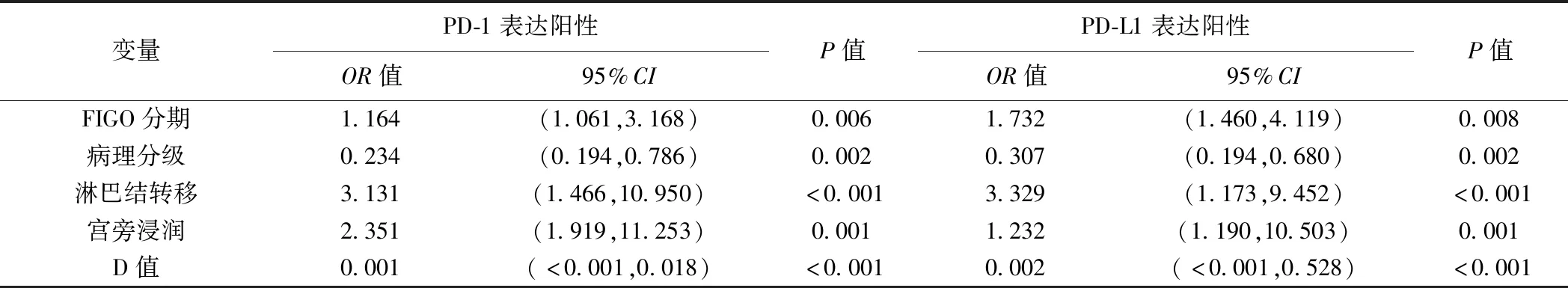
表2 宫颈癌PD-1/PD-L1表达阳性的独立影响因素:logistic回归分析结果

表3 单一独立影响因素及各模型预测PD-1/PD-L1表达阳性的效能
2.3 相关性分析 宫颈癌PD-1/PD-L1表达均与其D值呈负相关(rs=-0.36、-0.39,P均<0.05),与D*、f值无明显相关性(P均>0.05);PD-1与PD-L1表达呈正相关(rs=0.12,P<0.01)。
3 讨论
肿瘤PD-1/PD-L1表达水平与预后相关[2]。IVIM基于双指数模型提取定量参数,可区分水分子弥散运动与微循环灌注,对组织微观变化更为敏感。SHAP法以直方图展示模型中各变量的贡献,某变量的直方图图形越长,其SHAP值绝对值越大,贡献值越高。本研究中,宫颈癌FIGO分期、病理分级、宫旁浸润、淋巴结转移及病灶D值均为其PD-1/PD-L1表达阳性的独立影响因素;以之建立的联合模型预测其PD-1/PD-L1表达阳性的AUC分别为0.85及0.89,高于临床-病理模型及单一独立影响因素;两个联合模型中FIGO分期及病理分级的贡献均最大,D值为其重要补充。本研究logistic回归分析显示,宫颈癌PD-1/PD-L1表达阳性与其FIGO分期较晚、病理分级较低、宫旁浸润及淋巴结转移有关,与OMENAI等[7]的结果相符,提示PD-1/PD-L1阳性与预后密切相关。
本研究发现宫颈癌D值与其PD-1/PD-L1表达呈负相关。RASMUSSEN等[8]报道,头颈部鳞癌ADC与其PD-L1表达呈负相关。ADC和D值均可反映组织内细胞密度。ADC基于单指数模型DWI获得,在一定程度上受体内组织毛细血管内血流灌注的影响,可能高估病灶内纯水分子的弥散运动;而D值可将病灶内纯水分子运动与微循环灌注分离,能更准确地反映细胞内水分子弥散及细胞增殖情况[9]。PD-1/PD-L1表达阳性宫颈癌内细胞密度更高、水分子弥散受限更明显,故其D值更低。

图3 患者女,46岁,低分化宫颈鳞癌,PD-L1表达阳性 A、B.轴位T2WI(A)示宫颈不规则中-高信号肿块,D值伪彩图(B)示D值为0.46×10-3 mm2/s(箭示病灶);C.免疫组化染色呈PD-L1阳性(×400);D.SHAP实例图示联合模型中FIGO分期的价值最高,蓝色和绿色代表预测风险评分的正向和负向贡献,E [f(x)]为联合模型的截断值(5.04),f(x)为联合模型的预测值(6.46),预测值高于截断值表示PD-L1表达阳性风险高,与实际相符
D*和f值均可反映微循环灌注。D*值主要由毛细血管长度、数量及血流速度决定,而f值指病灶内微循环灌注效应占总体弥散效应的比重[10]。理论上,PD-1/PD-L1表达阳性肿瘤组织内血管密度增加、灌注增加,D*及f值应随之升高;但本研究 PD-1/PD-L1阳性与阴性组间D*及f值差异均无统计学意义,病灶D*及f值与PD-1/PD-L1表达亦无明显相关,可能与样本量小,且D*及f值的稳定性和受宫颈癌的影响程度均不及D值有关。
本研究发现宫颈癌PD-1与PD-L1表达呈正相关,与既往研究[11]结果一致,但相关性系数不高,考虑与样本量少有关。PD-1主要与其配体PD-L1结合,抑制自身免疫反应。人体被肿瘤细胞侵袭时,PD-1与肿瘤细胞表面PD-L1结合可抑制T细胞增殖并诱导其凋亡和耗竭,导致肿瘤细胞免疫逃逸而促进肿瘤发生发展;耗竭的T细胞特征性高表达PD-1,且与PD-L1相关[12]。综上,基于宫颈癌临床、病理、MRI特征及D值构建的联合模型可有效预测其PD-1/PD-L1表达状态。但本研究为单中心小样本观察,且免疫组织化学所针对的肿瘤层面与肿瘤整体情况可能存在差异,有待后续进一步观察。
