震颤型与强直型帕金森病静息态脑功能度中心性的差异
2023-02-23宋宸蝶廖海燕蔡赛男谭长连
宋宸蝶,周 繁,廖海燕,沈 琴,王 敏,蔡赛男,谭长连
(中南大学湘雅二医院放射科,湖南 长沙 410011)
帕金森病(Parkinson disease,PD)的典型运动症状包括静止性震颤、肌强直、运动迟缓和姿势不稳等,可根据主要运动症状分为震颤(tremor dominant,TD)型、强直(akinetic-rigid dominant,ARD)型和混合型。不同运动表型PD临床进程及预后存在差异[1],目前其潜在神经病理机制尚不明确。静息态功能MRI(resting-state functional MRI,rs-fMRI)相关研究[2-3]显示,TD型与ARD型PD患者间脑结构及功能改变存在差异。既往针对不同运动表型PD的脑功能研究主要关注功能连接、低频振幅及局部一致性等,而反映全脑功能连接信息的指标(如基于种子点)需要先验假设,使结果可能存在偏倚;且低频振幅及局部一致性等不能反映全脑功能连接改变。度中心性(degree centrality,DC)是无需先验假设即可反映全脑功能连接强度的rs-fMRI参数。本研究比较TD型与ARD型PD患者静息态脑功能DC的差异。
1 资料与方法
1.1 一般资料 收集2019年6月—2021年12月于中南大学湘雅二医院就诊的90例首诊特发性PD患者,男49例、女41例,年龄41~78岁、平均(57.6±9.3)岁;其中51例TD型(TD组),39例ARD型(ARD组)。纳入标准:①符合2015国际运动障碍协会PD诊断标准,且未接受药物等治疗;②均为右利手;③Hoehn-Yahr分级(简称HY分级)≤3级;④无明显认知障碍;⑤无严重器质性、神经系统或精神疾病史。排除有慢性药物治疗史及酗酒史、MR检查禁忌证及图像质量较差者。同时招募56名年龄及性别与PD患者匹配的健康对照者(healthy control,HC) (HC组),男23名、女33名,年龄44~79岁、平均(56.5±8.0)岁。于MR检查前对PD患者行统一PD评定量表(unified PD rating scale,UPDRS)、HY分级、汉密尔顿抑郁(Hamilton depression,HAMD)量表和简易精神状态检查(mini-mental state examination,MMSE)量表评分。参照文献[4]方法,根据UPDRS评分第3部分(UPDRS-Ⅲ)中有关震颤(包含第20、21条目)的平均得分与UPDRS量表中有关强直(包含第22~27、第31条目)的平均得分的比例进行分型,将比例>1.0判断为TD型,<0.8为ARD型,0.8~1.0为混合型。检查前受试者均签署知情同意。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0T MR仪,嘱受试者仰卧,头先进,佩戴耳机,于其头部周围填塞泡沫垫,采集头部MRI;参数:三维加权T1磁化准备快速梯度回波(magnetization prepared rapid acquisition gradient echo,MPRAGE)序列,TR 1 900 ms,TE 2.01 ms,层厚1.0 mm,层间距0,FA 9°,FOV 256 mm×256 mm,扫描层数176;rs-fMRI,采用平面回波序列,TR 2 500 ms,TE 25 ms,层厚3.5 mm,层间距0,FA 90°,FOV 240 mm ×240 mm,扫描层数39,包括200个时间点。
1.3 图像分析 基于Matlab R2013b平台以REST plus工具包进行图像预处理[5]:①格式转换;②去除前10个时间点数据;③时间层校正;④头动校正以剔除头部运动>0.5 mm或旋转角度>0.5°图像;⑤基于MPRAGE序列图像配准,并行蒙特利尔神经学研究所(Montreal Neurological Institute,MNI)功能像模板空间标准化,之后行体素重采样,体素3 mm×3 mm×3 mm;⑥去线性漂移;⑦协变量回归,降低6个方向头动、脑白质及脑脊液信号的影响;⑧以0.01~0.08 Hz的滤波频段消除混杂信号。
计算每个体素与全脑其余体素时间进程之间的Pearson相关系数,获得全脑相关系数矩阵;将相关阈值设为0.25,以Fisherr-z变换对个体相关系数矩阵进行标准化处理,采用半高宽6 mm的高斯平滑核进行空间平滑。以年龄、性别和教育水平为协变量,采用单因素方差分析比较3组DC值差异,以事后两样本t检验观察两两组间DC值差异(设定体素水平P<0.001),并对结果行AlphaSim校正(校正后P<0.05,团块大小≥13个体素)。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示不符合者。采用单因素方差分析比较3组年龄、教育水平,以χ2检验比较性别差异;以Mann-WhitneyU检验分析TD与ARD组间病程、UPDRS、UPDRS-Ⅲ、HY分级及MMSE评分的差异。提取TD及ARD组存在差异脑区的DC值,采用控制年龄、性别及病程的偏相关分析观察其DC值与临床量表评分的相关性,以Bonferroni法进行校正。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料比较 TD组、ARD组及HC组之间,年龄、性别及受教育年限总体差异均无统计学意义(P均>0.05);ARD组UPDRS、UPDRS-Ⅲ及HAMD评分高于TD组(P均<0.05),病程、HY分级及MMSE评分差异均无统计学意义(P均>0.05)。见表1。

表1 90例PD患者与56名HC基本资料比较
2.2 DC值比较 单因素方差分析显示,3组间双侧小脑、左侧壳核、左侧前扣带回、右侧辅助运动区及左侧中央旁小叶DC值差异均有统计学意义(图1)。事后分析结果显示,与HC组比较,TD组及ARD组双侧小脑DC值升高,TD组左侧壳核及左侧中央旁小叶DC值降低,ARD组左侧前扣带回和右侧辅助运动区DC值降低;与ARD组比较,TD组左侧前扣带回及右侧辅助运动区DC值升高,双侧小脑DC值降低。见图2及表2。

表2 TD组、ARD组及HC组间两两比较DC值存在差异的脑区

图1 TD组、ARD组及HC组DC值存在差异的脑区(红色区域) 色带代表F值
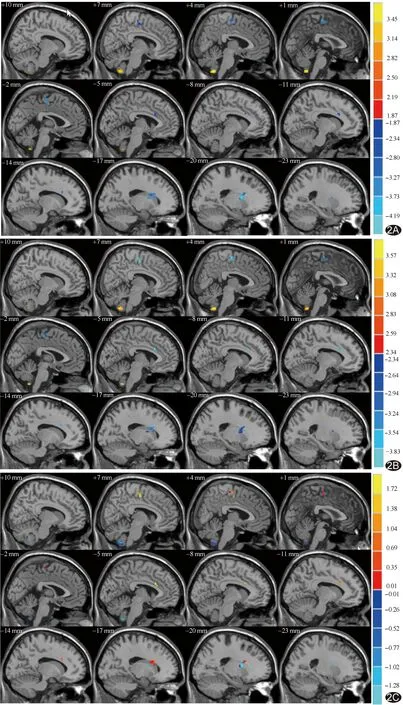
图2 TD组、ARD组及HC组间两两比较DC值存在差异的脑区 A.TD组与HC组比较;B.ARD组与HC组比较;C.TD组与ARD组比较 (色带代表t值,黄红色代表DC值升高,蓝色代表DC值降低)
2.3 相关性分析 TD组及ARD组存在统计学意义,差异脑区的DC值与临床量表评分之间均无明显相关,结果经Bonferroni法校正。
3 讨论
DC是反映节点(体素)在网络中重要性的rs-fMRI影像学标记物,可用于评估全脑任一节点与其他节点之间的功能连接强度,体现该节点在脑网络中的价值;DC值越高,则该体素在脑网络中越为重要[6]。本研究基于rs-fMRI发现TD型与ARD型PD患者左侧前扣带回、右侧辅助运动区及双侧小脑DC值差异均有统计学意义,提示两种运动表型PD患者多个脑区存在不同的内在连接模式。
小脑在解剖和功能上与大部分脑皮层和基底神经节相互关联,影响运动的规划和执行以及一系列高阶认知和情绪功能[7];皮质纹状体运动回路功能减退时,皮层-小脑运动回路过度激活将对基底神经节功能失调及运动行为正常化起到代偿作用。本研究结果显示,相比HC组,TD组及ARD组双侧小脑DC值均升高,提示两种运动表型PD患者的小脑均发挥代偿作用。初级运动皮层及小脑高度激活状态与疾病特征如强直相关,原因可能在于ARD型PD患者小脑功能更为活跃。本研究发现,相比TD组,ARD组小脑DC值更高,提示小脑代偿作用在ARD型PD患者更为明显。小脑结构和功能变化与PD患者步态异常、运动障碍及部分非运动症状有关,ARD型比TD型PD患者表现出更明显的强直和非运动症状,亦可与本研究上述结果互为佐证。
前扣带回在情绪调节、认知方面起着重要作用。本研究中,相比HC组及TD组,ARD组左侧前扣带回、右侧辅助运动区DC值均降低,表明ARD组患者参与情绪调节的关键节点受损,与既往研究[8-9]结果相符;而ARD组HAMD量表评分高于TD组,或可解释ARD型PD患者抑郁症发病率较高。此外,前扣带回是默认模式网络的关键节点,而默认模式网络的功能连接减少与认知能力下降密切相关[10]。本研究中两种运动表型PD患者前扣带回DC值差异虽存在统计学意义,但MMSE评分差异无统计学意义,可能与样本量较小、TD型及ARD型PD病程较短且无明显差异有关。辅助运动区在行为整合中的作用不可或缺,ARD型PD运动障碍/迟缓、异动等症状也可能与患者辅助运动区节点受损有关[11-13],辅助运动区整体同步性降低可能是ARD型PD患者运动能力下降的主要原因。同时,辅助运动区对计划和启动运动至关重要,该脑区活动增加与运动症状改善密切相关[14]。推测TD型PD因辅助运动区的代偿作用,使得该型PD较ADR型进展慢、预后好。
此外,本研究发现,相比HC组,TD组左侧壳核和左侧中央旁小叶DC值减低。壳核中含有丰富的多巴胺能神经元,其功能障碍与PD的关系已获证实[15]。中央旁小叶是躯体感觉区之一,负责对侧肢体的骨骼肌运动,包括对侧小腿和足部的运动和感觉,推测TD型PD患者某些非运动症状可能与中心旁小叶功能受损有关。本研究TD组、ARD组存在差异脑区的DC值与临床量表评分之间均无明显相关,推测与样本量较小且PD病程较短有关,有待扩大样本量进一步探讨。
综上,TD型与ARD型PD患者双侧小脑、左侧前扣带回及右侧辅助运动区DC存在差异,可能与不同运动表型PD具有临床异质性有关。但本组为单中心横断面观察,且样本量有限,未涉及不同运动表型PD患者脑DC动态变化,有待收集病例行纵向研究进一步观察。
