紫甘薯和胡萝卜加工前后抗氧化协同作用变化
2023-02-23李洪安彭小强刘思悦黄静怡李红艳
李洪安,彭小强,刘思悦,黄静怡,李红艳
南昌大学食品科学与技术国家重点实验室,南昌 330047
紫甘薯Ipomoesbatatas(L.) Lam不仅具有普通甘薯的成分,还富含花青素、酚类化合物、糖蛋白、类胡萝卜素等各种活性成分,具有显著的抗氧化、抗肿瘤、增强记忆、预防高血压、增强机体免疫力等功能等生理功效[1],花青素具有的酚羟基结构使其具有较好的抗氧化活性,能够有效地抑制ROS对机体的损伤[2],在抗突变、抗心血管疾病方面也有显著作用[3,4]。胡萝卜(Daucuscarotavar.sativaHoffm.)中含有丰富的类胡萝卜素,类胡萝卜素是一类植物中广泛存在的天然色素,能够参与光合作用,赋予植物颜色,具有多种生物活性,其中有些类胡萝卜素具有与维生素A1相同的环结构,在体内可转变为维生素A,是人体获取维生素A的一大途径。类胡萝卜素分子的异戊二烯结构是其抗氧化活性的结构基础,使其具有清除自由基、猝灭单线态氧、抑制低密度脂蛋白氧化等功效[5]。
研究表明[6],常见的抗氧化物质如VC、VE和β-胡萝卜素并非是为日常膳食提供抗氧化能力的主要活性成分,由此可知,膳食中所含其他植物化学物的复杂混合物可能具有更积极的抗氧化效果。Pan等[7]的研究表明:将不同植物来源的亲水性提取物与亲脂性提取物以不同的比例混合,某些组合提取物的组显示出比单个组更强的协同抗氧化作用,能够有效地清除机体内过量的自由基,提升抗氧化能力,对机体内炎症的抑制或慢性疾病的发生具有积极作用[8]。
我国对蔬菜的烹调方法主要有炒、炸、煮、蒸等,其中,炒、炸制方法的含油量普遍较高,而煮、蒸方法可以做到低油烹调,不同加工方式对膳食中所含植物化学物也存在一定影响。但目前采用不同加工方式处理果蔬,并按不同比例复配,评价其植物化学物及抗氧化活性的相关报道较少,相关研究都围绕不同加工前后果蔬内植物化学物活性的变化,未有对加工后果蔬提取物复配的报道。本实验对紫甘薯、胡萝卜采取不同热加工方式处理,测定加工前后紫甘薯、胡萝卜中的植物化学物含量以及提取物的体外抗氧化活性;以不同比例将提取物进行复配,评价其复配后的抗氧化作用;通过体外模拟消化,测定并分析其在不同消化阶段植物化学物含量及抗氧化活性的变化,为探寻科学的膳食配比提供方法和思路。
1 材料与方法
1.1 材料与试剂
材料:新鲜紫罗兰紫甘薯,重量为(100±10)g,产自江西;新鲜红森胡萝卜,重量为(100±10)g,产自江西,均购于南昌市江大南路天虹超市。
试剂:芦丁(生化试剂≥98%,批号:R106912)、1,1-二苯-2-苦基肼(DPPH,批号:D141336)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,批号:A109612)、Trolox(AR,批号:A103537)等,以上试剂均购于阿拉丁试剂有限公司;亚硝酸钠(AR,批号:20211109)、硝酸铝(AR,批号:20210819)、氢氧化钠(AR,批号:20210423)等(均为分析纯,国药集团化学试剂有限公司);盐酸(AR,批号:2108252)、无水乙醇(AR,批号:2204181)等,以上试剂均购于西陇科学股份有限公司。
1.2 实验方法
1.2.1 材料预处理
将新鲜成熟的紫甘薯和胡萝卜样品洗净,晾干,切成4 mm左右薄片。一部分置于-80 ℃冰箱预冻,冷冻干燥机冻干,将冷冻干燥处理后的样品置于-80 ℃环境超低温保存。另一部分用四种不同加工方法(蒸、煮、油炸、微波)烹调。
蒸制处理:将400 g左右紫甘薯、胡萝卜放在蒸箱内,紫甘薯蒸制7.5 min,胡萝卜蒸制10 min,取出后迅速冰浴冷却。
煮制处理:将400 g左右紫甘薯、胡萝卜加入沸水中,紫甘薯、胡萝卜皆煮制6.5 min。捞出后滤干水分,迅速冰浴冷却。
油炸处理:将400 g左右紫甘薯、胡萝卜放入炸锅内,炸锅内1 L葵花籽油温提前预热至150 ℃,紫甘薯炸制5 min,胡萝卜炸制6.5 min,迅速捞出,去除蔬菜表面附着的多余油脂后冰浴冷却。
微波处理:将400 g左右蔬菜置于托盘内,微波功率设置700 W,紫甘薯、胡萝卜皆处理7.5 min,取出后迅速冰浴冷却。
将经过处理的蔬菜样品置于-80 ℃冰箱预冻,冷冻干燥机冻干,粉碎,过60目筛,样品冻干粉置于-80 ℃环境超低温保存。
1.2.2 水溶性植物化学物的提取
称取紫甘薯和胡萝卜样品经蒸、煮、油炸、微波和未经处理的冻干粉各5 g置于500 mL烧杯中,加入250 mL 80%乙醇溶液,常温搅拌浸提3 h,4 200 r/min 离心5 min,分离上清液和残渣。残渣用250 mL 80%乙醇溶液,常温搅拌浸提2次,3 h/次。合并上清液,旋转浓缩(控制温度低于45 ℃),待有机溶剂挥发后,冻干提取液,避光保存所得冻干物。
1.2.3 脂溶性植物化学物的提取
称取紫甘薯和胡萝卜样品经蒸、煮、油炸、微波和未经处理的冻干粉各5 g置于500 mL烧杯中,加入250 mL乙醇-正己烷(4∶3,V∶V),常温搅拌浸提3 h,在4 200 r/min离心5 min,分离上清液和残渣,残渣中加入50 mL正己烷,常温水浴浸提3 h,重复两次。上清液合并后用250 mL蒸馏水和250 mL 10% NaCl溶液进行萃取清洗,合并上清液,氮吹至干,样品平行提取3次。所有过程均在避光操作下进行,防止类胡萝卜素氧化。
1.2.4 紫甘薯、胡萝卜中植物化学物含量测定
称取适量紫甘薯、胡萝卜水溶性冻干提取物配制10 mg/mL提取物乙醇溶液,过0.45 μm有机膜待测;称取适量没食子酸、芦丁标品,溶于乙醇,配制500 μg/mL没食子酸、芦丁标品储备液,梯度稀释至250、125、62.5、50、31.25、12.5 μg/mL待测。
1.2.4.1 总酚含量测定
采用福林酚法测定提取物中总酚含量[4]。向96孔板中加入25 μL紫甘薯、胡萝卜提取液或没食子酸标品,125 μL福林酚试剂,常温避光反应10 min,再加入125 μL饱和碳酸钠溶液,震荡摇匀,常温避光反应30 min,在765 nm波长下测定其吸光值。总酚含量以mg没食子酸/g干重(mg GAE/g DW)表示,所有样品均重复测定3次。
1.2.4.2 总黄酮含量测定
向96孔板中加入25 μL紫甘薯、胡萝卜提取液或芦丁标品,110 μL 0.066 mol/L NaNO2溶液,常温避光反应5 min,再加入15 μL 0.75 mol/L AlCl3溶液,常温避光反应6 min,最后加入100 μL 0.5 mol/L NaOH溶液,震荡摇匀,在510 nm波长下测定其吸光值。总黄酮含量以mg芦丁/g 干重(mg RT/g DW)表示,所有样品均重复测定3次。
1.2.4.3 总花青素含量测定
总花青素含量测定参照Denev等[9]的方法,稍作改动。取10 μL紫甘薯、胡萝卜提取液,分别与272 μL 4.9 mmol/L KCl缓冲液(pH 1.0)和24.8 mmol/L CH3COONa缓冲液(pH 4.5)混合后,震荡摇匀,常温避光平衡20 min。在510 nm和700 nm波长下测定其吸光值,总吸光值按下式计算:
A=(A510-A700)pH1.0-(A510-A700)pH4.5
(1)
式中:(A510-A700)pH1.0表示提取液与KCl缓冲液(pH 1.0)的混合溶液在510 nm与700 nm波长下吸光值之差,(A510-A700)pH4.5表示提取液与CH3COONa缓冲液(pH 4.5)的混合溶液在510 nm与700 nm波长下吸光值之差。
总花青素含量以mg矢车菊素-3-葡萄糖苷/g干重(mg C3G/g DW)表示,所有样品均重复测定3次。总花青素含量按下式计算:

(2)
式中:MW为矢车菊素-3-葡萄糖苷相对分子质量,449.2;DF为样品稀释倍数;ε为矢车菊素-3-葡萄糖苷消光系数,26 900。
1.2.4.4 总类胡萝卜素含量测定
采用透光法测定提取物中总类胡萝卜素含量,测定“1.2.3”提取后尚未旋蒸的脂溶性提取液体积,并在470 nm波长下测定其吸光值。总类胡萝卜素含量按下式计算:
总类胡萝卜素(g)=A×V×104/(A1%1 cm×P)
(3)

1.2.5 抗氧化活性测定
1.2.5.1 单一抗氧化活性测定
取紫甘薯、胡萝卜经蒸、煮、油炸、微波加工和无处理的提取物冻干粉,用乙醇溶解配置成10 mg/mL的溶液,过0.45 μm有机膜,冷藏备用,同时以水溶性维生素E(trolox)为阳性对照。
DPPH法测定抗氧化活性:向96孔板中加入20 μL紫甘薯、胡萝卜提取液和100 μL 0.026 mmol/L DPPH乙醇溶液,同时设置溶剂空白,常温避光反应30 min,震荡摇匀,在417 nm波长下测定其吸光值。DPPH自由基清除率按下式计算:
式中:A0为提取物溶剂与DPPH溶液的吸光值;Ai为提取物溶液与DPPH溶液的吸光值;Aj为提取物溶液与DPPH溶剂的吸光值。
ABTS法测定抗氧化活性:取88 μL 2.6 mmol/L K2S2O8溶液与5 mL 7.4 mmol/L ABTS储备液混匀,过夜避光静置12~16 h制成ABTS工作液。测定前,在734 nm波长下用乙醇将其稀释至吸光值为0.7±0.02。向96孔板中加入20 μL紫甘薯、胡萝卜提取液和200 μL 稀释后的ABTS工作液,同时设置溶剂空白,震荡摇匀,常温避光反应6 min,在734 nm波长下测定其吸光值。膳食提取物的DPPH自由基清除率按下式计算:
(5)
式中:A0为提取物溶剂与ABTS工作液的吸光值;Ai为提取物溶液与ABTS工作液的吸光值;Aj为提取物溶液与ABTS溶剂的吸光值。
最终结果以μmol水溶性维生素E/g鲜重(μmol TE/g FW)表示,所有样品均重复测定3次。
1.2.5.2 抗氧化相互作用评价
抗氧化测定方法同单一抗氧化能力测定,样品比例根据《中国居民膳食指南》对紫甘薯、胡萝卜的推荐摄入量进行配比,按鲜重质量进行复配。《中国居民膳食指南》对于深色蔬菜(紫甘薯、胡萝卜)的每日推荐摄入量为150~250 g,对于薯类(紫甘薯)每日推荐摄入量为50~100 g,深色蔬菜同时包含紫甘薯、胡萝卜,因此二者推荐摄入量大体相当,在1∶1上下分别设置五个比例,探究不同鲜重复配后对于抗氧化相互作用的影响,具体见表1。

表1 紫甘薯、胡萝卜抗氧化相互作用复配比例Table 1 Purple sweet potatoes and carrots antioxidant interaction compound ratio
抗氧化理论值和协同率参考Jiang[10]的方法,按如下公式计算:
抗氧化理论值=pA+(1-p)B
(6)

(7)
式中,A、B分别是紫甘薯、胡萝卜单独清除自由基的抗氧化值,对于2∶8(鲜重质量比)比例混合的果蔬,p=0.2,(1-p)=0.8。协同率大于0,即表示复配产生了抗氧化协同作用,协同率小于0,即为抗氧化拮抗作用。
同时将鲜重质量换算为对应质量中主要植物化学物含量比mg紫甘薯总酚含量∶mg胡萝卜总类胡萝卜素含量(mg GAE∶mg CAR),参考不同鲜重比例复配下,紫甘薯及胡萝卜中主要抗氧化成分的大致比例。
1.2.6 体外模拟消化实验
1.2.6.1 消化液配置
参照Minekus等[11]提出的标准化体外模拟消化方法,按表2比例添加试剂,并定容至500 mL,配制模拟唾液(simulated salivary fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intstinal fluid,SIF)。

表2 消化液配制成分及比例Table 2 Composition and ratio of digestive juice
1.2.6.2 体外模拟消化
体外模拟口腔消化:分别称取1 g紫甘薯、胡萝卜无处理、蒸、煮、油炸、微波处理冻干粉,加入8.5 mL SSF充分混匀,再加入1.25 mL 1 500 U/mL α-淀粉酶、25 μL 0.3 mol/L CaCl2和975 μL H2O,充分混匀后在37 ℃水浴震荡5 min。最后,加入100 μL PMSF终止口腔消化。
体外模拟胃消化:向10 mL上述口腔消化液中加入7.5 mL SGF充分混匀,加入1.6 mL 25000 U/ mL 胃蛋白酶、0.2 mL 1 mol/L HCl使其pH值至3,再加入5 μL mol/L CaCl2和695 μL H2O,充分混匀后在37 ℃水浴震荡2 h。最后,加入200 μL PMSF终止胃消化。
体外模拟肠消化:向20 mL上述胃消化液中加入11 mL SIF充分混匀,加入5 mL 800 U/ mL 猪胰酶、2.5 mL 160 mmol/L胆汁盐溶液、0.15 mL 1 mol/L NaOH使其pH值至7,再加入40 μL mol/L CaCl2和1.31 mL H2O,充分混匀后在37 ℃水浴震荡2 h。最后,加入200 μL PMSF终止肠消化。
1.3 数据分析

2 结果与讨论
2.1 不同加工处理后紫甘薯和胡萝卜中植物化学物含量
经过不同加工处理后,紫甘薯和胡萝卜中植物化学物含量如表3所示,紫甘薯中主要的植物化学物为酚类化合物,主要包括黄酮类化合物和花青素,类胡萝卜素含量很少。胡萝卜中主要富含类胡萝卜素,花青素含量很少。
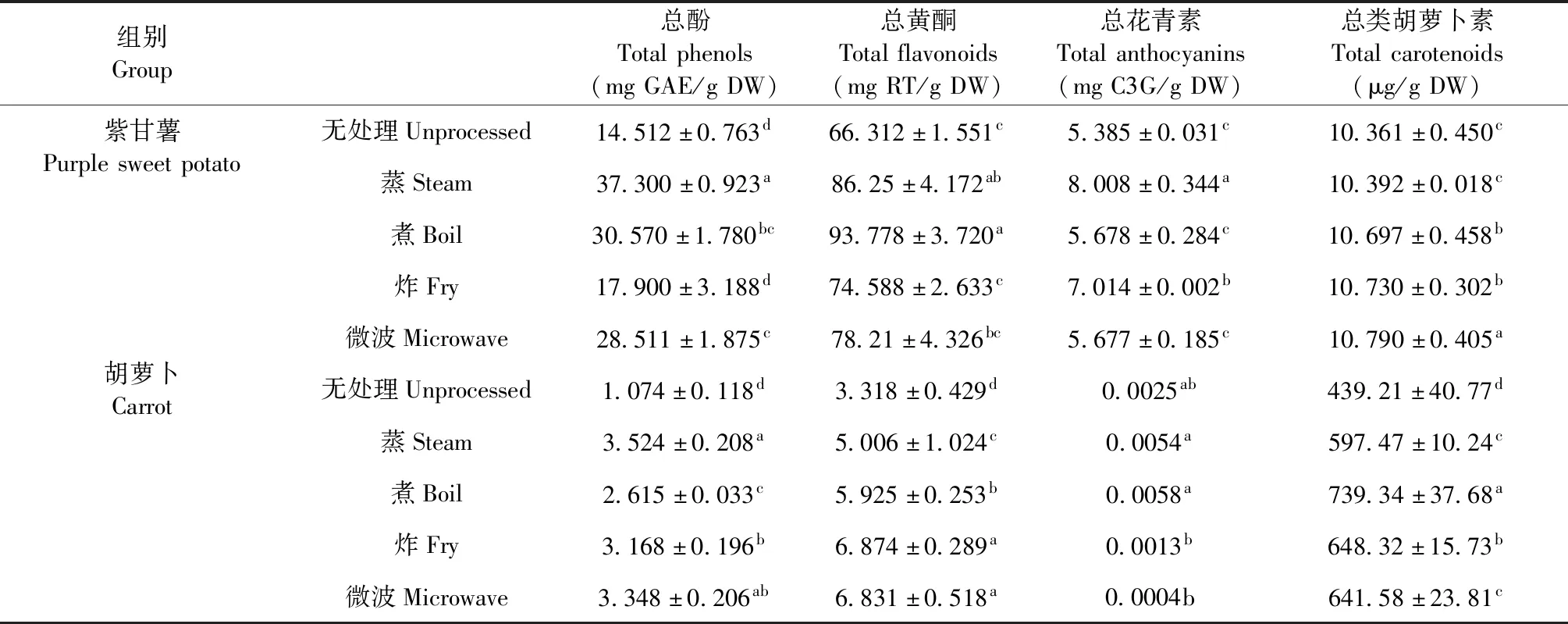
表3 不同加工方式处理后紫甘薯、胡萝卜中的植物化学物含量Table 3 The content of phytochemicals in purple potatoes and carrots after different processing
紫甘薯中的总酚、总黄酮、总花青素含量相对于无处理组(总酚:14.512±0.763 mg GAE/g DW;总黄酮:66.312±1.551 mg RT/g DW;总花青素:5.385±0.031 mg C3G/g DW),经过蒸(总酚:37.300±0.923 mg GAE/g DW ;总黄酮:86.25±4.172 mg RT/g DW;总花青素:8.008±0.344 mg C3G/g DW)、煮(总酚:30.570±1.780 mg GAE/g DW;总黄酮:93.778±3.720 mg RT/g DW;总花青素:5.678±0.284 mg C3G/g DW)处理后,均有明显提升(P<0.05)。胡萝卜中的总类胡萝卜素含量也有所提高(无处理:439.21±40.77 μg/g DW;蒸:597.47±10.24 μg/g DW;煮:739.34±37.68 μg/g DW;P<0.05)。紫甘薯中的植物化学物煮制处理后提升略低于蒸制处理(P<0.05),可能是由于部分植物化学物溶于水中流失导致的。在蒸煮的过程中,高温蒸汽将可溶性糖-酚酸化合物中的酯键破坏,从而释放其中的酚酸物质,提高总酚含量[12]。另外高温蒸汽还能够让紫甘薯的细胞结构溶胀破坏,使酚酸类物质更好地从紫甘薯结构中释放出来。胡萝卜中的类胡萝卜素与蛋白质的复合物在蒸制的高温作用下发生分解,使类胡萝卜素得以释放,同时,胡萝卜的组织细胞也因高温蒸汽的熏蒸而软化,提高总类胡萝卜素的提取率[13]。
在煮制过程中,虽然能够使紫甘薯细胞结构溶胀破坏,使酚类物质和花青素不断溶出,但随着煮制时间增长,溶出的植物化学物都溶解于水中,且高温煮制使得部分酚类物质和花青素发生降解,形成了一些新的酚类和黄酮类物质,最终导致酚类和花青素含量偏低,经过煮制,紫甘薯的总黄酮含量相对于无处理达到了最大峰值,推测可能是虽然煮制时黄酮类物质也不断被溶于水中,但高温使部分酚类物质降解形成部分黄酮类新物质,总体含量偏高可能是形成黄酮类新物质占主导作用的情况。有研究报道[14],相对于其他加热方式,煮制过程中由于蔬菜汁液损耗更多,导致总酚、总黄酮类物质更多地流失,而经过煮制处理的胡萝卜中总类胡萝卜素含量最大,由于类胡萝卜素是一类脂溶性植物化学物,几乎不溶于水[15],因此不会像酚类、黄酮、花青素一样溶于水中导致损失,且持续的煮制能够有效地破坏胡萝卜的质构与细胞结构,使一些结合态的类胡萝卜素游离出来,最终表现为总类胡萝卜素含量增大。
油炸处理后的总酚(17.900±3.188 mg GAE/g DW)、总花青素(7.014±0.002 mg C3G/g DW)含量均低于蒸制处理(总酚:37.300±0.923 mg GAE/g DW ;总花青素:8.008±0.344 mg C3G/g DW;P<0.05),其中油炸处理后总酚含量下降最为明显,而总黄酮含量虽然相对于蒸煮处理后有所降低,但相对于无处理仍有一定程度的升高,推测可能是由于油炸时温度过高,反应过程复杂,酚类黄酮类新物质的生成与旧物质的降解同时存在,从而导致总酚与总黄酮含量变化趋势不一致。经过油炸处理的总类胡萝卜素要明显低于煮制处理,可能是由于在油炸过程中类胡萝卜素不断溶于油中,导致了一定程度上脂溶性类胡萝卜素的损失。
经过微波处理后的紫甘薯相对于蒸煮处理,总酚(28.511±1.875 mg GAE/g DW)、总黄酮(78.21±4.326 mg RT/g DW)含量虽更低(P<0.05),但高于油炸后的总酚,总黄酮含量,而总花青素含量(5.677±0.185 mg C3G/g DW)与无处理的紫甘薯(5.385±0.031 mg C3G/g DW)相差不大(P>0.05),略微有所提升。微波辅助提取能够利用微波场的生物与热效应,及“扰动”效应来加速物质扩散溶解[16]。在微波的作用下,细胞破碎导致花青素溶出,达到微波辅助提取的效果。因此,虽然在此过程中花青素可能存在降解现象,但由于微波辅助提取能够将部分低聚花青素或结合态花青素变成花青素单体或游离态花青素,整体含量未发生大的改变。
2.2 不同加工处理后紫甘薯、胡萝卜的抗氧化活性
采用DPPH法和ABTS法分别测定不同加工处理后紫甘薯、胡萝卜提取物的体外抗氧化活性,结果如表4所示。DPPH法测定结果中,经过煮制处理的紫甘薯具有最强的抗氧化活性(1.179±0.023 μmol TE/g FW;P<0.05),未经处理的紫甘薯抗氧化活性最弱(1.103±0.093 μmol TE/g FW;P<0.05);与紫甘薯类似,煮制处理也使胡萝卜拥有最强的抗氧化活性(0.449±0.014 μmol TE/g FW;P<0.05),同样,无处理的胡萝卜拥有最弱的抗氧化活性(0.186±0.010 μmol TE/g FW;P<0.05)。在ABTS法测定结果中,除无处理的紫甘薯外,微波处理后的紫甘薯抗氧化活性最差(1.605±0.042 μmol TE/g FW;P<0.05),其次为油炸处理(1.617±0.022 μmol TE/g FW;P<0.05),而蒸煮处理的结果相近,都具有较好的抗氧化活性;而在胡萝卜中,无处理的抗氧化活性依旧最弱(0.259±0.038 μmol TE/g FW),蒸制处理后胡萝卜的抗氧化活性最强(0.653±0.092 μmol TE/g FW)。

表4 不同加工方式紫甘薯、胡萝卜抗氧化活性Table 4 Antioxidant activity of purple potatoes and carrots in different processing
该结果与经过不同加工处理对紫甘薯、胡萝卜中植物化学物的含量变化影响有关。未经处理时,紫甘薯中部分酚类物质通过共价键的作用,与细胞壁等植物基质结合,难以萃取[17],只有游离态多酚才能够表现出抗氧化活性,这类结合态多酚只有受到外界因素干扰,醚键、酯键等共价键断裂后,从结合部位释放出来,转化成游离态多酚,才能表现抗氧化活性[18]。与其类似,胡萝卜中的类胡萝卜素也多与蛋白质等结合于组织中,未经处理难以释放。而热加工不仅能够破坏细胞结构,促进植物化学物的溶出,还能够有效地使这些活性成分从组织中释放出来,使其从结合态转化为游离态,从而表现出更好的抗氧化活性。蒸、煮处理相对于油炸、微波处理,温度更低,酚类、类胡萝卜素等植物化学物因高温所致的降解作用更小,因此蒸、煮处理后,抗氧化活性有了一定程度的上升,而油炸、微波处理的降解损耗更大。总体来说,油炸、微波处理组抗氧化活性增长要低于蒸、煮处理,当降解反应占主导地位时,甚至可能低于未经处理的样品。
2.3 植物化学物含量与抗氧化活性相关性分析
为明确经不同加工处理后紫甘薯、胡萝卜中各种植物化学物含量与其抗氧化活性间的关系,对植物化学物含量与其抗氧化活性(DPPH、ABTS)作相关性分析,具体见表5与表6。由表5可知,总酚、总黄酮与DPPH、ABTS均表现出显著正相关(R2>0.747,P<0.01),而总花青素含量与DPPH、ABTS的相关性稍差,分别为R2=0.516,R2=0.536,但也表现出一定的正相关性(P<0.05)。在表6中,总酚、总类胡萝卜素与DPPH、ABTS均表现出较好的正相关性(R2>0.747,P<0.01),而总黄酮含量与DPPH、ABTS的相关性差,分别为R2=0.490,R2=0.320,其原因可能是不同加工处理后的胡萝卜中相对于紫甘薯来说,总黄酮含量过少,胡萝卜提取物表现出的抗氧化活性并不依赖于其中的黄酮类物质,类胡萝卜素是其抗氧化活性的主要来源。

表5 紫甘薯中植物化学物含量与抗氧化活性相关性分析Table 5 Correlation analysis of phytochemical content and antioxidant activity in purple potatoes

表6 胡萝卜中植物化学物含量与抗氧化活性相关性分析Table 6 Correlation analysis of phytochemical content and antioxidant activity in carrots
2.4 不同加工处理后紫甘薯、胡萝卜提取物体外抗氧化相互作用
由表7、8可知,按不同鲜重比例将加工处理后紫甘薯、胡萝卜提取物进行复配后,大部分呈现出明显的抗氧化协同作用,只有少部分组别存在抗氧化拮抗作用。在DPPH组内,当经过煮制加工处理的紫甘薯与胡萝卜按2∶8的鲜重比例进行复配时,其协同率达到最大(50.76%),抗氧化活性为(0.897±0.267 μmol TE/g FW),而煮制加工处理的紫甘薯与胡萝卜按8∶2的鲜重比例进行复配时,其整体表现出的抗氧化活性最强(1.155±0.055 μmol TE/g FW),但其抗氧化协同率却只有11.86%。由此可见,复配提取物的抗氧化活性强,不代表其能够表现出较高的抗氧化协同率,抗氧化协同率与抗氧化活性并无线性关系。煮制8∶2组能够表现出最强的抗氧化活性,主要因为在该组别中,紫甘薯提取物所占比例远大于胡萝卜提取物。单独测定紫甘薯、胡萝卜提取物抗氧化活性,紫甘薯提取物的抗氧化活性比胡萝卜抗氧化活性更强,煮制2∶8组抗氧化活性虽然弱于煮制8∶2组,但其表现出的抗氧化协同率更高,说明在胡萝卜所占鲜重比例更大时,提取物共同作用所表现的抗氧化活性比单独使用时效果更好,紫甘薯与胡萝卜的鲜重复配比例合适时,能使原有的提取物发挥更强的抗氧化能力。紫甘薯、胡萝卜提取物复配比例不同时,其抗氧化协同率也不同,这可能与紫甘薯、胡萝卜提取混合物中的植物化学物含量不同有关。Young等[19]的研究表明,混合物的抗氧化相互作用受混合物中某些成分浓度的影响,浓度的增加或减少都会影响最终的抗氧化相互作用。

表7 DPPH模型中紫甘薯、胡萝卜组合的理论值和实验值Table 7 Theoretical and experimental values of the combination of purple sweet potatoes and carrots in the DPPH model
在ABTS组内,抗氧化协同率最高的是微波5∶5组(39.52%),其次为微波4∶6组(38.41%),这与DPPH组结果略有不同,但纵观全部复配组合可发现,当复配比例在4∶6左右时,各复配比例组合中大多协同率达到峰值,借此可判断,当胡萝卜占比略大于紫甘薯时,其抗氧化协同率往往更高。而ABTS组与DPPH组所表现出的最佳协同率复配比不同的原因可能在于DPPH和ABTS法测定抗氧化活性的机理不同:DPPH法主要依靠单电子/氢转移反应,或二者同时反应从而达到清除自由基的目的,其主要影响因素为空间位阻效应;ABTS法主要依靠氢转移反应机制清除自由基,且对反应物氧化还原电势有要求,低于0.68 V时ABTS自由基才能被还原,从而使颜色渐弱,发生吸光度的改变[20]。
虽然当胡萝卜质量大于紫甘薯质量时,表现出较强的抗氧化协同效应,但将鲜重质量换算为对应质量中植物化学物含量比(紫甘薯总酚含量∶胡萝卜总类胡萝卜素含量)可发现,各比例水溶性植物化学物含量都大于脂溶性植物化学物含量。当总酚含量与总类胡萝卜素含量比值过大时,抗氧化协同效果反而降低,可能由于当脂溶性植物化学物含量过少时,抗氧化协同增效作用在总体的抗氧化效果中占比太低,并不明显,整体表现的抗氧化效果主要由水溶性植物化学物提供。文献也表明,当水溶性植物化学物与脂溶性植物化学物按不同比例进行复配时,水溶性植物化学物占比更高时,其表现的抗氧化协同效应更强[21]。
经过煮制与微波加工后的复配组合表现的协同率相比于其他加工方式更高。煮制处理后的植物化学物含量与蒸制处理的含量相当,而微波处理后的植物化学物含量要低于蒸制后含量,但蒸制复配组合所表现出的抗氧化协同效应却不如煮制与微波处理,借此推测,抗氧化协同拮抗作用与植物化学物含量并无明显线性关系。在煮制过程中,由于水的持续浸润,以及沸腾过程中水对紫甘薯、胡萝卜的不断搅动,使紫甘薯、胡萝卜的细胞结构充分溶胀破坏,其中的各类抗氧化活性成分释放更为充分,因而在复配中能够产生更高的抗氧化协同作用,而微波处理由于其特有的原理,细胞结构中结合探讨状态的植物化学物得以更好释放,提高紫甘薯、胡萝卜的复配效果。

表8 ABTS模型中紫甘薯、胡萝卜组合的理论值和实验值Table 8 Theoretical and experimental values of the combination of purple potatoes and carrots in the ABTS model

续表8(Continued Tab.8)
2.5 体外模拟消化后不同加工处理组紫甘薯和胡萝卜中植物化学物含量变化
通过对比经不同加工处理后,紫甘薯和胡萝卜口腔消化液、胃消化液、肠消化液中活性成分,发现蒸制处理的紫甘薯在消化的各阶段,总酚(口消化:7.250±0.470 mg GAE/g DW;胃消化:36.517±1.181 mg GAE/g DW;肠消化:46.787±2.960 mg GAE/g DW)、总黄酮(口消化:17.660±1.760 mg RT/g DW;胃消化:93.753±3.224 mg RT/g DW;肠消化:99.487±2.429 mg RT/g DW)、总花青素(口消化:6.866±0.526 mg C3G/g DW;胃消化:5.373±0.234 mg C3G/g DW;肠消化:2.022±0.138 mg C3G/g DW)的含量都最高(见图1,P<0.05),与消化前所表现的测定结果一致。紫甘薯各种处理方式在消化各阶段,植物化学物含量变化趋势都一致,表现为口腔消化液中植物化学物含量较低,胃消化液中植物化学物含量迅速提升,而肠消化液中植物化学物含量升高趋势明显放缓。口腔消化阶段,由于作用时间过短,大量活性物质未从组织间溶出,因此总酚、总黄酮、总花青素含量偏低。进入胃消化阶段后,胃蛋白酶开始作用,催化蛋白质进行水解,与蛋白质固定的结合酚被释放,转化成游离酚。且胃蛋白酶能将酚酸与细胞壁间的酯键减弱,使酚酸被释放。因此花青素、黄酮与酚类物质含量在胃消化阶段迅速提升[22]。进入肠消化阶段,肠道内的化学环境呈弱碱性,酚类物质在酸性条件下较为稳定,但处于碱性环境中时,受限于自身结构特点,易发生降解或聚合反应,致使其含量降低,但在持续的肠道消化过程中,依旧有部分结合酚不断被释放,当释放的酚类物质大于降解聚合的酚类物质时,最终表现为肠消化阶段总酚含量缓慢上升。而在碱性条件下,花青素相对于其它酚类物质更加不稳定,易降解成为查尔酮或者其余小分子酚类物质[23],致使其含量降低。

图1 体外模拟消化各阶段加工紫甘薯、胡萝卜中植物化学物含量变化Fig.1 Changes of phytochemicals contents in processed purple potatoes and carrots in different stages of simulated digestion in vitro不同小写字母表示不同加工处理前后紫甘薯、胡萝卜提取物植物化学物含量在0.05水平上的存在显著性差异(P<0.05)。Different lowercase letters indicate significant differences in the phytochemical content of purple sweet potatoes and carrots extracts before and after different processing treatments at the 0.05 level (P<0.05).
不同加工处理后胡萝卜中的类胡萝卜素在各阶段中的释放规律与紫甘薯中各类水溶性植物化学物的释放规律有所差别。在口腔消化阶段,由于消化环境呈现中性,较为温和,且消化时间较短,因此类胡萝卜素释放有限,含量较低。进入胃消化阶段,胃消化液呈现的酸性条件能够有效破坏胡萝卜细胞壁,使类胡萝卜素从中释放,但由于类胡萝卜素在酸性条件下易分解,致使部分类胡萝卜素总体含量提升较缓。进入肠消化阶段后,肠消化液中的胰酶在与胡萝卜细胞壁接触后能使其上的孔径进一步扩大,促使类胡萝卜素进一步释放[24],且类胡萝卜在碱性肠消化液中不易分解,使总类胡萝卜素含量在肠消化阶段达到最大。
2.6 体外模拟消化后不同加工处理组紫甘薯和胡萝卜的抗氧化活性变化
通过测定不同加工处理后紫甘薯、胡萝卜口腔消化液、胃消化液、肠消化液对DPPH自由基和ABTS自由基的清除能力(见图2),发现经蒸(口消化:2.070±0.373 μmol TE/g FW;胃消化:7.022±0.525 μmol TE/g FW;肠消化:6.549±0.590 μmol TE/g FW)、煮(口消化:2.799±0.312 μmol TE/g FW;胃消化:7.120±0.473 μmol TE/g FW;肠消化:6.810±0.516 μmol TE/g FW)处理后的紫甘薯胃消化液对于DPPH自由基的清除效果最佳(P<0.05),经蒸制处理的紫甘薯胃消化液对ABTS自由基的清除效果最好(9.317±0.327 μmol TE/g FW;P<0.05)。紫甘薯各组别都呈现出胃及肠消化液的DPPH、ABTS自由基清除能力强于口腔消化液(P<0.05),胡萝卜各组在消化过程中消化液的抗氧化活性呈逐步上升的趋势(P<0.05)。

图2 体外模拟消化各阶段加工紫甘薯、胡萝卜中抗氧化活性变化Fig.2 Changes of antioxidant activity in processed purple potatoes and carrots in different stages of in vitro simulated digestion注:不同小写字母表示不同加工处理前后紫甘薯、胡萝卜提取物抗氧化活性在0.05水平上的存在显著性差异(P<0.05)。Note:Different lowercase letters indicate significant differences in antioxidant activity of purple sweet potatoes and carrots extracts before and after different processing treatments at the 0.05 level (P<0.05).
有研究表明,样品中的酚类物质含量与清除DPPH自由基的能力呈现正相关,虽然消化过程中蛋白质降解形成的肽可能会与酚类物质反应,但仍具有很强的自由基清除能力[25]。各组胃消化液中酚类化合物含量高,因此胃消化液具有较强的自由基清除能力。模拟口腔消化液与胃消化液呈现弱酸性与酸性,酸性条件下,反应体系中的氢离子浓度高,体系中高浓度的氢离子更易与DPPH自由基孤对电子进行配对,进而使DPPH自由基更容易被清除[26],由于在碱性条件下,多酚类物质易被氧化成为醌类物质,使得整体的DPPH,ABTS自由基清除效果大大降低[27],酸性条件下多酚类物质更稳定,能够表现出更好的抗氧化效果,因此胃消化液的DPPH、ABTS自由基清除能力强于肠消化液。
胡萝卜中主要的抗氧化活性物质为类胡萝卜素,其各阶段消化液的抗氧化能力与各阶段消化液中的总类胡萝卜含量呈正相关。在胡萝卜消化过程中,总类胡萝卜素在口腔阶段释放最少,胃阶段与肠阶段不断增加,且肠阶段释放量大于胃阶段释放量,与各阶段消化液呈现出的DPPH、ABTS自由基清除能力具有相同的趋势。
3 结论
采用蒸、煮、炸、微波四种加工方式对紫甘薯、胡萝卜进行处理,并测定处理前后样品总酚、总黄酮、总花青素、总类胡萝卜素含量变化。结果表明,蒸、煮加工能有效地将紫甘薯、胡萝卜中结合状态的植物化学物转化为游离状态,供人体吸收利用,且蒸、煮加工所导致的植物化学物降解程度相对于油炸与微波较低。同时,采用DPPH和ABTS法测定蒸、煮、炸、微波与无处理的紫甘薯、胡萝卜抗氧化活性,发现蒸、煮加工处理后的紫甘薯、胡萝卜相对于其他加工方式具有更好的抗氧化活性。相关性分析也显示,总酚、总花青素、总类胡萝卜素与DPPH、ABTS均表现出较好的正相关性,表明植物化学物含量与其表现的抗氧化活性呈现较好的正相关性。
将相同处理方式的紫甘薯、胡萝卜按不同鲜重比例进行复配,复配组合表现出了显著的抗氧化协同作用。在DPPH组内,煮制加工的紫甘薯与胡萝卜按2∶8的比例进行复配时,其协同率达到最大(50.76%);在ABTS组内,抗氧化协同率最高的是微波5∶5组(39.52%),其次为微波4∶6组(38.41%),而蒸制8∶2组抗氧化协同率最低(0.03%)。整体而言,当紫甘薯:胡萝卜在鲜重比例2∶8至4∶6的配比范围左右,即胡萝卜所占质量更大时,其抗氧化协同效果最佳,将鲜重质量比例换算为水溶性、脂溶性植物化学物含量进行配比,则当水溶性植物化学物比例更高时,整体能够表现出明显的抗氧化协同作用。
对蒸、煮、炸、微波与无处理的紫甘薯、胡萝卜进行了体外模拟消化实验,并测定了其在不同阶段总酚、总黄酮、总花青素、总类胡萝卜素含量变化及抗氧化能力变化。各加工方式紫甘薯的总酚、总黄酮含量在胃消化阶段增长趋势最明显,在肠消化阶段增势明显放缓,总花青素含量在消化过程中持续下降,DPPH、ABTS自由基清除能力表现为胃消化阶段>肠消化阶段>口腔消化阶段。各加工方式胡萝卜的总类胡萝卜素含量在消化过程中持续上升,且肠消化阶段增长趋势大于胃消化阶段,其DPPH、ABTS自由基清除能力与总类胡萝卜素含量变化保持一致,表现为肠消化阶段>胃消化阶段>口消化阶段。
