基于Hippo信号通路的野黄芩苷抗结直肠癌HCT116细胞的研究
2023-02-23刘茂伦明天琪徐海波
杨 寒,任 珊,刘茂伦,赵 晖,陶 秋,唐 顺,明天琪,徐海波
成都中医药大学药学院药理系 西南特色中药资源国家重点实验室,成都 611137
结直肠癌(colorectal cancer,CRC)是一种常见的恶性消化道肿瘤。最新癌症统计数据显示,受老龄化、饮食习惯改变、肥胖、吸烟等因素的影响,CRC的患病率和死亡率在全球迅速上升,已分别高居第三和第二位,其中发达国家的CRC发病率比发展中国家高约4倍[1,2]。尽管近年来CRC在诊断技术和治疗方法上已取得较大突破,但其五年生存率仍不足10%。化疗是抗肿瘤治疗的基石。5-氟尿嘧啶、奥沙利铂、伊立替康等作为CRC治疗的常用药物,其在临床上的应用常因黏膜炎、骨髓功能抑制、脱水等毒副作用而受到限制[3]。因此,探索CRC的发病机制,寻求毒副作用低、靶向性强的治疗药物依然是目前CRC研究的重点。
实践证明,中药在抗肿瘤治疗中具有多方面的优势,不仅能增强化疗药的疗效、降低不良反应、逆转耐药性,还能改善预后、提高患者的生活质量,而且中药中含有多种活性成分,研究表明,很多活性成分可通过影响细胞的迁移、侵袭以及凋亡等方式来发挥抗肿瘤作用[4,5]。因此,中药及其活性成分对于肿瘤的治疗具有良好的开发前景。野黄芩苷(scutellarin,SCU),一种黄酮类化合物,主要来源于中药半枝莲、灯盏花以及黄芩,具有抗炎、抗氧化、抗纤维化、神经保护和心脑血管保护等多种药理作用[6]。近年的研究发现,SCU还具有广泛的抗肿瘤活性,能抑制结直肠癌、肝癌、肺癌、食管鳞状细胞癌等多种恶性肿瘤的发生及发展,是一种潜在的抗肿瘤药物[7]。
Hippo信号通路是过去十年中在肿瘤研究领域广受关注的一条信号通路。研究证实,Hippo信号通路的异常阻滞与肿瘤细胞的生存、增殖、侵袭以及耐药性的产生等密切相关[8]。当Hippo信号通路被抑制时,通路的主要效应因子Yes相关蛋白(Yes-associated protein,YAP)/具有PDZ结合基序的转录激活因子(Transcriptional co-activator with PDZ-binding motif,TAZ)核转位聚集到细胞核中,与TEA转录因子1~4结合,促进下游靶基因如细胞周期调节因子cyclin E1、原癌基因c-Myc等转录[9]。Hippo信号通路在维持正常肠道内稳态以及受损组织的修复和再生中起重要作用,YAP/TAZ高活性常作为CRC预后不良的独立预测因子,与肿瘤的分期、淋巴结状态和转移等呈正相关[10]。此外,YAP/TAZ的异常激活与Hippo信号通路上游调控因子的缺失有关,哺乳动物STE20样蛋白激酶1/2(Mammalian sterile 20-like kinase 1/2,MST1/2)或大肿瘤抑制因子1/2(Large tumor suppressor 1,LATS1/2)缺失可导致YAP/TAZ不同程度的激活[11]。
迄今为止,SCU抗CRC的作用已被获得多方面证实。有研究表明,SCU可通过多种信号通路发挥作用,包括Hedgehog[12]、Wnt/β-catenin[13]等。但目前还未见SCU通过调控Hippo信号通路发挥抗CRC作用的研究报道,因此本研究主要以结直肠癌HCT116细胞为体外模型,研究SCU对结直肠肿瘤细胞增殖、迁移以及凋亡的影响,初步探索其作用机制,为CRC治疗药物的开发提供参考和实验依据。
1 材料与方法
1.1 细胞株
结直肠癌细胞株HCT116购自中国科学院上海细胞库。
1.2 药物与试剂
野黄芩苷(成都曼思特生物技术有限公司,批号:MUST-20100910,纯度:98.13%);5-氟尿嘧啶(Merck life Science,批号:WXBC6532V,纯度:≥99%);McCoy’s 5A培养基(以色列Biological Industries,批号:01-075-1ACS 500mL);胎牛血清(南美)(依科赛生物科技有限公司,批号:20210928);青链霉素混合液(双抗)(武汉赛维尔生物技术有限公司,批号:CR2111084);MTT细胞增殖及细胞毒性检测试剂盒(上海碧云天生物技术有限公司,批号:C0009-2);RIPA裂解液(强)(武汉赛维尔生物技术有限公司,批号:CR2107181);结晶紫染液(北京索莱宝科技有限公司,批号:20210922);BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,批号:122120210430);抗荧光淬灭封片液(含Hoechst 33342/PI)(上海碧云天生物技术公司,批号:121818191028);Annecin V-FITC细胞凋亡试剂盒(MultiSciences,货号:A11015);LATS1(武汉三鹰生物技术有限公司,批号:00077426);MST1(Affinity Biosciences,批号:#10j6740);TAZ(Affinity Biosciences,批号:#89c2601);YAP1(武汉三鹰生物技术有限公司,批号:10010504);p-YAP(Ser127) (Affinity Biosciences,批号:#36z2539);c-Myc(Affinity Biosciences,批号:#49x79651);Bax(武汉三鹰生物技术有限公司,批号:00102164);Bcl-2(武汉三鹰生物技术有限公司,批号:10016705);Anti-GAPDH(武汉赛维尔生物技术有限公司,批号:AC2111015A);HRP标记山羊抗兔IgG二抗(杭州联科生物技术有限公司,批号:A00251);HRP标记山羊抗鼠IgG二抗(武汉三鹰生物科技有限公司,批号:10010504);SDS-PAGE凝胶制备试剂盒(武汉赛维尔生物科技有限公司,批号:HJ202301);牛血清白蛋白(BSA)(武汉赛维尔生物科技有限公司,批号:CR2108100);BeyoRTTMⅢ cDNA第一链合成试剂盒(上海碧云天生物技术公司,批号:06162122010);2×Universal Blue SYER Green qPCR Master Mix(武汉赛维尔生物科技有限公司,批号:MPC2112039)。
1.3 主要仪器
3001多功能酶标仪(美国Thermo公司);SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司);DMI30008倒置显微镜(德国Leica公司);CytoFLEX流式细胞仪(Beckman coulter);QUOTQTION电泳仪、化学发光凝胶成像系统(美国Bio-Rad公司);Forma3111CO2培养箱(美国Thermo公司);Allegra X®-12series离心机(美国BECK MAN Coulter);CYT5MFV微孔板成像系统(美国Bio Tek公司);CFX Connect实时荧光定量PCR仪(美国Bio-Rad公司)。
1.4 方法
1.4.1 细胞培养
结直肠癌细胞株HCT116购自中国科学院上海细胞库,培养于37 ℃、5%CO2的恒温培养箱中,培养液为含10%胎牛血清和1%青霉素-链霉素的McCoy′s 5A完全培养基。根据细胞的生长状态,2~3 d更换新鲜培养基1次,待细胞生长面积达到80%~90%时,按1∶3的比例进行传代培养。
1.4.2 SCU母液配制
SCU溶于DMSO配制成浓度为50 mg/mL的母液,分装保存于-80 ℃冰箱中,临用前用McCoy′s 5A完全培养基稀释成不同浓度。
1.4.3 SCU对细胞形态的影响
收集处于对数生长期的HCT116细胞,调整细胞密度至1×106个/mL,以500 μL/孔的体积接种在24孔板中,培养过夜,吸去培养液,空白对照组(control,Con)加入含0.28%DMSO的培养基、给药组分别加入等体积的含35、70、140 μg/mL SCU和5-氟尿嘧啶(5-fuorouracil,5-Fu)(40 μmol/L)的培养基,在37 ℃、5%O2的环境中继续培养24 h后,使用倒置荧光显微镜下于明场模式下观察各组细胞的形态,并拍照记录。
1.4.4 MTT法检测SCU对细胞存活率的影响
收集处于对数生长期的HCT116细胞,以1×104个/孔的密度接种至96孔板中,培养过夜,每孔加入100 μL不同浓度的SCU(0、20、40、80、120、160、200、240、280、300 μg/mL)处理24 h,吸去培养液,每孔加入100 μL MTT(0.5 mg/mL),37 ℃避光孵育4 h,吸除上清液,每孔加入150 μL二甲基亚(dimethyl sulfoxide,DMSO),摇床上避光反应10 min,用多功能酶标仪测定波长490 nm处的吸光度(A),参照下面公式计算细胞存活率,并求出SCU给药24 h的半数抑制浓度(50% concentration of inhibition,IC50),根据IC50值设置后续试验的给药浓度,实验重复6次。
细胞存活率=[(A给药-A空白)/(A对照-A空白)] × 100%
1.4.5 平板克隆形成实验
收集处于对数生长期的HCT116细胞,按照1×103个/孔的密度接种在6孔板中,细胞贴壁生长3 d后,按“1.4.3”项下分组并分别加入2 mL含0.28%DMSO和不同浓度药物的培养基,继续在37 ℃、5%CO2的环境中培养7 d,期间更换培养基3次。结束后,吸除培养基,PBS洗涤2次,用4%多聚甲醛固定细胞20 min,PBS清洗2次,用0.5%的结晶紫染液染色30 min,染色结束后用PBS清洗至背景干净,自然风干,拍照。
1.4.6 细胞划痕实验
收集处于对数生长期的HCT116细胞,以5×104个/mL的密度、500 μL/孔的体积接种至24孔板中,每组设4个复孔,培养过夜,用200 μL移液器枪头的尖端垂直于细胞培养板底部划出十字形的划痕,PBS清洗后按“1.4.3”项下分组并分别加入500 μL含0.28%DMSO和不同浓度药物的无血清培养基,并分别于0、24、48 h时置于荧光倒置显微镜下成像,记录细胞划痕的愈合情况,使用Image J软件测定划痕面积,以0 h划痕面积为基准,计算各组细胞24 h和48 h的划痕愈合率。
收集处于对数生长期的HCT116细胞,以1×106个/mL的密度,1 mL/孔的体积接种于6孔板中,培养过夜,按“1.4.3”项下分组并分别加入2 mL含0.28%DMSO和不同浓度药物的培养基,于37 ℃、5%CO2的环境中培养24 h。结束后,吸除培养基,PBS清洗,每孔加100 μL含Hoechst 33342/PI的抗荧光淬灭封片液,于微孔板成像系统中观察并拍照记录各组细胞的凋亡情况。
1.4.8 流式细胞术检测SCU对HCT116细胞凋亡率的影响
采用Annexin V-FITC凋亡试剂盒测定SCU对HCT116细胞凋亡的影响。收集处于对数生长期的HCT116细胞,将细胞浓度调整至2×106个/mL,以1 mL/孔的体积接种在6孔板中,每组3个复孔,待细胞贴壁后,吸除培养液,按“1.4.3”项下分组并分别加入2 mL含0.28%DMSO和不同浓度药物的培养基,于孵箱中继续培养24 h。收集细胞,并用预冷的PBS洗涤2次,300 g离心5 min,弃上清;从样品管中分出小部分细胞,设置1管空白管和2管单染管;再用预冷PBS清洗细胞1次,离心后弃上清,加入500 μL预冷的1×Binding Buffer工作液重悬细胞;每管样本管加入5 μL Annexin V-FITC和10 μL PI染色液,2管单染管中分别加入5 μL Annexin V-FITC或10 μL PI,轻轻涡旋后混匀,室温避光孵育5 min;打开流式细胞仪,用空白管调节FSC、SSC、FITC和PI通道的电压,在此电压条件下,用单染管调节FITC和PI之间的补偿,然后上机样本。
1.4.9 qRT-PCR检测SCU对HCT116细胞凋亡及通路相关mRNA表达的影响
收集处于对数生长期的HCT116细胞,以1×106个/mL的密度、1 mL/孔的体积接种到6孔板中,培养过夜,按“1.4.3”项下分组并分别加入2 mL含0.28%DMSO和不同浓度药物的培养基,于孵箱中继续培养24 h,提取各组细胞总RNA,测定RNA浓度,并按照逆转录和扩增试剂盒说明书,将RNA逆转录为cDNA后进行扩增,PCR反应程序为95 ℃预变性30 s,95 ℃变性15 s、60 ℃退火30 s、72 ℃延伸30 s,共进行40个循环。每组4个复孔,以β-actin为内参采用2-ΔΔCt方法计算各mRNA的相对表达量,所得数据进行归一化处理。基于National Center for Biotechnolgy Information(NCBI)数据库的基因词典,查阅相关基因信息,寻找合适的外显子基因序列,采用Blast检测引物的特异性。引物合成来自上海生工生物工程股份有限公司和北京擎科生物技术有限公司,引物序列见表1。

表1 实时荧光定量PCR引物序列Table 1 Real-time quantitative PCR primer sequences
1.4.10 Western blot检测SCU对HCT116细胞凋亡及通路相关蛋白表达的影响
收集处于对数生长期的HCT116细胞,以1×106个/mL的密度、1 mL /孔的体积接种至6孔板中,培养过夜,按“1.4.3”项下分组并分别加入2 mL含0.28%DMSO和不同浓度药物的培养基继续培养24 h,提取各组细胞蛋白,BCA法测定蛋白浓度,通过SDS-PAGE凝胶电泳分离蛋白样本,然后依次进行湿法转膜、封闭、一抗孵育、二抗孵育。结束后,化学发光成像系统显影,以GAPDH为内参,采用Image Lab 3.0软件对蛋白条带进行定量分析。
被国人称之为“东方犹太人”的温州商人,以白手起家、艰苦奋斗的创业精神;不等不靠、依靠自己的自主精神;闯荡天下、四海为家的开拓精神,开创出了自己的一片天地。坐在我们面前的浙江劲豹机械有限公司掌门人方新通,正是这样一位具有创业精神、自主精神和开拓精神的温州商人——他外表斯文儒雅,骨子里却有着温州人敢想敢拼的精神。从1995年的下岗职工到如今的企业掌门人,从企业开创时的步履维艰到如今在国内丝网印刷设备制造领域的领先地位,方新通向我们讲述了其自己的草根进化史,以及劲豹的发展变革史。在他娓娓道来的讲述中,我们深切地感受到了温州企业的魅力之所在。
1.4.11 统计学分析

2 结果
2.1 SCU对HCT116细胞形态的影响
如图1所示,使用倒置荧光显微镜于明场模式下观察SCU处理对HCT116细胞形态的影响,结果表明,空白对照组中的HCT116细胞形态清晰可见,贴壁生长良好,胞体饱满。给予SCU和阳性药5-Fu处理后,HCT116细胞的贴壁能力明显降低,细胞皱缩变圆,且随着SCU浓度的增加,细胞皱缩和碎片化的比例也明显增加,提示SCU能诱导HCT116细胞形态的改变。
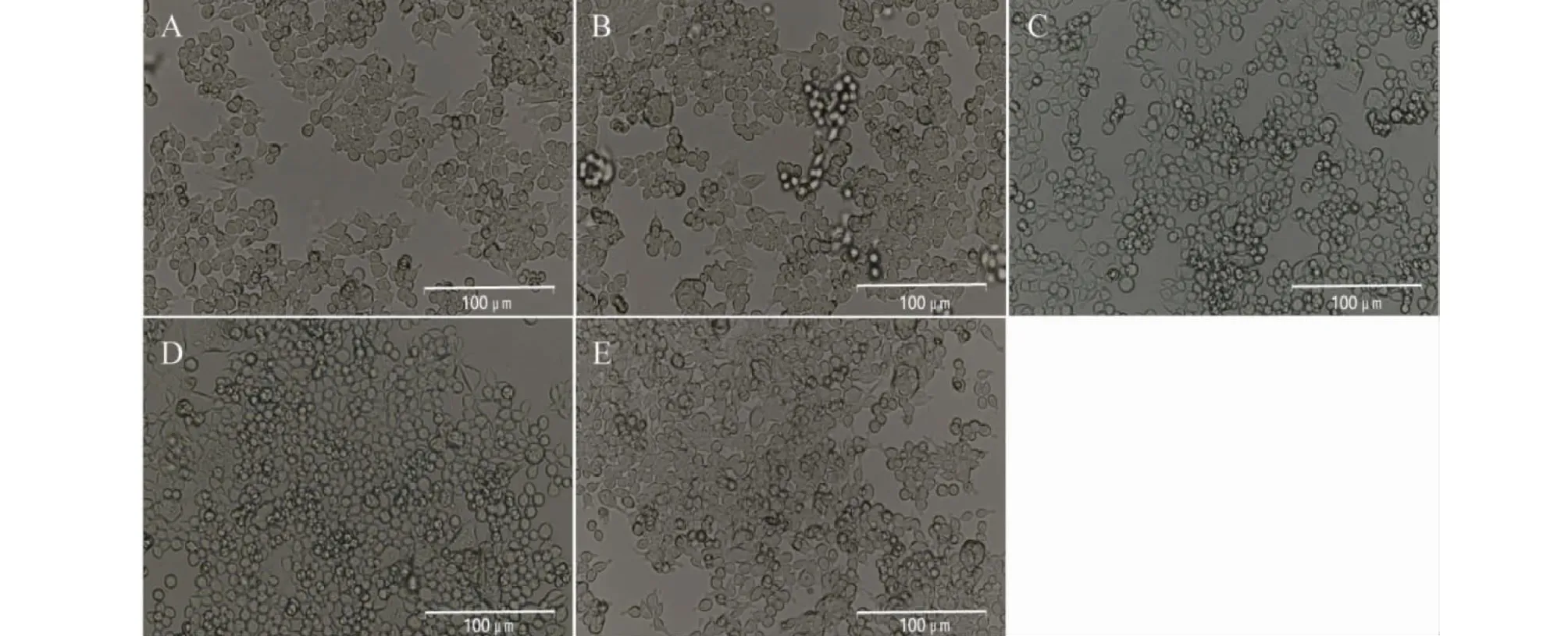
图1 SCU对HCT116细胞形态的影响Fig.1 Effect of SCU on morphology of HCT116 cells注:A.空白对照组;B.SCU 35 μg/mL组;C.SCU 75 μg/mL组;D.SCU 140 μg/mL组;E.5-Fu 40 μmol/L组。Note:A.Control;B.SCU 35 μg/mL group;C.SCU 75 μg/mL group;D.SCU 140 μg/mL group;E.5-Fu 40 μmol/L group.
2.2 SCU抑制HCT116细胞活性
如图2所示,使用不同浓度的SCU(0、20、40、80、120、160、200、240、280、300 μg/mL)处理HCT116细胞24 h后,相比空白对照组,SCU在浓度达到40 μg/ mL后能显著降低HCT116细胞的存活率,呈浓度依赖性,其IC50值为75.96 μg/mL。参考以上结果,确定将35、70、140 μg/mL分别作为后续实验的SCU低、中、高剂量组,并选择24 h作为SCU的给药处理时间。
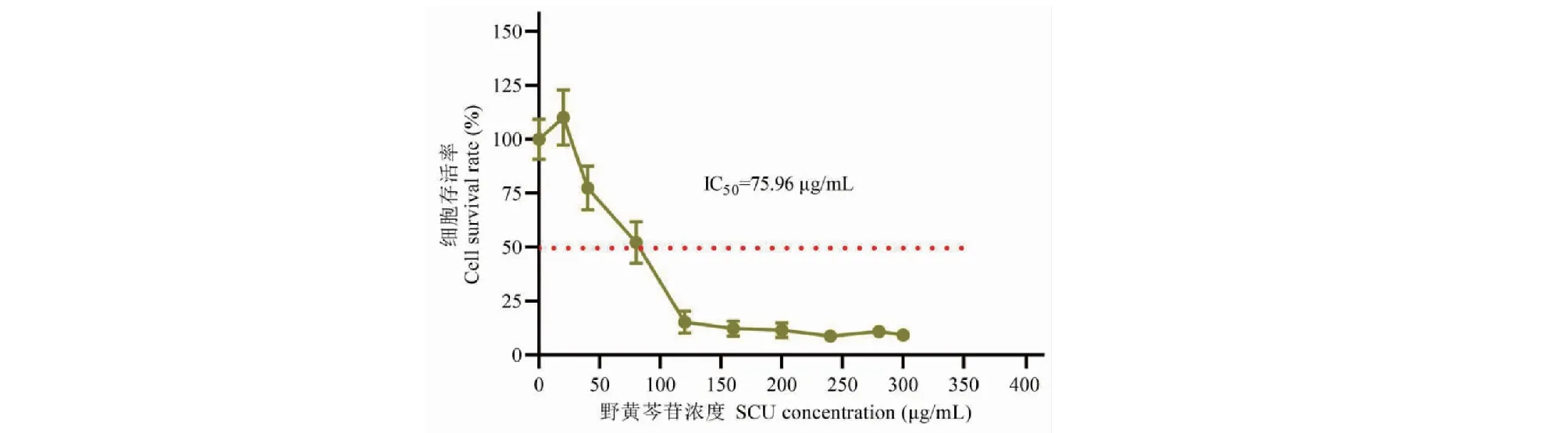
图2 SCU对HCT116细胞形态的影响Fig.2 Effect of SCU on proliferation of HCT116 cells
2.3 SCU抑制HCT116细胞克隆形成能力
如图3所示,在平板克隆形成试验中,SCU 140 μg/mL组和阳性药5-Fu组能显著减少HCT116细胞的集落形成数目,70 μg/mL组的抑制作用其次,35 μg/mL组也能在一定程度上减少HCT116细胞的集落形成数目,提示SCU对HCT116细胞的克隆形成能力具有抑制作用。

图3 SCU对HCT116细胞克隆形成能力的影响Fig.3 Effect of SCU on colony-formation ability of HCT116 cells
2.4 SCU抑制HCT116细胞迁移
如图4和表2所示,与空白对照组相比,SCU处理24 h和48 h均能显著降低HCT116细胞的迁移率(P<0.01),表明SCU能有效地抑制HCT116细胞迁移,且这种抑制作用随SCU的浓度增加而逐渐增强,呈浓度依赖性。

图4 SCU对HCT116细胞迁移的影响Fig.4 Effect of SCU on migration of HCT116 cells
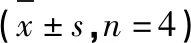
表2 SCU对HCT116细胞迁移的影响Table 2 Effect of SCU on migration of HCT116 cells
2.5 SCU诱导HCT116细胞凋亡
采用Hoechst 33342/PI染色法观察不同浓度的SCU对HCT116细胞凋亡的影响,结果如图5所示,与空白对照组相比,SCU干预后的HCT116细胞表现出凋亡早期染色质固缩所形成的致密浓染,发出亮蓝色荧光,颜色泛白且比较明亮,提示SCU能够诱导HCT116细胞凋亡。此外,随着SCU给药浓度的增加,发亮蓝色荧光的细胞数目也逐渐增多。值得注意的是,SCU 140 μg/mL组诱导发生凋亡的细胞数目明显多于阳性药5-Fu。

图5 SCU对HCT116细胞凋亡的影响Fig.5 Effect of SCU on apoptosis of HCT116 cells
2.6 SCU对HCT116细胞凋亡率的影响
使用Annexin V-FITC流式细胞分析法检测SCU处理24 h后各组细胞的凋亡率,结果如图6和表3所示,与空白对照组相比,SCU各给药组均能显著提高HCT116的细胞凋亡率(P<0.05,P<0.01),且随着给药浓度的提高,细胞总凋亡比例逐渐增加,呈浓度依赖性。其中,35、70、140 μg/mL组的细胞凋亡率分别为(10.62 ± 0.21)%、(17.26 ± 0.45)%和(21.51 ± 2.26)%,5-Fu组的细胞率为(14.59 ± 1.40)%,提示SCU能诱导HCT116细胞发生凋亡,且70、140 μg/mL组对HCT116细胞凋亡的诱导作用强于阳性药组。
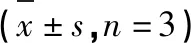
表3 SCU对HCT116细胞凋亡率的影响Table 3 Effect of SCU on apoptosis rate of HCT116 cells
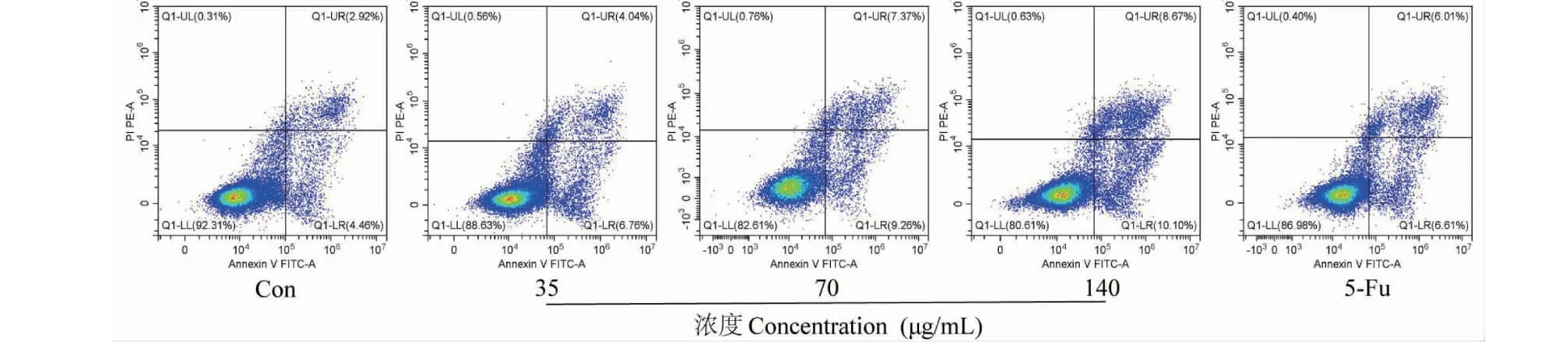
图6 SCU对HCT116细胞凋亡率的影响Fig.6 Effect of SCU on apoptosis rate of HCT116 cells
2.7 SCU对HCT116细胞凋亡相关因子mRNA表达水平的影响
如表4所示,与空白对照组相比,SCU处理后能显著上调Bax、caspase-9和caspase-3的mRNA表达水平(P<0.01),下调Bcl-2的mRNA表达水平(P<0.01),呈浓度依赖性。其中,SCU 70、140 μg/mL组对上述凋亡相关因子的mRNA表达水平的调控作用更加显著,且140 μg/mL组的作用强于阳性药5-Fu组,表明线粒体介导的凋亡途径在SCU诱导结直肠癌HCT116细胞凋亡中发挥了重要作用。
表4 SCU对HCT116细胞凋亡相关因子mRNA表达水平的影响Table 4 Effect of SCU on mRNA expression of apoptosis-related factors in HCT116
2.8 SCU对HCT116细胞Hippo-YAP/TAZ信号通路相关因子mRNA表达水平的影响
如表5所示,与空白对照组相比,SCU干预后能显著升高MST1、LATS1的mRNA表达水平(P<0.01),降低YAP1、TAZ以及通路下游靶基因c-Myc的mRNA表达水平(P<0.05,P<0.01),其中SCU 70、140 μg/mL组的作用更加显著,表明SCU对结直肠癌HCT116细胞的作用与其参与Hippo信号通路活性的调控有关。
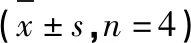
表5 SCU对HCT116细胞中Hippo-YAP/TAZ通路相关mRNA表达的影响Table 5 Effect of SCU on mRNA expression of Hippo-YAP/TAZ pathway-related factors in HCT116
2.9 SCU对HCT116细胞凋亡相关蛋白表达的影响
Western blot检测SCU对HCT116细胞凋亡相关蛋白Bax、Bcl-2表达水平的影响,结果如图7所示,与空白对照组相比,SCU 35、70、140 μg/mL组均能显著升高HCT116细胞中促凋亡因子Bax的蛋白表达水平(P<0.01),显著降低抗凋亡因子Bcl-2的蛋白表达水平(P<0.01),与qRT-PCR的结果相对应,从蛋白水平上表明SCU能通过调控HCT116细胞中凋亡相关蛋白Bax、Bcl-2的表达来促进细胞凋亡。
图7 SCU对HCT116细胞凋亡相关蛋白表达的影响Fig.7 Effect of SCU on expression of apoptosis-related proteins in HCT116 注:与空白对照组比较,*P<0.05,**P<0.01,下同。Note:Compared with Con,*P<0.05,**P<0.01,the same below.
2.10 SCU对HCT116细胞Hippo-YAP/TAZ通路相关蛋白表达的影响
Western blot检测SCU对HCT116细胞中Hippo-YAP/TAZ信号通路相关蛋白表达水平的影响,结果如图8所示,与空白对照组相比,SCU能显著升高LATS1、MST1、p-YAP(Ser127)的蛋白表达水平(P<0.05,P<0.01),降低YAP1、TAZ、c-Myc的蛋白表达水平(P<0.05,P<0.01),呈浓度依赖性,与qRT-PCR的结果相对应,从蛋白水平上表明SCU能对Hippo信号通路的活性产生影响。

图8 SCU对HCT116细胞中Hippo信号通路相关蛋白表达的影响Fig.8 Effect of SCU on expression of Hippo signaling pathway-related proteins in HCT116
3 讨论与结论
越来越多的证据表明,SCU可通过多种途径抑制肿瘤的发生和发展,具有开发成为抗肿瘤药物的潜力。Sun等[14]发现,SCU能明显抑制非小细胞肺癌PC-9和H1975细胞的增殖。Han等[15]的研究结果也表明,SCU能以浓度依赖的方式显著抑制人骨肉瘤143B和U2OS细胞的增殖。在本研究中,SCU能显著降低结直肠肿瘤HCT116细胞的活性,抑制细胞克隆,阻碍其增殖,与上述结论一致。
在癌症中,癌细胞常通过上皮间质转化来获得增殖和侵袭的能力。在肝细胞癌中,Liu等[16]研究发现,SCU可通过下调Janus激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路的活性来抑制肝癌细胞上皮间质转化,降低肝癌细胞侵袭和转移的能力。Li等[17]发现,在胃癌中,SCU可通过调节PTEN/PI3K信号通路的活性,下调胃癌MGC-803、AGS细胞中的上皮性钙黏附蛋白(E-caderin)表达水平,上调波形蛋白(Vimentin)和神经性钙黏附蛋白(N-cadherin)的表达水平,抑制胃癌细胞的上皮间质转化。本研究中,细胞划痕试验的结果表明,与空白对照组相比,SCU给药组HCT116细胞的迁移率被显著降低,并呈浓度依赖性,提示SCU对结直肠肿瘤细胞的迁移能力具有抑制作用,与前面的研究结果相符。
目前普遍接受的观点认为,细胞凋亡不足是肿瘤发生、发展的一个重要原因。因此诱导肿瘤细胞凋亡被认为是肿瘤治疗的一种有效手段[18]。Cao等[19]的研究证实,SCU可通过抑制AKT/mTOR/4EBP1和STAT3通路,将顺铂耐药肺腺癌A549细胞阻滞在G0/G1期,并诱导其发生凋亡。在肝癌中,Xu等[20]发现,SCU可通过抑制肝癌HepG2细胞中活性氧ROS的产生使STAT3信号通路的活性降低,进而下调下游靶蛋白BCL-XL和MCL-1的表达水平,诱导细胞凋亡。同样,在本研究中,我们通过Hoechst 33342/PI双染和细胞流式细胞术检测发现,SCU能诱导细胞凋亡,显著提高HCT116细胞的凋亡率。然而SCU的具体调控机制尚不明确,因此在后续研究中做了进一步探索。
有研究指出,Hippo信号通路能参与细胞增殖的调控,YAP过度激活或过度表达可导致肝脏、胃肠道、皮肤和心脏等多个组织的细胞过度增殖[21]。此外,YAP和TAZ还是细胞上皮间质转化的活性诱导剂,高活性的YAP和TAZ能诱导上皮间质转化中的关键转录调节因子ZEB1/2的表达,从而促进上皮间质转化[22]。Hippo信号通路对细胞凋亡也起重要调控作用。YAP可通过调控下游抗凋亡基因如COX-2、Survivin和Glut1等转录促进细胞凋亡[23];而且过表达的YAP还能阻断肿瘤坏死因子、FAS以及化疗药物诱导的凋亡[24];He等[25]的研究也证实,YAP可通过Ser351驱动NR4A1发生AKT依赖性的磷酸化,使其被隔离在细胞核中,削弱其促进细胞凋亡的作用。
本研究的结果表明,SCU能上调HCT116细胞中MST1、LATS1的mRNA和蛋白表达水平,下调YAP1和TAZ的mRNA和蛋白表达水平,促进YAP磷酸化,使p-YAP(Ser127)蛋白表达水平升高,因此推测SCU的作用可能与激活Hippo信号通路有关。qRT-PCR检测结果表明,SCU处理24 h能有效升高HCT116细胞中的Bax、caspase-3、casepase-9的mRNA表达水平,降低Bcl-2的mRNA表达水平;Western blot检测结果也表明,SCU能显著提高HCT116细胞中促凋亡蛋白Bax的表达水平,降低抗凋亡蛋白Bcl-2的表达水平。此外,c-Myc的mRNA和蛋白表达水平也在SCU处理24 h后被明显降低。以上结果提示,SCU可能是通过激活Hippo-YAP/TAZ信号级联,促进YAP/TAZ磷酸化,导致其转录活性被抑制,下游靶基因c-Myc的表达受到抑制,凋亡蛋白家族成员Bcl-2表达水平降低,Bax表达水平升高,并转位进入线粒体,促进细胞色素C的释放和凋亡复合体的形成,进而激活caspase家族中的凋亡启动因子caspase-9及下游的凋亡执行因子caspase-3,最终经线粒体途径诱发细胞凋亡,阻碍结直肠癌细胞的生长,发挥抗结直肠癌作用。
综上所述,本研究发现SCU能显著抑制结直肠癌HCT116细胞增殖、迁移,并诱导细胞凋亡,其作用机制可能与激活Hippo信号通路有关,但考虑到结直肠癌的形成原因复杂以及不同来源的肿瘤细胞系之间存在差异等诸多因素,关于SCU抗结直肠癌的作用仍需在其他多个结直肠癌细胞系上进行验证,并结合体内动物试验做进一步全面探讨。此外,据报道,Wnt、Notch、Hedgehog以及BMP信号通路都能参与肠道内环境的稳态和再生的调节,并且有研究发现,Hippo信号通路与这些通路之间能发生相互作用,存在串扰[26,27]。因此,SCU是否是通过综合调控Hippo信号通路及其串扰通路的活性来发挥抗结直肠癌的作用也需要深入探讨。
