一例孟加拉白虎幼崽猫细小病毒感染治疗
2023-02-22王晓佳殷子航吴登虎
王晓佳 ,喻 元 ,周 俊 ,殷子航,吴登虎
(重庆市动物园管理处,重庆,400050)
猫细小病毒(Feline parvovirus,FPV)为单股线状DNA 病毒,基因组序列全长约为5 200 bp[1-3],在自然条件下可感染猫科(Felidae)、浣熊科(Procyonidae)、鼬科(Mustelidae)和犬科(Canidae)等食肉性动物[4-5],圈养野生动物中也时有豹(Panthera pardus)[6]、东北虎(P.tigris altaica)[7-9]、非洲狮(P.leo)[10]和华南虎(P.tigrisamoyensis)[11]等感染,且部分成年猫科动物会出现无症状带毒的情况。FPV 进入肠道中首先侵入小肠上皮细胞,使肠道上皮脱落,肠绒毛变短,导致肠道出血性肠坏死。患病动物常常表现出剧烈呕吐和顽固腹泻的症状,进而出现咳血、便血。2021 年9 月,重庆市动物园自行繁育的1 只3 月龄孟加拉白虎(P.t.tigris)幼崽出现食欲下降、精神沉郁和发烧等症状,经过3 d 的抗生素干预治疗后,临床症状新增便血,血细胞检测发现白细胞数量急剧下降。根据幼崽临床症状、PCR 检测结果,确诊感染猫细小病毒,经过治疗,病情恢复,状态良好,现将该病例报告如下。
1 发病情况
2021 年9 月中旬,重庆市动物园1 只雄性3 月龄孟加拉白虎幼崽(体重21 kg)出现精神沉郁、拒绝进食症状,体温40.2 ℃,初步怀疑是由于气温变化引发的感冒症状,遂降温及控制感染。经过1 d 的治疗,该幼崽在恢复正常体温1 d 后,又再次升至40 ℃,用常规抗生素治疗未见病情改善,且出现呕吐症状,检测体温时发现应激排便,便中带血。
2 诊断方法
将患病幼崽与母虎隔离,单独饲养,采血检测血常规和生化指标,同时采集肛门黏液样本,使用伊诺威猫细小病毒抗原检测胶体金试纸进行检测,根据血象结果和临床症状,初步确诊为猫细小病毒感 染。初步确诊后采集患病幼崽、同胎幼崽和其母亲,以及虎山其他4 只成年华南虎的新鲜粪便样本,送悦洋宠物医院,使用GANGZHUMED GZ-8 Plus 便携式荧光PCR 仪进行实时荧光定量PCR 核酸检测,当0<Ct<38时,结果判定为阳性。
3 诊断结果
3.1 血常规检测
检测结果显示,幼崽白细胞极低,仅为3.50×109/L,红细胞、血红蛋白轻微下降,血小板升高(表1)。
3.2 生化检测
幼崽谷草转氨酶、尿素上升,碱性磷酸酶、总蛋白、白蛋白和肌酐下降(表2)。血淀粉酶虽远高于参考值,但是结果符合重庆市动物园以往对其他健康孟加拉虎和华南虎的检测结果范围,因此判定血淀粉酶在正常范围内。
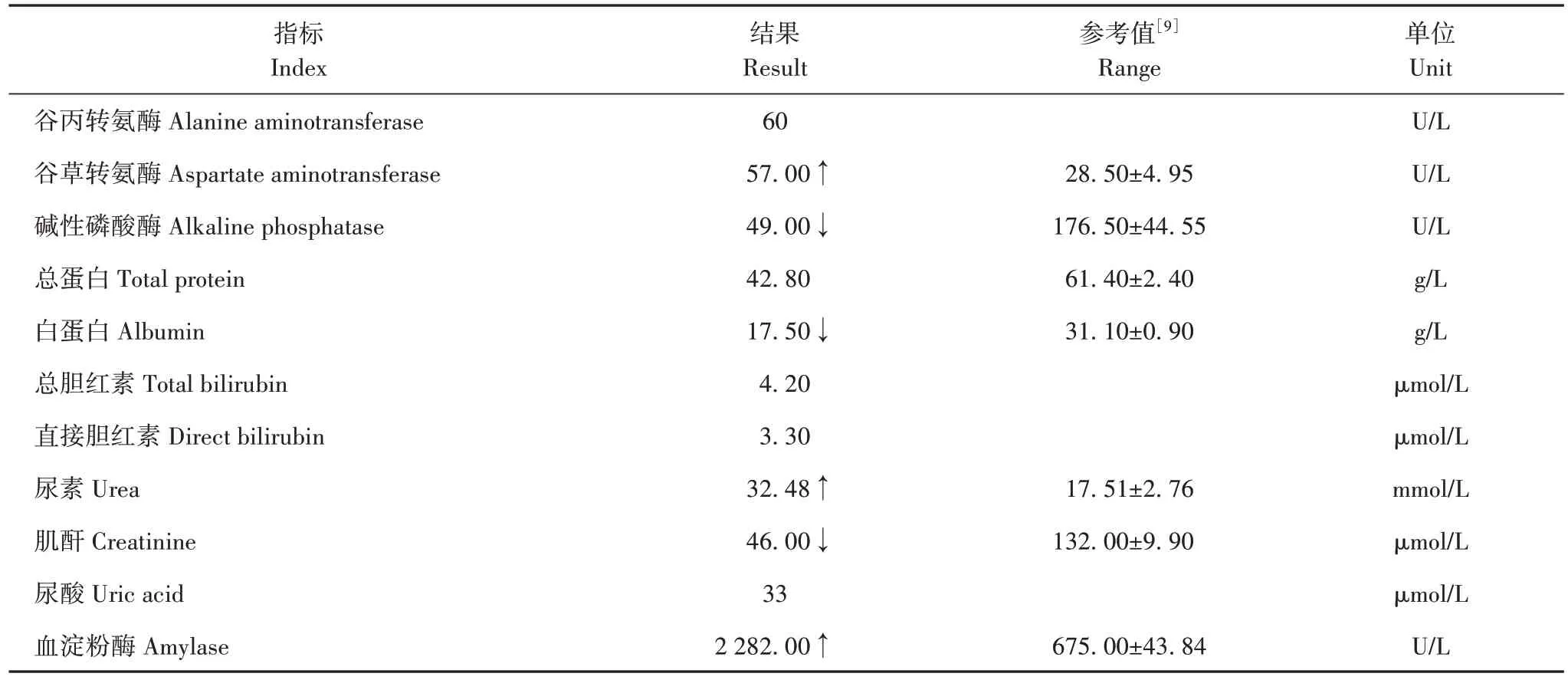
表2 生化检测结果Tab.2 The result of biochemical detection
3.3 抗原检测结果
首次抗原检测结果为阴性。在确诊猫细小病毒感染后,对幼崽又进行了5 次抗原检测。从输液治疗的第2 天开始,每天1 次,一直持续至便血症状消失。后续5次抗原检测均为阴性。
3.4 核酸检测
图1 显示,幼崽的PCR 核酸检测结果为细小病毒阳性(Ct值为12.51)。虎山其他6 份饲养虎样本中,有5 份检测为细小病毒阳性,阳性样本中包括患病幼崽的母亲和同胎幼崽,但未出现症状。最终确认虎山6只个体带毒。
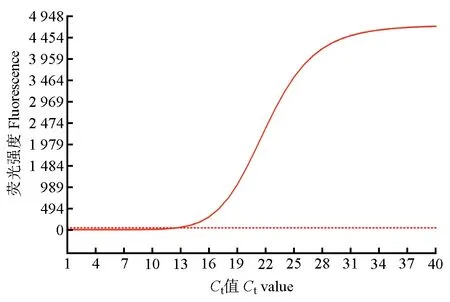
图1 实时荧光定量PCR检测结果Fig.1 The result of Real-time PCR test
4 治疗
细小病毒感染的一般治疗原则为应用抗体干扰素抑制病毒,抗菌消炎防止继发感染,止血止吐,保持空腹调节胃肠功能,对症治疗。根据治疗原则,在幼崽无呕吐,且便血症状消失的情况下,尽早给与一定食物,以维持消化道的正常功能,并提供必需的营养。
每日静脉输液细小病毒单克隆抗体10 mL(每公斤体重约0.5 mL)、重组猫ω干扰素(150 万IU)、200 单位辅酶A、注射用头孢哌酮舒巴坦钠2 g、炎琥宁80 mg、注射用白眉蛇毒血凝酶1 单位、50%高渗糖40 mL(稀释至10%浓度)、肌酐100 mg、甲硝唑氯化钠注射液0.3 g、林格氏溶液50 mL 和氨基酸注射液50 mL,同时肌注维生素B6 0.1 g,维生素C 0.5 g。该阶段完全禁食禁水(持续约1周)。
治疗第7 天,幼崽蛋白持续下降,在治疗处方不变的基础上添加人血白蛋白注射液2 g(20 mL)。输液过程中未出现任何异常表现,输液结束后约 3 min,出现精神沉郁,呼吸减慢的症状。立即肌内注射肾上腺素1 mg,尼克刹米0.375 g,注射后精神呼吸均有好转,约10 min后再次沉郁并呼吸减弱,立即再次注射相同剂量肾上腺素及尼克刹米,症状好转且状态逐步稳定。半小时后,幼虎除精神稍微不振外,呼吸心跳基本恢复正常。
治疗第2 周,白细胞数量开始上升且未再见消化道出血,总蛋白仍较低,静脉输液处方中去除干扰素、单克隆抗体、炎琥宁和注射用白眉蛇毒血凝酶,甲硝唑氯化钠注射液用量减半,增加谷胱甘肽0.6 g,氨基酸注射液全部改为口服。此阶段开始每日给与约20 g 鸡胸肉糜,然后每日逐步增加10 g 肉糜直至60 g 停止。饮水开始给与100 mL(饮用水和氨基酸注射液1∶1),4 d 后开始采用自由饮水方式,仍然采取饮用水和氨基酸注射液1∶1的比例。
治疗1 个月后,幼崽临床症状消失,血常规、生化指标恢复正常,两便正常,仅蛋白稍偏低,此时判断基本痊愈,停止所有药物治疗。开始饲喂鸡胸肉块,每隔2 d 增加10 g 鸡胸肉,直至恢复正常食量。饮水中不再添加氨基酸注射液,恢复正常自由饮水。
5 讨论
宠物临床检测证实检测试纸板具有较高的准确性,根据文献报道,犬和猫的细小病毒检测试纸板均成功确诊圈养野生动物临床样本阳性感染[6,12]。而本病例从最初症状开始直至治疗1周内,共计6次胶体金试纸板检测,均未能检测出细小病毒阳性,最终通过粪便样本PCR检测确诊。细小病毒检测试纸板在临床检测中的准确度可能并不灵敏,在临床诊断中依靠临床症状、分子诊断技术和胶体金检测相结合的方法能使检测结果更准确。
经过系统治疗,幼崽最终恢复健康,但是后期出现了肠道迟缓,可能是在治疗前期,停食导致的。这种情况在饮食恢复后慢慢改善,恢复过程长达1 个月。根据本病例情况,在确定动物便血症状结束后,且没有出现腹泻等其他肠道异常时,应尽早进食,刺激肠道维持正常蠕动,更有利于动物的消化道功能恢复。但是需要注意,前期给与的食物量需要谨慎控制,以防止动物过多进食加重肠道损伤。
在治疗第10 天,幼崽总蛋白和白蛋白降低,其余生化指标均在正常范围内。由于没有专门针对野生动物的蛋白类药物,只能使用人源蛋白类药物,但人源蛋白极易造成动物的过敏反应,可能导致死亡。因此,在病程早期,动物机体没有出现严重呕吐、腹泻等不适反应的情况下,应尽早提供少量食物,以防止机体蛋白过低。本病例中,在治疗结束、进入恢复期时,幼崽进食量逐步恢复至正常食量的一半后(约1 kg肉量),总蛋白和白蛋白2项指标才开始上升,缓慢恢复至正常。这一情况说明长时间的禁食禁水方案并不适合野生动物细小病毒病的治疗。野生动物治疗过程一般都无法保证长时间的输液,所以很难依靠输液补充所需的营养与液体。长时间的禁食禁水,可能会造成动物严重低蛋白和一定程度的脱水,从而导致无法挽回的后果。
园区内有大量流浪猫狗,带病毒的流浪猫狗可能感染成年虎。在后期检测中也发现,幼崽的母亲无症状带毒,繁殖母虎在带崽过程中可能导致幼崽感染,但幼崽在满3 个月停止进食母乳后才发病,且发病症状相对较轻、病程较慢,可能是母乳携带的母源抗体起到了保护作用。
在各项检测指标恢复正常、治疗结束后的恢复期中,发现幼崽出现了皮肤脆弱的临床表现。相对于患病前,幼崽皮肤变得极为脆弱,正常活动摩擦即会造成皮肤破裂,甚至大面积破损剥离。患病后幼崽伤口恢复时间与患病前相比明显延长,皮肤破损位置炎性渗出物更多,伤口愈合减慢。虽然症状不严重,但伤口反复感染化脓。这种情况可能与猫细小病毒有关,也可能是治疗过程中白蛋白过敏反应的后遗症。皮肤脆弱的情况一直持续至治疗结束后3个月才逐渐好转。本研究表明,在猫细小病毒感染治疗痊愈后,可能需要对患病动物的笼舍及周边环境做更加细致的防护工作,防止皮肤破损引发炎症反应,尤其是幼崽,在经历长时间的病程后,虚弱期再次引发严重炎症反应极易导致治疗失败,甚至死亡。
