光学相干层析技术在眼科手术导航方面的研究进展
2023-02-22李云耀樊金宇蒋天亮唐宁史国华
李云耀,樊金宇,蒋天亮,唐宁,史国华*
1中国科学技术大学,安徽 合肥 230026;
2中国科学院苏州生物医学工程技术研究所,江苏 苏州 215163
1 引言
随着显微外科手术的发展,微创眼科手术成为了治疗青光眼、白内障及视网膜病变等眼科疾病的主要手段。该类手术的实施需要在术中实时观察眼部表面下的结构,并对手术器械进行精确定位。常规的手术显微镜只能提供正面视角的视图,医生须借助内窥镜提供深度信息,不能无创地观察眼底,并且由于缺乏层析成像,可能会影响对结构边缘位置的判断[1]。电子计算机层析成像(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、超声(ultrasound)和非线性光学成像等成像技术被广泛用于术前诊断和术后观察,但由于分辨率有限、有辐射影响、难以配合手术器械[2-3]以及依赖特定化学物质[4]等原因,难以应用于术中实时导航。
光学相干层析成像技术是一种非接触式断层成像技术,该技术基于光的低相干干涉原理,通过测量组织中后向散射光的干涉信号获取被测物内部结构信息,从而进行断层成像[3]。与CT、MRI 和超声等成像技术相比,OCT 具有非侵入、速度快、分辨率高等优点,在临床与科学研究中获得了广泛应用。第一代OCT 即时域OCT 技术(time domain optical coherence tomography,TD-OCT)由于相对复杂的光学和机械设计的限制,难以在成像速度和质量上取得提升[5]。傅里叶域OCT 技术(Fourier domain optical coherence tomography,FD-OCT)极大提升了OCT 的成像速度和灵敏度[6-7],使得OCT 技术商业化程度提高,眼科OCT 由此广泛应用于临床手术[8-9],在诸如心脏病、胃肠病及癌症成像等领域的应用也日渐突出[10-14]。
OCT 于20 世纪90 年代中旬被首次报道用于眼科手术的术前规划和术后观察[15],相比传统的眼科仪器,OCT 能更好地在手术期识别病理结构和术后结构变化[16-18]。除了分辨率和成像速度的优势以外,基于光学原理的OCT 具有更低的成本,也更容易集成到外科器械和显微镜中,非常契合眼科手术对成像仪器的要求。对于眼科手术,在术中实时地提供图像信息尤为重要,随着21 世纪早期傅里叶域OCT 的革新,以及集成显微镜OCT 设备的出现[19-21],术中实时OCT 成像导航成为了发展趋势。
目前,基于OCT 的眼科手术导航设备已经较为成熟,本文主要介绍了OCT 在眼科手术导航中的应用;从成像原理、技术参数和临床应用等方面综述了其研究进展与现状;分析了各类OCT 设备的优劣,并对该技术未来发展做出了展望。
2 OCT 的原理和类型
2.1 OCT 的原理
光学相干层析成像技术起源于飞秒光学[22],其原理是利用生物组织内部折射率的变化,根据光波在组织中传播后的相位变化对组织进行成像。OCT 技术于1991 年由美国麻省理工大学的Fujimoto 小组首次提出[23],该技术基于低相干光干涉原理,使用一个参考臂作为纵向深度参考,通过移动参考臂对低相干干涉仪的光束进行扫描。对被测组织不同深度返回的干涉光进行分析处理,可以得到其纵向的一维结构(A扫描)[24]。在横向平面上控制参考臂,将所获得的A扫描结合起来,就能得到具有被测组织深度信息的二维图像(B 扫描)。对一系列连续的B 扫描进行处理,可以生成被测组织的三维图像。
2.2 时域OCT
最早的OCT 系统使用基于时域的探测器,因此将此类OCT 简称为时域OCT(TD-OCT)。TD-OCT 的主要结构如图1 所示。TD-OCT 是低相干系统,一般使用低相干光源。入射光通过光纤耦合器后分为两束,分别作为参考光束和探测光束进入参考臂和样品臂。探测光束在被测样品的不同深度产生背散射光,在光纤耦合器中与参考臂中平面镜反射回的参考光发生干涉,得到的干涉光中含有样品的内部信息。在此过程中,通常使用偏振调制器调节光线传播的偏振方向以得到较强的干涉信号,并利用相位调制器和解调器来处理干涉光中的噪声,提高信噪比。
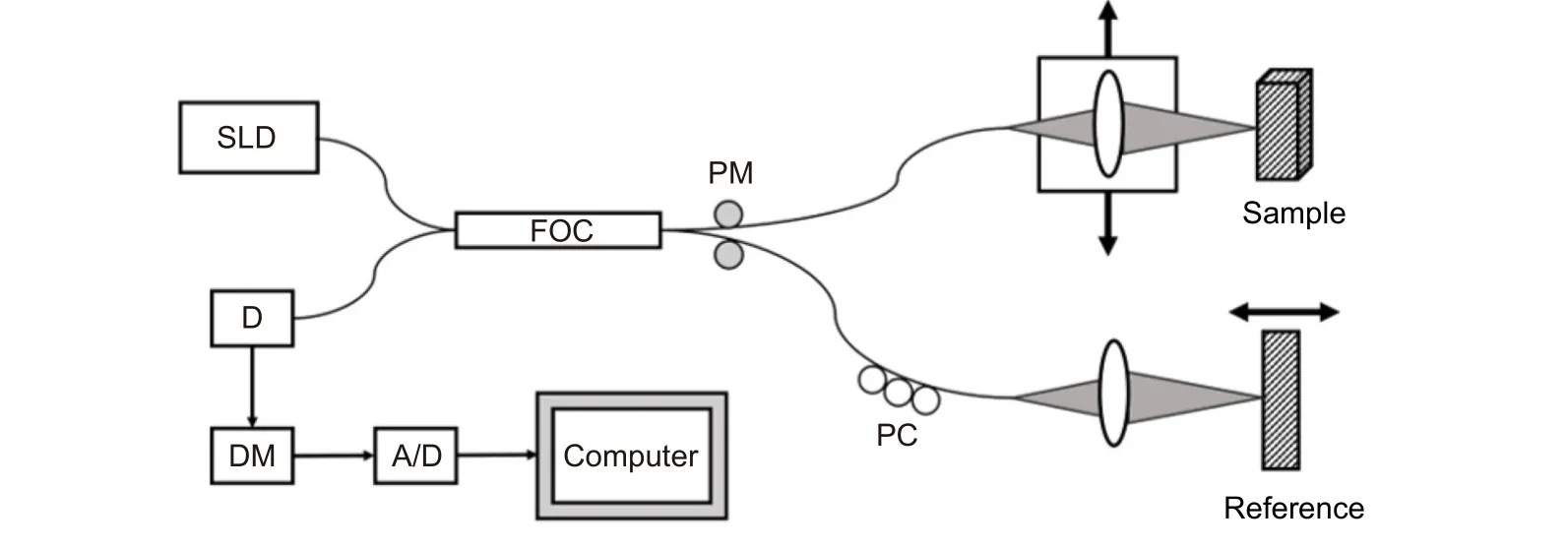
图1 时域OCT 系统示意图。SLD:低相干光源;FOC:光纤耦合器;PC:偏振调制器;PM:相位调制器;D:光电探测器;DM:解调器Fig.1 System schematic of the TD-OCT system.SLD: super luminescent diode;FOC: fiber optic couplers;PC: polarization modulators;PM: phase modulator;D: detector;DM: demodulator
TD-OCT 系统一般使用光电探测器接收干涉信号,通过样品臂的纵向扫描获得样品不同深度的信号并将这些信号叠加,得到样品的一维结构信息。再通过样品臂的横向扫描对一维信息叠加,得到样品的二维断层扫描信息。干涉光在经过解调器、A/D 转换器后由计算机进行数字图像处理,从而得到样品内部结构的二维图像[25]。
TD-OCT 的成像速度受机械扫描机构的限制,最早的TD-OCT 系统生成单个二维截面图像需要的时间约为190 s[26]。后续的TD-OCT 中引入了可旋转的立方体反射镜系统[27]、高灵敏度的干涉接收器[28-30]以及双通道快速扫描光学延迟线系统等技术,使成像速度能够达到两千赫兹(每秒钟A 扫描次数)[31],虽然相比早期的TD-OCT 具有了极大提升,但仍然难以满足临床应用的需要。
2.3 频域OCT
频域OCT(FD-OCT)又称傅里叶域OCT,是TDOCT 问世十年后(2001 年)诞生的新一代OCT 技术[28]。FD-OCT 系统舍弃了TD-OCT 中的机械扫描结构,不需要移动参考臂来对样品进行纵向扫描,而是通过对干涉光信号做傅里叶变换获得样品的深度信息。FDOCT 不仅在成像速度上远超TD-OCT[7,32],还拥有极高的灵敏度,这使得FD-OCT 在高速成像的同时,不会因为灵敏度低而损失图像质量[33]。
根据不同的光源和干涉信号采集方式,可将FDOCT 分为谱域OCT(spectral-domain OCT,SD-OCT)和扫频OCT(swept-source OCT,SS-OCT)两类。SDOCT 使用近红外超发光二极管作为光源(中心波长约840 nm),使用光谱仪对干涉信号进行分光后,再用线阵探测器采集信号[32,34]。SS-OCT 使用可调谐的扫频激光器作为光源(中心波长约1050 nm),对光源进行分光后使用单个光电二极管作为探测器采集信号[35-36]。
随着光源和采集设备的发展,FD-OCT 的成像速度不断提升。SD-OCT 的成像速度已经达到十万赫兹,而SS-OCT 则超过了二十万赫兹[28,31,36]。凭借成像速度快、成像质量高的优点,FD-OCT 技术迅速抢占了OCT 市场,并取得了广泛的临床应用。尽管SDOCT 和SS-OCT 的成像速度都可以满足临床需求,但成本较低的SD-OCT 系统的商业化应用更为广泛[26]。
3 手持式术中OCT
传统的台式OCT 系统由于其物理结构的限制,在用于眼科成像时需要患者采用站姿或坐姿,并使用托腮板和头枕等设备保持头部稳定,难以对处于仰卧或麻醉状态的患者进行成像。随着小型化光学元件的发展,具有更小外形的OCT 系统开始出现,手持式OCT(Handheld OCT,HHOCT)应运而生[28,37]。HHOCT技术的出现使患者在仰卧状态下也能进行成像。相比台式OCT 系统,HHOCT 在轴向和横向测量方面都有更好的重复性和再现性[38],并且具有更低的成本和操作难度,因此适合作为商业化OCT 设备的替代。
3.1 外部HHOCT 探头
1997 年,Boppart 等研发了首个手持式OCT 探头[39]。该探头采用压电材料移动光纤,对聚集光束扫描的部分进行成像。基于光纤的HHOCT 结构紧凑,但相比传统振镜扫描的方式,视野更小且图像采集速率低[40]。随后振镜被引入HHOCT 中,一种外置的手持OCT 探头被开发出来,基于振镜的HHOCT 探头尺寸和重量更大,能够实现更高速的光学扫描[41],并且其非接触式的特点适用于无创手术的术中导航。
早期的HHOCT 探头使用两个电机控制振镜提供X和Y方向扫描,从而将其集成到手持探头中[42]。2001 年,Radhakrishnan 等设计了一种基于振镜的眼科HHOCT (图2(a))[41]。探头的光学元件可将样品臂末端的放大图像转移到前段,同时将振镜平面成像到物镜平面。研究人员使用该手持设备完成了对5 名受试者眼前节的高速实时成像(图2(b)),实现了角膜层的划分和角膜结构的全厚度可视化(图2(c)),并对角膜上皮、基质厚度以及前房角进行了测量。2007 年,美国Bioptigen 公司商业化了一款同样使用振镜的眼科HHOCT 探头[43]。Bioptigen HHOCT 探头被首次用于儿童、婴儿眼部成像[44],并于2009 年被引入临床眼科手术进行术中成像[45]。此后,类似的HHOCT 也相继被开发并用于眼科手术[46-48]。
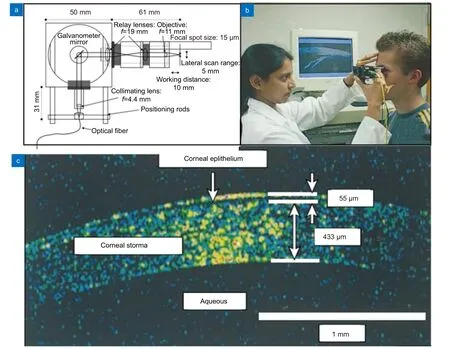
图2 Boppart 等研发的HHOCT 探头[39]。(a) HHOCT 探头结构;(b) 使用HHOCT 探头扫描眼部;(c) 角膜的实时OCT 成像Fig.2 HHOCT probes developed by Boppart et al[39].(a) The structure of the HHOCT probe;(b) Eye scan using HHOCT probe;(c) Real-time OCT imaging of the cornea
尽管基于振镜的HHOCT 探头减小了传统台式OCT 的尺寸,振镜扫描所采用的两个正交方向的电机仍然限制了其最小尺寸和重量[42]。为了进一步提高HHOCT 的便携性,微机电系统(micro electro mechanical system,MEMS)开始被引入扫描装置中。使用半导体技术制造的MEMS 扫描镜可以封装在一枚紧凑的集成芯片上,在此基础上开发的二维MEMS 扫描镜可以提供两个方向的扫描(图3),因此可以替代体积较大的振镜扫描仪,目前已被广泛应用于紧凑型HHOCT 探头[49-51]。

图3 二维MEMS 扫描镜[50]。(a) 扫描示意图;(b) 封装后的MEMS 扫描镜Fig.3 Two dimensional MEMS scanning mirror[50].(a) Layout of the scanning system;(b) Packaged MEMS scanning mirror
MEMS 扫描镜大幅改善了便携性后,HHOCT 探头开始追求更高的成像速度。随着SS-OCT 技术的进步,HHOCT 探头得以实现更高的成像速度和更宽的视场[52-53]。2013 年,麻省理工大学的Lu 等基于SSOCT 设计了一种用于眼科视网膜成像的HHOCT 探头(图4(a),4(b)),展示了截止当时所有HHOCT 设备的最高成像速度,并实现了对五名受试者眼底的高清晰度实时成像(图4(c))[42]。此外,一些HHOCT 探头利用SS-OCT 的高成像速度实现了眼底的三维成像,这是HHOCT 技术的一个重大进步[54-55]。
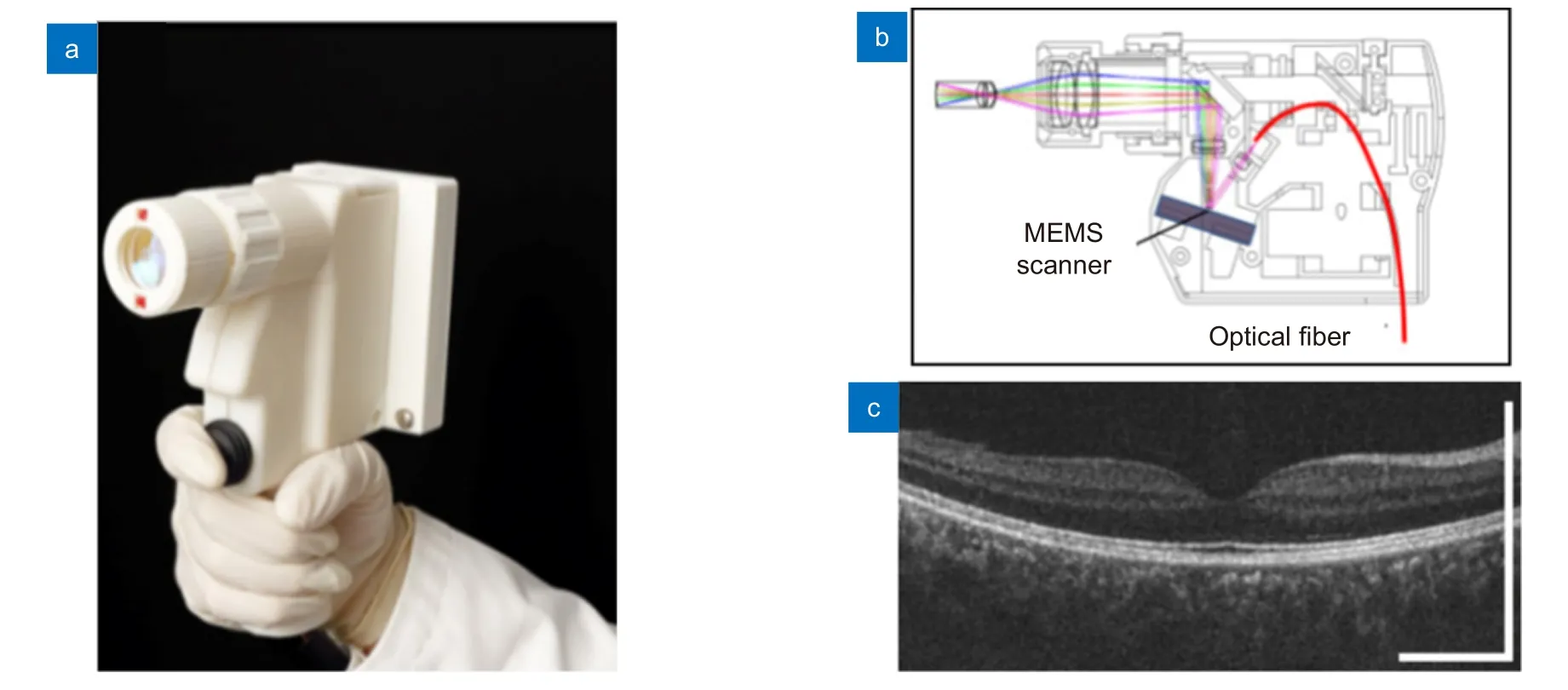
图4 Lu 等研发的HHOCT 探头[42]。(a,b)探头外观及结构;(c) 使用HHOCT 得到的眼底黄斑区图像Fig.4 HHOCT probes developed by Lu et al[42].(a,b) The probe and its structure;(c) HHOCT imaging of the macula
3.2 HHOCT 探针
由于HHOCT 探头非侵入方式成像的局限性,此类设备无法绕开眼内不透明组织和浑浊介质,因此难以扫描视网膜最外围部分[3,56]。与HHOCT 探头相比,探针型HHOCT 系统的结构更加紧凑,能够在微创条件下进入眼内,对眼底结构进行成像,同时也可以优化与光学显微镜等设备的体积干涉问题。HHOCT 探针一般使用23G(外径0.64 mm)~27G(外径0.41 mm)针管,通过手术切口插入眼内后,可以将扫描光投射到眼内任意位置的目标组织[56]。2013 年,Joos 等设计了25G(外径0.51 mm)薄壁HHOCT 探针[57](图5(a)),该探针将一根直径为125 μm 的光纤(图5(b))置于34G(外径0.18 mm)针管内,34G 针管末端部分制成弯曲的“S”形,34G 针管外套一根28G(外径0.36 mm)针管,28G 管沿34G 针管弯曲部分滑动时会迫使单模光纤振动,从而形成横向扫描。探针外管规格为25G,可以通过同样为25G 的玻璃体切口进入眼内(图5(c)),对眼底进行成像。2016 年,Asami 等设计了一种使用电机驱动光纤扫描的23G 术中HHOCT探针[56](图5(d),5(e),5(f)),完成了对离体猪眼、兔眼视网膜组织的成像,并在随后的人体临床病例中检测到了视网膜、脉络膜、视盘和睫状体等微小结构。
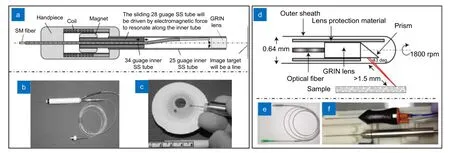
图5 HHOCT 探针。(a-c) Joos 等设计的25G 手持OCT 探针[57];(d-f) Asami 等设计的23G 手持OCT 探针[56]Fig.5 Needle-based HHOCT probes.(a-c) 25G needle-based fiber HHOCT probe designed by Joos et al[57];(d-f) 23G needle-based fiber HHOCT probe designed by Asami et al[56]
3.3 OCT 集成手术器械
使用HHOCT 探针进行眼内成像时,会出现手术器械末端在图像中不可见、器械投影影响OCT 成像的问题[58],OCT 集成手术器械的出现有效地改善了此类问题。约翰霍普金斯大学的研究团队证明,在眼科手术器械末端的外沿或内部安装光纤,可以对器械末端附近区域进行A 扫描[58-60]。通过这种方法将OCT 集成到手术器械中,可以保证图像与器械末端对齐,有利于术中对器械位置的判断。2013 年,Song 等将光纤式OCT 探针集成到眼科手术钳中,设计了SMART 微型手术钳(图6(a))[58]。该手术钳内部植入一根单模光纤,手术钳末端的运动可由电机微调。控制手术钳移动的电机使用PID(proportional-integralderivative)控制方案,在接收OCT 信号后高速调节手术钳末端位置,使其与手术目标的距离保持在预定值,而不受医生手部震颤和手术目标位移的影响。2015 年,Yu 等将OCT 探针植入了25G 手术钳(图6(b),6(c))[61],该设计中扫描探针与手术器械末端共面,从而在确保成像不被器械末端投影影响的同时,也能保证手术钳末端稳定出现在成像画面中,而不需要添加额外的定位装置。在后续试验中,研究人员使用该OCT 集成手术钳实现了对离体山羊眼视网膜成像(图6(d)),并剥离了10 μm 厚的人造视网膜。
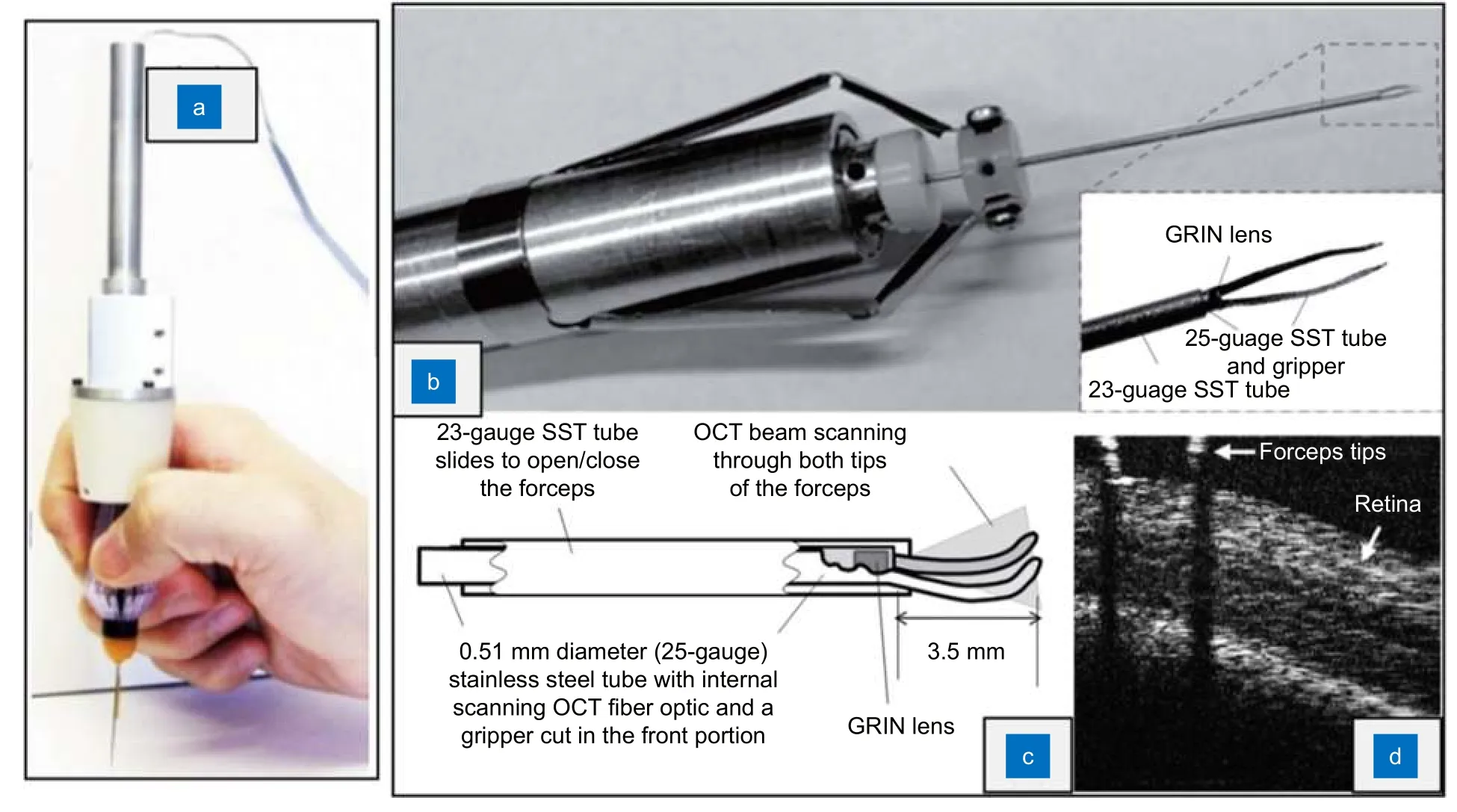
图6 集成OCT 的手术器械。(a) SMART 微型手术钳[58];(b,c) Yu 等设计的OCT 集成手术钳[61];(d) 使用OCT 集成手术钳接近离体山羊眼视网膜[61]Fig.6 OCT-integrated surgical instruments.(a) SMART micro forceps[58];(b,c) OCT-integrated micro forceps designed by Yu et al[61];(d) Approaching goat retinal using OCT-integrated micro forceps[61]
4 手术显微镜集成OCT
在眼科手术中进行术中成像时,手持OCT 具有如下局限性:外部HHOCT 探头在成像时需要放置在患者面部,因此需要移开手术显微镜和手术器械,进而中断手术;HHOCT 探针可以在进行手术时使用,但需要额外的切口来进入眼内,且一般需要一名助手来操作;集成在手术器械中的OCT 探针可由主刀医生手持且无需额外切口,但是光纤体积和扫描范围的限制导致其图像质量受限,因此只在需要观察特殊位置或结构的情况下适用。
术中OCT 成像的另一种方法是将OCT 样品臂集成到显微外科手术使用的手术显微镜中,这种手术显微镜集成OCT(microscope-integrated OCT,MIOCT)在使用时无需中断手术或增加操作人员,目前已被广泛地应用于眼科手术中。
4.1 MIOCT 光学设计
1998 年,Boppart 等设计了首个MIOCT 设备,其集成方式是在显微物镜后使用双色镜将OCT 光源整合到显微镜的光轴中[20,62],OCT 和显微镜系统不共用任何光学器件,因此两个光学系统相互独立,可以分别优化。然而,这种集成方式会缩短设备的工作距,导致手术操作空间被压缩。此外,术中成像显示在独立显示器上,医生在进行手术时不能看到[63]。此后的MIOCT 为了更好地用于手术,采用在显微镜物镜前整合的方式[21,64-65],此类设计的工作距更长,并且OCT 可以永久地集成到显微镜中。但由于OCT 系统和显微镜光路耦合,其性能通常会受到一些影响。
首个应用于人体的MIOCT 采用将OCT 整合到显微镜相机端口的设计(图7(a))[64,66-68]:在显微镜的光学变焦模块之前使用双色镜将OCT 光束折叠至显微镜的一个目镜中,在物镜前对光束进行放大后,获得的图像分辨率最高可达23 μm。该设计的一大优点是只需对显微镜进行最小程度的修改就可以得到MIOCT 设备,而不会改变原显微镜的高度和工作距。其缺点是OCT 和显微镜的光学变焦耦合后,显微镜放大倍数的改变会引起OCT 分辨率和视场的变化,而这会导致在某些放大倍数下OCT 的光学性能降低。

图7 研究阶段MIOCT 设备。(a) 在显微镜相机端口集成的MIOCT[64];(b,c) 显微镜物镜前集成的MIOCT[68]Fig.7 Research-grade MIOCT systems.(a) MIOCT scanner coupled onto the camera port of a microscope[64];(b,c) MIOCT integrated prior to the objective[68]
另一种MIOCT 通过放置于显微镜物镜前、光学变焦模块后的双色镜来集成OCT 和显微镜[21,68],这种集成方式下两种系统共用的光学元件最少,且OCT得以从显微镜的光学变焦中解耦,避免了其光学性能随显微镜放大倍数改变而变化。然而,在物镜前的空间中放置双色镜会增加显微镜的高度以及手术区域和显微镜之间的距离;并且为使OCT 分辨率达标,需要在物镜前增加额外光学设备以放大OCT 光束,而这会导致仪器末端体积增加。上述情况都可能对手术的人机工程产生负面影响。2014 年,Tao 等采用电动可调节透镜对这种集成方式进行了改良(图7(b),7(c))[68],电调透镜可提供45 mm~120 mm 的焦距调整,允许实时调节OCT 焦平面,以保证与显微镜视图同焦。近年来,将显微镜和OCT 在物镜前集成的设计方案已经被商业化的眼科手术导航设备采纳,例如蔡司RESCAN 700(图8(a))和徕卡EnFocus 等。在DISCOVER 研究中,RESCAN 700被用于一系列临床病例的术中成像(图8(b),8(c),8(d))[69-71],在包括眼前节和眼后节的一系列手术中实现了对角膜、巩膜、视网膜、黄斑等结构的观察,并提供了手术器械和对应结构的相对位置信息。
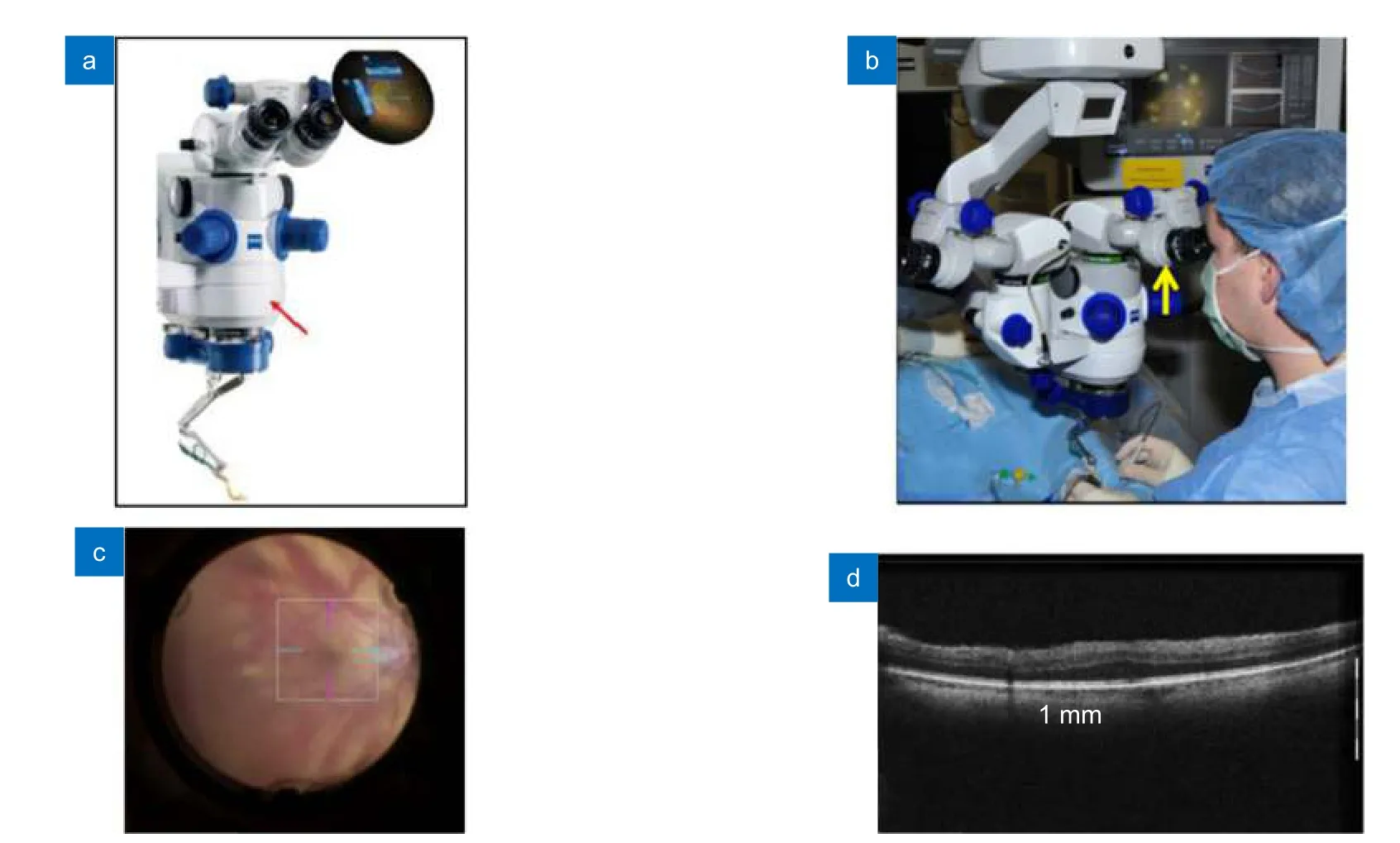
图8 商业化MIOCT:蔡司RESCAN 700。(a) RESCAN 700 机体[3];(b) 医生在手术中使用RESCAN 700[69];(c) RESCAN 700 光学显微镜眼底成像[68];(d) RESCAN 700 OCT 系统眼底成像[71]Fig.8 Commercialized MIOCT system: Zeiss RESCAN 700.(a) RESCAN 700 system[3];(b) Surgeon using RESCAN 700 during ocular surgeries[69];(c) Microscope imaging of the RESCAN 700 system[68];(d) OCT imaging of the RESCAN 700 system[71]
4.2 实时二维MIOCT
目前应用最为广泛的MIOCT 设备采用的傅里叶域OCT 技术为谱域OCT,其A 扫描频率一般在40 kHz 以下[21,66],仅能在手术暂停时实现短暂的密集采样,且不能实时呈现采集到的数据。因此,术中实时成像采用连续的高分辨率B 扫描,在商业化的MIOCT 设备中,一般采用单幅或正交扫描的方式(图9(a),9(b))[72-73],或者采用多个(一般为3~5 个)平行B 扫描来对目标区域成像(图9(c))[69]。实时二维(two-dimensional,2D)OCT 成像技术的出现,进一步提高了眼科手术的水平,使得眼底的精密手术成为可能。

图9 使用MIOCT 进行术中实时2D 成像。(a) 使用单个B 扫描对视网膜成像[71];(b) 使用正交B 扫描对角膜成像[73];(c) 使用5 束平行B 扫描对视网膜成像[69]Fig.9 Intrasurgical live 2D imaging with MIOCT.(a) Retinal imaging using single B-scan[71];(b) Corneal imaging using two orthogonal B-scans[73];(c) Retinal imaging using 5 parallel B-scans[69]
4.3 实时三维MIOCT
由于眼科手术视野本质上是三 维(threedimensional,3D)的,大多数手术操作并不只在单个横截面进行。当手术操作区域偏离成像平面时,实时2D 成像将不能提供完整的图像信息。随着图形处理器(graphics processing unit,GPU)的出现和发展,3D 和4D(体积随时间变化)OCT 技术成为可能。GPU拥有极高的运算速度,在OCT 激光器重复频率高达千赫兹时也能实时处理数据,并能进行实时体绘制来达到图像可视化。
2010 年,Probst 等设计了首个采用GPU 辅助的实时体成像的MIOCT 系统[67],实现了4D MIOCT 成像。约翰霍普金斯大学的Kang 等于2011 年开始报道了一系列4D OCT 的研究[74-75],采用双GPU 架构实现4D 成像,其中一个GPU 用于SD-OCT 的数据处理,另一个用于体积渲染和显示,通过频率为128 kHz 的A 扫描,得到了5 单位体积/秒的三维图像。研究者在该4D OCT 的术中引导下完成了人工视网膜手术、牛视网膜动脉血管分离术等模拟眼科手术。尽管4D OCT 技术在上述研究中展现出眼科手术可视化的潜力,但由于SD-OCT 系统成像速度和灵敏度的限制,这一阶段的4D OCT 设备难以应用到术中实时导航。
随着扫频光源技术和高速数字采集卡的发展,SS-OCT 的采集速度、成像深度、扫描范围等方面的性能都超过了SD-OCT。基于SD-OCT 的三维实时成像MIOCT 发展受限后,SS-OCT 开始被引入到MIOCT 中。
2015 年,Li 等使用SS-OCT 开发了一种MIOCT系统,并首次报道了对离体兔眼的青光眼手术引导结果[76]。该系统使用带1310 nm 的扫频光源的OCT,采用双GPU 架构来提高数据处理速度,可以实现实时体积渲染。2020 年,复旦大学以及中科院苏州生物医学工程技术研究所的研究人员基于Li 等研发的MIOCT 系统,以离体猪眼为对象,辅助眼科医生进行了眼科基本操作的成像实验[77]与青光眼手术导航试验(图10)[78],这些模拟实验的结果表明,SS-OCT集成手术显微镜可有效提高手术长度方向的精度以及深度方向的操作精度。同时,使用该系统定量化手术导航也能对医生起到训练效果,使其在传统手术显微镜下的操作精度也得到提升(图11)。
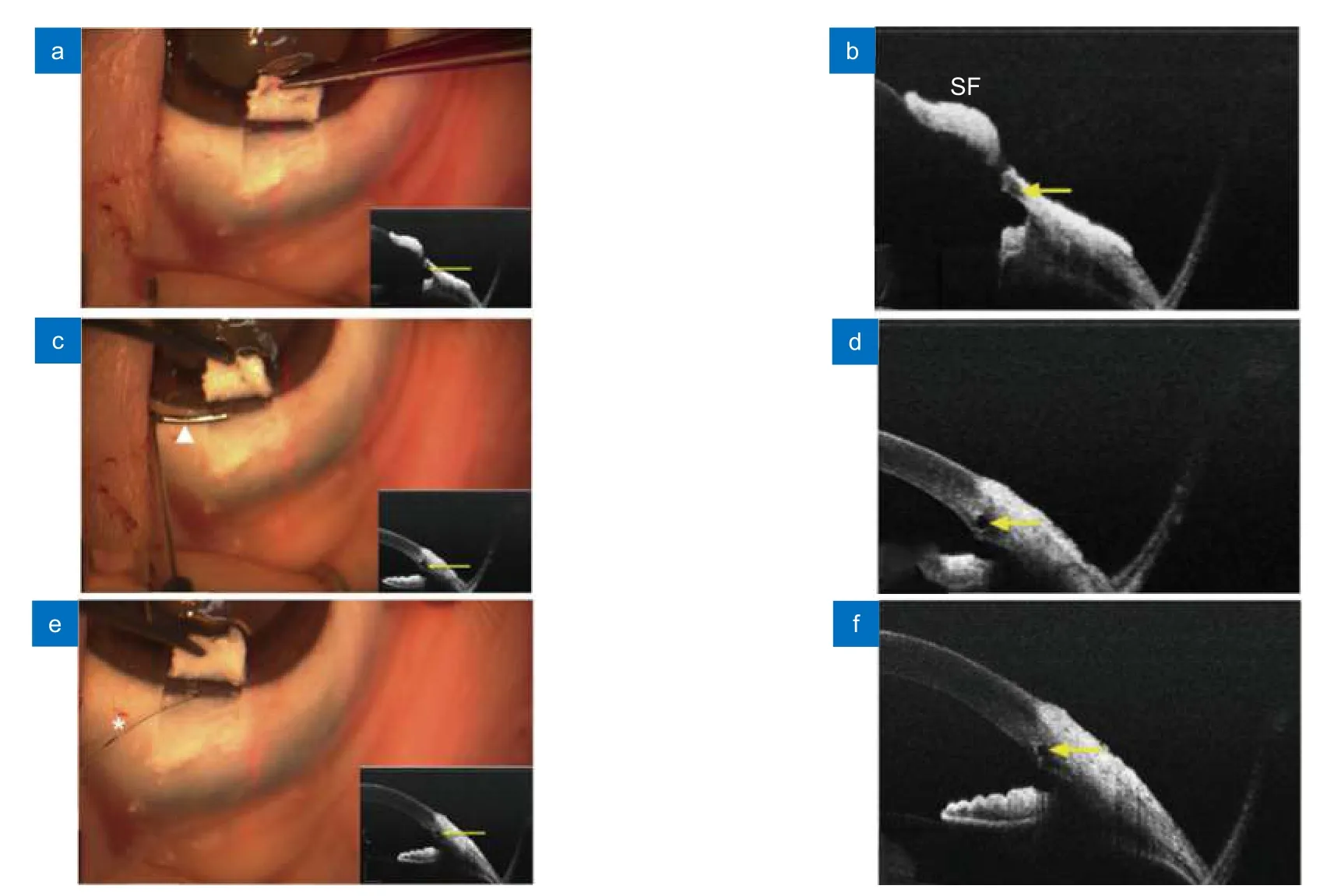
图10 使用基于扫频OCT 的MIOCT 对眼前节手术(泪道成形术)成像[78]。(a,b) 切开浅层巩膜瓣后的MIOCT 图像;(c,d) 插入小梁切刀后的MIOCT 图像;(e,f) 借助MIOCT 图像确认集束管扩张Fig.10 Real-time images of anterior segment surgery(canaloplasty) from the microscope-integrated swept-source optical coherence tomography (MIOCT) system[78].(a,b) MIOCT image after incision of a superficial scleral flap;(c,d) MIOCT image after insertion of a custom-made trabeculotomy;(e,f) Confirming expansion of the collector vessel using MIOCT image

图11 使用基于扫频OCT 的MIOCT 导航眼科手术操作的实验结果[77]。(a) 术中OCT 成像;(b) 术后OCT 切口分析;(c) 精度测试结果。Trial 1:使用(+)和未使用(-)MIOCT 的对比;Trial 2:经MIOCT 训练(+/-)和未经MIOCT 训练(-/-)后使用传统显微镜的手术精度对比(*代表统计学显著不同)Fig.11 Experimental results of ophthalmic surgeries navigated by swept-frequency OCT-based MIOCT.(a) Intraoperative OCT image;(b) Postoperative suture analysis using OCT;(c) Accuracy test results.Trial 1: comparison of the results with (+) and without (-) MIOCT;Trial 2: accuracy of traditional microscope guided surgeries with (+/-) and without (-/-) MIOCT training (* represents statistically significant difference)
2016 年,Carrasco-Zevallos 等使用SS-OCT 开发了用于眼科手术成像的4D MIOCT 系统[79-81],该系统使用1040 nm 的扫频光源,其A 扫描速率可以达到100 kHz,为普通术中SD-OCT 的3~5 倍。该4D MIOCT 系统实现了三维体积的实时可视化,并在后续研究中被用于视网膜下出血测量、视网膜下注射、玻璃体切除术中视网膜脱离等特殊场合下的导航(图12)[81-84]。
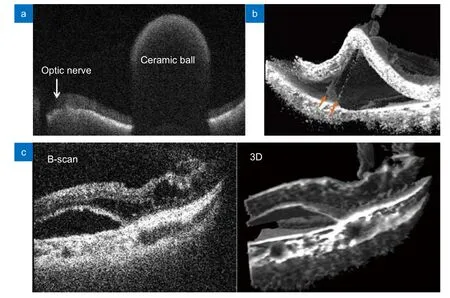
图12 4D MIOCT 实时成像。(a) 观测视网膜上的陶瓷球体[82];(b) 手术工具抓取视网膜色素上皮细胞层的实时图像[83];(c) 玻璃体切除术中视网膜下积液的二维和三维图像[84]Fig.12 4D MIOCT real-time imaging.(a) Observing a ceramic ball on the retina[82];(b) Real-time image of a surgical tool grasping the retinal pigment epithelial cell layer[83];(c) 2D and 3D images of subretinal fluid during vitrectomy[84]
4.4 平视显示和OCT 可视化
医生在进行眼科手术时,如果实时OCT 图像使用独立的显示器,则需要医生暂停手术才能看到OCT 图像,不能达到实时指导手术的效果。平视显示系统(Heads-up displays,HUD)可以将OCT 图像显示在手术显微镜的目镜上,从而实现术中OCT 的实时反馈。常见的使用HUD 的MIOCT 一般在目镜上显示实时2D OCT 图像[85-86]。4D MIOCT 技术日趋成熟后,出现了能够实时在目镜上显示三维图像的立体HUD(图13)[79],这种紧凑型的HUD 比一般的商用HUD 体积更小,并且在一定程度上提高了图像的对比度。目前,HUD 技术已经成为MIOCT 设备中至关重要的部分,研究表明,医生在进行手术时更倾向于使用HUD,而不是外部独立显示器[85]。
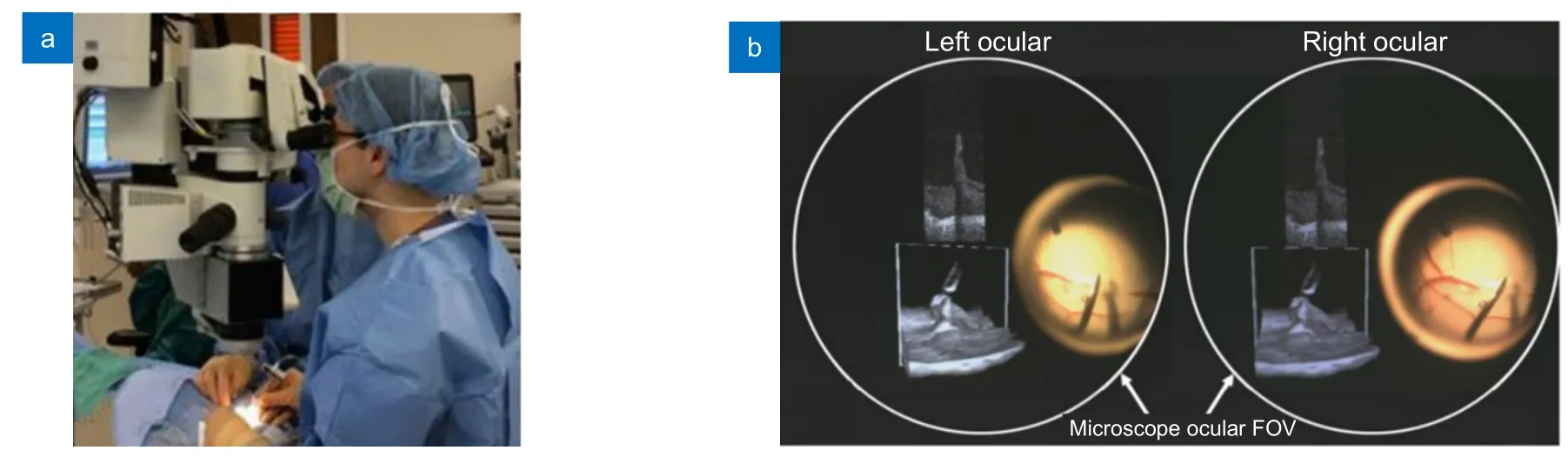
图13 可实现三维可视化的HUD 集成MIOCT[79]。(a) 医生在手术中使用带有HUD 的MIOCT 系统;(b) 左右目镜中的实时图像Fig.13 HUD-integrated MIOCT for 3D visualization[79].(a) HUD-integrated MIOCT in use during a surgery;(b) Real-time image displayed on both oculars
4.5 术中图像增强
近年来,术中实时三维成像成为了MIOCT 的发展趋势,目前的图像处理算法已基本满足3D 可视化的采集速度和渲染速度,然而,三维OCT 图像仍然存在结构表面模糊、边缘清晰度差以及手术器械难以识别等问题[84]。提高目标组织与器械在图像中的对比度,是解决上述问题的关键。
Carrasco-Zevallos 等于2016 年提出了体积增强渲染算法[81],并使用其对1040 nm 扫频光源的MIOCT三维图像进行了优化。该算法在传统图像处理的基础上,引入了体积过滤、边缘加强、特征增强、基于深度的阴影上色以及Phong 光照模型,在利用GPU 进行采集和图像处理的基础上,使用逐步增强的体积渲染方式,对猪眼的视网膜血管、黄斑内缘膜等结构进行了三维成像(图14)。该算法被证明能够改善术中MIOCT 三维图像,随着GPU 硬件的处理速度上升,未来将有可能实现高分辨率和对比度的术中实时三维成像。
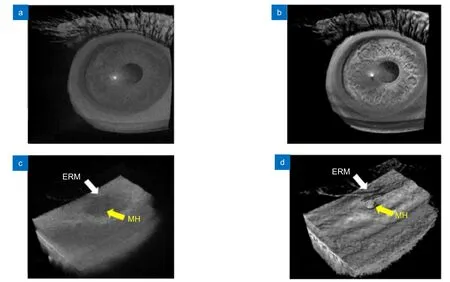
图14 使用体积增强渲染算法处理MIOCT 图像[81]。(a) 渲染前的人眼MIOCT 图像;(b) 增强渲染后的人眼MIOCT 图像;(c) 原始视网膜(Epiretinal membrane,ERM)及黄斑孔(macular hole,MH)MIOCT 图像;(d) 增强渲染后的视网膜及黄斑孔MIOCT 图像Fig.14 MIOCT images with enhanced volume rendering[81].(a) Original MIOCT image of human eye;(b) Enhanced MIOCT image of human eye;(c) Original MIOCT image of an epiretinal membrane (ERM) and a macular hole (MH);(d) Enhanced MIOCT image of an epiretinal membrane (ERM) and a macular hole (MH)
另一种提高对比度的方法是基于深度以及强度信号在体积绘制过程中进行伪彩着色。该方法由美国杜克大学的Bleicher 等于2018 年提出[87]。该研究使用带有1060 nm 扫频光源的MIOCT 系统,在进行体积渲染的过程中,对沿着B 扫描轴向的给定位置分配独特的颜色,并在每两个位置之间用插值法分配颜色梯度,从而对三维图像进行着色(图15)。在术中成像测试中,该着色方法被证明提高了区分视网膜、正确识别仪器与膜的接触以及识别视网膜变形的能力,能在一定程度上改善手术的效率和准确性。
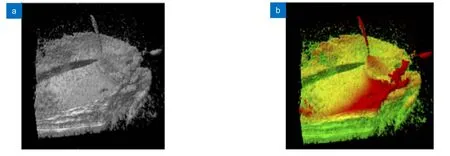
图15 视网膜剥离术中的MIOCT 图像及其着色[87]。(a) 术中MIOCT 图像;(b) 着色后的MIOCT 图像Fig.15 Original and colorized MIOCT images of retinal membrane peeling[87].(a) Intraoperative MIOCT image;(b) Colorized MIOCT image
5 总结与展望
OCT 技术能够提供具有深度信息的术中成像,其成像速度快、分辨率高以及非侵入性的特点十分适用于眼科手术的术中导航。自20 世纪90 年代问世以来,OCT 技术经过了时域OCT、傅里叶域OCT 的技术迭代,在临床眼科学领域发展出了手持OCT、集成显微镜OCT 等用于术中导航的设备。在各种动物眼、人眼模型以及人体临床实验中,OCT 在眼科手术术中导航的重要作用得到了验证,商业化的OCT手术导航设备也在眼科临床手术中得到了广泛应用。目前OCT 眼科手术导航设备仍存在该技术在未来的发展方向有:
1) 结合手术机器人。随着医学机器人的发展,机器人辅助手术开始成为眼科手术的研究趋势。OCT集成手术器械可以移植到手术机器人中,作为机器人的末端执行器,有利于判断器械末端和目标组织的相对位置。在集成OCT 的手术机器人中,如何提高OCT 机械扫描的稳定性、确保光路和手术设备的高精度配合将成为研究的难点。
2) 图像渲染算法。随着数据采集和图像处理技术的发展,术中实时三维成像是未来OCT 手术导航的发展趋势,而目前的实时三维OCT 成像仍存在对比度不足的问题。采用更高效的算法对图像进行实时渲染增强,提高目标组织、手术器械以及结构边缘轮廓的可识别度是未来OCT 手术导航技术的研究重点之一。
3) 高分辨率血管成像。由于眼球运动以及眼球曲率的变化,OCT 尚不能对血管系统进行高质量成像,该问题在血液流速较慢的眼前段尤为明显[88]。如何改善扫描方式,并通过更先进的图像处理算法实现高分辨率的实时血管成像,是眼科OCT 亟待解决的问题之一。
4) 人工智能。将人工智能引入医疗仪器是近年的研究热点,在完善的数据库基础上,通过深度学习算法实现目标结构自动识别,并在术中成像时提供实时反馈,可以有效地提高手术效率和成功率,并且促进手术的智能化。
随着图像处理技术、图像和眼科医学的进步,在不久的将来,OCT 手术导航设备将会进一步推动眼科医学手术的创新,从而促进整个人类眼科领域的发展。
