细菌介导水铁矿合成铁硫矿物去除水体铬污染
2023-02-22倪海燕龙中儿黄运红
邹 龙,朱 菲,唐 洁,朱 祺,倪海燕,龙中儿,黄运红
细菌介导水铁矿合成铁硫矿物去除水体铬污染
邹 龙,朱 菲,唐 洁,朱 祺,倪海燕,龙中儿,黄运红*
(江西师范大学生命科学学院,南昌市鄱阳湖湿地微生物资源开发与利用重点实验室,江西 南昌 330022)
为了去除水体中六价铬(Cr(VI)),利用MR-1在硫代硫酸盐存在情况下驱动水铁矿转化为铁硫次生矿物制备微生物/矿物杂化体,探究了杂化体对水体中Cr(VI)去除效果,影响因素及去除机理.物相组成分析和显微形貌观察发现,细菌转化合成的黑色方硫铁矿(FeS)次生矿物纳米颗粒包裹MR-1细胞从而组装形成了Bio-FeS@MR-1杂化体.所制备的杂化体4h内完全去除了初始浓度26mg/L的Cr(VI),其效率显著高于单独的等量菌体和FeS次生矿物总和,表明菌体与FeS次生矿物之间存在协同增强效应.Bio-FeS@MR-1杂化体具有较宽的pH值适用范围(3.0~9.0)和较好的再生能力,其去除Cr(VI)的效率和重复使用次数均与FeS次生矿物含量和菌体密度成正相关.去除产物中铬主要以Cr(III)沉淀物(如Cr2O3和Cr(OH)3)形式存在,表明水体中Cr(VI)的去除方式包括吸附和还原作用.
希瓦氏菌;水铁矿;硫化亚铁;矿物生物转化;铬;重金属
伴随工农业和城镇化的快速发展,重金属污染问题日益突出,其中铬(Cr)是我国重点防控的重金属污染物之一[1].铬及其化合物被广泛应用于印染、皮革、电镀、油漆、化工等工业[2-4],由于技术不完善、管理不规范等原因致使含铬废物排放,造成水体、土壤等环境受到不同程度污染.铬具有多种不同的化学价态(-2~+6),其中Cr(VI)和Cr(III)是水体等自然环境中两种常见的稳定价态,它们表现出不同的理化性质和生物毒性.Cr(VI)在水环境中具有更高的溶解度和迁移性,其生物毒性比Cr(III)高出2个数量级,被国际癌症研究机构列为I类致癌物[5-6].因此,将Cr(VI)转化为低溶解度、低毒性的Cr(III)或者将其吸附去除是环境中铬污染的常用处理策略.
微生物是铬污染去除的重要生物材料,不仅具有高的生物吸附能力,而且能够通过能量代谢将Cr(VI)还原为Cr(III)[7-10].希瓦氏菌属菌(spp.)因其广泛的生态分布和独特的胞外电子传递机制,是研究Cr(VI)生物吸附和还原的模式微生物之一,对Cr(VI)具有强的胞内、胞外还原能力[11-15].硫化亚铁(FeS)具有强还原性和吸附性,常被用作铬等重金属的吸附剂和还原剂[16].天然FeS矿物[17]和化学合成的FeS颗粒材料[18]分别被研究证明能够有效去除废水和土壤中Cr(VI),去除率可达到近100%.相比于化学合成方法,微生物合成纳米FeS具有诸多优点,包括生物分子(如多糖、蛋白质)的包覆提高纳米颗粒的稳定性、合成过程的可调控提高产物特性、微生物/无机纳米颗粒杂化体系的自组装提高应用效果等[19].异化铁还原菌(MR-1)[20]和硫酸盐还原菌(SRB)[21]先后被用于生物合成纳米FeS,通过调节底物浓度实现了FeS颗粒尺寸的可控,并可组装成FeS/菌体杂化体系强化Cr(VI)还原效果.以上研究证明微生物合成FeS在去除水体Cr(VI)方面已崭露头角,但是其去除效率和重复使用能力仍有待提升.
地表环境中广泛存在的铁(氢)氧化物,是包含重金属在内的各种污染物的天然“吸附剂”,显著影响其环境命运[22].弱结晶的水铁矿具有极大的比表面积和高表面活性,通过吸附和共沉淀与地表水中污染物相互作用,成为后者的重要赋存介质[23-24].在自然条件下,水铁矿会向结晶度高的其它铁(氢)氧化物转化[25],从而影响重金属离子的迁移性.微生物是驱动自然环境中铁(氢)氧化物转化的关键因素[26],比如异化铁还原菌还原性溶解铁(氢)氧化物会增加重金属离子的释放[27-28].因此,通过微生物介导铁(氢)氧化物转化为对Cr(VI)具有更高还原能力的铁硫次生矿物[29],从而实现对水体中铬污染物的高效去除理论上是可行的,但是相关研究鲜见报道.本文以典型异化铁还原菌MR-1和水铁矿为研究对象,在硫代硫酸盐存在条件下,通过利用MR-1的铁、硫异化还原途径介导水铁矿转化形成FeS次生矿物,进而原位组建Bio- FeS@MR-1杂化体,探究其对水体中Cr(VI)还原去除性能及机制,以期为水体中重金属铬污染防治技术提供可行的理论基础和依据.
1 材料与方法
1.1 实验菌株、试剂与仪器装置
实验所用菌株:MR-1(ATCC 70050)及不同色素蛋白基因缺失株(D,D/),均由本实验室保存.
主要试剂:乳酸钠购自默克Sigma-Aldrich(上海);无水醋酸钠、冰醋酸购自广东汕头市西陇科学股份有限公司;其余化学试剂均购自上海阿拉丁生化科技股份有限公司;所有化学试剂均为分析纯以上;溶液均用去离子水配制.
主要仪器装置:紫外-可见光分光光度计(UV 2600,日本岛津),扫描电子显微镜(SEM,JSM-7800F,日本电子),X射线衍射仪(XRD-7000,日本岛津),X射线光电子能谱仪(XPS,AXIS Supra,日本岛津).
1.2 细菌培养与收集
MR-1野生型菌株或基因缺失株(D,D),接种在LB肉汤培养基中进行好氧培养(30℃,200r/min),培养物吸光度(OD600nm)达到1.0~1.5后离心收集菌体细胞,经灭菌的M9缓冲液(Na2HPO4,6g/L; KH2PO4,3g/L; NaCl,0.5g/L; NH4Cl,1g/L; MgSO4,1mmol/L; CaCl2,0.1mmol/L, pH7.0)离心洗涤2次后,重悬于添加有20mmol/L乳酸钠(电子供体)的M9缓冲液中备用,菌悬液OD600nm=0.5.
1.3 FeS次生矿物的原位合成
采用1mmol/L NaOH中和0.4mmol/LFeCl3·6H2O的方法合成水铁矿[30];将1mL所合成水铁矿加入等量体积的6mmol/L盐酸溶液酸化溶解,用0.22μm滤膜过滤,取0.1mL滤液加入至10倍体积的100g/L盐酸羟胺溶液还原后,采用邻菲啰啉分光光度法[31-32]测定Fe(II)浓度,即等量为水铁矿中Fe(III)浓度.
利用MR-1的铁、硫异化还原途径原位合成FeS次生矿物:在装有100mL菌悬液(OD600nm=0.5)的玻璃厌氧瓶(约110mL)中,加入适量水铁矿悬液至Fe(III)终浓度为0.5,1.0,2.5, 5.0mmol/L,再分别加入终浓度为1.0,2.0,5.0, 10.0mmol/L的Na2S2O3,高纯氮气鼓泡30min排尽溶解氧,用丁基橡胶瓶塞密封,置于30oC 200r/min恒温摇床中振荡培养12h,离心收集黑色产物,即为原位生物合成的FeS次生矿物与MR-1杂化体(根据水铁矿浓度不同依次记为Bio-FeS- 0.5@MR-1、Bio-FeS-1.0@MR-1、Bio-FeS-2.5@ MR-1、Bio-FeS-5.0@MR-1).产物离心收集操作在厌氧培养箱中进行,避免FeS次生矿物在空气中氧化.所获得的Bio-FeS@MR-1产物直接用于后续Cr(VI)还原去除实验,或者真空密封短暂保存于4℃备用.另外,Bio-FeS@MR-1产物经真空冷冻干燥后用于理化表征鉴定,或作为杂化死菌的FeS次生矿物(即Abio-FeS-0.5、Abio-FeS-1.0、Abio-FeS-2.5、Abio-FeS-5.0)用于对照实验.
1.4 Cr(VI)还原去除体系
将1.3中所获得的Bio-FeS@MR-1、Abio-FeS或等量细胞密度的MR-1菌体加入不同Cr(VI)浓度(5.2,13,26,39,52mg/L)的K2Cr2O7溶液(溶解于添加或者不添加20mmol/L乳酸钠的M9缓冲液,装于110mL血清瓶)中,高纯氮气鼓泡30min排尽溶解氧,用丁基橡胶瓶塞密封,置于30℃ 200r/min恒温摇床中振荡反应.在厌氧培养箱中,用5mL无菌注射器于不同时间点取样,离心收集上清液,经0.22μm水系微孔滤膜去除杂质后用于溶液相中Cr(VI)的定量测定.
1.5 分析方法
SEM、XRD、XPS表征测试方法及条件参考文献[33-34].
采用二苯碳酰二肼分光光度法(GB 7467-87)测定溶液相中Cr(VI)的浓度.每个处理组重复3次,计算平均值.
溶液相Cr(VI)残留率()的计算根据公式(1):
(%)=C/o´100%(1)
式中:o为溶液相初始Cr(VI)浓度,mg/L;C为溶液相时刻Cr(VI)浓度,mg/L.
2 结果与讨论
2.1 FeS次生矿物的原位合成与表征

图1 Bio-FeS@MR-1的颜色、XRD、SEM、EDS表征
在添加Na2S2O3情况下,MR-1可将砖红色的水铁矿转化为黑色的次生矿物,如图1(a)所示.对比水铁矿及其转化产物的XRD图谱(图1(b))可知,所形成次生矿物中出现了明显的四方硫铁矿(PDF #15–0037)特征衍射峰(星号标记),表明FeS次生矿物成功合成[35].其原因是MR-1多样化的厌氧呼吸特性,一方面具有高效的异化铁还原途径(如Mtr直接途径和核黄素介导的间接途径)[36],可将水铁矿中Fe(III)还原为Fe(II);另一方面还具有硫代硫酸盐歧化和亚硫酸盐还原途径[37-38],将Na2S2O3还原为S(-II).由于微生物转化过程的复杂性以及反应缓冲液含有多种矿物盐,水铁矿生物转化产物中还可能存在其他次生矿物.对水铁矿生物产物进行SEM表征(图1(c)~(d)),发现其为FeS次生矿物与MR-1细胞的杂化体(即Bio-FeS@MR-1),同时MR-1细胞表面被纳米颗粒状的FeS次生矿物形成的鞘包裹.由X射线能谱(EDS)结果(图1(e))可知,Bio-FeS@MR-1杂化体富含C、O、Fe、S等元素,其中Fe和S元素物质的量比约为1.6:1,与反应液中Fe(III)与S2O32-的物质的量投料比(1:2)存在差异,推测主要原因是生物形成的S(-II)由于位阻效应未能与矿物内部的Fe(III)或Fe(II)反应,而是以气体H2S释放.
2.2 S. oneidensis MR-1还原去除Cr(VI)的行为
添加不同浓度Cr(VI)对MR-1好氧生长的影响如图2(a)所示,结果表明在LB肉汤培养基中添加K2Cr2O7对菌株的生长产生抑制,抑制程度与Cr(VI)添加量成正相关.厌氧条件下,在添加有20mmol/L乳酸钠的M9缓冲液中,考察了不同菌体浓度对52mg/L Cr(VI)的去除效果,结果如图2(b)所示,发现Cr(VI)的去除率与MR-1菌体浓度成正相关.当OD600nm值达到1.5时,3h内基本能够将52mg/L Cr(VI)完全从水相中去除,表明MR-1细胞具有较明显的Cr(VI)去除能力,实验结果与杜艳影等[14]的研究结果相符.
微生物对水体中Cr(VI)的去除有生物吸附、胞内和胞外生物还原等多种方式,MR-1是典型的具有胞外电子传递途径的异化金属还原菌,因此有必要分析其胞外电子传递途径(特别是Mtr途径)在Cr(VI)去除中的作用.MR-1野生株、内膜色素蛋白CymA基因缺失株()、外膜色素蛋白OmcA和MtrC基因共缺失株()在有无电子供体(乳酸钠)存在情况下,对52mg/L Cr(VI)的去除率结果如图2(c)所示.在不添加电子供体情况下,相同菌体浓度(OD600nm=1.5)的野生株与突变株的去除率均在1h后基本达到平衡,均约为25%,主要是由于菌体细胞吸附所致.在添加电子供体情况下,野生株和缺失株的去除率在1h内分别达到83%和73%,在3h内均基本能完全去除;但是D缺失株的去除率在1h内仅为50%,3h内约为70%.结果表明,除了菌体细胞生物吸附作用外,MR-1对水体中Cr(VI)的去除还包括细胞内、周质空间内及细胞外的生物还原作用,这与MR-1独特的胞外电子传递特性密切相关[19,36].
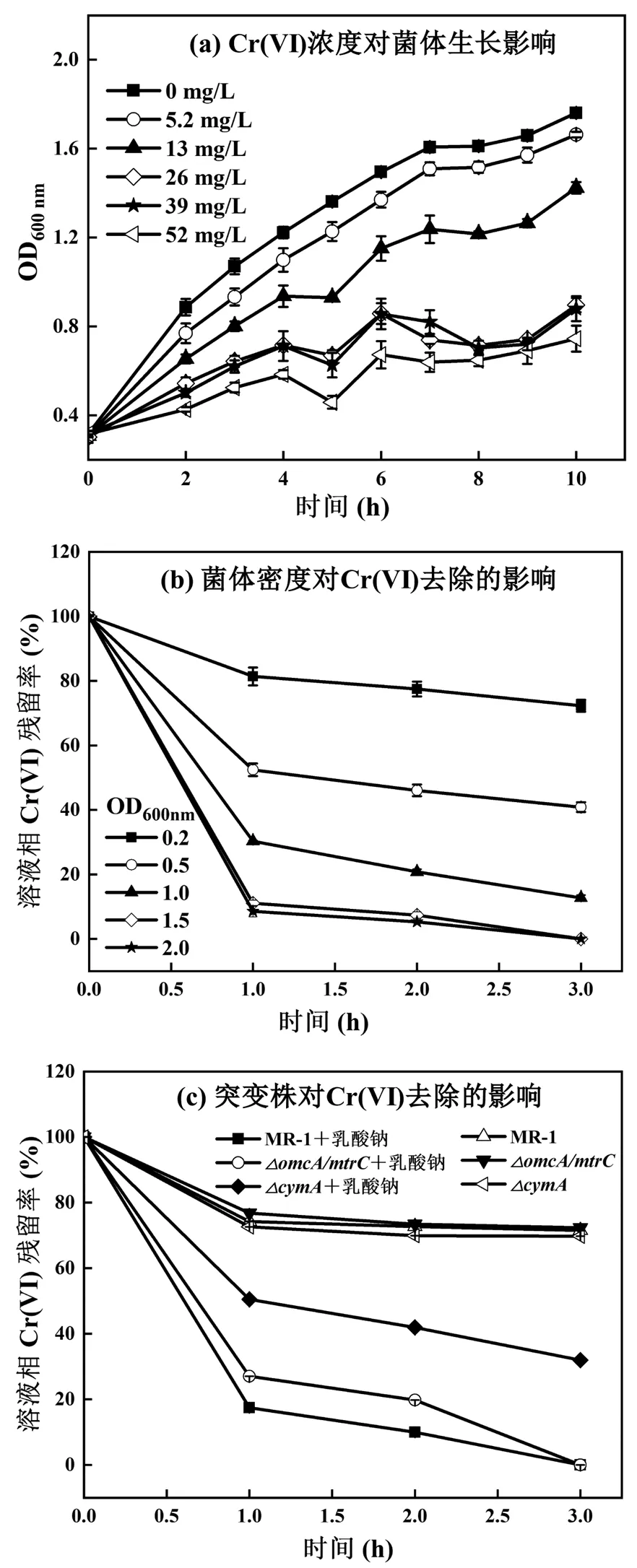
图2 Cr(VI)浓度对S. oneidensis MR-1菌体生长及菌体浓度、细胞色素蛋白对Cr(VI)去除效果的影响
2.3 Bio-FeS@MR-1杂化体去除Cr(VI)的效果
在添加20mmol/L电子供体的除氧M9缓冲液中,对比分析了活菌杂化体Bio-FeS-2.5@MR-1、死菌杂化体Abio-FeS-2.5和单独的MR-1菌体(OD600nm=0.5)对初始浓度26mg/L Cr(VI)的去除效果,结果如图3(a)所示.MR-1菌体和Abio-FeS-2.5加入Cr(VI)溶液中20min后,溶液相中Cr(VI)残留率基本达到平衡,分别为76%和73%.然而,Bio-FeS-2.5@MR-1加入20min后Cr(VI)残留率仅为24%,表明其去除率(76%)显著高于MR-1菌体和Abio-FeS-2.5两者之和;且随着反应时间延长,溶液相中Cr(VI)浓度持续降低,4h后可完全去除.分析了三者对不同初始浓度(5.2,13,26,52mg/L) Cr(VI)的去除能力(图3(b)~ (d)),Bio-FeS-2.5@MR-1能够将初始浓度低于26mg/L的Cr(VI)完全去除,初始浓度为52mg/L的Cr(VI)在4h内可去除39.6mg/L;但是MR-1菌体和Abio-FeS-2.5在4h内只能分别将初始浓度13mg/L和5.2mg/L的Cr(VI)完全去除.因此可推测,Bio-FeS-2.5@MR-1杂化体在去除水体中Cr(VI)过程中,原位合成的FeS次生矿物与MR-1两组分之间存在协同增强作用.另外,所制备的Bio-FeS-2.5@MR-1杂化体对Cr(VI)的去除能力明显高于报道的Nano-FeS@SRB杂化体[21].
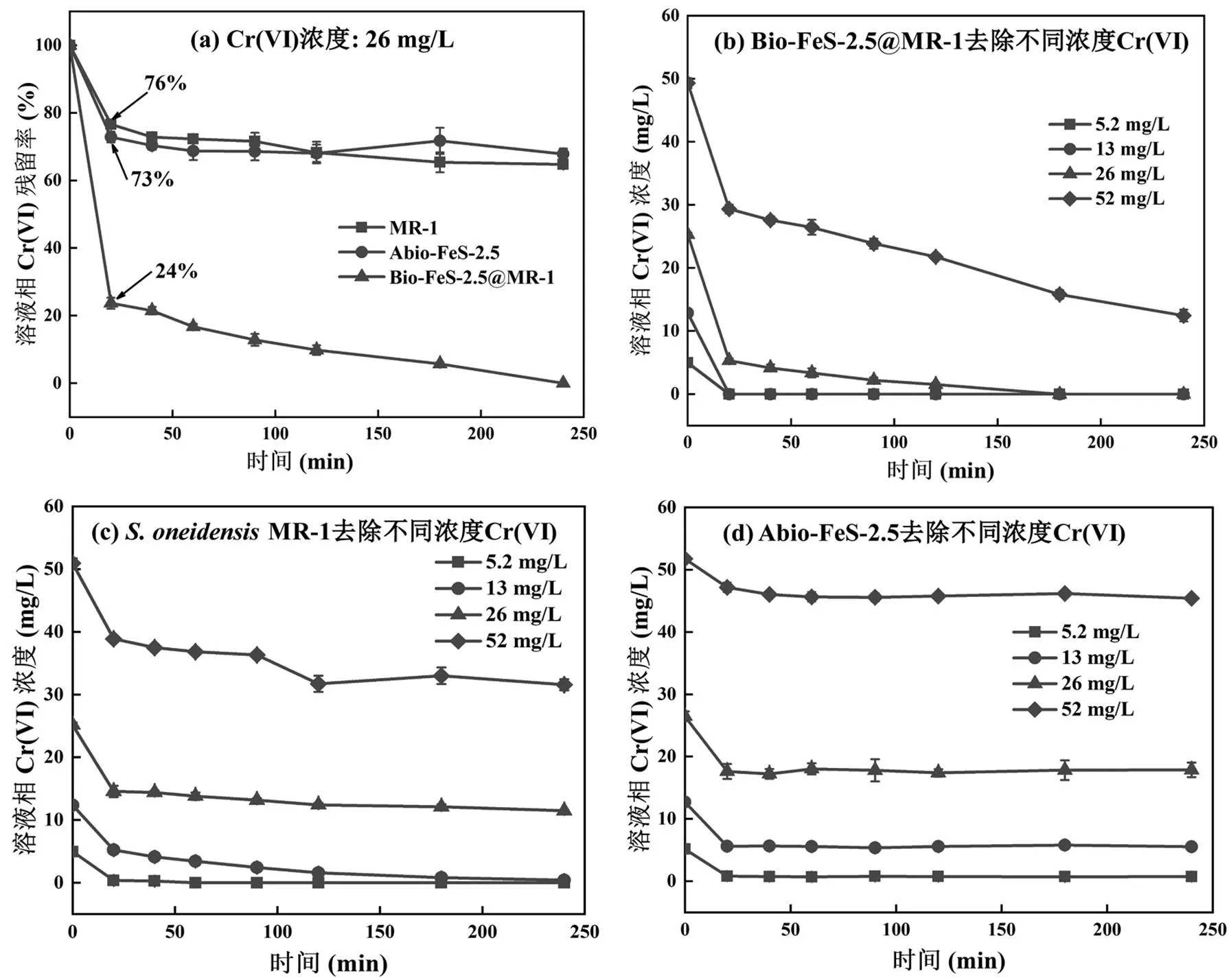
图3 S. oneidensis MR-1、Bio-FeS-2.5@MR-1和Abio-FeS-2.5去除Cr(VI)能力的比较
2.4 初始pH值对Bio-FeS@MR-1去除效率影响
在不同初始pH值(3.0,5.0,7.0,9.0,11.0)的反应液中,Bio-FeS-2.5@MR-1对26mg/L Cr(VI)的去除曲线如图4所示.总体而言,在pH值3.0~9.0范围内均表现出较好的去除效果,在酸性和中性反应液中的去除率高于碱性缓冲液中.在反应时间20min时,去除率依次为pH值3.0>7.0>5.0>9.0>>11.0;在反应时间4h时,去除率依次为pH值7.0>3.0≈5.0>9.0>> 11.0.主要原因是:一方面,FeS次生矿物在酸性条件下易溶解释放出还原性Fe(II)和S(-II)用于快速还原Cr(VI),FeS的溶解度随着pH值的升高而降低;且当溶液pH值超过FeS等电点(≈7.5)[21,39]时,FeS与Cr(VI)的含氧阴离子(在碱性条件下形成更不易被还原的Cr2O72-)之间存在静电排斥作用,不利于其对Cr(VI)的吸附,从而降低了Cr(VI)的还原去除率[40-41].另一方面,pH值影响MR-1菌体的细胞代谢活力和相关还原酶(包括Cr(VI)还原酶[14]和Fe(II)、S(-II)再生还原酶[35])活性,中性pH值对其更为有利,尽管在反应时间20min时,pH值7.0反应液中的Cr(VI)去除率略低于pH值3.0,但随着反应时间的延长前者增加更快进而明显超过后者.因此,实验结果表明中性pH值条件更有利于Bio-FeS- 2.5@MR-1杂化体对水体中Cr(VI)的高效去除,而且再次证实了原位合成的FeS次生矿物与MR-1之间的协同效应.
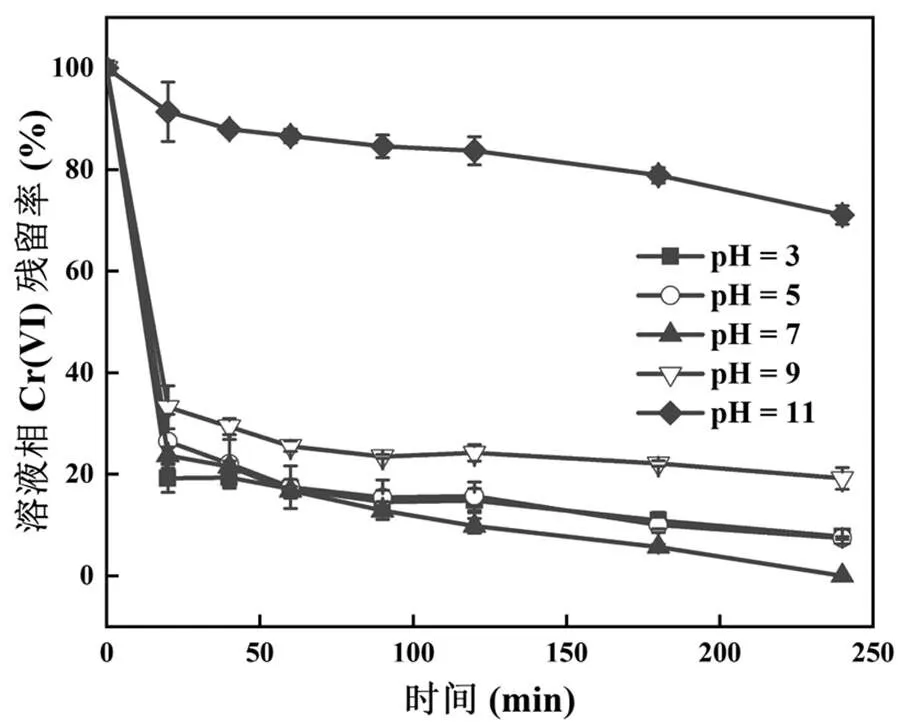
图4 初始pH值对Bio-FeS-2.5@MR-1去除Cr(VI)的影响
2.5 投料量对Bio-FeS@MR-1去除效率的影响
FeS次生矿物可能是Bio-FeS@MR-1杂化体还原去除Cr(VI)过程中的吸附和还原位点,因此有必要分析杂化体中FeS投料量对Cr(VI)去除的影响.在相同MR-1菌体浓度(OD600nm=0.5)下,通过添加不同浓度水铁矿(0.5,1,2.5,5mmol/L)和等比浓度Na2S2O3(1,2,5,10mmol/L),合成了不同FeS含量的活菌杂化体Bio-FeS@MR-1及相应的死菌杂化体Abio-FeS,考察了其去除水体26mg/L Cr(VI)的能力,结果如图5所示.所有Abio-FeS在反应时间20min后均基本达到平衡,溶液相中Cr(VI)残留率不再明显降低,Cr(VI)的去除能力依次为Abio-FeS- 5.0>Abio-FeS-2.5>Abio-FeS-1.0>Abio-FeS-0.5,即与FeS次生矿物投料量成正相关.Bio-FeS@MR-1对Cr(VI)的去除能力也与FeS次生矿物投料量成明显正相关.相同FeS次生矿物含量下,Bio- FeS@MR-1对Cr(VI)的去除能力显著高于相应的Abio-FeS,且前者溶液相中Cr(VI)的残留率在实验时间(4h)内表现出持续降低的现象,主要原因是活的MR-1细胞可以厌氧氧化电子供体(乳酸钠)持续产生电子输送至胞外用于FeS的再生和Cr(VI)还原,从而实现了协同增强效应.
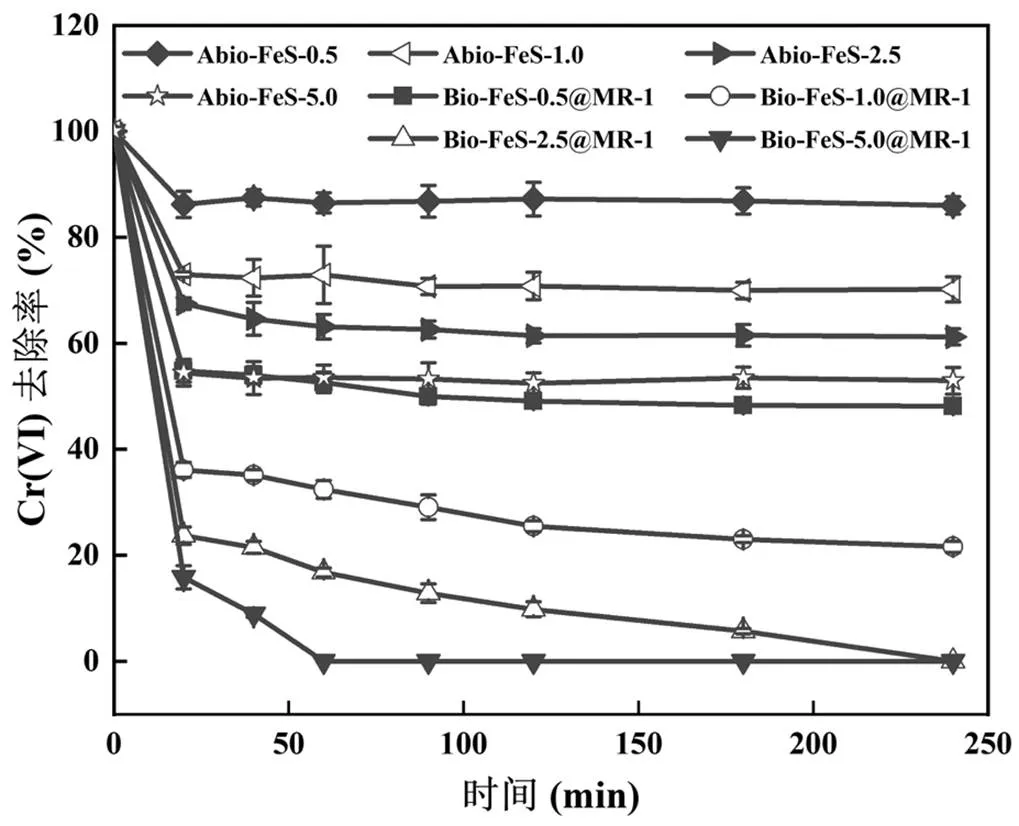
图5 FeS次生矿物量对Bio-FeS@MR-1去除Cr(VI)的影响
2.6 Bio-FeS@MR-1去除Cr(VI)的使用重复性
Bio-FeS@MR-1去除Cr(VI)实验过程中发现(图6(a)),将黑色的Bio-FeS@MR-1杂化体加入装有橙黄色K2Cr2O7溶液的厌氧血清瓶后, Bio- FeS@MR-1杂化体会发生明显的褪色,可能原因是黑色的FeS次生矿物被Cr(VI)氧化所致.但是随着反应时间的延长,反应溶液在12h内又会完全恢复至黑色,推测是由于黑色的FeS次生矿物的再生所致.对反应12h后的产物进行XRD分析,结果(图1(b))表明产物XRD图谱与反应前的Bio- FeS@MR-1一致,具有明显的四方硫铁矿特征衍射峰,进一步证明了杂化体中FeS次生矿物的再生.由于Cr(VI)还原去除的反应体系添加有MR-1可利用的电子供体(乳酸钠),MR-1细胞能厌氧氧化电子供体持续产生胞内电子,并将其传递至周质空间或胞外用于异化还原被Cr(VI)氧化的铁、硫元素,从而再生形成Bio- FeS@MR-1杂化体[35].
进一步研究了Bio-FeS@MR-1杂化体的再生特性是否能够赋予其反复用于Cr(VI)还原去除的能力.当反应12h后溶液相中Cr(VI)几乎为零时,再次向反应液中添加26mg/L Cr(VI)进行反应(分别于5min和12h后取样测定溶液相中Cr(VI)浓度),以考察不同Bio-FeS@MR-1杂化体重复去除溶液相中Cr(VI)的能力(图6(b)).Bio-FeS-2.5@MR-1、Bio-FeS- 1.0@MR-1和Bio-FeS-0.5@MR-1在第一轮反应12h后均可完全去除溶液相中Cr(VI),但是在第二轮反应中去除Cr(VI)的能力依次降低,仅Bio-FeS- 2.5@MR-1可完全去除.此外,Bio-FeS- 2.5@MR-1在第三轮反应中可去除溶液相中50%以上的Cr(VI).结果表明,Bio-FeS@MR-1杂化体重复去除溶液相中Cr(VI)的能力与FeS次生矿物的含量有关.分析其可能原因是当含量较低时,尽管FeS次生矿物能够再生,但是其反应活性位点被还原后的Cr(III)吸附占据而无法再次有效吸附去除溶液相中Cr(VI).
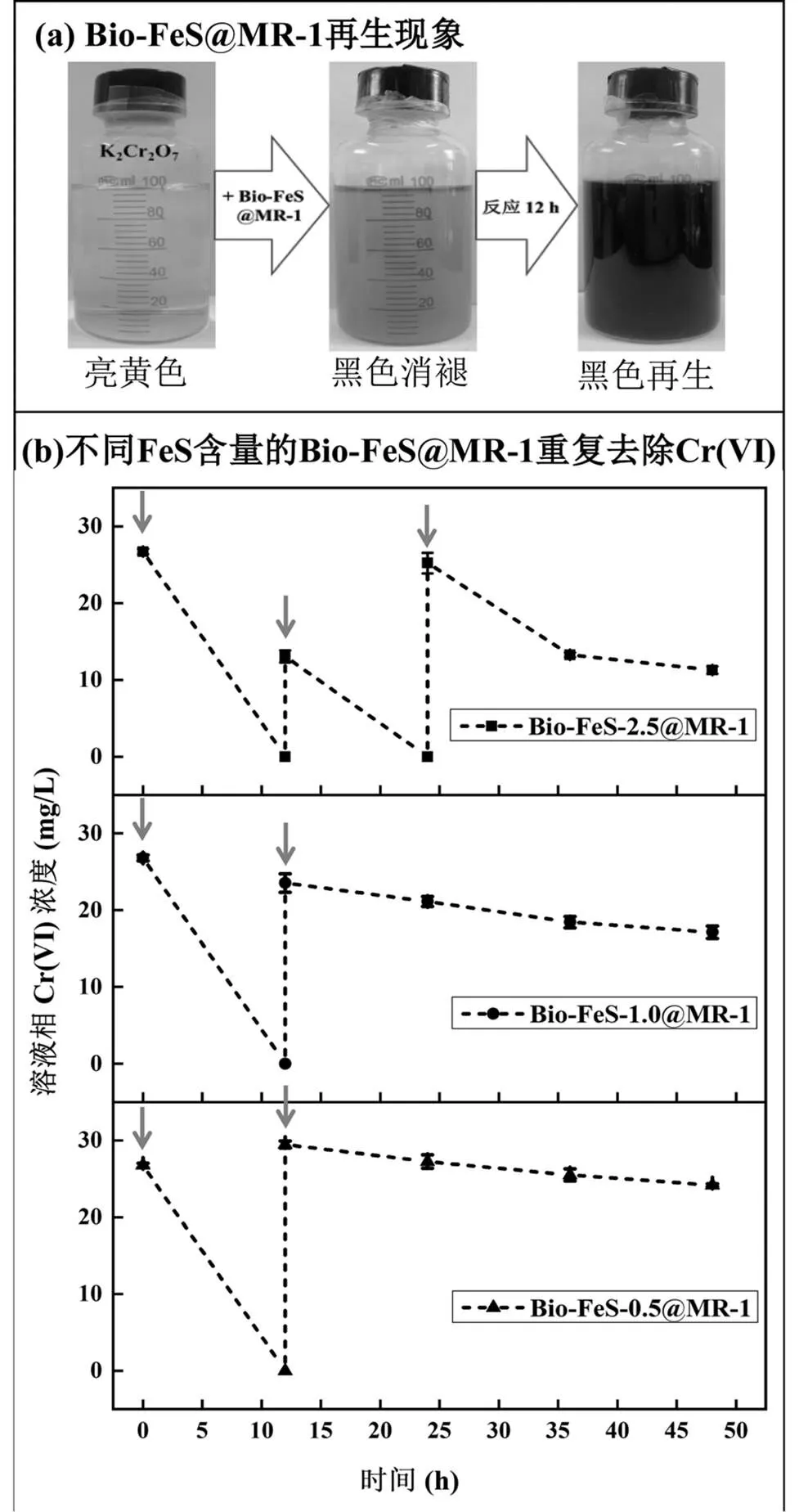
图6 Bio-FeS@MR-1再生现象及其重复去除Cr(VI)的能力
灰色箭头表示添加26mg/L Cr(VI)
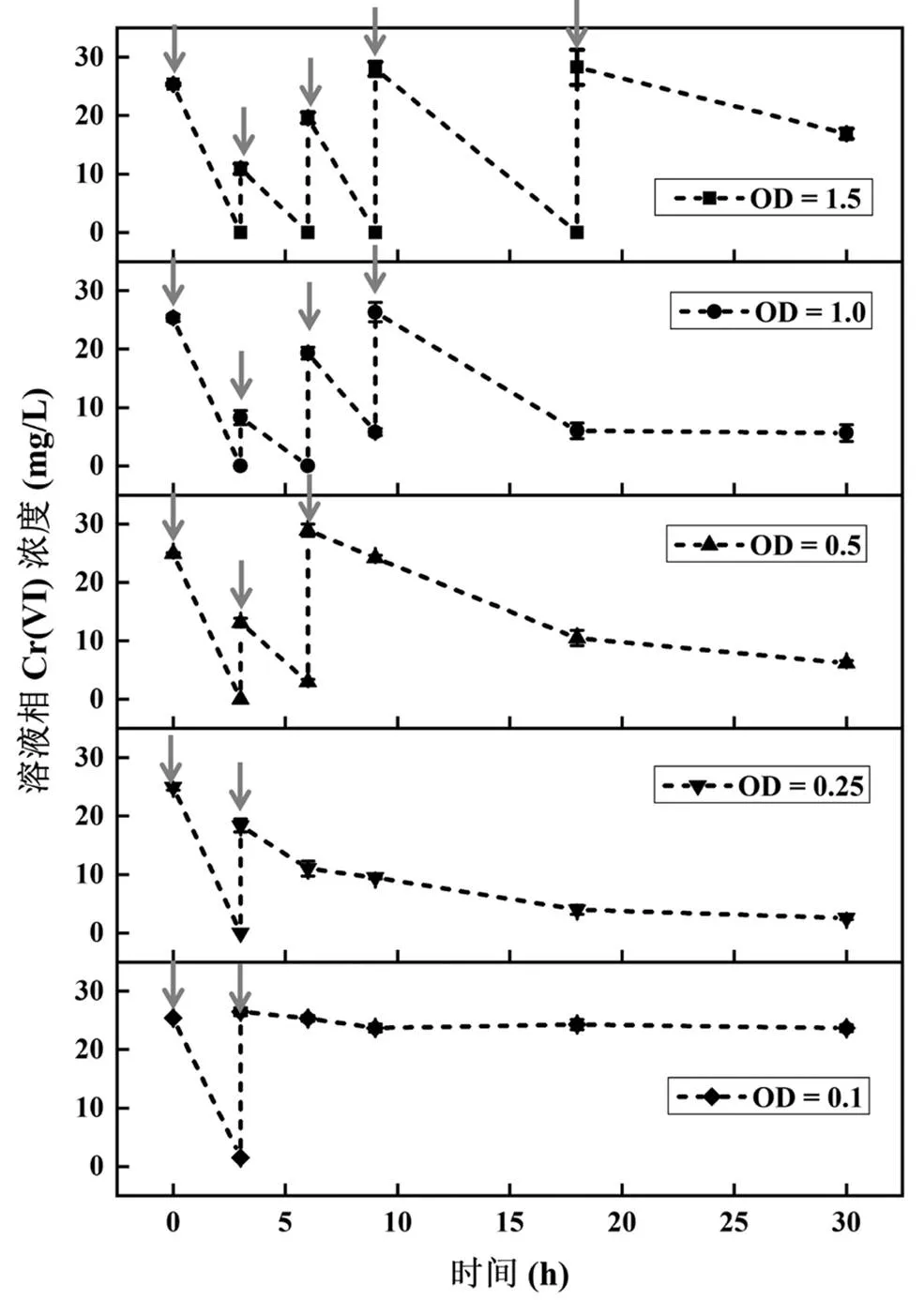
图7 不同菌体浓度合成Bio-FeS-2.5@MR-1重复去除Cr(VI)的能力
灰色箭头表示添加26mg/L Cr(VI)
在相同FeS次生矿物含量情况下,不同MR-1菌体密度(OD600nm=0.1、0.25、0.5、1.0、1.5)介导合成的Bio-FeS-2.5@MR-1杂化体对26mg/L Cr(VI)反复去除的能力,如图7所示.当杂化体中菌体浓度很低(OD600nm=0.1)时,由于有限的MR-1细胞不能有效再生FeS次生矿物,故只能进行一轮反应.随着菌体浓度增加,Bio- FeS@MR-1杂化体在第二轮反应中还原去除Cr(VI)的能力逐步增强.当菌体浓度增加至OD600nm=0.5、1.0、1.5时,Bio-FeS@MR-1杂化体重复去除溶液相中Cr(VI)的能力依次增加至3、4、5次.这是因为更高浓度的菌体不仅更有利于FeS次生矿物的再生,还可为铬的吸附提供了更多活性位点.
2.7 Bio-FeS@MR-1还原去除Cr(VI)的产物分析
对去除26mg/L Cr(VI)后的Bio-FeS-2.5@MR- 1杂化体进行XPS表征分析,探究Cr(VI)的产物形态.由XPS全谱(图8(a))结果可知,去除Cr(VI)的Bio- FeS-2.5@MR-1杂化体中出现C1s、O1s、N1s、Fe2p、S2p和Cr2p轨道的特征峰.如图8(b)所示,Cr2p3/2轨道和Cr2p1/2轨道分别在结合能572~582eV和582~ 592eV区间内有明显出锋.Cr2p3/2轨道峰是由Cr(III)在575.7eV处的出锋和Cr(VI)在578.0eV处的出锋叠加而成;同时,Cr2p1/2轨道峰是由Cr(III)在585.5eV处的出锋和Cr(VI)在587.8eV处的出锋叠加而成,其结合能比Cr2p3/2轨道峰高约9.8eV.根据Cr2p3/2轨道和Cr2p1/2轨道的出峰面积计算分析,Cr(III)/Cr(VI)在Bio-FeS-2.5@MR-1杂化体中的含量比为3.7:1,表明吸附在Bio-FeS-2.5@MR-1杂化体中的铬主要是低毒性的Cr(III)(约占80%).根据相关文献[14,20,42]报道以及Cr2p3/2轨道峰的结果分析,推测Cr(VI)的还原产物主要是Cr2O3或Cr(OH)3沉淀.研究结果表明,生物合成的Bio-FeS@MR-1杂化体不仅对水体中铬污染物有较强吸附作用,而且表现出强的还原能力,有效地将可溶性高、毒性强的Cr(VI)转化为低毒性的Cr(III)沉淀,真正实现重金属污染物的减毒化处理.

图8 Bio-FeS-2.5@MR-1还原去除Cr(VI)产物的XPS全谱和Cr2p轨道峰
3 结论
3.1MR-1在添加硫代硫酸盐条件下将水铁矿异化还原为黑色次生矿物,FeS次生矿物纳米颗粒包覆在菌体细胞表面形成Bio-FeS@MR-1杂化体,杂化体对水体中Cr(VI)的去除效率与FeS次生矿物含量和菌体密度成正相关,具有较宽的pH适用范围(3.0~9.0).
3.2 Bio-FeS-2.5@MR-1杂化体能够在4h内将初始浓度26mg/L的Cr(VI)完全去除,去除效率明显高于单独的等量菌体(13mg/L)和FeS次生矿物(5.2mg/L)两者总和,表明菌体与FeS次生矿物之间存在协同增强效应.
3.3 由于菌体代谢活性可持续供应电子,Bio- FeS@MR-1杂化体具有再生能力,可反复用于水体Cr(VI)的去除,使用次数与FeS次生矿物含量和菌体密度成正相关,Bio-FeS-2.5@MR-1杂化体可重复使用3次.
3.4 Bio-FeS@MR-1杂化体去除产物中的铬主要以Cr(III)沉淀物(如Cr2O3、Cr(OH)3)形式存在(约占80%),表明水体中Cr(VI)去除机制主要包括吸附和还原作用.
[1] 生态环境部.关于进一步加强重金属污染防控的意见[EB/OL]. https://www.mee.gov.cn/xxgk2018/xxgk/xxgk03/202203/t20220315_971552.html.
Ministry of Ecology and Environment. Opinions on further strengthening the prevention and control of heavy metal pollution [EB/OL]. https://www.mee.gov.cn/xxgk2018/xxgk/xxgk03/202203/ t20220315_971552.html.
[2] 董全胜,赵庆良,于 航,等.CaO2促进MFC同步处理剩余污泥和六价铬废水的效能 [J]. 中国环境科学, 2019,39(6):2387-2394.
Dong Q S, Zhao Q L, Yu H, et al. Enhanced efficiency of the simultaneous treatment of sewage sludge and Cr(VI)-containing wastewater by CaO2in microbial fuel cell [J]. China Environmental Science, 2019,39(6):2387-2394.
[3] Peng H, Guo J. Removal of chromium from wastewater by membrane filtration, chemical precipitation, ion exchange, adsorption electrocoagulation, electrochemical reduction, electrodialysis, electrodeionization, photocatalysis and nanotechnology: a review [J]. Environmental Chemistry Letters, 2020,18(6):2055-2068.
[4] Xia S P, Song Z L, Jeyakumar P, et al. A critical review on bioremediation technologies for Cr(VI)-contaminated soils and wastewater [J]. Critical Reviews in Environmental Science and Technology, 2019,49(12):1027-1078.
[5] Ukhurebor K E, Aigbe U O, Onyancha R B, et al. Effect of hexavalent chromium on the environment and removal techniques: a review [J]. Journal of Environmental Management, 2021,280:111809.
[6] Loomis D, Guha N, Hall A L, et al. Identifying occupational carcinogens: an update from the IARC Monographs [J]. Occupational and Environmental Medicine, 2018,75(8):593-603.
[7] Chen J, Tian Y Q. Hexavalent chromium reducing bacteria: mechanism of reduction and characteristics [J]. Environmental Science and Pollution Research, 2021,28(17):20981-20997.
[8] 祝国文,张 瑾,杜 杰,等.微生物技术治理水体重金属镉、铬污染的研究进展 [J]. 生物资源, 2020,42(3):313-321.
Zhu G, Zhang J, Du J, et al. Research progress of treatment of cadmium and chromium wastewater by microbiological technology [J]. Biotic Resources, 2020,42(3):313-321.
[9] 夏 险,李明顺,武士娟,等.微生物铬转化和抗性机制与生物修复研究进展 [J]. 微生物学通报, 2017,44(7):1668-1675.
Xia X, Li M S, Wu S J, et al. Research progress in microbial chromium-transformation and resistance and bioremediation [J]. Microbiology China, 2017,44(7):1668-1675.
[10] 李 斗,赵由才,宋立岩,等.六价铬细菌还原的分子机制研究进展 [J]. 环境科学, 2014,35(4):1602-1612.
Li D, Zhao Y C, Song L Y, et al. Advances in molecular mechanism of bacterial reduction of hexavalent chromium [J]. Environmental Science, 2014,35(4):1602-1612.
[11] Ri C, Tang J C, Liu F, et al. Enhanced microbial reduction of aqueous hexavalent chromium byMR-1with biochar as electron shuttle [J]. Journal of Environmental Sciences, 2022,113: 12-25.
[12] Meng Y, Zhao Z W, Burgos W D, et al. Iron(III) minerals and anthraquinone-2,6-disulfonate (AQDS) synergistically enhance bioreduction of hexavalent chromium byMR-1 [J]. Science of the Total Environment, 2018,640:591-598.
[13] An H, Tian T, Wang Z T, et al. Role of extracellular polymeric substances in the immobilization of hexavalent chromium byCN32 unsaturated biofilms [J]. Science of the Total Environment, 2022,810:151184.
[14] 杜艳影,刘小红,李 劲,等.MR-1对Cr(Ⅵ)的还原及其影响因素 [J]. 中国环境科学, 2018,38(7):2740-2745.
Du Y Y, Liu X H, Li J, et al. Reduction of Cr (VI) byMR-1and its influencing factors [J]. China Environmental Science, 2018,38(7):2740-2745.
[15] 肖长烨,肖 勇,赵 峰.全基因组重测序研究长期铬胁迫对希瓦氏菌MR-1的影响机制 [J]. 中国环境科学, 2019,39(3):1261-1267.
Xiao C Y, Xiao Y, Zhao F. Mechanism of long-term chromium stress onMR-1using whole genome resequencing technique [J]. China Environmental Science, 2019,39(3):1261-1267.
[16] Gong Y, Tang J, Zhao D. Application of iron sulfide particles for groundwater and soil remediation: A review [J]. Water Research, 2016,89:309-320.
[17] 王东申,杨伊迪,贾 珂,等.天然FeS矿处理含Cr(Ⅵ)废水研究 [J]. 水处理技术, 2019,45(1):23-27.
Wang D, Yang Y, Jia K, et al. Natural FeS mineral treatment of wastewater with Cr(VI) [J]. Technology of Water Treatment, 2019, 45(1):23-27.
[18] Li Y J, Wang W Y, Zhou L Q, et al. Remediation of hexavalent chromium spiked soil by using synthesized iron sulfide particles [J]. Chemosphere, 2017,169:131-138.
[19] Zou L, Zhu F, Long Z-E, et al. Bacterial extracellular electron transfer: a powerful route to the green biosynthesis of inorganic nanomaterials for multifunctional applications [J]. Journal of nanobiotechnology, 2021,19(1):120.
[20] Yu Y-Y, Cheng Q-W, Sha C, et al. Size-controlled biosynthesis of FeS nanoparticles for efficient removal of aqueous Cr(VI) [J]. Chemical Engineering Journal, 2020,379:122404.
[21] 胡 凡,陈元彩,胡勇有,等.硫酸盐还原菌原位合成纳米硫化亚铁还原Cr(Ⅵ) [J]. 化工环保, 2022,42(1):61-67.
Hu F, Chen Y, Hu Y, et al. In-situ synthesis of Nano-FeS by sulfate reducting bacteria for Cr(Ⅵ) reduction [J]. Environmental Protection of Chemical Industry, 2022,42(1):61-67.
[22] Shi M Q, Min X B, Ke Y, et al. Recent progress in understanding the mechanism of heavy metals retention by iron (oxyhydr)oxides [J]. Science of the Total Environment, 2021,752:141930.
[23] Jambor J L, Dutrizac J E. Occurrence and constitution of natural and synthetic ferrihydrite, a widespread iron oxyhydroxide [J]. Chemical Reviews, 1998,98(7):2549-2586.
[24] 王小明,杨凯光,孙世发,等.水铁矿的结构、组成及环境地球化学行为 [J]. 地学前缘, 2011,18(2):339-347.
Wang X, Yang K, Sun S, et al. The structure and composition of ferrihydrite and its environmental geochemicalbehaviors [J]. Earth Science Frontiers, 2011,18(2):339-347.
[25] Liu H, Ma M R, Qin M, et al. Studies on the controllable transformation of ferrihydrite [J]. Journal of Solid State Chemistry, 2010,183(9):2045-2050.
[26] Shi L, Dong H, Reguera G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals [J]. Nature Reviews Microbiology, 2016,14(10):651-662.
[27] Smeaton C M, Walshe G E, Smith A M L, et al. Simultaneous release of Fe and As during the reductive dissolution of Pb-As Jarosite byCN32 [J]. Environmental Science & Technology, 2012,46(23):12823-12831.
[28] Bencheikh-Latmani R, Obraztsova A, Mackey M R, et al. Toxicity of Cr(III) tosp strain MR-4during Cr(VI) reduction [J]. Environmental Science & Technology, 2007,41(1):214-220.
[29] Zhang S J, Peiffer S, Liao X T, et al. Sulfidation of ferric (hydr)oxides and its implication on contaminants transformation: A review [J]. Science of the Total Environment, 2022,816:151574.
[30] Schwertmann U, Cornell R M. Iron oxides in the laboratory: Preparation and characterization [M]. Weinheim: WILEY-VCH, 2000:103-112.
[31] 程千文.高效还原六价铬的生物纳米杂合体系的构建及其还原机制研究 [D]. 镇江:江苏大学, 2019.
Cheng Q W. Development of bio-nano hybrid system for efficient reduction of hexavalent chromium [D]. Zhenjiang: Jiangsu University, 2019.
[32] HJ/T 345-2007 水质铁的测定邻菲啰啉分光光度法 [S].
HJ/T 345-2007 Water quality. Determination of iron. phenanthroline spectrophotometry [S].
[33] Zou L, Qiao Y, Gu S, et al. Nano-porous Mo2C in-situ grafted on macroporous carbon electrode as an efficient 3D hydrogen evolution cathode [J]. Journal of Alloys and Compounds, 2017,712:103-110.
[34] Zou L, Lu Z, Huang Y, et al. Nanoporous Mo2C functionalized 3D carbon architecture anode for boosting flavins mediated interfacial bioelectrocatalysis in microbial fuel cells [J]. Journal of Power Sources, 2017,359:549-555.
[35] Zhu F, Huang Y, Ni H, et al. Biogenic iron sulfide functioning as electron-mediating interface to accelerate dissimilatory ferrihydrite reduction byMR-1 [J]. Chemosphere, 2022, 288:132661.
[36] Zou L, Huang Y-H, Long Z-E, et al. On-going applications ofspecies in microbial electrochemical system for bioenergy, bioremediation and biosensing [J]. World Journal of Microbiology & Biotechnology, 2019,35(1):9.
[37] Shirodkar S, Reed S, Romine M, et al. The octahaem SirA catalyses dissimilatory sulfite reduction inMR-1 [J]. Environmental Microbiology, 2011,13(1):108-15.
[38] Burns J L, Dichristina T J. Anaerobic respiration of elemental sulfur and thiosulfate byMR-1requires, a homolog of thegene ofSerovar Typhimurium LT2 [J]. Applied and Environmental Microbiology, 2009,75(16):5209-5217.
[39] Lan Y Q, Yang J X, Deng B. Catalysis of dissolved and adsorbed iron in soil suspension for chromium(VI) reduction by sulfide [J]. Pedosphere, 2006,16(5):572-578.
[40] Yao Y, Mi N, He C, et al. A novel colloid composited with polyacrylate and nano ferrous sulfide and its efficiency and mechanism of removal of Cr(VI) from water [J]. Journal of Hazardous Materials, 2020,399:123082.
[41] 韩选利,傅贤书,黄琼玉,等.FeS除Cr(Ⅵ)机理初探 [J]. 西安建筑科技大学学报(自然科学版), 1991,(1):39-46.
Han X, Fu X, Huang Q, et al. A study on the mechanism of removing Cr(VI) from wastewater by FeS [J]. Journal of Xi'an University of Architecture & Technology(Natural Science Edition), 1991,(1):39-46.
[42] Tian X, Wang W, Tian N, et al. Cr(VI) reduction and immobilization by novel carbonaceous modified magnetic Fe3O4/halloysite nanohybrid [J]. Journal of Hazardous Materials, 2016,309:151-156.
Bacterial synthesis of iron sulfur minerals from ferrihydrite for aqueous chromium pollutant removal.
ZOU Long, ZHU Fei, TANG Jie, ZHU Qi, NI Hai-Yan, LONG Zhong-Er, HUANG Yun-Hong*
(Nanchang Key Laboratory of Microbial Resources Exploitation & Utilization from Poyang Lake Wetland, College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China)., 2023,43(2):610~619
In order to remove Cr(VI) from water,MR-1 was used to promote the biotransformation of ferrihydrite into iron sulfur secondary minerals in the presence of thiosulfate, and thus producing a microbe/mineral hybrid. The Cr(VI) removal ability and the influence factors, as well as the Cr(VI) removal mechanism of the synthesized hybrid were investigated. The phase composition analysis results and microscopic morphology showed that theMR-1 cells were coated by the black secondary mineral nanoparticles identified as mackinawite (FeS), thereby forming the Bio-FeS@MR-1hybrid. The Cr(VI) with the initial concentration of 26mg/L had been removed completely by the prepared hybrid within 4h. Its removal amount was significantly higher than the total amount removed by individual bacterial cells and FeS secondary minerals with an equal amount, which demonstrating a synergistic effect between bacterial cells and FeS secondary minerals. The Bio-FeS@MR-1 hybrid possesses good tolerance to a wide pH range (3.0~9.0) and excellent regeneration ability. The removal efficiency of aqueous Cr(VI) and number of repeats were positively correlated with the content of FeS secondary mineral and cell density. The major chromium compounds existing in the Cr(VI) removal product were Cr(III) precipitates (such as Cr2O3and Cr(OH)3), indicating that the removal mechanism of aqueous Cr(VI) include both adsorption and reduction.
;ferrihydrite;iron sulfide;mineral biotransformation;chromium;heavy metal
X142
A
1000-6923(2023)02-0610-10
邹 龙(1987-),男,江西高安人,副教授,博士,主要从事微生物胞外电子传递界面调控及环境应用研究.发表论文30余篇.
2022-06-27
国家自然科学基金资助项目(32260025,31900109);江西省自然科学基金资助项目(20202ACB215001,20202BAB203022)
* 责任作者, 副教授, sallyyunhong@jxnu.edu.cn
