北美红枫秋色叶呈色过程中GC-MS代谢组学分析1)
2023-02-22唐玉情张捷刘洋吴可心闫雪唐中华
唐玉情 张捷 刘洋 吴可心 闫雪 唐中华
(东北林业大学,哈尔滨 150040)(黑龙江大学)(东北林业大学)
北美红枫(AcerrubrumL.)属槭树科槭树属[1],原产美国东海岸,秋季叶片鲜红,是我国北方打造季相景观的主要秋色叶树种之一。前人针对北美红枫叶色的研究大多集中在呈色的生理机制方面,如李力[2]、吴琰琰等[3]、李梅洁等[4]研究表明,花色苷、光合色素和可溶性糖是影响叶片变红的重要因素;宋岩[5]针对北美红枫和元宝枫呈色的生理特性进一步研究表明,花色苷与叶绿素质量分数比的变化是叶片呈色的主要影响色素;郭聪等[6]针对北美红枫呈色的转录组学研究中共筛选出7个与叶片呈色相关的基因。
气相色谱-质谱联用技术(GC-MS)可追踪低分子量代谢物的动态变化,如氨基酸、有机酸、脂质和碳水化合物等[7]。目前利用GC-MS研究植物呈色上也有一定的应用,如Fukuda et al.[8]在马铃薯块茎的研究中,筛选出可用于马铃薯薯片颜色预测的生物标志物;Zhang et al.[9]在对紫芽和绿茶的研究中,发现紫茶颜色较深,与其碳水化合物(如甘露糖、果糖、d-半乳糖、山梨糖和d-葡萄糖等)的代谢增加和氨基酸的代谢减少有关。目前,国内外利用GC-MS技术探讨北美红枫秋季呈色过程代谢机制的研究尚无报道。
本研究以自然生长下的北美红枫叶片为试材,以着色过程中花色苷与叶绿素质量分数比的变化为划分依据,分别追踪了北美红枫叶片呈色初期、渐变初期、渐变中期、渐变末期以及完全呈色期5个呈色阶段内的叶绿素、花色苷、可溶性糖和可溶性蛋白质质量分数的变化,并通过GC-MS组学技术进一步分析了5个呈色阶段内物质的动态变化,旨在从形态和生理角度揭示北美红枫叶片秋季着色过程中的表型和物质的动态变化,并探讨其秋季呈色过程中的适应性机制,为促进叶片呈色,提高观赏价值提供一定的理论和实践指导。
1 材料与方法
试验材料为东北林业大学丹青楼广场(45°43′N,126°37′E)引种多年、生长健壮且景观效果良好的24株北美红枫植株,平均株高约18 m,平均冠幅约732.75 cm,平均胸径约16.93 cm,平均地径约18.79 cm。该实验于 2020年9月中旬至10月下旬进行,累计时长为45 d。秋色叶呈色前每隔一周观察一次树冠外围下部叶片的叶肉、叶柄和叶脉的颜色变化,逐渐呈色期每隔两天观察一次树冠外围下部叶片的叶肉、叶柄和叶脉的颜色变化,并根据三者渐次呈色变化,将其分为十个呈色阶段。
于叶片呈色占整株树木的80%时进行取样,并挑选出数枚健康、成熟完整的叶片,用蒸馏水擦去表面的尘埃,用剪刀去除距离叶边缘与叶脉处1~2 cm不稳定的部分,装进锡箔纸中,液氮速冻后在冰箱内-80 ℃储在。
1.1 生理指标测定
叶绿素和花色苷采用混合液浸泡法测定[10-11]。于冰箱中-80 ℃取出制备好的样品,花青素采用1%(V/V)盐酸甲醇溶液浸泡;叶绿素和类胡萝卜素采用1∶1(V/V)的丙酮乙醇溶液浸泡。在浸泡过程中需注意避光,低温和定时摇荡,浸泡时间均为24 h。
可溶性糖和可溶性蛋白质生理指标的测定参考《植物生理生物技术指导》[12]。可溶性糖测定的方法:取-80 ℃的样品0.3 g,用液氮研磨成匀浆,加入5 mL的蒸馏水在沸水下浸提30 min,重复提取三次,离心抽取上清液,并定容至 25 mL,冷却后,吸取2 mL提取液于大试管中,加入4 mL蒽酮试剂,摇匀,10 min后测定625 nm处的吸光值,每个阶段重复3次,求取平均值。可溶性蛋白质测定的测定:取-80 ℃的样品0.2 g,在2 mL磷酸缓冲液中将其研磨成匀浆,离心15 min(4 ℃,10 000 r/min),取上清液。反应体系:取0.1 mL上清液,加入2.9 mL考马斯亮蓝(G-250试剂),充分摇匀,在室温条件下,放置2 min,用紫外分光光度计测定波长在595 nm处的吸光值,每个阶段重复3次,求取平均值。
1.2 GC-MS代谢组学分析方法
于冰箱中-80 ℃取出制备好的样品,根据Liu et al.[13-14]方法进行GC-MS样品提取,精密称0.09 g,置于2 mL离心管中,并依次加入一颗玛瑙珠、540 μL的冷甲醇和60 μL的内标,放入研磨机中研磨(45 Hz,2 min),在40 ℃温度下超声提取30 min;超声结束后,加入300 μL的氯仿,在研磨机中涡旋2 min,再加入600 μL的纯净水,研磨涡旋2 min,超声提取30 min后,低温离心10 min(12 000 r/min,4 ℃),取800 μL的上清液,快速离心浓缩挥干。
并使用安捷伦(Agilent)7890A系列自动取样器(Agilent Technologies,USA)与Agilent 5975C气相色谱-质谱仪以及非极性DB-5毛细管色谱柱(30 m×250 μm ID,J & W Scientific,Folsom,CA)分离后进行质谱检测。高纯氦气被用作载气,载气流速为1.0 mL/min。程序升温为8 ℃/min,60~125 ℃;4 ℃/min,125~210 ℃;5 ℃/min,210~270 ℃;10 ℃/min,270~305 ℃;305 ℃维持3 min。进样口的温度为260 ℃,电子轰击电离源(EI)温度为260 ℃,电压为-70 V。
下机后的气质数据,根据其质量扫描范围,筛去系统内匹配度低于50以及衍生化试剂中的物质,并将剩下的化合物归一化后做偏最小二乘法分析(PLS-DA),结合VIP>1,P<0.05筛选出5个呈色阶段中的差异化合物。
1.3 数据处理
采用统计产品与服务解决方案(IBM SPSS Statistics 23)进行单因素方差分析,多元数据分析软件(SIMCA-P14.1)进行主成分分析(PCA)和偏最小二乘法分析(PLS-DA),通过京都基因与基因组百科全书(KEGG)(https://www.genome.jp/kegg)数据库和代谢组学分析工具(MetaboAnalyst)(http://www.metaboanalyst.ca)数据库进行差异代谢途径的筛选,并采用棱镜(Graphpad prime8)绘制柱状图,热图分析软件(Heml)绘制热图。
2 结果与分析
2.1 北美红枫秋季呈色表型变化
通过定期的对叶肉、叶脉和叶柄观察,将其分为10个呈色阶段,各阶段划分的基本信息见表1。

表1 北美红枫叶片各阶段的特性
2.2 北美红枫秋季呈色色素物质变化
北美红枫呈色期内叶绿素、花色苷的质量分数以及花色苷与叶绿素质量分数之比的具体变化见表2。

表2 北美红枫不同阶段色素鲜质量测定结果
利用D35578 Wetzlar相机拍摄北美红枫叶片十个阶段的表型变化,将相机模式调至手动 M 档,参数调整为光圈F=4.5,快门 320 s,感光度 iso=500,具体变化见图1。结合北美红枫呈色的表型变化,发现北美红枫呈色具有一定的变化规律,即在光照充足的情况下,叶片呈现出由叶柄鲜红到叶脉鲜红再到叶肉组织鲜红的渐次过程,叶肉组织则是由基部到四周的变化过程。

图1 北美红枫S1~S10阶段表型观察图
由表2可知,w(叶绿素)呈下降趋势,w(花色苷)、w(花色苷)∶w(叶绿素)呈上升趋势。10个时期内的w(花色苷)∶w(叶绿素)变化具有明显的阶段性差异,因此可将其分为5个呈色阶段,分别为:T1呈色初期 (S1~S6),此阶段叶片表观上叶绿素率先降解,但叶面仍以绿色为主,尚未呈现出明显的红色素聚集;T2渐变初期 (S7),此阶段内叶片表观变化为叶片出现少许红色素;T3渐变中期 (S8),此阶段内叶片表观出现约二分之一的红色素;T4渐变末期 (S9),对应的表观变化为发生明显的降解,叶面开始出现红色素斑块状聚集;T5完全呈色期 (S10),叶片表观变化为叶绿素持续分解而花色苷快速积累,此时叶面主要以红色为主,为秋色叶的最佳观赏时期。
2.3 北美红枫秋季呈色可溶性糖和可溶性蛋白质变化
北美红枫可溶性糖质量分数和可溶性糖蛋白质质量分数的变化见表3。

表3 北美红枫不同呈色阶段的可溶性糖质量分数和可溶性蛋白质质量分数测定结果
由表3可知,可溶性糖和可溶性蛋白质的质量分数在整个呈色期内均持续增加,且差异显著。
2.4 北美红枫叶片呈色过程的GC-MS代谢特性分析
2.4.1 主成分分析和偏最小二乘法分析
GC-MS组学分析中共检测到94种化合物,将其归一化后的数据导入多元数据分析软件(SIMCA-P14.1)中可得到主成分分析(PCA)和偏最小二乘法(PLS-DA)分析图,通过单因素方差分析发现,各组间的差异明显(p<0.05),而组内无明显差异(p>0.05)。由图2可见,呈色初期、完全呈色期与其他3个呈色期显著分开,表明这2个变化时期内的叶片代谢物质有明显的差异性,而渐变初期、渐变中期和渐变末期的组间距离较近,表明这3个呈色阶段内,物质的代谢具有一定的相似性。
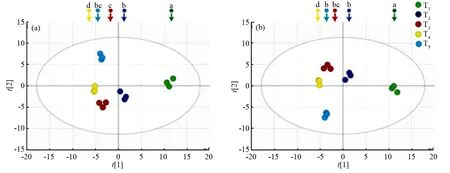
图中不同小写字母,表示不同呈色阶段差异显著(p<0.05)。
2.4.2 差异化合物分析
进一步通过PLS-DA投影变量权重值(VIP)分析后得出45种差异化合物(表4),结合T检验的p值后(VIP>1且p<0.05)最终筛选出42种差异化合物,包括2种氨基酸、5种醇类、14种糖、6种有机酸、2种脂肪酸、15种其他物。
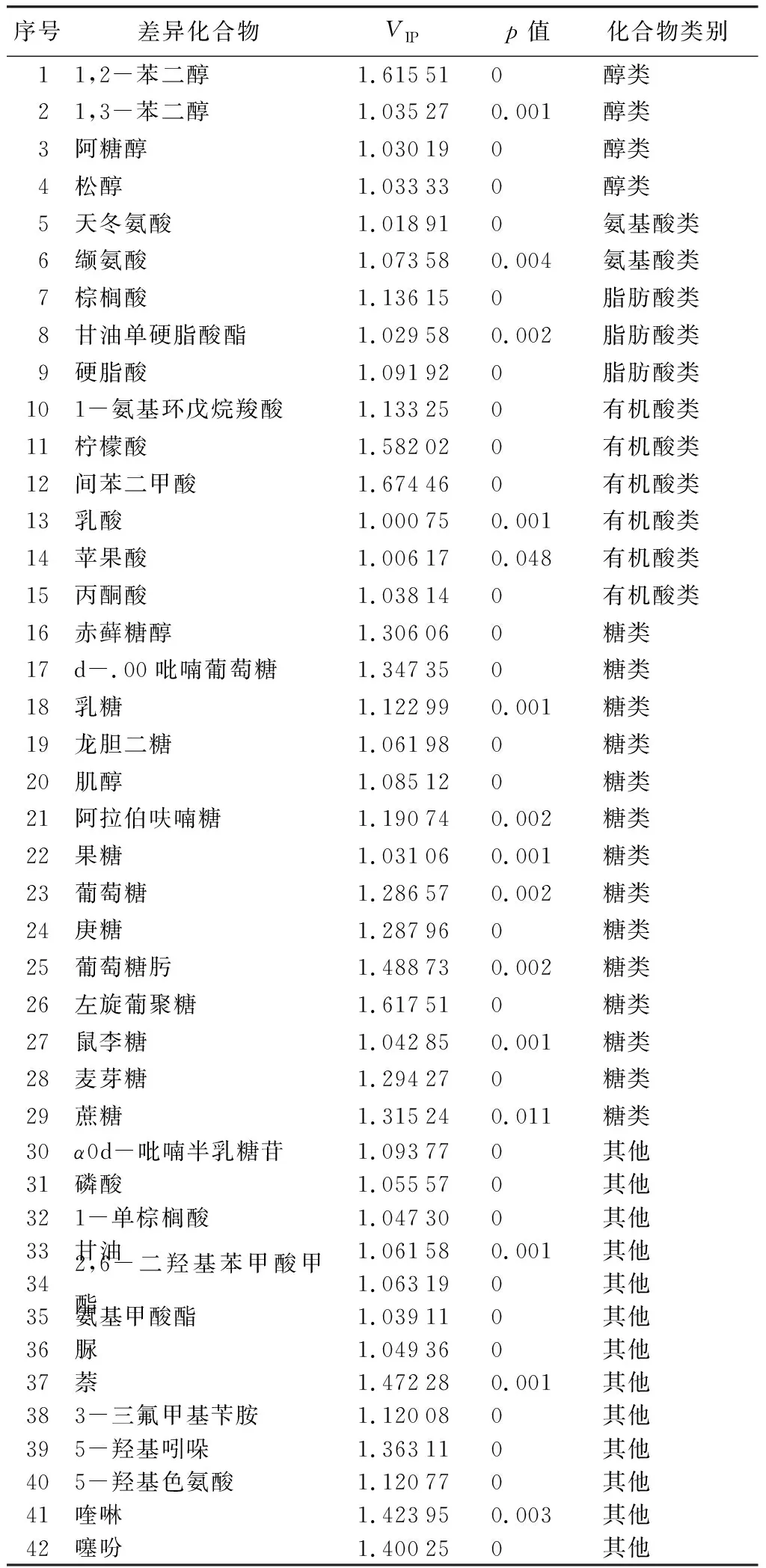
表4 北美红枫呈色过程的差异化合物
2.4.3 差异化合物相对质量分数分析
将42种差异化合物归一化后的数据导入热图分析软件(Heml)软件中得到热图。由图3可知,在整个呈色阶段内,化合物大致进行了四类变化。Ⅰ类中氨基酸类和糖类化合物呈先下调后上升的趋势变化,代表化合物:天冬氨酸、缬氨酸和5-羟基吲哚等;Ⅱ类中有机酸类、糖类和醇类化合物主要在呈色初期前富集,在叶色着色的过程中不断下调;Ⅲ类中主要是糖类化合物呈先上调后下降的趋势变化,且集中在渐变中期达到了最大值,代表化合物:蔗糖、麦芽糖、赤藓糖和左聚旋糖等;Ⅳ类中主要是有机酸类和糖类的化合物呈上调趋势变化,代表化合物:柠檬酸、丙酮酸、阿拉伯呋喃糖、葡萄糖和L-鼠李糖等。
2.4.4 差异化合物代谢通路分析
将筛选出的42种差异化合物导入到代谢组学分析工具(MetaboAnalyst)数据库中,筛选出9条差异的化合物代谢通路(p<0.05,表5)。
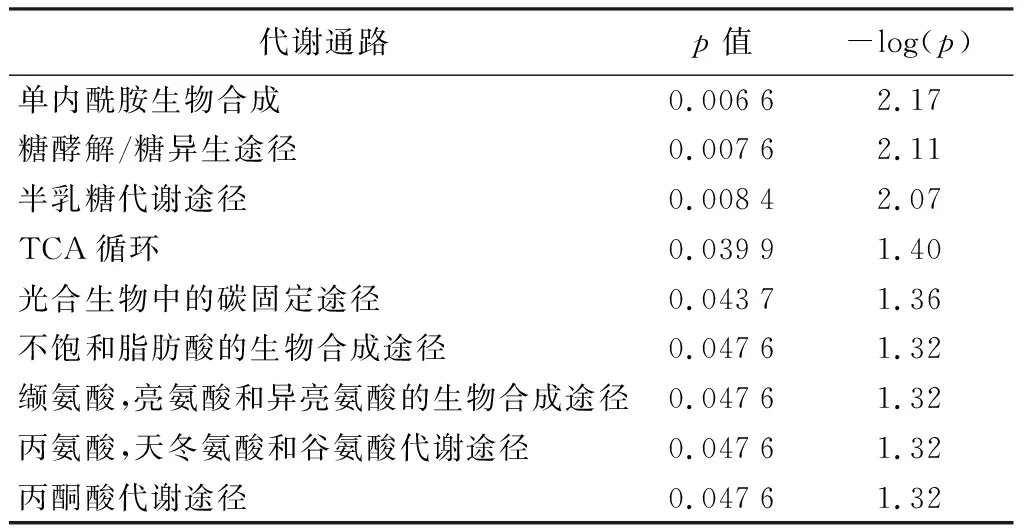
表5 北美红枫叶片差异化合物的代谢途径

图3 北美红枫叶片不同类别化合物热图
由表5可知,叶片着色过程中,糖类物质是整个呈色过程中的主要代谢活动,包括糖酵解/糖异生途径和半乳糖代谢途径。结合代谢通路和京都基因与基因组百科全书(KEGG)数据库,可绘制糖类、有机酸类和氨基酸类化合物热图以及代谢通路图(图4)。

Maltose为麦芽糖,Sucrose为蔗糖,Lactose为乳糖,d-Glucose为d-葡萄糖,D-Fructose为D-果糖,L-Rhamnose为L-鼠李糖,D-(-)-Erythrose为D-(-)-赤藓糖;Arabinitol为阿拉伯糖醇,Myo-inositol为肌醇,Glycerol为甘油,Palmitic Acid为棕榈酸,Stearic acid为硬脂酸,Pyruvic acid为丙酮酸,L-Valine为L-缬氨酸,Lactic Acid为乳酸,Aspartic acid为天冬氨酸,Malic acid为苹果酸,Citric acid为柠檬酸,oxaloacctic acid为草酰乙酸,Succinic acid为琥珀酸,α-ketoglutaric acid为α-酮戊二酸,Glucose-6-phosphate为葡萄糖-6-磷酸,Glycerol triphosphate为甘油三磷酸腺苷。
由图4可知,叶片呈色过程中,通过糖酵解和半乳糖代谢途径将蔗糖、麦芽糖、乳糖等二糖类物质分解为葡萄糖、D-果糖和L-鼠李糖等单糖物质,为花青素后期的糖基化提供了充足的糖原供应,且这种变化在呈色的早期较为活跃,后期随着叶绿素的下降而有所降低。柠檬酸、苹果酸、棕榈酸、硬脂酸和缬氨酸参与了TCA循环、不饱和脂肪酸合成、缬氨酸,亮氨酸和异亮氨酸的代谢途径。呈色过程中,氨基酸的合成在早期活跃,后期有所下降,而有机酸的合成有所上升,如丙酮酸、柠檬酸等。
3 讨论
3.1 北美红枫秋色叶呈色的阶段划分
叶绿素和花色苷等色素会影响高等植物叶片的呈色[15]。以往关于丝棉木、卫矛[16]、榉树[17]、栾树[18]的呈色研究结果,证明了花色苷与叶绿素的质量分数之比是秋季叶片变红的主导影响因子。本研究结果也表明,北美红枫秋季着色过程中叶绿素质量分数明显下降而花色苷质量分数明显上升,花色苷与叶绿素质量分数之比的差异性变化与秋叶变红息息相关。因此,以花色苷与叶绿素质量分数之比为标准,可将叶片呈色划分为呈色初期、渐变初期、渐变中期、渐变末期和完全呈色期5个呈色阶段,这5个阶段与叶片呈色时的形态表征也最为接近,故而本研究认为花色苷与叶绿素质量分数之比可作为秋季叶片呈色阶段的划分依据之一。
3.2 秋季叶片发生色素变化的适应性表现
北美红枫秋季变红是落叶乔木典型的物候表现,发生这种变化的原因主要是秋叶变色的过程也是植物体季节性衰老的过程[19],在这个过程中,叶绿素率先发生降解[20-21],将高活性的物质分解为无光化学特性或具有稳定化学特性的物质,在一定程度上可减缓植物过快的生命活动[22],故叶绿素及时的降解不仅导致了叶片的褪绿现象,而且也具有重要的发育生物学意义[23-24]。花色苷有促进植物繁殖[25]、抵御各种非生物和生物胁迫[26]、以及吸收过量光,清除自由基,为光合系统提供一层光幕[27-28],保护低温下的秋叶免受光破坏,延长碳捕获,并帮助提供韧皮部从衰老叶片输出养分所需的能量和渗透控制[29]的作用。故秋叶合成花色苷可延缓植物的衰老,为叶片物质的转运赢得生存时间。但花色苷保护植物光合系统的论点也有所争议,如有研究者[30]认为叶子变红是树木对蚜虫等觅食昆虫发出的一种防御状态的警告信号。但毋庸置疑,花色苷的大量积累以及叶绿素的持续降解最终形成了北美红枫视觉上群体性和醒目性的秋叶呈色景观,这既带来了极大的美感,也是植物对外界环境变化的一种适应性选择。
3.3 叶片着色过程中的代谢变化
花色苷的大量合成不仅需要进行丰富的物质转运,还需要大量的底物支撑。糖是花色苷合成的前体物质,在糖基化的过程中也起着重要的媒介作用[31-32]。北美红枫在呈色的过程中可溶性糖质量分数持续上调。由于花青素性质不稳定,一般与葡萄糖、鼠李糖、半乳糖、阿拉伯糖和木糖等结合形成花色苷显色[31-32],以蔗糖、麦芽糖和乳糖为底物进行糖酵解(或糖异生)途径和半乳糖代谢途径,分解出大量的葡萄糖、果糖和鼠李糖等,这保证了花色苷代谢途径中有充足的糖基化底物供应。而蔗糖早期有所上调,呈色后期才进行了大量的分解,植物体在早期还具有生产碳水化合物的能力,此时进行糖酵解的底物主要是乳糖和麦芽糖,而叶片的表观此时也以绿色为主。后期则主要是通过蔗糖分解来为植物的运转和合成其他物质提供能量和底物,叶片表观主要以红色为主,故蔗糖对花色苷的大量形成有着重要的作用,而这点在喷施蔗糖溶液调控叶片呈色的研究中也得到了一定的验证[33-36]。
另外,秋叶在衰老呈色的过程中,其光合作用逐渐丧失,为维持机体在最后阶段内完成叶片由绿变红的转变,还需要有大量的能量供应。TCA循环既是一些重要的初级代谢产物生成的中央枢纽,也是植物体将糖或其他物质氧化以获得能量的最有效方式。叶片秋季呈色的过程中TCA循环在渐变末期和完全呈色期有所加快,差异性代谢产物为柠檬酸和苹果酸,两者在渐变中期至完全呈色期内逐渐增加,保证了叶片呈色过程中的能量供应和底物支持,而且苹果酸还能作为细胞渗透压和氧化还原物质参与非生物胁迫抗性。除了TCA循环途径的供能外,不饱和脂肪酸合成途径以及缬氨酸,亮氨酸和异亮氨酸的生物合成途径也有显著差异。但差异代谢产物棕榈酸、硬脂酸均呈现先下降后上升的趋势,表明植物体在前期还具有一定光合作用时,脂肪有所积累,而到后期光合作用基本丧失,为了维持机体内物质的循环、合成和降解,脂肪大量水解为棕榈酸、硬脂酸和甘油,释放出大量的能量。但脂肪酸在有氧的正常发育中能提供能量,随着光合作用的逐渐丧失,大量的脂肪酸可能会在活性氧的作用下生成丙二醛,破坏细胞的膜结构,从而加速植物的衰老。缬氨酸在呈色的过程中,相对质量分数持续增加,故缬氨酸可能在叶片的呈色过程中发挥重要的促进作用。
4 结论
通过追踪自然条件下北美红枫叶片着色进程和生理性状,发现花色苷质量分数、叶绿素质量分数、花色苷与叶绿素质量分数之比、可溶性糖质量分数和可溶性蛋白质质量分数均发生了显著变化。进一步通过GC-MS分析表明,秋叶合成花色苷、降解叶绿素,并提高叶片内的渗透势,是为了应对低温,延长生存时间进行物质转运的一种适应性机制。在这个过程中,糖类物质的代谢变化是叶片着色的主要代谢过程。通过糖酵解(或糖异生)途径和半乳糖代谢途径,将蔗糖、麦芽糖、乳糖等糖源物质,分解为流动性较强的单分子葡萄糖、果糖和鼠李糖等,这不仅提高了细胞的渗透保护能力,也为花青素的糖基化提供了充分的底物供应。蔗糖相对质量分数差异显著,且与叶片由绿变红的着色变化密切相关,表明蔗糖是促进叶片着色的重要糖类物质。除了糖类物质,有机酸类的柠檬酸、苹果酸,脂肪酸类的棕榈酸、硬脂酸,以及氨基酸类的缬氨酸等保护性物质,分别参与了TCA循环、不饱和脂肪酸合成、缬氨酸、亮氨酸和异亮氨酸的代谢途径,这不仅为叶片的着色提供了能量,也增强了叶片的渗透保护,为叶片赢得了生存时间,促进了叶片的着色。
