下延叶古当归种子休眠特性与解除方法
2023-02-21徐珊珊王环宇刘爱民
徐珊珊,王环宇,陆 婷,刘爱民
(1.新疆农业大学林学与风景园林学院,乌鲁木齐 830052 2.哈巴河县林业局,新疆阿勒泰 836700)
0 引 言
【研究意义】下延叶古当归(ArchangelicadecurrensLedeb.)属于伞形科广义当归属[1],在我国自然分布主要在新疆(阿尔泰地区、塔城地区)及内蒙古,一般生长于海拔2 200~2 300 m的山谷[2]、林下、沟边的灌丛或草丛中;作为多年生草本植物,其株形高大;茎中空,有细纵棱;叶片为宽三角状卵形;具有硕大的近球状伞形花序,直径7~15 cm;花白色;花期7~8月,果期8~9月[3],有良好的观赏价值;其根部可入药,还可作为欧白芷(Angelicaarchangelica)精油生产的替代原料[4,5],具有多种应用价值,是开发应用前景广阔的野生植物资源。新疆是典型的生态脆弱地区[11],本土野生植物的开发利用对丰富新疆地区园林绿化植物种类,增加生态效益和经济效益有重要的意义。【前人研究进展】我国当归属植物资源面临研究进展缓慢,仅有部分物种被栽培和利用,如当归(Angelicasinensis)、东当归(Angelicaacutiloba)、紫花前胡(Angelicadecursiva)等[6]。当归属植物种子普遍存在休眠或萌发不整齐的特点,例如当归种子采收时种胚发育不完全,低温干藏15 d可促进种胚的发育和种子萌发[7];温水浸种、赤霉素处理也可促进其种子萌发,6-BA对其种子萌发的促进效果不明显,IAA的促进效果尚有争议[8]。林当归(Angelicasylvestris)及滨海当归(Angelicakeiskei)种子休眠都属于形态生理休眠类型,层积与赤霉素处理可以打破其种子休眠,前者经过处理胚率快速达到萌发临界值[9],后者打破休眠后其种子萌发率达到80%[10]。【本研究切入点】目前关于下延叶古当归的研究主要集中在其药理学的应用方面[4],并无与其种子休眠类型及人工栽培相关的报道,若要进行人工种植则需要解决种子休眠时间长、萌发率低等问题。【拟解决的关键问题】以野生下延叶古当归种子为材料,通过室内控制实验法研究其种子休眠类型和原因,并寻求打破种子休眠,提高种子萌发率和萌发整齐度的方法,解决播种出苗困难的问题,为种质资源保护和开发利用提供科学依据。
1 材料与方法
1.1 材 料
材料下延叶古当归种子于2021年9月采集于新疆阿勒泰地区哈巴河县(48°38′13″N、86°31′27″E),海拔500 m,其果实为双悬果,果皮疏松包裹着种皮,采集果实后揉搓除去果皮,选取健康饱满种子备用。萌发抑制物质的检测选取白菜种子采购于石家庄先风种业有限公司,纯度≥96.0%,发芽率≥85.0%。
1.2 方 法
1.2.1 生物学特性
使用游标卡尺测量种子长宽,使用百粒法[12]计算种子千粒重,使用TTC法[13]测定种子活力;种子吸水率测定:将种子置于蒸馏水中0、1、2、4、6、8、12、24、36、48、60 h后用电子天平进行称重,每组处理100粒种子,重复3次[13]。
吸水率(%)= (吸水后种子的重量-吸水前种子重量)/吸水前种子重量 ×100%[13].
1.2.2 萌发抑制物质的检测
孙佳等[14]认为一些萌发抑制物质在10-3~10-5浓度下,对萝卜、白菜等种子具有抑制作用,大多数植物抑制物质都具有较强的亲水性,用水或亲水性的溶剂提取抑制物质。参考李询等[15]种子浸取液制作方式,取下延叶古当归种子4 g,研制成粉末,加入30 mL无菌蒸馏水,25℃中浸泡24 h,用滤纸过滤后取浸取液备用。取白菜种子50粒,清洗消毒后置于垫有一层滤纸的培养皿中,加入浸取液5 mL,置于室温下做白菜种子萌发实验,与正常萌发的白菜种子做对比,每组处理3个重复,48 h后统计白菜种子萌发率并计算萌发势及萌发指数,萌发120 h后使用游标卡尺测定白菜幼苗根长,即幼苗根茎部至根尖的长度[16];下胚轴长,即子叶至根茎的长度[16];使用电子天平测定幼苗鲜重。
1.2.3 低温层积对种胚生长及种子萌发的影响
低温层积处理可以软化种皮,促使种胚进行形态发育[17],还可以使与合成激素有关的转录因子得以表达,其指导合成的物质对种子萌发具有重要作用[18]。实验将下延叶古当归种子放入湿润的蛭石中于5℃条件下进行低温层积处理,每隔10 d取出180粒种子,其中150粒用纸培法进行种子萌发实验,具体操作为每个培养皿放置50粒种子于温室(25 ±5)℃避光条件下萌发,每组处理设3个重复,每天定期观察种子萌发动态,计算种子萌发率、萌发势、萌发指数,以未经层积的种子作为对照;另外30粒种子用于胚发育情况的观察,将种子沿胚轴切开,在体视显微镜(尼康SMZ25)下观察种胚发育情况,测量并计算种胚长度与种子长度比,即胚率[19]。
胚率(%)=种胚长度/种子长度×100%。
1.2.4 赤霉素浸种对种子萌发的影响
将种子分别置于0、1 000、2 000、3 000、4 000 mg/L的赤霉素溶液内浸泡12、24、36 h,随后使用纸培法将种子置于室温(25±5)℃避光条件下进行萌发实验,每个处理50粒种子,重复3次。在萌发期间逐日记载萌发个数并计算萌发率、萌发势和萌发指数。
1.3 数据处理
萌发率(%)=萌发种子数/供试种子总数×100%[20];
萌发势(%)=最高萌日萌发数/供试种子总数×100%[20];
萌发指数(GI)=Σ(Gt/Dt)(Gt指在时间t日内的萌发数,Dt为相应的萌发天数)[21]。
数据采用Microsoft Excel进行数据记录整理,采用SPSS22.0软件进行差异显著性分析。
2 结果与分析
2.1 基本生物学特性
研究表明,下延叶古当归果实背腹扁平,分果具边翅,中脊及侧脊均向外突起;去果皮后其种子为淡棕褐色,具有浓郁气味;种子长(2.73±0.45) mm、宽(1.20±0.20) mm、千粒重为(2.6±0.18) g,属于中粒种子;生活力为(94.67% ± 0.04%);在0~4 h内种子的吸水速度较快,随后吸水速率逐渐变缓,24 h吸水率达到最大值(111.51%±1.98%),种皮对种子吸水不产生阻碍作用。图1
2.2 萌发抑制物检测
研究表明,处理组白菜种子萌发率、萌发势、萌发指数均极显著低于对照(P<0.01),种子浸取液明显抑制白菜种子的萌发;种子浸取液对白菜幼苗下胚轴的生长无显著抑制作用(P>0.05),但对幼苗鲜重的增加和根长的变化则有显著抑制作用(P<0.05),下延叶古当归种子内含的萌发抑制物具有抑制其种子萌发和幼苗根部生长的作用。表1
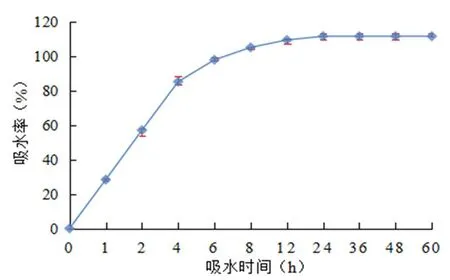
图1 下延叶古当归种子吸水率曲线Fig.1 The water absorption rate curve of A.decurrens
2.3 低温层积处理对种子萌发及种胚生长影响
2.3.1 低温层积处理对种子萌发的影响
研究表明,随层积时间从0 d延长至50 d,种子萌发率、萌发势、萌发指数均呈上升趋势。萌发率从6.67%上升至66.67%,增长了60.00%;萌发势从3.33%上升至35.33%,增长了32%;萌发指数从0.47上升至5.62,增长了5.15。层积30~50 d的三组处理间种子萌发率无显著差异,但均极显著高于层积0~20 d的种子;层积40 d和50 d两组处理间萌发势无显著差异,但极显著高于层积0~30 d的种子;层积50 d的萌发指数显著高于层积40 d的种子但未达到极显著水平,而极显著高于层积0~30 d的种子,低温层积处理可有效解除种子休眠,促进种子萌发。表2
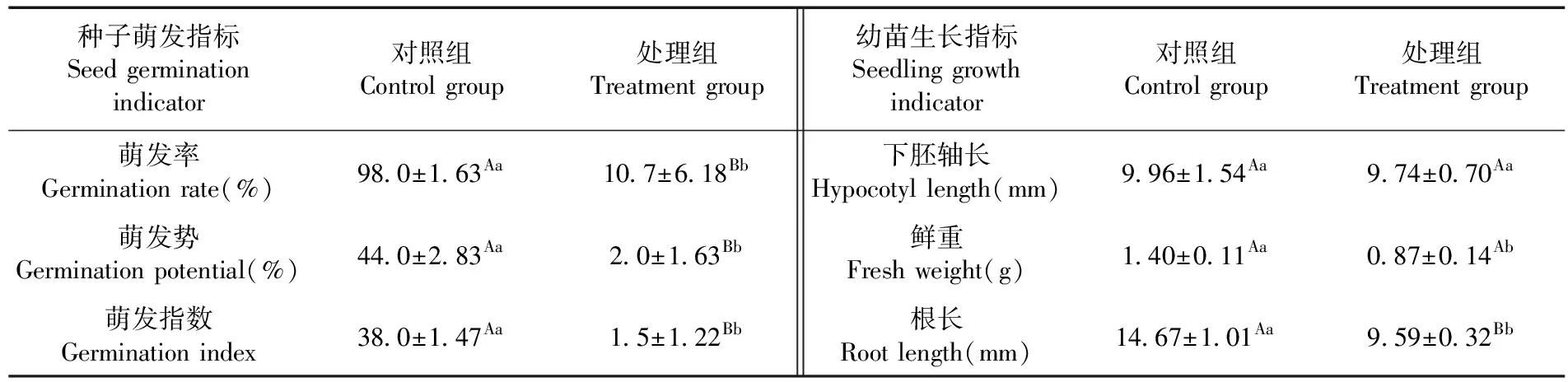
表1 下延叶古当归种子粉末浸取液下白菜种子萌发及幼苗生长变化
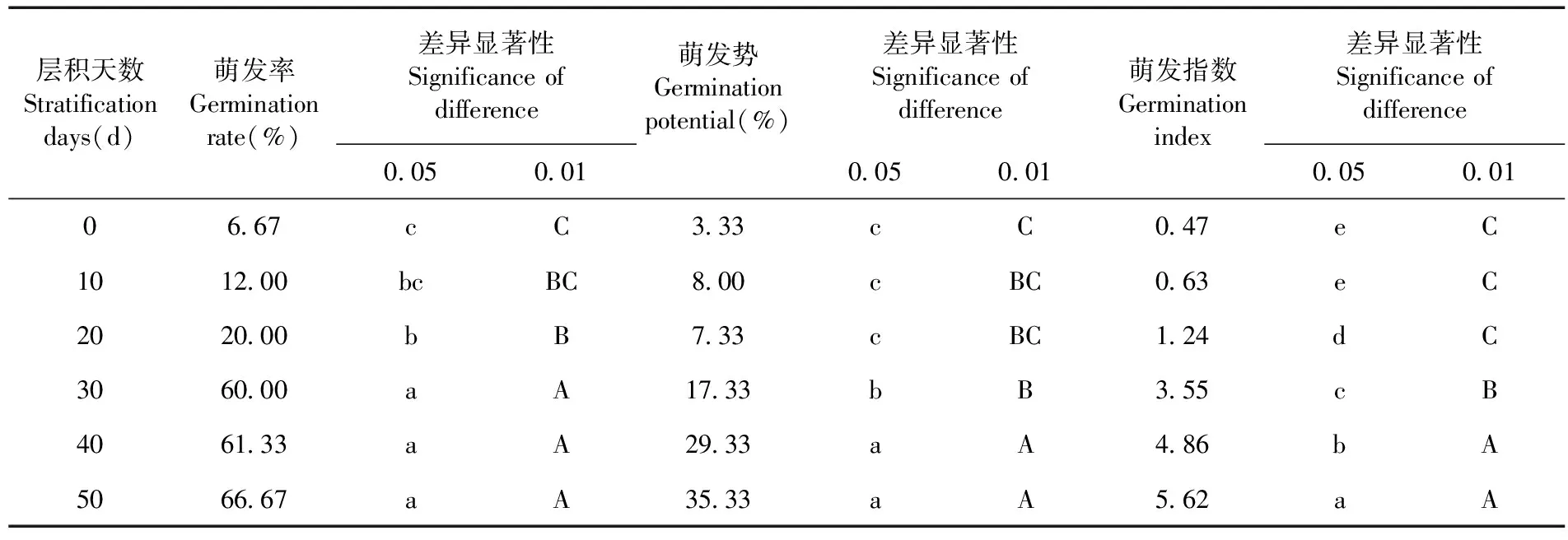
表2 低温层积处理中下延叶古当归种子萌发率、萌发势、萌发指数变化
2.3.2 低温层积处理对种胚生长的影响
研究表明,果实成熟时种子胚较小,呈椭圆形,未分化完全,种子胚率仅有15.70%;层积过程中种胚继续生长发育,在层积50 d时,种子胚率达到27.67%;种子在培养皿纸培过程中种胚会进一步生长发育,胚根突破种皮时胚率达到51.33%,未经层积的种子胚率变化不明显,下延叶古当归存在种子形态后熟现象。图2,表3

表3 低温层积过程中下延叶古当归种子胚率变化
2.4 赤霉素的浓度与浸种时间对种子萌发影响
研究表明,在相同浸种时间下,所有赤霉素浓度处理组的种子萌发率、萌发势、萌发指数均高于对照组;使用浓度为1 000 mg/L的赤霉素处理种子其萌发率随着浸种时间延长不断增加,其他处理组则是随赤霉素浓度和浸种时间的提升,种子各项萌发指标均呈先上升后下降的趋势,赤霉素对种子萌发具有促进作用,但过高的赤霉素浓度和浸种时间的组合会使赤霉素对种子萌发的促进效果降低。对比所有组合间种子萌发率、萌发势、萌发指数的差异显著性,赤霉素浸种时间为24 h,浓度分别为2 000、3 000和4 000 mg/L的三种处理组合种子各项萌发指标最高,且无显著差异,三种处理组合对于促进种子萌发的效果最佳。表4
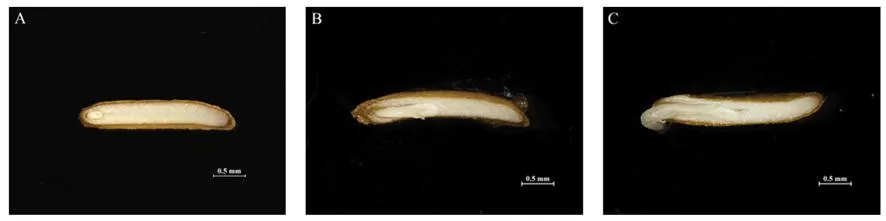
注:A:新鲜种子;B:低温层积50 d的种子;C:胚根突破种皮的种子
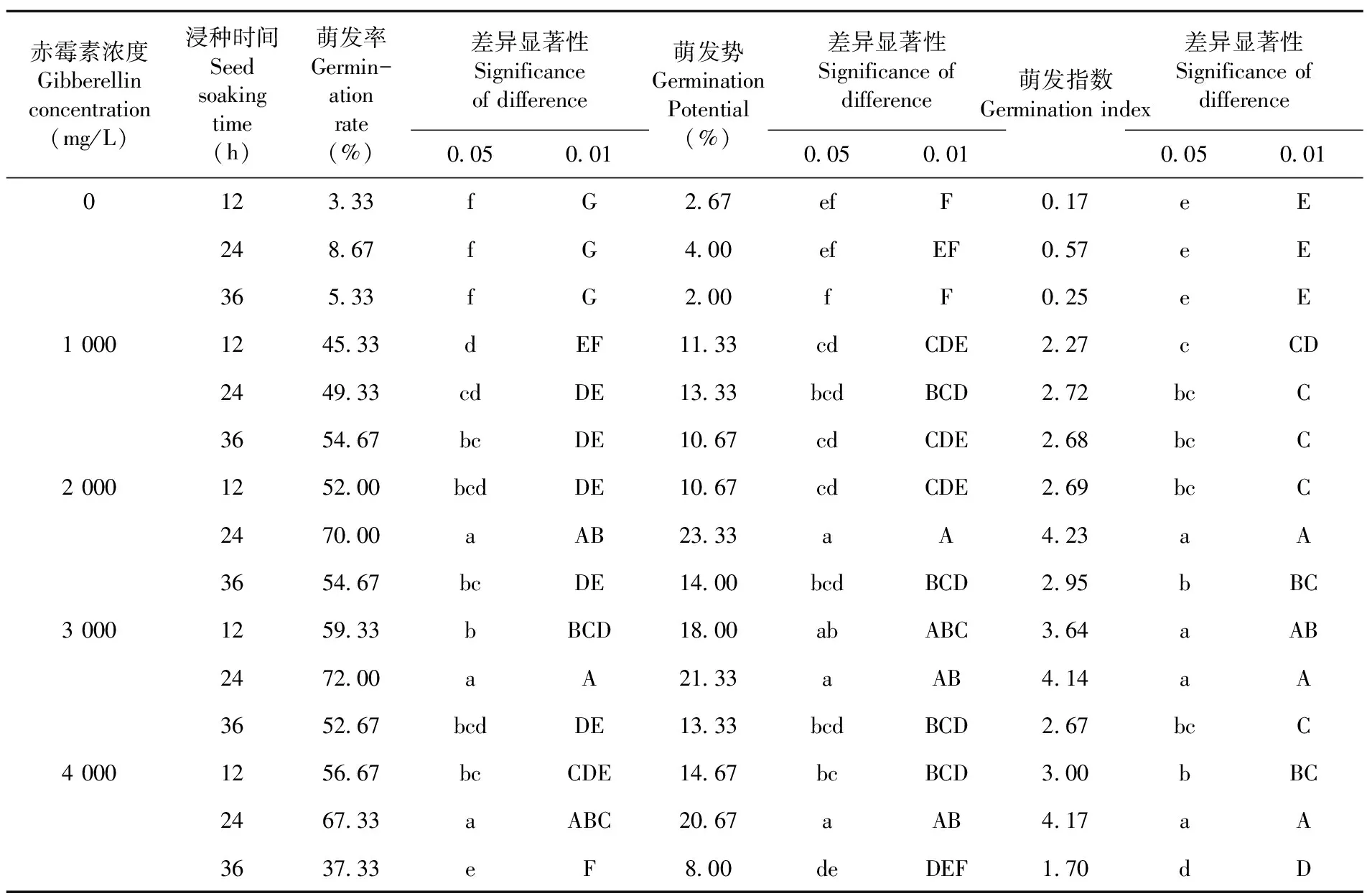
表4 赤霉素浓度和浸种时间组合对下延叶古当归种子萌发变化
两者及两者间交互作用对种子萌发率的影响显著,不同赤霉素浓度与浸种时间的综合处理对种子萌发具有增益效果。表5

表5 赤霉素浓度和浸种时间对下延叶古当归种子萌发率的双因素方差
3 讨 论
3.1 种子的休眠类型
Baskin等[22]将种子休眠类型划分为物理休眠(PY)、生理休眠(PD)、形态休眠(MD)、形态生理休眠(MPD)和复合型休眠(PY+PD)五种类型,目前这一休眠分类体系已被广泛应用。完整种子能否吸水是判断种子是否存在物理休眠的标志,在研究中,通过对种子吸水率的测定可以看出种子在萌发过程中可以正常吸水,认为种子不具备物理休眠的特点。生理休眠则是由于种子内含有萌发抑制物或种胚生长势较弱引起的,通过将白菜种子置于本物种种子粉末浸取液的试验中可以看出,种子粉末浸提液对白菜种子萌发和幼苗生长具有显著抑制作用,种子内含有萌发抑制物,具有生理休眠的特点。具有形态休眠的种子通常种胚较小,未分化或分化不完全,通过对新鲜种子和层积过程中种子种胚发育变化的观察,果实成熟时的种胚胚率低,仅有15.70%,达到萌发阙值时胚率为51.33%,种子具有形态休眠的特点。下延叶古当归种子同时具有生理休眠和形态休眠的特点,属于形态生理休眠类型,与广义当归属植物林当归(Angelicasylvestris)[9]、滨海当归(Angelicakeiskei)[10]是同一种休眠类型。
种子休眠是植物长期适应复杂环境条件而形成的生理生态特性[23],在冬季寒冷的地区,许多植物的种子在秋季扩散,在土壤中经历过冬季的低温后,于第二年春季萌发。因此,休眠在调控种子萌发和出苗的时间方面起着关键作用。实验材料采集于阿勒泰地区,该地区冬季寒冷漫长,是我国最寒冷的地区之一。下延叶古当归种子扩散发生在8~9月,如果种子没有休眠,那萌发后的幼苗将很可能无法度过当地漫长的冬季。在同样分布于该地区的林当归(Angelicasylvestris)[9]、大白花贝母(Fritillariaverticillatavar.albidoflora)[24]等植物种子扩散时期和休眠特性与下延叶古当归具有高度的相似性,这种休眠特性是保障寒冷地区植物繁殖的有效策略。
3.2 打破下延叶古当归种子休眠方法
层积处理对于打破因内源抑制物存在、种胚形态发育未完全所引起的种子休眠有较好的效果[25]。在广义当归属植物的研究中,林当归(Angelicasylvestris)层积28 d后萌发率可达到50%[9],滨海当归(Angelicakeiskei)种子在层积8周后萌发率达到75%[10]。研究中,未经层积处理的种子种子萌发率仅有6.67%,经低温层积处理50 d后种子萌发率显著上升,达到66.67%。低温层积同样能够有效促进下延叶古当归种子萌发。
赤霉素是一种广泛存在的具备高度生理活性的植物激素,可诱导与种子萌发相关的酶的合成,促进种子内部物质的转化,进而促进种子萌发[26],适宜的赤霉素浓度和浸种时间的组合对于种子萌发的促进效果较好,而过高的赤霉素浓度和浸种时间的组合则会减弱对种子萌发的促进效果,甚至抑制种子萌发[27,28]。研究中,当赤霉素浓度分别为2 000、3 000、4 000 mg/L时,浸种24 h种子萌发的各项指标均高于浸种36 h的种子各项萌发指标。虽然赤霉素可以促进下延叶古当归种子萌发,但过高浓度的赤霉素和浸种时间的组合会减弱赤霉素对种子萌发的促进效果。可能是过高的赤霉素浓度和浸种时间会打破种子内激素物质的平衡,从而使种胚生长受到抑制[27]。
在其他当归属植物中,层积虽可以缓解休眠,但还仍需要额外的环境信号,如光照、温度、湿度等,多种环境因素共同作用对下延叶古当归种子休眠的影响还有待进一步研究。
4 结 论
下延叶古当归种子休眠是由于种子内萌发抑制物质和种胚发育不完全共同作用引起的形态生理休眠现象。使用低温层积和赤霉素处理均能有效促进种子萌发。在播种前,可先将种子置于5℃湿冷条件中层积50 d,或使用2 000~4 000 mg/L赤霉素浸种24 h解除其休眠提高种子萌发率。
