水铝英石对Cs的吸附及固化性能研究
2023-02-21辜证成邹若雪郭建锋
辜证成,邹若雪,崔 政,郭建锋,吴 艳,*
(1.上海交通大学 核科学与工程学院,上海 200240;2.中核四〇四有限公司,甘肃 嘉峪关 732850)
137Cs(t1/2=28.79 a)是高放废物300年内的主要高释热裂变产物之一,具有较高的放射毒性,易在水中迁移,并通过食物链在人体聚集[1]。如果将137Cs从高放废物中分离后处理,可减少玻璃固化体的体积和释热量,进而提升地质处置库的利用效率及安全性。如何实现放射性废物的减容以及安全稳定的处置形态是固化技术研究的关键,目前对于137Cs的固化手段聚焦于地聚物固化和陶瓷固化。
地聚物固化是用铝硅酸盐矿物或工业固体废物为主要原料,加入高岭土、硅酸钠、氢氧化钠,形成由[AlO4]和[SiO4]单元组成的三维网状无机聚合物[2-3]。Tian等[4]制备了粉煤灰基地质聚合物并将其用作吸附剂从溶液中去除Cs,对Cs的饱和吸附容量为0.842 mmol/g,离子交换被认为是Cs吸附到地聚物上的主要机制,而粉煤灰基地聚物固化金属离子主要依靠机械阻滞作用、吸附作用和化学作用[5]。
陶瓷固化是利用人造岩石作为多矿相固溶体,将放射性核素固溶,实现晶格固化[6-7]。Carter等[8]研究了碱硬锰矿((Ba,Cs)(Al,Ti)2Ti6O16)的抗浸出性能,在90 ℃和150 ℃的去离子水中,Ba和Cs的浸出率低于0.001 g/(m2·d),主要是由于在样品表面形成了富含Al、Ti的不透水涂层。滕元成等[9]合成了单相掺铯碱硬锰矿固溶体Csx+zBaAl2+xTi6-xO16,其中z为高温煅烧时Cs的挥发量,该固溶体在1 200 ℃下Cs无明显挥发。
铯榴石(Cs2O·Al2O3·4SiO2·nH2O)是一类有望长期固定和贮存137Cs的矿物,由于可形成稳定的晶相,对Cs的包容性好,且性质稳定。Anchell等[10]的研究发现,在铯榴石中Cs的浸出率较在硅酸盐玻璃中低约3个数量级。Hess等[11]的研究表明,经过β辐照后铯榴石只有轻微肿胀,且具有良好的抗浸出性能。
天然矿物水铝英石((1~2)SiO2·Al2O3·(5~6)H2O)是一种纳米尺寸的水合硅铝酸盐,短程有序,由于其结构的特殊性具有气体捕集的能力[13],本文拟研究水铝英石作为固化基材固封Cs的性能,并采取吸附-冷压型-烧结固化一体化工艺,探究水铝英石对Cs的固封性能和机制,包括水铝英石在液相中对Cs的吸附性能和高温固化反应机理,并从量子化学计算角度分析烧结产物的结构特征,为放射性核素Cs的安全处置提供技术支持。
1 方法
1.1 主要试剂
硝酸铯,分析纯,阿拉丁试剂有限公司;水铝英石((1~2)SiO2·Al2O3·(5~6)H2O),日本Hattori公司。水铝英石中各元素的含量列于表1。

表1 水铝英石的元素组成Table 1 Main element component of allophane
高分辨场发射扫描电子显微镜(SEM),美国FEI公司;X射线能谱仪(EDS),美国赛默飞公司;XRF-1800波长色散型X射线荧光光谱仪(XRF)、AUY2000电子天平,日本岛津公司;多功能X射线衍射仪(XRD),德国Bruker公司;SA-2100E纯水仪,东京理化器械株式会社;A-1000S水浴摇床,日本EYELA公司;SP3880原子吸收分光光度计,上海光谱仪器有限公司。
1.2 水铝英石吸附实验
具体过程如下:1) 配置pH=1~9、Cs浓度为100~1 200 mg/L的去离子水溶液;2) 取5 mL上述含Cs溶液与100 mg水铝英石混合;3) 将混合液置于恒温水浴(水浴温度25 ℃)摇床中,以120 r/min振荡24 h;4) 取出反应液过滤,分别收集上清液和固相,固相为吸附Cs的水铝英石(Cs-水铝英石)。采用原子吸收分光光度计测量吸附前后溶液中Cs的浓度。
以式(1)~(3)计算分配系数Kd、吸附率R及吸附容量qt。
(1)
(2)
qt=(c0-ct)V/m
(3)
式中:V为溶液体积,L;c0为Cs的初始浓度,mg/L;ct和ce分别为吸附时间为t和吸附平衡时Cs的浓度,mg/L;m为水铝英石的质量,g。
1.3 固化体制备与性能测试
取1.2节所得Cs-水铝英石,用柱状模具在40 MPa压力下,将Cs-水铝英石冷压制成直径约10 mm的圆片,并置于马弗炉中,在800~1 200 ℃下烧结,升温速率保持在10 ℃/min,保温1 h,获得Cs-水铝英石自吸附固化体。
为研究Cs含量对水铝英石固化性能的影响,将水铝英石粉末和CsNO3粉末以一定质量比混合,充分研磨得到Cs质量含量分别为1%、5%和10%的水铝英石-CsNO3混合物。将混合物按上述方式冷压成型、烧结,制成Cs-水铝英石固化体。采用SEM观察烧结固化体的表面形貌,EDS观察固化体表面元素分布,XRD确定固化体晶体结构。Cs的固定率为烧结后与烧结前固化体中Cs元素的质量比,通过XRF测量固化体烧结前后Cs元素的质量分数,按式(4)计算Cs的固定率S。
(4)
式中:m0与m分别为烧结前、后固化体的质量;w0与w分别为烧结前、后固化体中Cs的质量分数。
1.4 密度泛函计算
为研究不同Cs含量下固化体的晶体结构,本文采用密度泛函(DFT)计算铯榴石结构中K原子取代Cs原子形成混晶(CsxK1-xAlSi2O6)的取代能,其定义为:
E取代=E(Cs)+E(CsnK16-nAl16Si32O96)-
E(K)-E(Csn+1K15-nAl16Si32O96)
(5)
其中:E(Cs)为Cs原子的能量;E(K)为K原子的能量;E(CsnK16-nAl16Si32O96)、E(Csn+1K15-n-Al16Si32O96)分别为取代前后晶胞的能量。为定量评估晶体对Cs的固定效果,本文计算了晶体中Cs原子与周围原子成键的键能。其计算公式为:
E键能=Edefect(CsxK1-xAlSi2O6)+
E(Cs)-E(CsxK1-xAlSi2O6)
(6)
其中:Edefect(CsxK1-xAlSi2O6)为具有1个Cs原子空位的缺陷晶体的能量;E(CsxK1-xAlSi2O6)为完整晶体的能量。
为研究固化体中Cs的成键类型,本文还计算了铯榴石(CsAlSi2O6)晶胞中的电荷分布。所有DFT计算均通过VASP程序包[14],采用PAW赝势和GGA-PBE 交换关联函数,截断能ENCUT=400 eV。结构优化时,选布里渊区Gamma点计算,电子自洽计算收敛至10-4eV,结构优化收敛标准为所有原子的受力均小于0.2 eV/nm。计算电子结构时,在布里渊区以Gamma点为中心划分格子,电子自洽计算收敛至10-5eV。
2 结果与讨论
2.1 吸附等温线
为获得最佳的吸附条件,首先研究了pH值对吸附性能影响,结果示于图1。由图1可见,分配系数Kd随pH值的增大而增大,pH=3~9时Kd>150 cm3/g。吸附率在pH=5附近时达到最大,约为90%。此外,从图1还可看出,pH=1时,水铝英石几乎不吸附Cs,这是因为酸性条件下溶液中的H+与Cs+存在竞争效应,因此,水铝英石对Cs的吸附选择pH中性及弱碱性环境为佳。
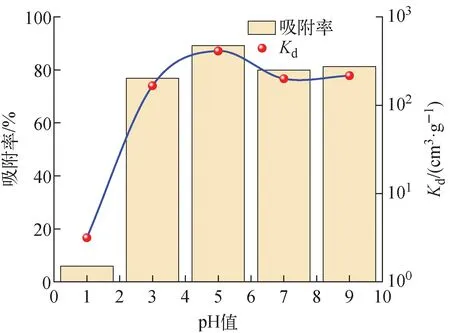
图1 吸附分配系数及吸附率随pH值的变化Fig.1 Variation of adsorbed distribution coefficient and adsorption rate with pH value
Langmuir、Freundlich、Redlich-Peterson和Koble-Corrigan是4种经典的吸附等温线模型。本文采用这4种吸附等温线模型对吸附容量数据进行拟合,分析pH=5.5条件下水铝英石对Cs的吸附特性。
Langmuir吸附等温线模型是一种单分子层吸附理论模型,方程式[15-16]为:
(7)
式中:qe为平衡吸附容量;Ka为单分子层吸附平衡常数;qm为最大吸附容量,mg/g。
Freundlich吸附等温线模型应用于多层物理化学吸附过程,方程式[17-21]为:
(8)
式中:KF为水铝英石对Cs的相对吸附容量常数,mg·g-1/(L·mg-1)n;1/n为吸附过程强度常数,0.1<1/n<0.5时吸附剂易于吸附目标元素,1/n>2时吸附过程难以发生。
Redlich-Peterson吸附等温线模型方程式[22-23]为:
(9)
式中:KR(L/g)和Kp(L/mg)为与吸附能力有关的常数;g为该吸附等温线模型的经验常数,取值0~1。
该模型同时具有Langmuir吸附等温线模型和Freundlich吸附等温线模型的特征,当参数g变化时,Redlich-Peterson吸附等温线模型可转化为上述两种模型:g=1时为Langmuir吸附等温线模型;Kp≫1时,分母中的1可忽略,g为特定值时转化为Freundlich吸附等温线模型。
与Redlich-Peterson吸附等温线模型相似,Koble-Corrigan吸附等温线模型同样结合了Langmuir吸附等温线模型和Freundlich吸附等温线模型的特征,方程式[24]为:
(10)
式中,a、b、n均为Koble-Corrigan模型常数。若n=0~1,则说明该吸附过程具有Langmuir模型和Freundlich模型的共同特征。
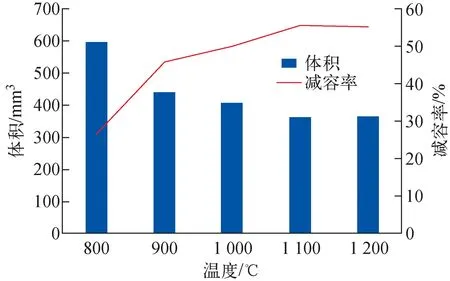
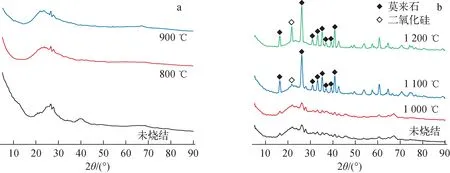
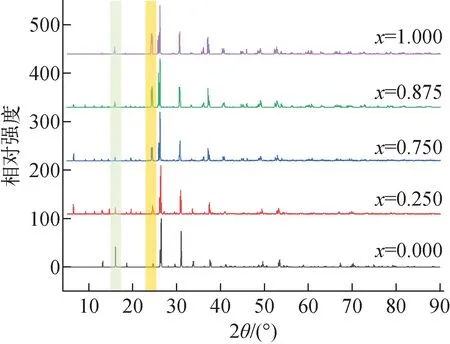
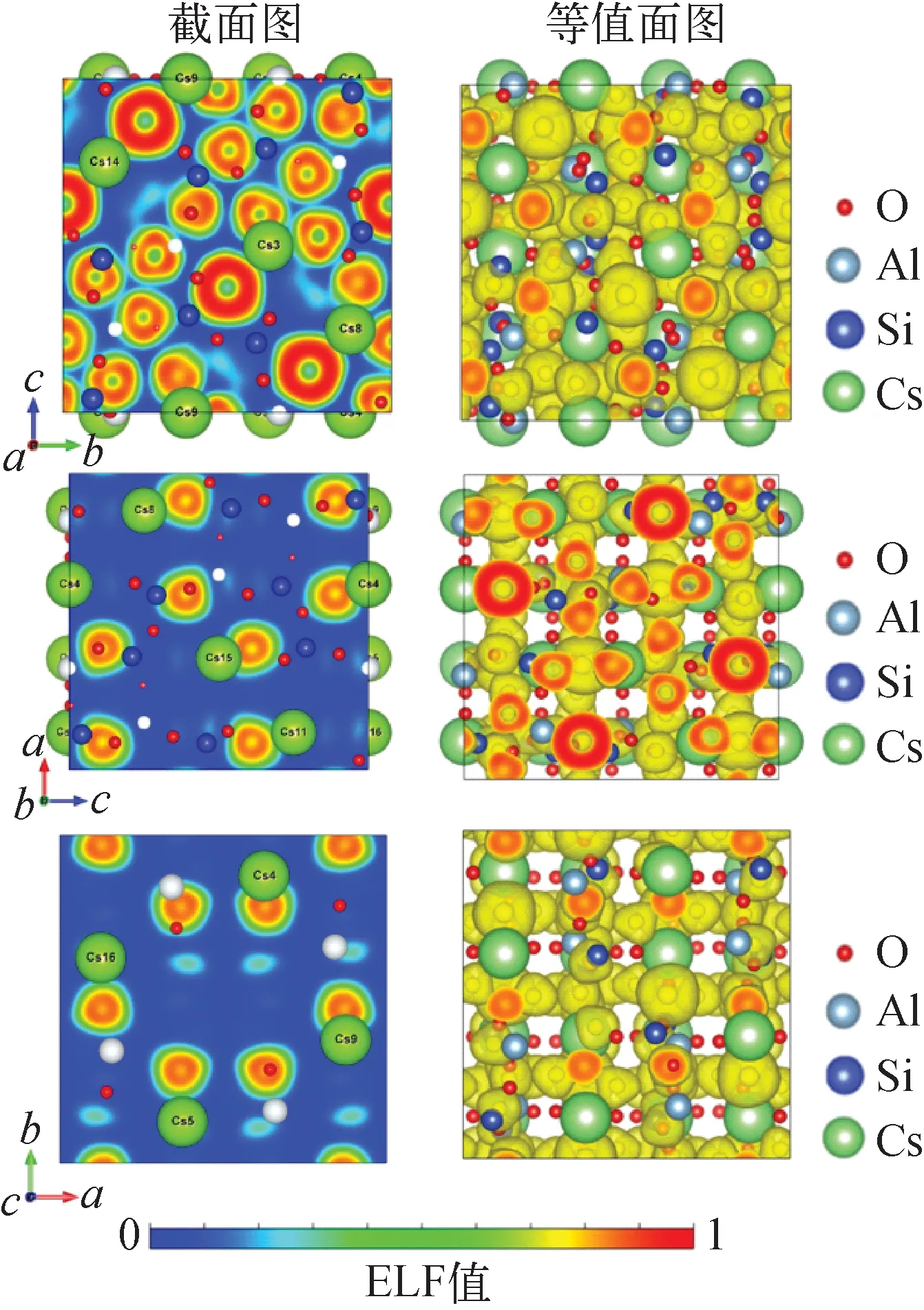
采用上述4种吸附等温线模型对pH=5.5,温度T=25 ℃,c0分别为100、200、400、600、1 000、1 200 mg/L,V=5 mL,m=0.1 g条件下吸附24 h得到的平衡吸附容量实验数据进行拟合,结果示于图2,拟合参数列于表2。由图2可见,在pH=5.5条件下,Cs的饱和吸附容量qe为11.095 mg/g。由拟合参数可知,4种模型的相关系数均大于0.94,都具有较好的拟合效果,Langmuir模型对吸附剂的饱和吸附容量拟合结果为11.014 mg/g,与实验值接近。其中,Koble-Corrigan模型拟合的相关系数最接近于1(R2=0.973),水铝英石对于Cs的吸附更符合该类型的吸附等温线模型,且由于0 图2 Cs的吸附等温线Fig.2 Adsorption isotherm of Cs Cs-水铝英石在不同温度下烧结形成的固化体及其体积和减容率分别示于图3、4。由图3可见,冷压成型未烧结的Cs-水铝英石呈黄棕色,随着烧结温度的升高,固化体颜色变浅、体积变小,说明固化体的微观结构在高温下发生了变化。由图4可见,烧结温度大于900 ℃后,固化体体积明显减小。1 100~1 200 ℃烧结温度范围内,体积减小超过55%。可见,烧结有利于实现废物最小化。 表2 等温吸附模型拟合参数Table 2 Fitting parameter of isothermal adsorption model 图3 不同温度烧结的Cs-水铝英石固化体Fig.3 Cs-allophane solidified products sintered at different temperatures 图4 不同烧结温度下Cs-水铝英石固化体的体积与减容率Fig.4 Volume and volume reduction ratio of Cs-allophane solidified product sintered at different temperatures 不同烧结温度下所形成固化体的表面形貌示于图5。从图5c、f可看出,经800 ℃和1 000 ℃烧结的固化体表面疏松,具有孔隙结构。相对松散的结构可能会对固化体的机械性能产生影响。随着烧结温度的升高,固化体表面孔隙和缝隙减少,达到1 200 ℃(图5i)时,固化体表面开始熔融,形成光滑、致密的结构。 图5 不同温度烧结的Cs-水铝英石固化体的SEM图像Fig.5 SEM image of Cs-allophane solidified product sintered at different temperatures 采用EDS扫描1 200 ℃下烧结的固化体,观察烧结固化体表面的元素分布,结果示于图6。EDS图像中亮度高的位置表明元素含量高。由图6可知,固化体中Si、Al、O的含量较高,它们是水铝英石的主要组成元素。烧结后,Cs在固化体表面的分布与Si、Al、O的分布相似,说明水铝英石具有固化Cs的能力。 图6 1 200 ℃烧结固化体表面的元素分布Fig.6 Surface element distribution of Cs-allophane solidified product sintered at 1 200 ℃ XRD可直接探测不同温度烧结固化体的晶格结构,分析固化体的结晶形态以评估固化效果。冷压成型未烧结、800 ℃和900 ℃下烧结固化体的XRD谱示于图7a,1 000、1 100、1 200 ℃下烧结固化体的XRD谱示于图7b。由图7a可见:未烧结的Cs-水铝英石没有形成明显的衍射峰,说明水铝英石是非晶体结构;26.6°和28°处有2个微弱的衍射峰,这可能是因为水铝英石是由二氧化硅和氧化铝构成的球壳状结构[19],该结构具有短程有序性;经800 ℃和900 ℃烧结,晶体结构没有明显变化,说明固化体中没有生成晶相,非晶相固化体与Cs原子形成的结构不稳定,对Cs原子的作用力弱。由图7b可见,当烧结温度达到1 000 ℃时,XRD谱上形成了多个衍射峰,说明形成了晶相,但峰强较弱,表明固化体的结晶程度低。烧结温度升高到1 100 ℃时,XRD谱上出现了明显的莫来石(Al6Si2O13)衍射峰,而1 200 ℃时出现了莫来石和二氧化硅的衍射峰。据此可知,Cs-水铝英石固化体在1 200 ℃烧结形成了莫来石和二氧化硅晶体。没有检测到含铯晶相,这可能是因为Cs的含量较少,Cs原子掺杂进入Al、Si、O等元素形成的晶体结构中所致。 图7 不同温度烧结固化体XRD谱Fig.7 XRD of Cs-allophane solidified products sintered at different temperature 由前期研究[12]可知,Cs在400 ℃以上高温烧结过程中易形成Cs2O气体而挥发。不同烧结温度下Cs-水铝英石固化体对Cs的固定率示于图8。由图8可见,经800~1 200 ℃烧结后,固化体中的Cs含量几乎与烧结前一致,固定率接近100%,说明水铝英石抑制了Cs的挥发,具有稳定固化Cs的能力。 Cs在固化体中的含量会影响固化体的结晶行为,进而影响固化性能。为进一步解析固化体的晶相结构,本文研究了不同Cs含量下固化体的结晶行为。Cs质量分数为10%时,不同烧结温度下形成的固化体的表面EDS图像示于图9。由图9可见,烧结温度为800 ℃和1 000 ℃时,固化体中没有形成稳定的晶体结构,Cs元素均匀分布在固化体表面。当温度升高到1 200 ℃时,Cs的分布明显不均匀,出现了聚集区,说明高温烧结形成了富Cs结晶相。 图9 不同温度下固化体表面Cs(Lα1)元素的分布Fig.9 Cs (Lα1) distribution of solidified products sintered at different temperatures 不同Cs含量时1 200 ℃下烧结固化体的XRD谱示于图10。由图10可见,1 200 ℃烧结后,不同Cs含量固化体的晶体结构发生了变化。Cs含量为1%时没有检测到明显的Cs晶相,主要是水铝英石自烧结形成的莫来石结构。Cs含量为10%时,生成了铯榴石(CsAlSi2O6)晶相。这表明Cs元素与水铝英石在高温下可形成具有晶体结构的稳定固化体。这与文献[18]的研究结果一致,即水铝英石能选择性地捕获Cs2O,抑制其挥发,形成铯榴石晶体,从而固化Cs,其可能的化学反应如下: (11) 图10 不同Cs含量时1 200 ℃下烧结固化体的XRD谱Fig.10 XRD pattern of solidified productswith difference Cs contents sintered at 1 200 ℃ 另一方面,Cs含量为5%时尽管检测到了铯榴石结构的衍射峰,但属于铯榴石结构的约24°的特征峰很弱,说明此含量下固化生成的并非纯的铯榴石晶相,可能有其他杂质离子掺杂进入铯榴石的晶体结构中,发生类质同象替代原有晶格中的部分Cs位点,导致铯榴石晶体的衍射峰发生改变。相互取代的质点(原子或离子)拥有相同的价态,且半径差值与较小离子的半径比满足10%<(r1-r2)/r2<20%~25%,完全类质同象能在高温条件下形成[25]。考虑到水铝英石中含有少量K,K与Cs价态相同,在固化体中的摩尔含量与Cs相当(表1),且(rCs+-rK+)/rK+=27%,根据以上理论可认为,K在高温下能与Cs发生类质同象,形成CsxK1-xAlSi2O6混晶结构,CsAlSi2O6和Cs0.875K0.125AlSi2O6的晶胞结构如图11所示。图11b即为部分Cs位点被K取代所形成的混晶晶胞结构。 图11 CsAlSi2O6(a)和Cs0.875K0.125AlSi2O6(b)的晶胞结构Fig.11 Crystal structure of CsAlSi2O6 (a) and Cs0.875K0.125AlSi2O6 (b) 为进一步验证Cs含量较低时,K取代铯榴石中Cs的合理性,本文采用DFT计算K取代Cs的取代能,结果示于图12。图12显示,在不同Cs含量下取代能均小于0,说明K原子取代铯榴石中的Cs原子使体系能量降低,更稳定。因此,K原子取代铯榴石中的Cs原子形成CsxK1-xAlSi2O6在热力学上是有利的。 图12 CsxK1-xAlSi2O6中K取代Cs的取代能随Cs含量的变化Fig.12 Substitution energy change of K substitutedCs in CsxK1-xAlSi2O6 with content of Cs 根据XRD谱可进一步分析CsxK1-xAlSi2O6的晶格结构。根据图12的计算结果对晶胞进行结构优化,优化后的CsxK1-xAlSi2O6的模拟XRD谱如图13所示。由图13可见,当有Cs原子加入(x=0.000~0.250)时,模拟XRD谱中16.5°处的峰强明显降低。16.5°处的峰对应于KAlSi2O6中(211)晶面的衍射,其强度降低可能是因为Cs原子掺入破坏了KAlSi2O6结构的对称性,导致衍射峰减弱。16.5°处峰强的变化规律与图10一致。此外,图13还表明,随着Cs含量的提高,24.3°处的衍射峰强度逐渐减弱,这也与图7的实验结果吻合。CsxK1-xAlSi2O6模拟XRD结果与固化体实测XRD特征峰的变化趋势一致,再一次说明Cs与水铝英石高温烧结固化可能形成了CsxK1-xAlSi2O6晶体。 图13 CsxK1-xAlSi2O6计算模拟XRD谱Fig.13 Simulated XRD of CsxK1-xAlSi2O6 本文通过DFT计算来研究固化体固定Cs的机理。采用DFT计算得到铯榴石晶胞,a、b、c晶向截面ELF图和等值面ELF图示于图14。ELF描述的是三维实空间电子的定域程度,其值域为0~1,ELF值越大表明在位置空间中该处的电子越不易逃逸。ELF广泛用于判断化学键类型。铯榴石中,Cs原子与近邻原子成键方式有多种。如图14中标号为Cs3的原子与左下方2个O原子和1个Si原子形成的区域中电子定域程度高,表明该区域电子被限定,Cs3与近邻的Si、O形成多中心共价键。Cs15与左边的Al、Si、O原子之间的区域内,电子定域程度低,说明这些原子更可能形成离子键。ELF的计算结果显示,Cs原子在铯榴石晶体中与其他原子形成多种形式的共价键、离子键等,因而能被固定。 图14 铯榴石不同晶面ELF图Fig.14 ELF images of different sections in pollucite conventional cell 为定量评估晶体对Cs的固定效果,本文计算了晶体中Cs原子与周围原子成键的键能,结果列于表3。由表3可知,Cs原子在Cs0.25K0.75AlSi2O6中的键能大于CsAlSi2O6中的。这是因为K原子掺杂替代铯榴石(CsAlSi2O6)晶胞中的部分Cs原子形成Cs0.25K0.75AlSi2O6,晶体的结构发生了变化,原CsAlSi2O6晶胞中部分被Cs原子占据的格点变为被K原子占据。根据式(5),键能是晶胞中单个Cs原子与其余原子的结合能,其大小是晶体中原子核与原子核、原子核与电子、电子与电子共同作用的结果。由于CsAlSi2O6与Cs0.25K0.75AlSi2O6晶胞结构中占据晶格点的原子有区别,导致Cs原子与其他原子、电子相互作用的结合能不同,因此两种结构中Cs的键能不同。Cs原子在Cs0.25K0.75AlSi2O6中的键能更大,说明Cs原子与晶体结合更紧密,固定效果更好,表明K原子掺杂进入铯榴石晶体结构提高了Cs的键能,有利于Cs被固定。DFT计算结果从理论上预测了,相比于形成CsxK1-xAlSi2O6,Cs含量过高形成的CsAlSi2O6将不利于其固化。 表3 不同晶体结构中Cs的键能Table 3 Bond energy of Cs in different crystal structures 本文通过对天然矿物水铝英石对Cs的吸附和固化性能的研究,得到如下主要结论。 1) 通过调控pH值能提高水铝英石对Cs的吸附性能,pH=1~3的酸性环境抑制了水铝英石对Cs的吸附;pH=4~9时,Cs的分配系数显著提高,即水铝英石在中性和偏弱碱性环境中吸附效果最佳。 2) 水铝英石对Cs的吸附为单层与多层吸附的共同作用。在pH=5.5的环境中,Cs的饱和吸附容量达11.1 mg/g。 3) 以水铝英石为固化基材,烧结温度为1 200 ℃时,固化体表面熔融、致密,形成晶体结构,Cs的固定率接近100%,减容率超过55%。 4) 高温烧结形成的固化体的晶体结构与Cs的含量有关,Cs含量小于5%时,主要晶相为莫来石;Cs含量等于10%时,主要晶相为铯榴石结构。DFT计算分析表明,Cs含量较低时,固化体的含铯晶相可能为CsxK1-xAlSi2O6。 5) 电子结构和能量计算表明,水铝英石对Cs的固化机理为Cs与晶格中的原子形成离子键和共价键。在铯榴石中Cs的键能为5.85 eV。K原子取代铯榴石中部分Cs原子形成CsxK1-xAlSi2O6结构,使Cs的键能提高到7.25 eV/原子,有利于Cs的固化。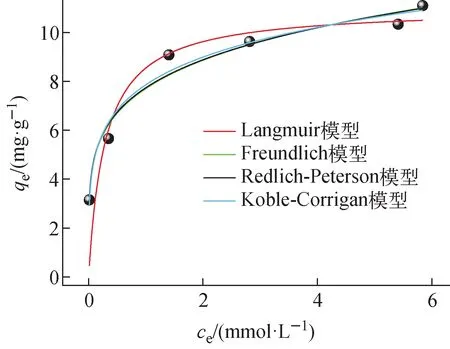
2.2 烧结温度对固化性能影响




2.3 Cs含量对固化性能影响




2.4 固化机理

3 结论
