NICU新生儿脐静脉置管血流感染风险预测模型的构建与验证
2023-02-21苗逸群刘文文赵淑良姜汇敏李亚男王爱华张媛媛
苗逸群,刘文文,赵淑良,姜汇敏,李亚男,滕 平,王爱华,张媛媛
(1.潍坊医学院护理学院,山东 潍坊 261053;2.潍坊市妇幼保健院产房,山东 潍坊 261011)
脐静脉置管是指新生儿脐静脉尚未关闭,将一次性硅胶导管插入脐静脉,经静脉导管置入下腔静脉的一种中心静脉置管术[1]。脐静脉置管操作简单且成功率高,可在新生儿生后迅速建立静脉通路,降低由高渗溶液引起的皮下坏死风险,还能避免因反复穿刺给新生儿带来的疼痛及损伤,是新生儿重症监护病房(neonatal intensive care unit, NICU)救治危重新生儿的重要技术[2]。但脐静脉置管作为一种侵入性操作,可能伴发多种并发症,其中中心静脉导管相关血流感染(central line-associated bloodstream infection,CLABSI)是最常见且严重的感染性并发症,严重影响新生儿的治疗成效及生存质量[3]。因此构建一个有效、直观的风险预测模型,对NICU新生儿脐静脉置管血流感染进行风险筛查及早期干预,是降低感染发病率的关键。目前国内尚无适用于NICU新生儿脐静脉置管血流感染的风险预测模型。基于此本研究构建并验证NICU新生儿脐静脉置管血流感染风险预测模型,旨在为医务人员早期监测及精准预防提供便捷的工具。
1 对象与方法
1.1 研究对象 回顾性选取2020年7月—2022年7月潍坊市某三甲医院NICU内行脐静脉置管的新生儿为研究对象。2020年7月—2021年12月纳入的病例作为建模组,根据是否感染分为感染组和非感染组,2022年1—7月收集的病例作为验证组。纳入标准:(1)胎龄<37 W;(2)新生儿脐带未干结,脐静脉血管未闭锁,符合脐静脉置管术适应证;(3)首次使用脐静脉置管,置管时间超过24 h;(4)新生儿各项临床资料完整。排除标准:(1)新生儿存在器官或系统发育畸形;(2)入院时即存在感染征象;(3)凝血功能异常。本研究经医院伦理委员会审核批准通过(潍坊妇幼科研批第158号)。
1.2 研究方法
1.2.1 诊断标准 脐静脉置管血流感染诊断标准依照《新生儿脐静脉置管相关并发症防控指南》[4]:留置或拔除脐静脉置管48 h内的新生儿出现明显感染症状,即发热、寒战或低血压等,且除脐静脉置管外无其他明确感染源;同时采集导管血和外周血进行培养,若两者培养分离到同一种病原体,且导管血培养阳性的时间早于外周血>2 h,则诊断为脐静脉置管血流感染。病原学监测细菌分离培养严格按照《全国临床检验操作规程》,通过细菌鉴定药敏系统(法国梅里埃公司),采用VITEK 2 Compact微生物全自动分析仪和配套试剂药敏鉴定卡片进行细菌种类鉴定。
1.2.2 资料收集方法 基于文献回顾及专家讨论,纳入18个可能影响脐静脉置管血流感染的因素。具体包括以下内容,(1)新生儿基本信息:胎龄、出生体重、新生儿窒息史、机械通气史、输血治疗史、经外周静脉穿刺中心静脉置管(PICC)治疗史、肺表面活性物质的使用、喂养方式;(2)置管相关信息:置管人员、置管前泡管方式、置管日龄、置管总时间、穿刺次数;(3)出生后第一次血常规参数:白细胞、清蛋白、血红蛋白、血小板计数、总胆红素。所有数据由统一培训的研究人员通过医院电子病历系统、护理文书系统、病案室档案等获取。收集过程中严格遵循保密原则,调查完成后由专人保管,并对其所有数据进行核实。
2 结果
2.1 一般情况 最终纳入2020年7月—2021年12月符合标准的447例新生儿作为建模组,根据是否感染分为感染组34例,非感染组413例,感染发病率为7.6%。将2022年1—7月收集的225例新生儿作为验证组。研究人群筛选流程见图1。建模组新生儿血微生物培养中共检出49株病原菌,其中革兰阳性(G+)菌20株(40.8%),主要为表皮葡萄球菌8株(16.3%),溶血性葡萄球菌5株(10.2%),金黄色葡萄球菌3株(6.1%),屎肠球菌、其他G+菌各2株(分别占4.1%);革兰阴性(G-)菌26株(53.1%),主要为肺炎克雷伯菌12株(24.5%),大肠埃希菌6株(12.2%),阴沟肠杆菌4株(8.2%),鲍曼不动杆菌、其他G-菌各2株(分别占4.1%);真菌3株(6.1%),白念珠菌、光滑念珠菌、其他真菌各1株(分别占2.0%)。

图1 研究对象筛选流程图
2.2 NICU新生儿脐静脉置管血流感染单因素分析 建模组NICU新生儿脐静脉置管血流感染单因素分析结果显示,新生儿窒息史、肺表面活性物质的使用、喂养方式、置管人员、置管前泡管方式、置管日龄、血红蛋白、血小板计数、总胆红素与NICU新生儿脐静脉置管血流感染的发生无关,差异均无统计学意义(均P>0.05);不同出生体重、置管总时间、机械通气史、PICC治疗史、输血治疗史、清蛋白水平、穿刺次数、白细胞计数的NICU新生儿脐静脉置管血流感染发病率比较,差异均有统计学意义(均P<0.05)。见表1。

表1 NICU新生儿脐静脉置管血流感染的单因素分析
2.3 NICU新生儿脐静脉置管血流感染多因素logistic回归分析 将出生体重<1 500 g(0=否;1=是)、置管总时间>7 d(0=否;1=是)、机械通气史(0=否;1=是)、PICC治疗史(0=否;1=是)、输血治疗史(0=否;1=是)、清蛋白<35 g/L(0=否;1=是)、穿刺次数>2次(0=否;1=是)、白细胞计数(原值)、胎龄(原值)作为自变量,是否发生脐静脉置管血流感染作为因变量纳入多因素logistic回归分析,结果显示,置管总时间>7 d、出生体重<1 500 g、清蛋白<35 g/L、穿刺次数>2次、机械通气史、PICC治疗史是NICU新生儿发生脐静脉置管血流感染的独立危险因素(均P<0.05),见表2。

表2 NICU新生儿脐静脉置管血流感染的多因素logistic回归分析
2.4 NICU新生儿脐静脉置管血流感染风险的列线图构建及检验效能评价 根据logistic回归分析结果,本研究拟合的回归方程为Logit(P)=-7.045+0.989×置管总时间>7 d+1.607×出生体重<1 500 g+1.854×清蛋白<35 g/L+1.749×穿刺次数>2次+0.950×机械通气史+1.382×PICC治疗史,并将其绘制成列线图,见图2;Hosmer-Lemeshow结果显示,χ2=9.235,P=0.323;Calibration图显示校准曲线与理想曲线基本重合,见图3;建模组受试者工作特征(ROC)曲线下面积为0.866(95%CI: 0.784~0.947),约登指数为0.642,最优截断点为0.066,在最优截断点灵敏度为0.853,特异度为0.789,见图4;验证组ROC曲线下面积为0.837(95%CI: 0.744~0.930),约登指数为0.549,灵敏度为0.700,特异度为0.849,见图5。
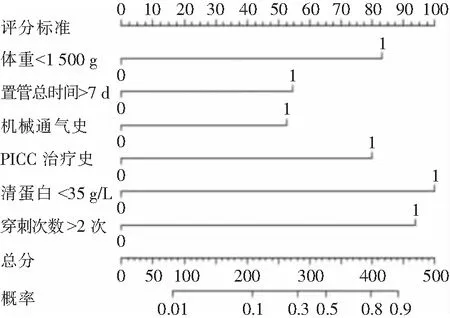
图2 NICU新生儿脐静脉置管血流感染列线图

图3 列线图预测模型的校准曲线图
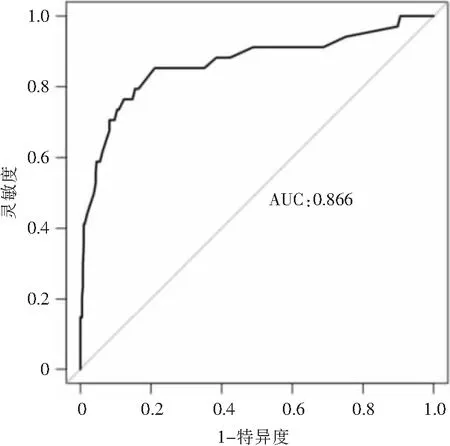
图4 建模组ROC曲线图
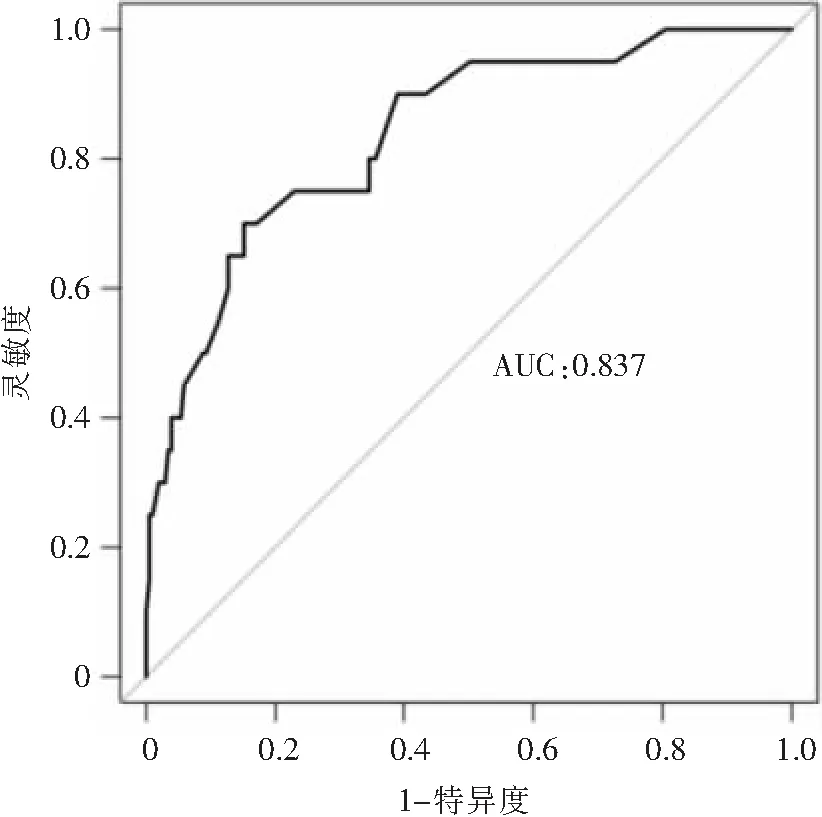
图5 验证组ROC曲线
3 讨论
本次研究选取的447例行脐静脉置管的新生儿中,发生血流感染34例,感染发病率为7.6%,低于相关研究[5]报道的10%左右,可能与本研究中脐静脉置管总体留置时间相对偏短有关。病原菌检查结果显示,NICU新生儿脐静脉置管血流感染病原菌主要以G-菌为主,最常见的是肺炎克雷伯菌,与Ardura等[6]研究结果一致,但也有研究[7]称G+菌为新生儿CLABSI最常见的病原体。而真菌感染呈散发状态,NICU常规预防性使用氟康唑明显降低了新生儿的真菌感染率[8]。不少医护人员通过在脐根部局部应用抗菌药物软膏降低细菌定植率,但适用于新生儿的抗菌药物软膏抗菌谱均较窄,还可能造成真菌感染及抗菌药物耐药,国内指南尚不推荐在脐根部常规使用抗菌药物软膏[9]。目前有研究证明,新生儿使用抗生素锁[10](即抗生素封管)可有效减少细菌在管腔中定植,由于缺少大样本多中心研究,其利弊尚存在争议[11],后续仍需进一步通过前瞻性随机对照试验提供循证依据。
本研究显示,留置总时间>7 d是NICU新生儿发生脐静脉置管血流感染的独立危险因素,与Yumani等[12]的结果一致,其研究表明脐静脉置管留置总时间>7 d的新生儿发生CLABSI的风险是留置≤7 d新生儿的5.48倍。Sanderson等[13]也发现1周内选择性拔除脐静脉置管能明显降低CLABSI。脐静脉置管术为危重新生儿建立了有效血管通道,但随着脐静脉置管留置时间的延长,细菌容易黏附在导管上并迅速繁殖,在血流冲击下静脉内膜易发生静脉炎及感染等并发症。尽管脐静脉置管留置时程与CLABSI之间的正向相关性已被证实,脐静脉置管最佳留置时程尚无确定的依据和指南[2],今后应进行大样本随机对照研究加以完善。本研究提示医务人员应每日对导管通路进行风险效益评估,尽量缩短脐静脉置管时间以保证留置管道的安全,一旦完成主要治疗或有感染依据尽早拔管。
本研究显示,极低出生体重儿是NICU新生儿发生脐静脉置管血流感染的独立预测因子,中国新生儿重症监护室协作性质量改进研究协作组[14]也证实,CLABSI发病率会随出生体重的下降呈上升趋势。分析原因,极低出生体重儿身体机能极不完善,脐带与正常新生儿相比扭曲偏细,静脉壁相对更薄,加大了置管难度及感染风险。此外,极低出生体重儿危急情况相对更多,短期内可能会被静脉注射或滴注各种抢救药物、血液制品及静脉营养液[15],脐静脉导管操作次数的增加提高了导管污染的概率。因此,医务人员应对极低出生体重儿重点监护及管理,置管期间每班评估导管通畅度,观察新生儿脐部有无渗血渗液、脐轮有无红肿及腹部有无异常[16]。
清蛋白能在一定程度上反映机体营养状况、病情危重程度。本研究结果显示,清蛋白水平<35 g/L是NICU新生儿发生脐静脉置管血流感染的独立预测因子。分析原因,清蛋白水平高低与患儿免疫水平密切相关,机体清蛋白过低可通过促进肉芽肿形成和减少胶原蛋白合成抑制先天免疫反应[17],进而诱发患儿感染;此外,清蛋白水平下降还会影响抗菌药物药效[18],导致新生儿临床抗感染能力降低,加大感染风险。因此监测新生儿清蛋白水平对预测感染的发生具有重要的临床意义。但目前清蛋白水平与CLABSI的关系研究较少,尚未受到研究人员重视,建议医务人员定期检测新生儿清蛋白水平,提高低清蛋白水平新生儿的营养支持,实施对症治疗,以提高新生儿免疫力。
穿刺次数>2次是NICU新生儿发生脐静脉置管血流感染的独立预测因子。目前穿刺人员均接受过置管专业培训,但多次或反复穿刺的情况仍难以避免。反复穿刺不仅容易导致皮肤表面的细菌进入深静脉导管从而释放入血,还增加了无菌物品暴露空气时间过长、手卫生不严格等医疗性感染风险,严重影响新生儿局部组织的抵抗、修复能力[19]。此外,穿刺次数过多会损伤血管内壁,增加新生儿的疼痛体验。因此,管理层应加强对置管人员的培训[20],定期考察操作技能,提高一针穿刺成功率;同时置管人员应严格执行手卫生消毒及无菌操作,规范中心静脉导管的维护,降低NICU新生儿脐静脉置管血流感染发病率。
本研究显示机械通气史、PICC治疗史是NICU新生儿发生脐静脉置管血流感染的独立预测因子,与相关研究[21-22]结果一致。分析原因,机械通气主要用于呼吸衰竭的新生儿[23],人工气道建立后气管直接对外,新生儿失去了正常的上呼吸道过滤作用,导致其非特异性免疫保护能力下降。此外,细菌从导管连接处进入管腔是发生CLABSI的主要方式之一[24],同时进行PICC置管增加了新生儿交叉感染的可能,因此加强关键环节的消毒是标准预防的主要措施[25]。本研究提示医务人员在临床工作中应严格把握侵入性管道的置管指征,降低环路中的交叉感染概率。目前也有研究显示,脐静脉置管联合PICC方案更能满足NICU新生儿静脉输液治疗需求[26],契合早产儿出生后早期肠外营养的治疗需要[27],但由于缺乏原始数据本研究没有具体分析,其临床效益需进一步研究论证。
本研究构建的预测模型除了包含新生儿基本情况、治疗情况及置管信息,还纳入了新生儿实验室检查指标,便于医护人员进行早期预防。此次使用列线图呈现危险因素对感染风险的贡献度,不仅可将各项指标可视、可读化,还有利于医务人员进行基于证据的个体化风险预测。一般认为,当ROC曲线下面积为0.700~0.900时,提示模型预测效果较好。本研究建模组ROC曲线分析结果显示,该模型的曲线下面积达0.866,预测模型的灵敏度和特异度分别为85.3%、78.9%,说明其诊断效能较佳;验证组曲线下面积为0.837,说明本模型在验证组中的区分度良好;校准曲线为斜率接近于1的直线,Hosmer-Lemeshow拟合优度检验χ2=9.235,P=0.323,表明该模型预测NICU新生儿脐静脉置管血流感染风险的准确性良好。
综上所述,置管总时间>7 d、出生体重<1 500 g、穿刺次数>2次、清蛋白<35 g/L、机械通气史、PICC治疗史是NICU新生儿发生脐静脉置管血流感染的独立危险因素,本研究构建的NICU新生儿脐静脉置管血流感染风险列线图模型经验证具有较好的区分度和校准度,有助于医护人员早期识别高危新生儿并及时采取干预措施,减轻导管相关并发症对新生儿造成的伤害。但本研究为回顾性、单中心研究,存在一定的局限性,需进一步通过多中心、前瞻性试验对模型进行优化及推广。
利益冲突:所有作者均声明不存在利益冲突。
