普通烟草GATA 转录因子家族鉴定及基因表达分析
2023-02-21杨玄松谢雯榕宋江雨赵云飞林晓路谢小芳张炳辉
杨玄松,谢雯榕,顾 钢,宋江雨,赵云飞,林晓路,谢小芳,张炳辉*
1. 福建农林大学生命科学学院, 福州市仓山区上下店路15 号 350002
2. 福建省烟草专卖局烟草科学研究所,福州市鼓楼区北环中路133 号 350003
3. 福建省烟草公司南平市公司,福建省南平市延平区江滨中路389 号 364200
4. 福建省烟草公司三明市公司,福建省三明市三元区崇桂新村100 幢 365000
5. 福建省烟草公司龙岩市公司,福建省龙岩市新罗区龙岩大道288 号 364000
GATA 转录因子是真核生物中一种含有高度保守的Ⅳ类锌指基序的DNA结合蛋白,这类反式作用因子能够特异性地结合含有WGATAR 的DNA 序列(其中:W对应A或T,R对应A或G),从而调控相关基因的表达。该转录因子最初在动物和真菌中被证实,之后发现GATA转录因子也大量存在于植物中[1]。
动物中GATA 转录因子的DNA 结合域表现为C-X2-C-X17-C-X2-C的形式[2],同时GATA蛋白有两个功能不同的锌指结构[3-4]。目前发现动物GATA家族有6个成员,依次为GATA1-6,根据其结构特征可分为两个亚族,其中GATA1-3 为一个亚族,GATA4-6为另一亚族[5]。有研究表明,动物中GATA转录因子与细胞的增殖分化以及动物个体的生长发育有着密切联系[2],其中GATA1-3与动物细胞的造血功能密切相关[6],而GATA4-6在动物心脏形成过程中发挥重要作用[7-8]。与动物的GATA转录因子家族不同,真菌中大多数的GATA蛋白仅包含单个锌指结构域,通常分为两大类:一类GATA蛋白是带有17个残基的Ⅳa 型锌指(C-X2-C-X17-C-X2-C);另一类则是带有18 个残基的Ⅳb 型锌指(C-X2-C-X18-C-X 2-C)[9],此外,在极少数真菌中也发现带有19个或20个残基锌指环的GATA蛋白。GATA转录因子在真菌中参与调控氮代谢、铁载体的生物合成、光诱导以及昼夜节律等过程[10]。
植物中的第1个GATA 转录因子NTL1克隆于烟草,揭示了高等植物GATA转录因子的存在,该转录因子被证实参与了氮代谢途径[11]。大多数植物GATA转录因子通常只包含1个带有18或20个残基的锌指结构域(C-X2-C-X18-C-X2-C 或C-X2-C-X20-C-X2-C),但也存在两个锌指结构域的特殊情况[12]。已有研究表明,植物中GATA 转录因子通过与启动子上的WGATAR序列结合,从而启动或抑制转录过程而调控植物的生长发育[13],包括调控花器官、茎尖分生组织的发育以及细胞的增殖与分化[14],促进种子萌发[15],调控叶绿体的形成[16],参与叶绿素的合成和葡萄糖信号传导[17],光保护反应[18],干旱、冷害、黑暗等非生物胁迫响应过程[19-22]和植物激素的合成(如细胞分裂素等)[23],以及碳、氮代谢等生物学过程[11,17]。同时研究还发现GATA转录因子对叶片衰老也起着重要的调控作用[24]。
烟草收获的主要器官为烟叶,而叶片的生长发育、叶色的转换以及衰老成熟与烟叶品质密切相关[25]。此外,在生产过程中,烟叶常常受高温和冷害等各种逆境胁迫的影响,从而影响烟叶产量。已有研究表明:GATA 转录因子在植物叶片衰老[24]和逆境胁迫过程中起着重要的调控作用[19-22]。鉴于该家族的重要性,近年来在许多植物中开展了GATA基因家族成员的鉴定和系统分析,包括水稻[1]、拟南芥[1]、大豆[26]、沙冬青[22]、苹果[23]、毛竹[27]和蓖麻[28]等。然而,目前有关烟草GATA 基因家族及其成员表达情况尚鲜见报道。为此,通过生物信息学分析在烟草全基因组范围内全面鉴定烟草GATA 转录因子家族成员,并分析GATA 家族成员在不同逆境胁迫和不同成熟时期烟叶中的表达情况,旨在为烟草GATA 转录因子的功能研究提供依据。
1 材料与方法
1.1 材料、试剂和仪器
供试品种为翠碧1 号。反转录试剂盒由福建佰孟医学科技有限公司生产;多糖多酚植物总RNA快速提取试剂盒由北京百泰克生物技术有限公司生产;引物由生工生物工程(上海)股份有限公司合成;其他常规试剂均为国产分析纯。
ETC811型基因扩增仪(东胜创新生物科技有限公司);Thermofisher ABI QuantStudio1 实时荧光定量PCR仪(QS1型,美国应用生物系统公司)。
1.2 方法
1.2.1 低温、干旱和盐胁迫处理
以培养45 d 的烟苗为材料,将幼苗移植到装有营养液的托盘中,分别进行低温胁迫(4 ℃)、干旱胁迫(托盘营养液中加入260 mmol/L 甘露醇溶液)和盐胁迫(托盘营养液中加入150 mmol/L NaCl 溶液)处理[29],并以常温(25 ℃)下托盘营养液中未添加甘露醇和NaCl为对照。在处理6 h后采集处理和对照烟苗叶片,迅速冷冻于-80 ℃冰箱中。每个样品3次生物学重复。
1.2.2 生物信息学分析
将前人已鉴定的30 个拟南芥GATA 家族成员的蛋白序列作为种子序列[1,9],利用植物数据库Phytozome(http://www.phytozome.net/)下载 30 个拟南芥GATA基因的蛋白序列。利用茄科数据库(https://solgenomics.net/)进行 BLASTP 搜索,将满足相似度≥30%,且 E 取值≤E-10的序列初筛为烟草GATA候选蛋白,随后利用在线工具CDD(https://www.ncbi.nlm.nih.gov/cdd/)对候选蛋白进行结构域鉴定,将具有GATA 蛋白典型的锌指结构域(pfam00320)的序列作为最终的候选蛋白,下载对应的基因序列并重新命名(NtGATA)。利用Protparam(http://web.expasy.org/ptotparam/)对烟草GATA蛋白的氨基酸数目、分子量、等电点和亲疏水性进行分析。
利用软件ClustalX 以及MEGA7 采用邻接法(Neighbor-Joining,NJ)进行系统发育树构建,设置1 000 次自举重复[30-31],用软件 DNAMAN 对烟草GATA蛋白进行多重序列比对[32]。
使用烟草品种K326 更新版本的基因组数据库(Edwards 2017 版本)(https://solgenomics.net/organis m/Nicotiana_tabacum/genome),从数据库中下载烟草GATA 基因结构的文件(包含GFF、核酸和蛋白序列等),利用 GSDS(Gene Structure Display Server;http://gsds.cbi.pku.edu.cn/)软件分析烟草 GATA 基因结构并绘图。利用DNAman 6.0 软件对烟草GATA基因家族成员的GATA保守域组成进行分析。利用MEME(http://meme-suite.org/tools/meme)工具获取烟草GATA 蛋白的保守基序(motif),motif 个数设置为10个。
1.2.3 基因表达分析
利用不同成熟期中部叶(M1~M5)的转录组数据[33],获取NtGATA 的表达值(FPKM 值)。不同成熟期烟叶(M1~M5)的判断主要基于叶色、叶脉和绒毛等外观特征[34]。其中:M1 叶色翠绿,茸毛多;M2叶缘泛黄,茸毛部分脱落,主脉半白;M3叶片黄多绿少,叶面出现黄色凸起,主脉和支脉有部分发白,茸毛脱落;M4 叶面80%以上变黄,茸毛脱落,主脉全白;M5 烟叶片黄白色,叶尖卷曲干枯。利用R 语言中gplots 包的Heatmap 功能分析不同成熟时期烟叶中NtGATA 基因表达量的变化。采用植物总RNA 提取试剂盒分别提取经各胁迫处理样品的总RNA。采用 SYBR Premix Ex Taq(Takara)两 步 法 进 行qRT-PCR 测定,qRT-PCR 引物序列和内参基因引物见表1。设置3次重复,以对照烟叶基因表达量为参照,采用 2-△△Ct方法[35]计算烟草 GATA 家族各个成员的相对表达量。

表1 烟草NtGATA 基因qRT-PCR 引物Tab.1 Primers for qRT-PCR analysis of NtGATA genes in tobacco
2 结果与分析
2.1 烟草GATA基因家族成员及理化性质分析
通过相似性搜索,在烟草基因组中共获得64 个初步的GATA 候选蛋白(去除重复),利用CDD 工具分析这些序列的保守结构域,发现其中7个蛋白不含该家族典型的锌指结构域(pfam00320),将这些序列剔除,最终在烟草全基因组中确定了57 个GATA 基因家族成员。对57个烟草GATA蛋白的理化性质分析(表2)发现,氨基酸长度从77 到681 不等,其中NtGATA51 的氨基酸长度最短为 77 aa,NtGATA28 的氨基酸长度最大为681 aa,说明各成员之间的氨基酸保守性较差。分子量从8 251.34 Da(NtGATA51)到 73 703.62 Da(NtGATA28)不等,等电点在 4.93~9.99 之间。所有成员的疏水性指数均为负值(-0.367~ -1.008),可见烟草GATA 蛋白均为不同程度的亲水蛋白[28]。
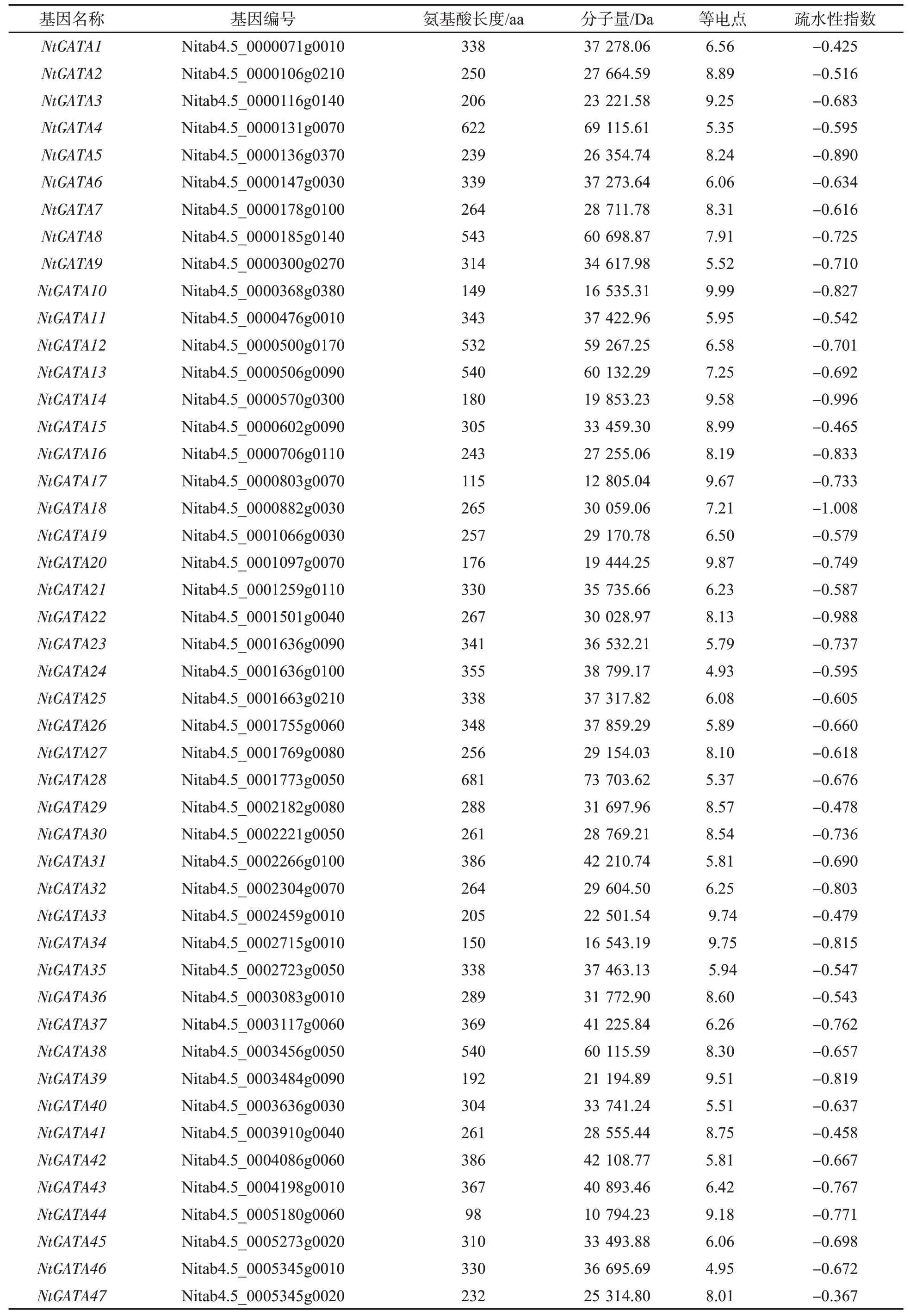
表2 烟草GATA 基因信息Tab.2 Information on GATA genes in tobacco
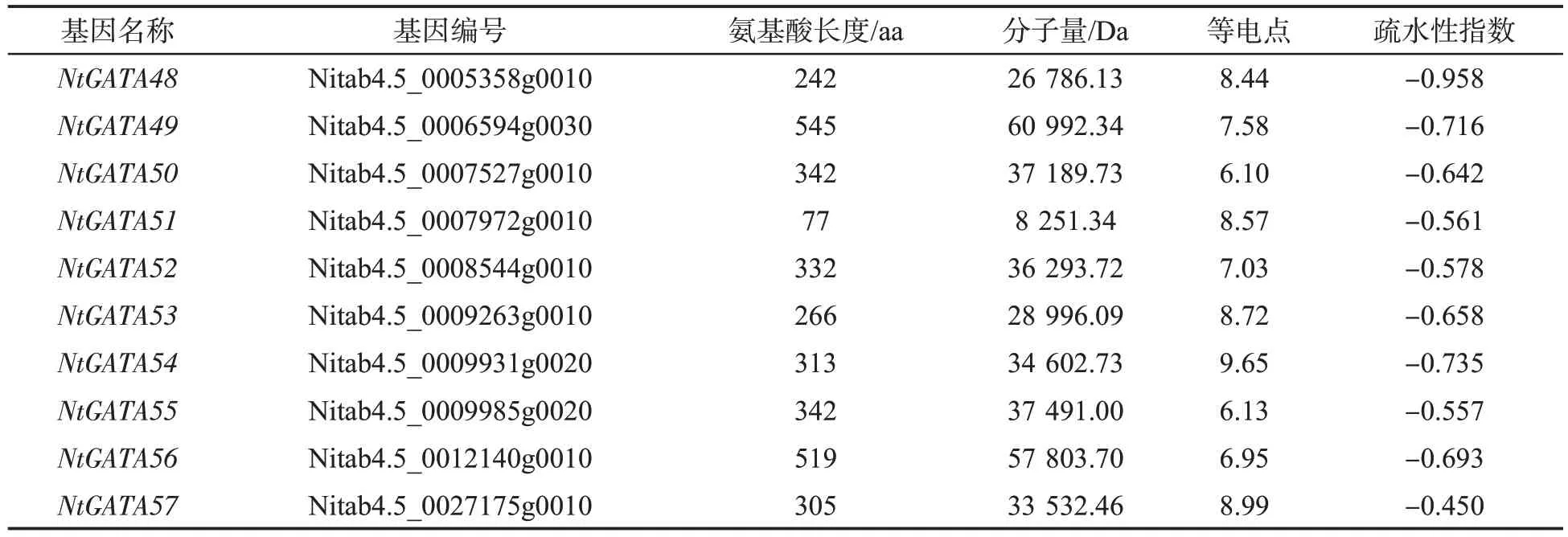
表2(续)
2.2 NtGATA基因结构与进化分析
将57个NtGATA分成4个亚族(Ⅰ~Ⅳ)(图1A),其中第Ⅰ亚族成员数量最多,达到29个(约50.9%);第Ⅱ亚族次之,包含14个成员(约24.6%);第Ⅲ亚族有8个成员(约占14.0%);第Ⅳ亚族成员最少,仅6个成员(约10.5%)。烟草GATA基因家族成员的外显子个数差异较大(图1B),变化区间在1(NtGATA16)到17(NtGATA28)之间;每个亚族具有相似的基因结构,同一亚族的外显子数量与长度大体相似;值得注意的是,第Ⅱ亚族中的NtGATA3 的基因结构与亚族中的其他成员差异较大,可能是进化过程中发生了内含子的插入;第Ⅰ亚族和第Ⅱ亚族外显子长度较长,外显子个数相对较少,大多在1~3个之间;第Ⅲ亚族和第Ⅳ亚族的NtGATAs 外显子长度较短,但是外显子个数较多,大多在8~10个之间。
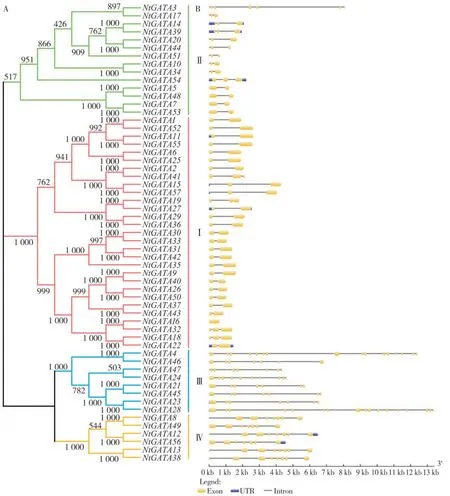
图1 烟草GATA家族基因结构分布与进化Fig.1 Structure and evolution of tobacco GATA gene family
2.3 NtGATA蛋白保守结构分析
利用MEME 工具获取了烟草GATA 蛋白的10个保守基序(motif),见表3。基序分析结果(图2)表明:同一亚族中大部分成员具有相似的基序组成。第Ⅰ亚族成员较多,其保守基序数量在1~5个之间,其中motif 2、7、9为第Ⅰ亚族特有的保守基序。第Ⅱ亚族成员只含有motif 1,是4 个亚族中motif 种类最少的亚族。第Ⅲ亚族的8 个成员中均有motif 1 和motif 4,其中两个成员(NtGATA4 与NtGATA47)还具备第Ⅲ亚族特有的保守基序motif 3 和motif 4。第Ⅳ亚族含有6种保守基序,是保守基序种类最丰富的亚族,其中motif 5、6、8、10 为第Ⅳ亚族特有的保守基序。

图2 NtGATA蛋白质保守基序分布Fig.2 Distribution of conserved motifs of NtGATA proteins

表3 烟草GATA蛋白的保守基序信息Tab.3 Conserved motifs of tobacco NtGATA proteins
通过 DNAMAN 对 57 个 GATA 蛋白序列(图 3)的联配分析发现,除第Ⅱ亚族的NtGATA44 和NtGATA51以及第Ⅳ亚族的NtGATA8、NtGATA49和NtGATA56 外的52 个烟草GATA 基因均含有完整的锌指结构域。NtGATA44 与NtGATA51 丢失了第2个 半 胱 氨 酸 对 ,而 NtGATA8、NtGATA49 和NtGATA56丢失了第1个半胱氨酸对,可能是在进化过程中造成了丢失。57个GATA蛋白锌指结构域的形式分为两大类,分别为C-X2-C-X18-C-X2-C 和C-X2-C-X20-C-X2-C。 其 中 结 构 域 为C-X2-C-X20-C-X2-C 的8 个成员均来自第Ⅲ亚族。其余49 个第Ⅰ、Ⅱ、Ⅳ亚族成员结构域均为C-X2-C-X18-C-X2-C。4 个的亚族中的结构域氨基酸组成高度保守,如锌指结构域的第13、14、17、19和20号位点上的氨基酸,依次为苏氨酸、脯氨酸、精氨酸、甘氨酸和脯氨酸(图中第1 个氨基酸作为第1个位点)。但各亚族也存在个别特异的氨基酸,如第Ⅰ亚族烟草GATA蛋白特有的保守氨基酸为锌指结构域第15 号位点上的谷氨酰胺以及第25 号位点上的苏氨酸;第Ⅲ亚族特有的保守氨基酸为第16号位点上的甲硫氨酸、第18号位点上的精氨酸以及第32号位点上的亮氨酸;第Ⅳ亚族特有的保守氨基酸为第22 号位点上的谷氨酸。此外,第Ⅲ亚族NtGATA蛋白还具有一个显著特征,即在锌指结构域的第11和12号位点上插入了两个氨基酸。

图3 烟草GATA蛋白成员保守结构域Fig.3 Conserved domains of tobacco GATA family proteins
2.4 烟草GATA转录因子家族的系统进化分析
参照 Reyes 等[1]在拟南芥中 GATA 家族的分组,整合57 条烟草的GATA 蛋白序列和30 条拟南芥的GATA 蛋白序列构建系统发育树并进行分类,将GATA 蛋白聚类成4 个亚族,见图4。各个亚族成员数量分布与拟南芥基本吻合[1,29],其中第Ⅰ亚族的成员最多,拥有29个烟草的GATA家族成员和14个拟南芥的GATA 成员,约占所有GATA 成员的50%,而第Ⅳ家族的成员最少,仅含有6个烟草GATA成员和2 个拟南芥的GATA 成员。此外,4 个分支中均含有烟草和拟南芥的GATA 家族成员,说明这两个物种的GATA家族成员并未因物种差异而进化出单独的分支,推测GATA 家族的基本特征在这两个物种分化之前就已经形成,而且在进化上较为保守。所构建的进化树中共鉴定出38对同源蛋白,其中直系同源蛋白较少,仅有1 对(NtGATA35 与AtGATA7),其余37 对均为旁系同源蛋白(烟草27 对,拟南芥10对)。烟草的旁系同源蛋白对的数量远多于拟南芥的旁系同源蛋白对的数量,推测是由于普通烟草为异源四倍体,从而产生大量的同源基因所致。
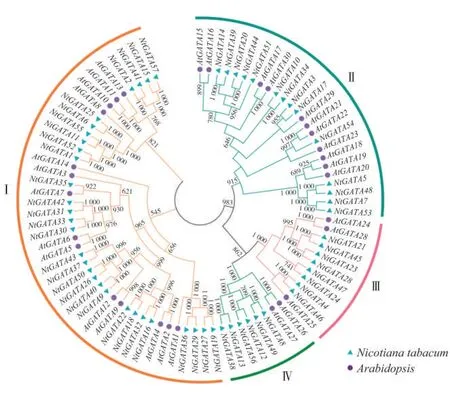
图4 烟草与拟南芥GATA基因家族系统进化树Fig.4 Phylogenetic tree of GATA gene family in Nicotiana tabacum and Arabidopsis thaliana
2.5 NtGATA 基因在不同衰老程度烟叶中的表达分析
根据成熟期(M1~M5)烟叶的转录组数据,从中获取NtbGATA 基因的表达量数据,整合表达量较高的46 个NtGATA 基因(PFKM≥0.5)并绘制热图(图5)。结果发现:第Ⅲ组的9个基因在不同成熟时期中的表达均较高,而第Ⅱ组的10个基因的表达量较低;第Ⅰ组的家族成员表达量居中,其中有部分基因表达表现出明显的时空特异性,例如NtGATA55、NtGATA52、NtGATA11 和 NtGATA1 等在 M2 和 M3 时期有较高的表达量;NtGATA32 基因在烟叶M5 时期的表达量远高于其他时期。值得注意的是,部分基因的表达与成熟度呈现出较高的相关性,例如第Ⅲ组中的NtGATA25和NtGATA35在叶片成熟过程中的基因表达量随着烟叶成熟度的提高逐渐降低;第Ⅰ组中的NtGATA44 在叶片成熟过程中的表达量则呈现 上 升 趋 势 ;NtGATA1、NtGATA11、NtGATA52 和NtGATA55随着烟叶成熟度的提高,表达量先升高后下降,在M2时期表达量最高。这暗示着在烟叶衰老过程中,NtGATA 基因家族成员的功能可能存在多样性。
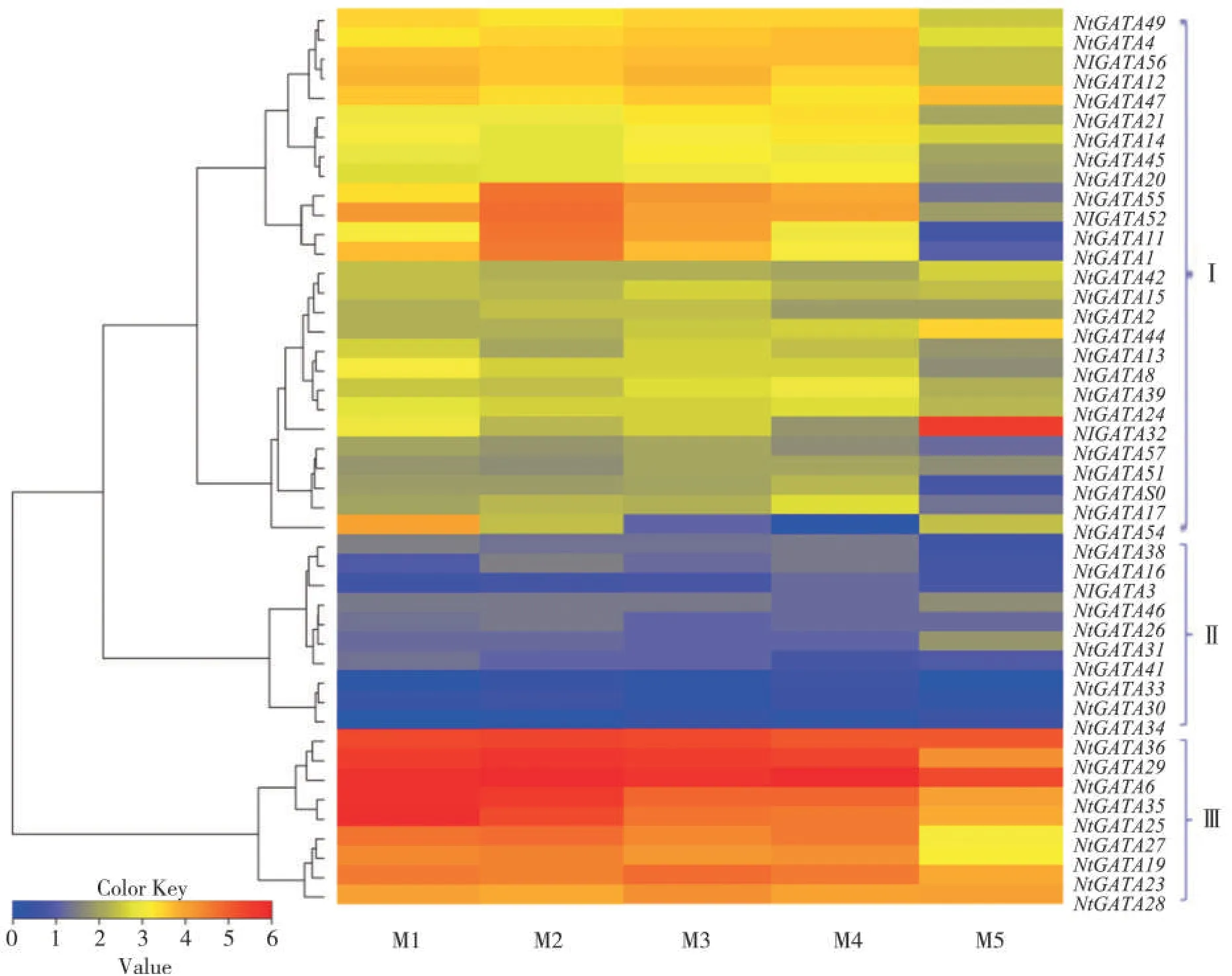
图5 NtGATA基因在不同成熟期烟叶中的表达分析Fig.5 Expression of NtGATA in tobacco leaves at different maturity stages
2.6 NtGATA基因在非生物胁迫下的表达分析
随机挑选了 10 个基因(NtGATA1、NtGATA5、NtGATA6、NtGATA7、NtGATA11、NtGATA25、NtGATA27、NtGATA48、NtGATA54 和 NtGATA55),利用 qRT-PCR分析10个基因在干旱、低温和盐胁迫下的表达量变化。由图 6A 可知,在干旱胁迫下,NtGATA1 表达量轻微上调,其余9 个NtGATA 基因均表现出不同程度的下调;而在低温胁迫条件下(图6B),NtGATA1基因表达量明显上调,暗示该基因可能在抗低温胁迫中发挥重要作用;其余9 个基因(尤其NtGATA6、NtGATA11、NtGATA25、NtGATA54 和 NtGATA55)表现为明显下调;在盐胁迫条件下(图 6C),10 个NtGATA 基因的表达量均明显低于对照,其中NtGATA54 的表达量几乎下降了20 倍。推测大多数烟草GATA基因可能在干旱、低温和盐胁迫中起负向调控作用。
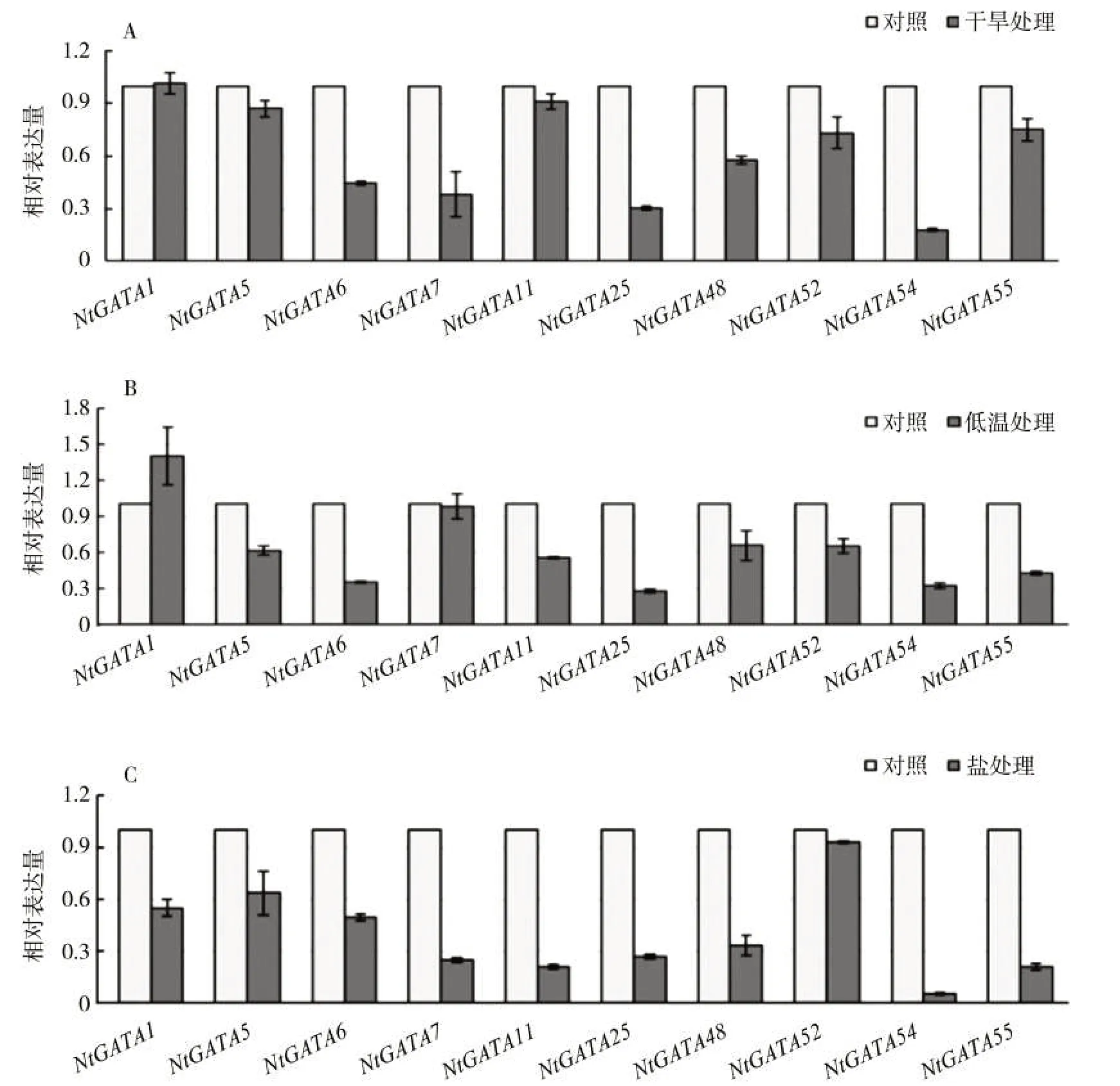
图6 NtGATA基因在低温、盐和干旱胁迫条件下的表达分析Fig.6 Expressions of NtGATA genes under cold, salt and drought stresses
3 讨论
利用生物信息学方法,在烟草全基因组中鉴定出57个GATA基因家族成员,与拟南芥(30个)、水稻(29 个)中的GATA 家族相比,烟草中GATA 家族成员数量明显较多。这可能与烟草是异源四倍体的性质相关,烟草异源四倍体分别来源于林烟草与绒毛状烟草[36]。研究表明,基因在发生倍增现象后,往往会出现两个相同的基因,即同一基因的两个拷贝,随后在自然选择的作用下,由于一个拷贝就能维持基因原有的功能,因此,当另一个基因拷贝上发生的突变时便很容易被积累,从而演变成假基因或进化出具有新功能的同源基因[37],所以,基因组多倍化后,容易进化出大量的新基因。烟草基因组的异源多倍化可能是烟草GATA基因家族成员扩增的重要原因。
植物的衰老过程中,一些转录因子会激活或抑制逆境基因的表达,其实质是细胞的程序性死亡[38]。烟叶成熟过程中叶色的转换是关键环节,包含了叶绿体的降解和一系列物质能量的转变,实际上也是一种衰老的过程。本研究中发现NtGATA 基因在烟叶中广泛表达,而且大多数NtGATA基因在烟叶的不同成熟时期呈现出差异性表达;在水稻中GATA基因家族成员的过量表达可以延缓其衰老[39];这与王志敏等[25]研究提出的GATA 转录因子对植物叶片衰老起调控作用的结论相符。此外,还有部分NtGATA基因随着烟叶成熟程度的提高表达量表现出规律性的变化,例如NtGATA25 和 NtGATA35 基因表达量随着烟叶成熟度的增加逐渐降低,NtGATA44随成熟度提高呈现上升趋势,我们推测这些基因可能在烟叶成熟衰老过程中发挥重要作用,可进一步开发为烟叶成熟鉴定的标记基因。
本研究中还发现,在干旱、低温和盐胁迫条件下,NtGATA 基因家族成员表达量大多呈现下调趋势,其中NtGATA54 在盐胁迫条件下,表达量下降了近20 倍,说明烟草GATA 基因家族成员对逆境响应敏感,这与王娟等[13]得出的GATA 转录因子响应植物在非生物胁迫下的调节机制相同。在玉米的GATA基因家族研究中,玉米GATA基因家族成员在热胁迫过程中响应各异,有些基因呈现上调表达,有些基因则表现出下调表达[40]。这说明GATA基因家族在长期进化过程发生了功能分化,各物种中的不同成员在不同逆境胁迫环境下存在响应程度的差异。
4 结论
通过生物信息学分析的方法在烟草基因组中共鉴定出57个GATA基因,分为4个亚族。NtbZIP成员基因结构多样,各GATA 蛋白成员具有典型的锌指结构域;大多数NtGATA基因在不同成熟时期的烟叶中均有表达,且不同成员的表达模式存在差异;其中大部分NtGATA基因对冷、盐和干旱等非生物胁迫存在不同程度的响应。说明烟草GATA 基因家族成员在烟叶成熟衰老及逆境胁迫响应中可能具有重要的调控作用。
