烤烟上部叶成熟过程中代谢组的差异分析
2023-02-21贾中林郑庆霞戴华鑫张艳玲周会娜张仕祥周汉平梁太波
贾中林,郑庆霞,戴华鑫,张艳玲,周会娜,张仕祥,周汉平,梁太波
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
烤烟上部烟叶占单株总产量的40%左右,与其他部位的烟叶相比,上部烟叶烟气浓度更高、香气量更足,优质的上部烟叶是生产高档卷烟的重要原料[1]。长期以来,我国部分烟区上部烟叶存在因成熟度不足而导致的化学成分不协调等问题,严重影响了上部叶的可用性[2-3]。自2010年以来,随着上六片烟叶一次性成熟采收等技术的应用,烤烟上部叶的可用性有了明显改善,部分上部烟叶也被应用于高端卷烟品牌的配方中。然而目前烤烟上部叶成熟过程中物质代谢的规律尚不完全明确,一定程度上限制了相关技术的应用和推广。
烟叶在成熟过程中经历了一系列复杂的生理代谢变化,代谢产物随时间的动态变化对烟叶内含物质组成有较大影响,进而也影响烟叶的感官品质[4]。代谢组学是一种用于全面表征代谢物全局变化的综合分析技术,在代谢物动态变化研究中发挥着重要作用[5]。植物代谢组学始于20世纪90年代初,Sauter等[6]首次在植物系统中引入代谢谱的概念,通过分析特定生理时期植物样品中的糖类、脂类、氨基酸等所有小分子代谢物的变化,可从全局表征生物体在受到各种内外环境扰动后其代谢产物的变化[7]。目前,应用比较广泛的植物代谢组学测定技术主要有液相色谱-质谱联用(LC-MS)、气相色谱-质谱联用(GC-MS)和毛细管电泳-质谱联用(CE-MS)等[8]。Zhang等[9]和Zhao等[10]运用GC-MS技术对我国不同地区(云南、贵州和河南)烟叶进行代谢组学分析,筛选出20种与产地相关的关键差异代谢物,并探讨了气候环境因素等对烟草生长发育的影响。近年来,代谢组学技术在烟草上的应用多集中在外源胁迫和环境差异条件下的烟叶代谢组学研究领域[11-12],而对烟叶成熟过程中代谢物质的变化研究相对较少。为此,采用GC-MS非靶向代谢组学技术对烤烟云烟87上部烟叶成熟过程中代谢物的动态变化进行分析,并结合烟叶成熟过程中色素、内源激素和化学成分含量的变化,综合研究了上部烟叶成熟过程中物质代谢规律以及不同成熟阶段代谢组的差异,旨在为进一步揭示上部烟叶的成熟机理提供依据。
1 材料与方法
1.1 试验材料
试验于2021年在福建省邵武市沿山烟草试验站进行,供试烤烟品种为云烟87。采用当地常规育苗方法育苗,烟苗于2021年2月20日移栽至大田,5月1日打顶,单株留叶数18片。供试烟田土壤类型为红壤,基本理化性质为pH 5.48、有机质30.19 g/kg、碱解氮90.21 mg/kg、有效磷45.42 mg/kg、速效钾304.02 mg/kg。其他田间管理措施参照当地优质烤烟生产技术规程进行。
1.2 试验设计
在烤烟打顶当天选择长势一致的烟株200株挂牌标记,作为试验取样烟株。取样时间分别为烤烟打顶后第20、30、40、50和60天,叶位为烟株从上往下数第3片,取样时将7片烟叶样品混合作为1个生物学重复。每次取3次重复。剔除主脉和较粗的支脉,将样品充分混合后用锡箔纸包裹立即放于液氮中速冻,干冰包埋运输,-80℃冰箱保存。打顶后不同时期烟叶特征如图1所示。

图1 打顶后不同时期的烟叶特征Fig.1 Characteristics of tobacco leaves on different days after topping
1.3 测定方法
1.3.1质体色素测定
采用李合生[13]的方法,用分光光度计(岛津UV-2550型,日本Shimadzu公司)测定质体色素含量(质量分数)。
1.3.2化学成分测定
将保存于-80℃冰箱的样品取出,低温真空冷冻干燥后,用破壁机粉碎成粉末状后进行化学成分检测,按照标准方法测定烟叶淀粉[14]、水溶性糖[15]、总植物碱[16]、总氮[17]和游离氨基酸含量(质量分数)[18]。
1.3.3内源激素测定
采用LC-MS靶向代谢组学方法对植物生长素(Auxin,IAA)、赤 霉 素(Gibberellin,GA)、乙 烯(Ethylene,ETH)和脱落酸(Abscisic acid,ABA)含量进行定量检测,仪器为AB Sciex QTRAP 6500+质谱仪和AB Sciex ExionLCTMAD液相色谱仪(美国Sciex公司),色谱柱为Waters XSelect HSS T3(2.1×150 mm,2.5 μm,美国Waters公司),流动相A为含0.01%甲酸的水溶液,B相为含0.01%甲酸的乙腈,柱温45℃,进样量10 μL,流速0.3 mL/min。质谱条件:电喷雾电离源(ESI),离子源温度550℃,负模式离子源电压4 500 V,正模式离子源电压4 500 V,气帘气压力241 kPa,雾化气压力413 kPa,辅助气压力413 kPa;采用多反应监测(MRM)模式进行扫描。
1.3.4代谢组测定
参照Liu等[4]的方法,取烟叶粉末20 mg于2 mL离心管中,加入1.5 mL提取试剂[V(乙腈)∶V(异丙醇)∶水=3∶3∶2],在4℃环境下超声提取1 h,高速离心机14 000 r/min离心10 min,取上清液500 μL真空浓缩干燥。干燥后的样品加入衍生化试剂进行衍生化处理,过0.22 μm滤膜至进样瓶中待测。使用Agilent 7890/5975C型气相色谱-质谱联用仪(美国Agilent公司)对样品进行测定,气相色谱条件参考文献[10],色谱柱为DB-5MS柱(0.25 μm,0.25 mm×30 m);载气:氦气;柱流速:1.2 mL/min;进样口温度:300℃;进样体积1 μL;分流比10∶1;检测器电压保持在1.2 kV,选择电子冲击(EI)模式以实现70 eV的电离。
1.4 数据分析
1.4.1代谢组数据预处理
参考郑庆霞等[19]的方法进行数据预处理,对采集的GC-MS数据进行色谱信号基线校正、峰提取、注释和对齐等处理,采用面积归一化法对代谢物进行相对定量。共检出656个特征峰,80%样品中均存在的特征峰有321个,依据代谢物的特征碎片使用NIST质谱数据库对代谢物进行定性分析,并确定代谢物种类。
1.4.2代谢组数据多元分析
采用SIMCA软件(MKS Umetric AB,v14.1)进行多元统计分析。首先应用主成分分析(PCA)对数据进行模式识别,考察各组样品代谢组的分离情况。在PCA分析的基础上,利用正交偏最小二乘-判别分析法(OPLS-DA)对在PCA模型中分离较好的两组样品进行加载分析,根据变量重要性分析(VIP)及t检验筛选并确定组间差异的变量。
2 结果与分析
2.1 烟叶成熟过程中色素含量的变化
从图2可以看出,随着成熟进程推进,烟叶中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均呈逐渐下降趋势,打顶后20~30 d烟叶色素含量变化较小,打顶后40 d色素含量呈现明显下降趋势。与打顶后30 d相比,叶绿素含量下降37.65%,类胡萝卜素含量下降29.35%,整个成熟过程中叶绿含量下降速率大于类胡萝卜素。
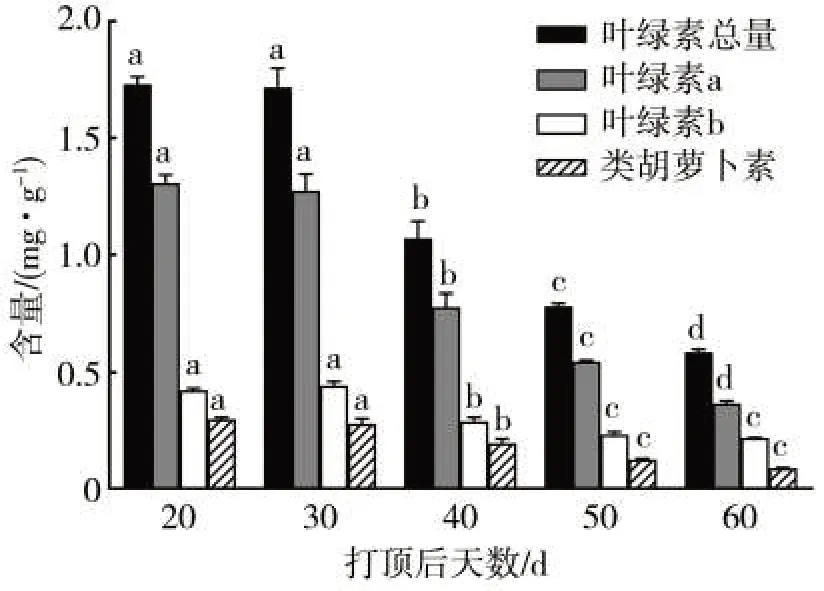
图2 打顶后不同时期烟叶色素含量的变化Fig.2 Pigment contents in tobacco leaves on different days after topping
2.2 烟叶成熟过程中化学成分含量的变化
由表1可知,烟叶成熟过程中总氮含量整体呈下降趋势,在打顶后40~60 d总氮含量显著低于打顶后20~30 d,打顶后40~50 d时总氮含量出现短暂升高,推测可能与外界环境变化等因素有关。烟叶含氮化合物中游离氨基酸含量在打顶后20~50 d逐渐下降,并在打顶后50 d时降至最小值3.98 mg/g,在打顶后60 d升高至6.77 mg/g。在成熟过程中烟叶总植物碱逐渐积累,在成熟后期(打顶后50~60 d)总植物碱含量显著高于其他时期。烟叶碳水化合物中总糖和还原糖含量在成熟前期(打顶后20~30 d)升高,在打顶后40 d呈明显下降趋势,之后总糖和还原糖含量逐渐升高,至打顶后60 d达到最大值,分别为6.88%和4.78%。淀粉含量在打顶后40 d呈现明显上升趋势,至打顶后50 d达到最大值35.08%,在打顶后60 d含量显著下降。可见,打顶后40 d和60 d是烟叶中碳水化合物和含氮化合物含量发生明显变化的两个关键时间节点。
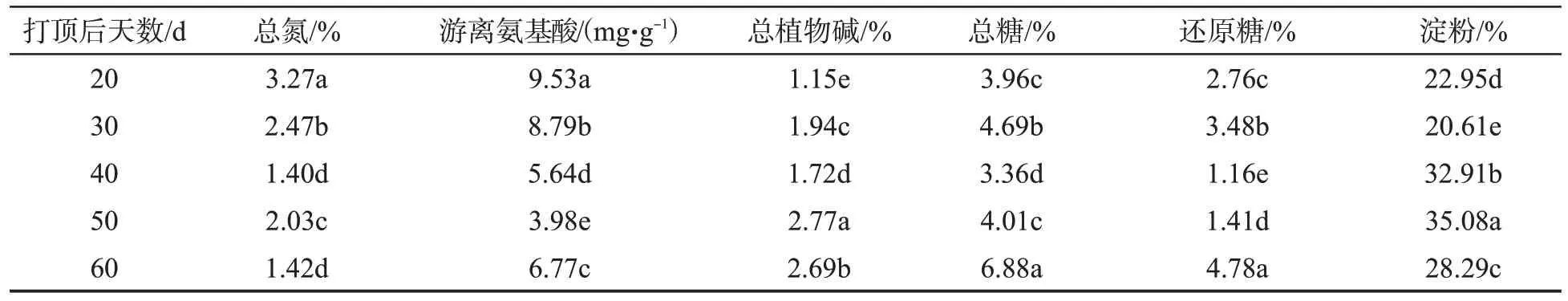
表1 烟叶成熟过程中化学成分含量的变化①Tab.1 Contents of chemical components in tobacco leaves during ripening
2.3 烟叶成熟过程中内源激素含量变化
从图3可看出,随着烟叶成熟进程的推进,IAA和GA含量均呈先升高后降低的变化趋势。IAA含量在打顶后20~30 d显著高于打顶后40~60 d,GA含量在打顶后20~40 d显著高于打顶后50~60 d。ETH含量在打顶后20~40 d逐渐升高,并在打顶后40 d达到最大值,之后开始下降。ABA含量整体呈升高趋势,在打顶后60 d达到最大值19.14 ng/g。总体来看,随着烟叶成熟进程的推进,促进生长类激素IAA和GA含量整体呈下降趋势,促进成熟和衰老类激素ETH和ABA含量整体呈升高趋势,4种激素均在打顶后40 d前后发生显著变化。
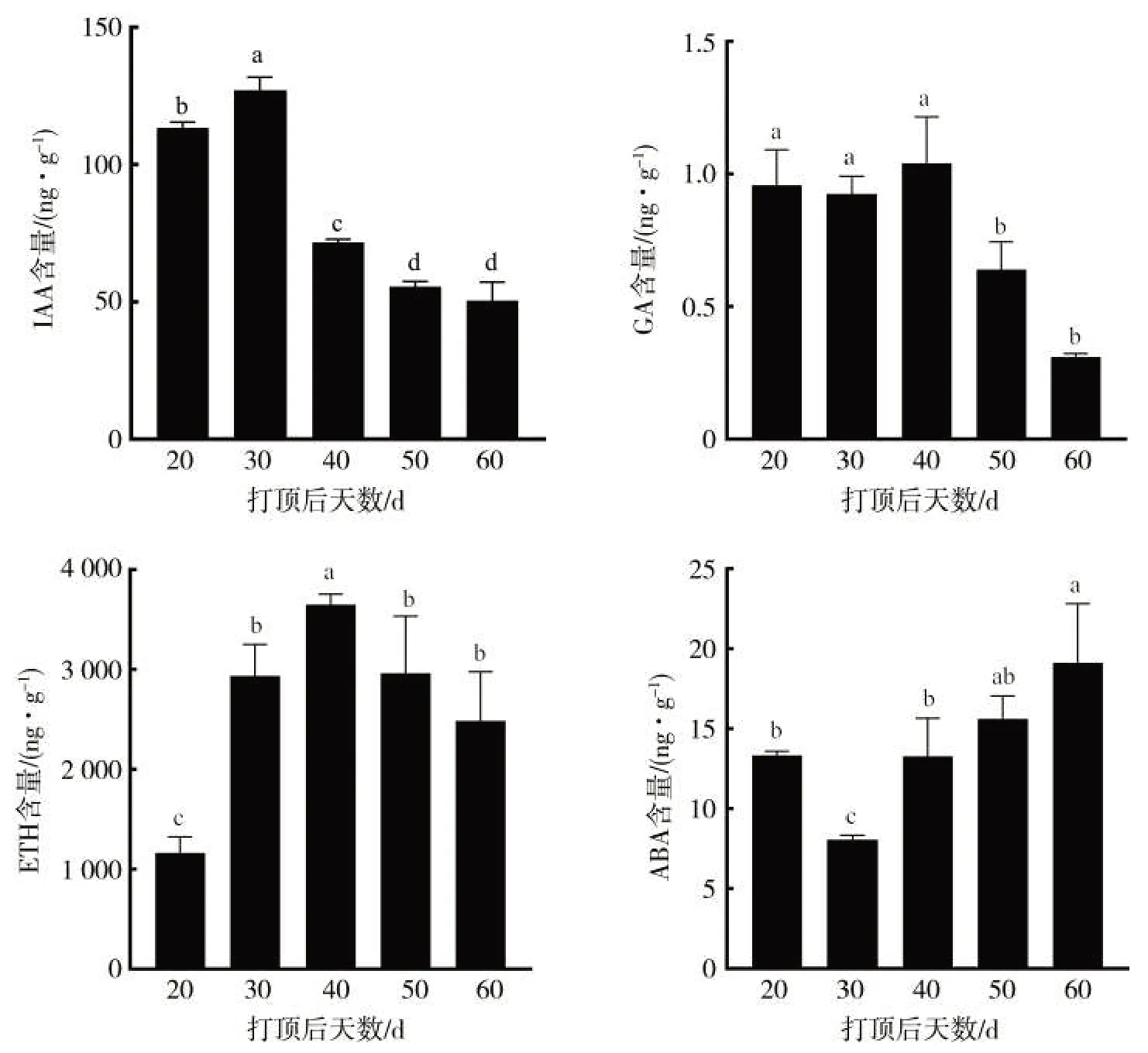
图3 烟叶成熟过程中内源激素含量的变化Fig.3 Changes of endogenous hormone contents in tobacco leaves during ripening
2.4 不同成熟期烟叶差异代谢物分析
代谢物数据的层次聚类分析结果如图4所示。所有样品依据打顶后天数不同被划分为三大簇。簇1包括打顶后20 d和30 d的样品,簇2包括40 d和50 d的样品,成熟后期60 d的样品被单独归为一簇。聚类结果表明,不同成熟期样品具有明显的差异,可将烟叶成熟期划分为3个阶段,分别为打顶后20~30 d、40~50 d和60 d。
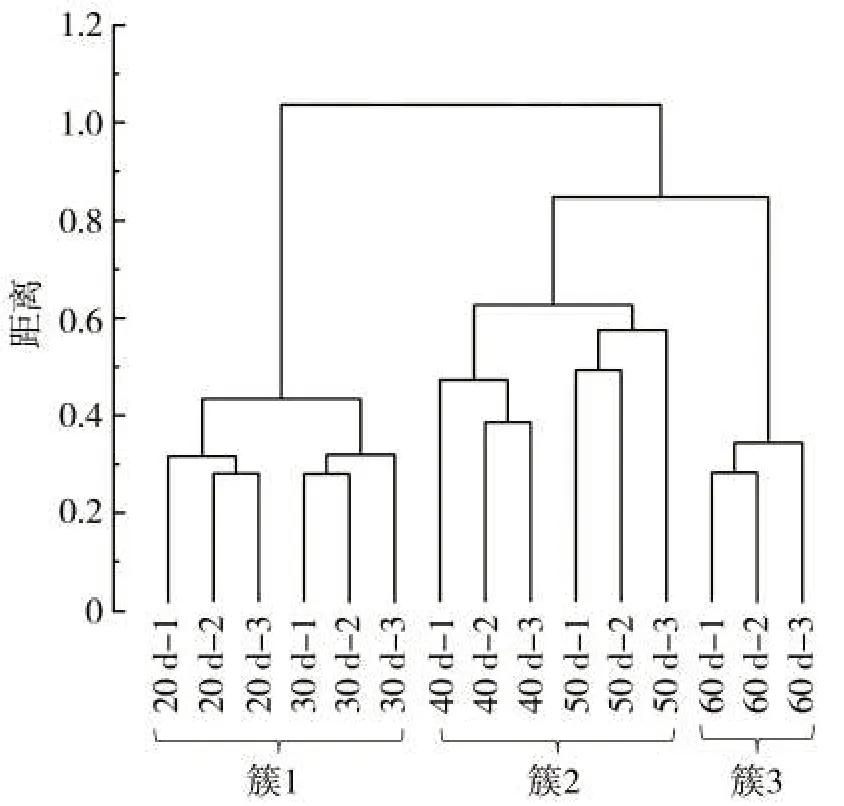
图4 不同成熟期烟叶代谢物HCA图Fig.4 HCA diagram of metabolites in tobacco leaves at different ripening stages
为了更直观地展示不同成熟期样品之间的差异,对所有样品进行了无监督主成分分析。从图5可看出,样品按照取样时间聚类,其中打顶后20 d 和30 d 样品的代谢轮廓相似,40 和50 d 样品的代谢轮廓差异较小,20 d 和 30 d、40 d 和 50 d、60 d 烟叶样品代谢轮廓明显分离,说明3组烟叶样品的代谢轮廓差异较大,与HCA 结果一致。根据HCA 和PCA 结果,挑选代谢轮廓差异较明显的20 d、40 d和60 d烟叶样品进行后续差异代谢物筛选分析。
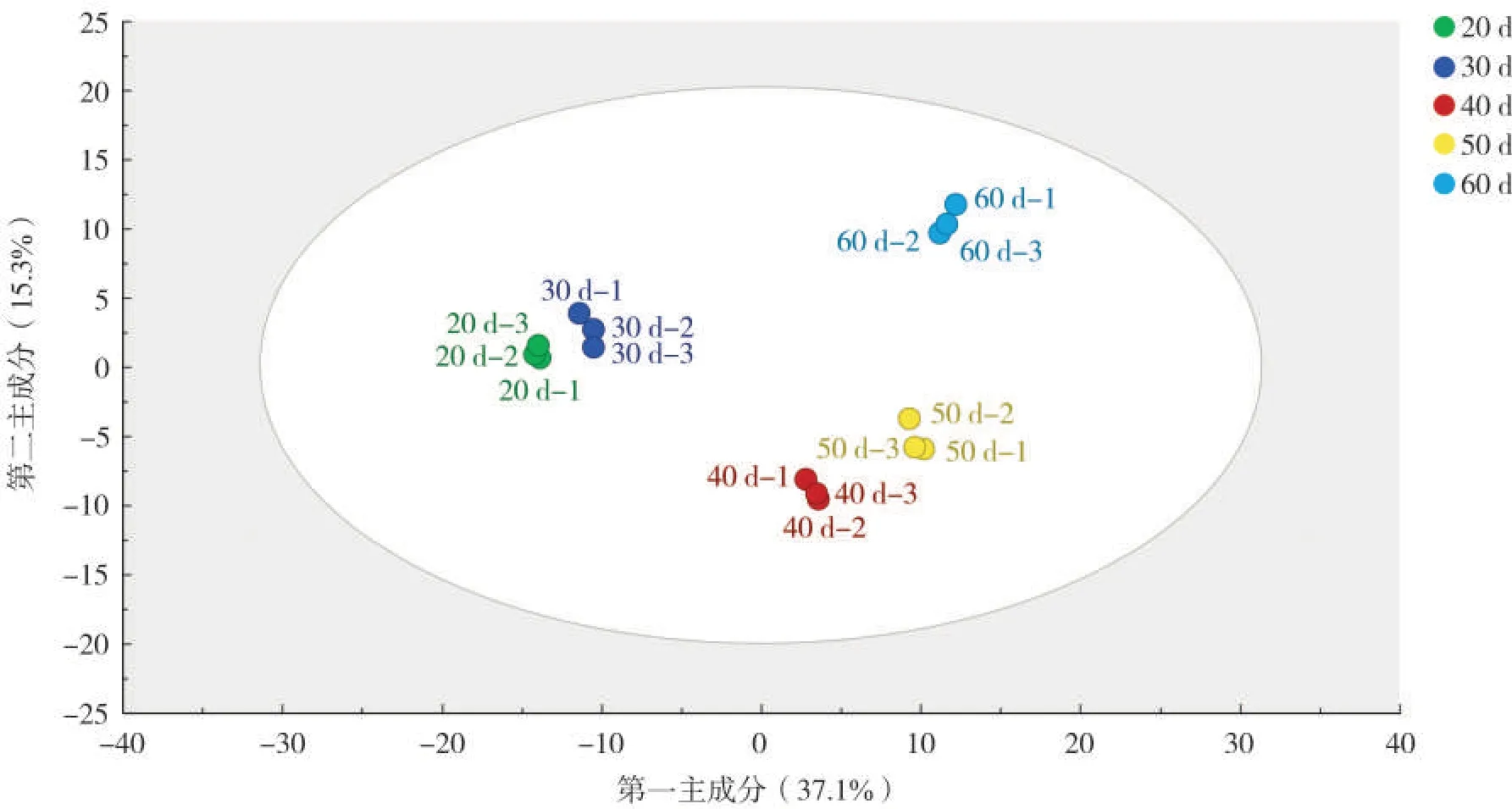
图5 不同成熟期烟叶代谢物PCA图Fig.5 PCA diagram of metabolites in tobacco leaves at different ripening stages
设立20 d vs 40 d、40 d vs 60 d、20 d vs 60 d 3个对比组进行正交偏最小二乘判别分析,以VIP>1和p<0.05为依据筛选差异代谢物,从3个对比组中分别筛选出28、21和30种差异代谢物。去除重复代谢物后,3个对比组中总共筛选出差异代谢物38种,分为4类,分别为氨基酸类(脯氨酸、苏氨酸、半胱氨酸等)、糖类(果糖、半乳糖、葡萄糖等)、有机酸类(柠檬酸、苹果酸、琥珀酸等)和降烟碱、莨菪亭等其他类代谢物。
从聚类热图(图6)可知,烟叶成熟过程中上调的差异代谢物主要是莨菪亭、降烟碱、糖苷类代谢物和苹果酸、柠檬酸等有机酸类代谢物以及半乳糖和蔗糖等糖类代谢产物,下调差异代谢物主要是脯氨酸、苏氨酸、半胱氨酸等氨基酸类代谢物和棕榈酸、琥珀酸、亚麻酸、莽草酸、甘油酸等有机酸类代谢物。此外,还有一些糖类代谢物如葡萄糖、果糖和阿洛糖等在打顶后20~40 d呈下调变化趋势,40~60 d呈上调变化趋势。
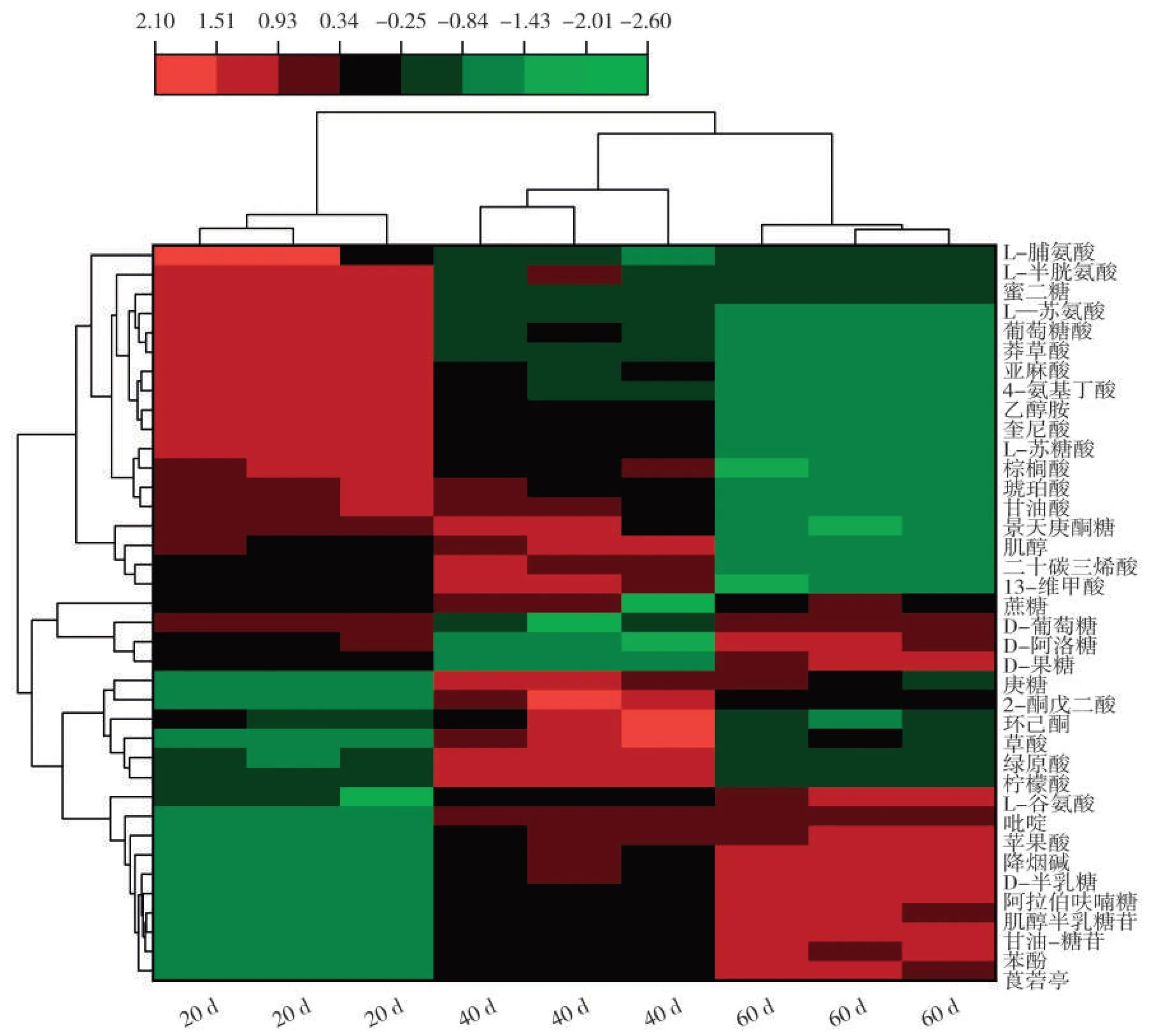
图6 差异代谢物聚类热图Fig.6 Cluster heat map of differential metabolites
Venn图(图7)显示,3个对比组有13个共同差异代谢物,分别为棕榈酸、奎尼酸、4-氨基丁酸、甘油-糖苷、L-苏糖酸、苹果酸、肌醇、D-果糖、甘油酸、D-阿洛糖、13-维甲酸、亚麻酸、莨菪亭。说明这些差异代谢物在上部烟叶成熟过程中均有较积极响应,可能是成熟过程中较关键的代谢物。与40 d vs 60 d组相比,20 d vs 40 d组特有的差异代谢物有糖类物质庚糖、半乳糖、蜜二糖,脂肪酸类物质酮戊二酸、莽草酸和氨基酸类物质脯氨酸、苏氨酸和半胱氨酸等,这些物质在成熟前期有较强的响应。40 d vs 60 d组特有的差异代谢物为L-谷氨酸、景天庚酮糖和二十碳三烯酸,说明这3种物质在烟叶成熟后期有较强的响应。20 d vs 60 d 组中特有的差异代谢物有降烟碱、琥珀酸、蔗糖、肌醇半乳糖苷、阿拉伯呋喃糖、乙醇胺和葡萄糖酸,这些差异代谢物虽然在打顶后20~40 d 和40~60 d 没有明显变化,但在打顶后 20~60 d 呈现显著变化,可见这些物质在成熟过程中的变化具有累加效应。
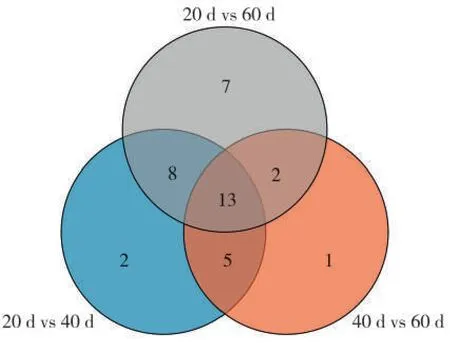
图7 差异代谢物韦恩(Venn)图Fig.7 Venn diagram of differential metabolites
将各组筛选出的差异代谢物映射到KEGG通路上进行注释和通路富集分析(图8),20 d vs 40 d 组中的差异代谢物共富集到32条代谢通路上。其中显著富集的有4条,分别为乙醛酸和二羧酸代谢,丁酸代谢,氨基酰-tRNA 生物合成,柠檬酸循环(TCA 循环)。40 d vs 60 d组差异代谢物共富集到27条代谢通路上,其中显著富集的有4条,分别为乙醛酸和二羧酸代谢,丁酸代谢,不饱和脂肪酸的生物合成,丙氨酸、天冬氨酸和谷氨酸代谢。20 d vs 60 d组中的差异代谢物共富集到34条代谢通路上,其中显著富集的有7条,分别为乳糖代谢,丁酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,氨基酰-tRNA生物合成,乙醛酸和二羧酸代谢,精氨酸和脯氨酸代谢,硫代谢。可见,烟叶成熟过程中差异代谢物主要是富集在糖代谢、氨基酸代谢和脂肪酸代谢等途径中,其中乙醛酸和二羧酸代谢,丁酸代谢,不饱和脂肪酸的生物合成,柠檬酸循环(TCA 循环),氨基酰-tRNA 生物合成,丙氨酸、天冬氨酸和谷氨酸代谢等通路在烟叶成熟过程中起重要调控作用,对烟叶代谢产物的形成具有重要影响。
2.5 代谢物间的相关性分析
对筛选出的关键代谢物进行相关性分析的结果如图9所示。莨菪亭和苹果酸呈极显著正相关,二者与甘油酸、棕榈酸、苏糖酸、奎尼酸、4-氨基丁酸、亚麻酸呈极显著负相关。代谢通路分析表明,莨菪亭参与次生代谢物的生物合成途径,苹果酸参与碳水化合物代谢中的TCA 循环,棕榈酸和亚麻酸参与脂肪酸代谢,甘油酸是磷酸戊糖途径的中间产物,同时可以作为前体物参与糖酵解途径,4-氨基丁酸参与丙氨酸、天冬氨酸和谷氨酸代谢,奎尼酸参与莽草酸代谢通路中的氨基酸合成途径。结合烟叶成熟过程中各代谢物的表达变化,即莨菪亭和苹果酸呈上调表达,甘油酸、棕榈酸、苏糖酸、奎尼酸等呈下调表达,推测在烟叶成熟过程中初生代谢如氨基酸合成代谢、脂肪酸代谢的活动减弱,而糖代谢活动和次生代谢物的生物合成活动逐渐增强。果糖和阿洛糖参与淀粉和蔗糖代谢,二者呈极显著正相关,且均与肌醇呈极显著负相关。肌醇是半乳糖代谢的中间产物,结合物质含量的表达变化可知,在烟叶成熟过程中淀粉和蔗糖的代谢活动增强,肌醇含量减少可能与半乳糖代谢中的物质更多地向合成半乳糖、葡萄糖等物质方向转变有关。
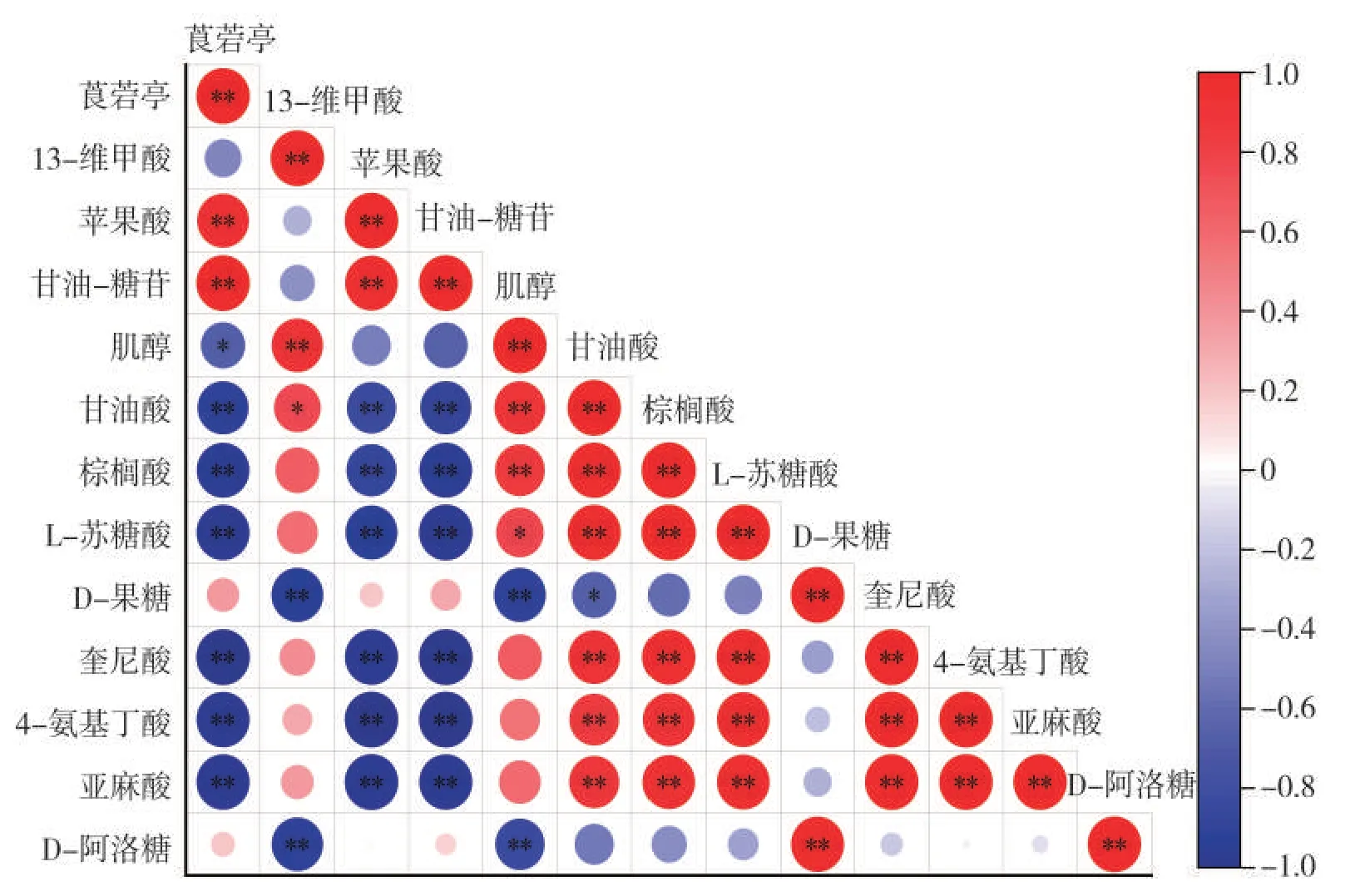
图9 烟叶代谢物相关性分析Fig.9 Correlation analysis of metabolites in tobacco leaves
3 讨论
烟叶生长发育是一个动态的过程,不同生长阶段烟叶生理功能和代谢组存在较大差异。本研究将上部烟叶成熟过程大致划分为3个阶段,分别为打顶后20~30 d、40~50 d 和60 d,随着成熟进程的推进,烟叶叶绿素含量逐渐下降,在打顶后30~40 d变化最明显,说明此阶段烟叶光合生理功能发生了较大变化。打顶后40 d烟叶中促进生长类激素IAA含量呈显著下降的变化趋势,促进成熟衰老类激素ETH 和ABA含量则显著增加。可见,打顶后40 d可能是烟叶生理功能由盛转衰的关键节点。本研究中从上部叶成熟过程中共筛选出38种差异代谢物,这些差异代谢物以糖类(果糖、葡萄糖、半乳糖等)、脂肪酸类(柠檬酸、草酸、棕榈酸、亚麻酸等)和氨基酸类(脯氨酸、半胱氨酸、苏氨酸等)物质为主,此外还有降烟碱、莨菪亭、绿原酸和糖苷类成分等物质。
糖类物质是植物能量代谢中的核心要素,可以调节植物生长和叶片衰老等发育进程。本研究中发现,在烟叶成熟过程中总糖、还原糖和淀粉含量整体上呈增加趋势,但在打顶后40 d,总糖和还原糖均呈现显著下降趋势,差异代谢物聚类热图结果显示,果糖、葡萄糖和阿洛糖等糖类代谢产物在打顶后40 d也呈现下调变化。近年来糖类物质在植物成熟衰老中的作用已被广泛研究,其对衰老的影响在不同物种之间存在差异[20-21]。在拟南芥叶片发育过程中糖的积累逐渐增加,施加外源糖会导致叶片衰老提前[22]。而对向日葵的研究发现,叶片中糖含量随叶片生长发育而降低[23],低水平的糖会促进乙烯的产生或增加对乙烯的敏感性,从而促进衰老[24]。在本研究中,糖代谢类产物在打顶后40 d 出现明显下调,这与Li等[25]发现烟叶衰老初期单糖含量水平显著下降的现象一致,说明叶片衰老可能是受糖含量变化的诱导影响。在打顶后60 d,烟叶总糖、还原糖含量以及代谢物中果糖、葡萄糖、蔗糖等呈现上调表达,而烟叶淀粉含量出现明显下降,成熟后期糖类物质含量的升高可能是由于烟叶中淀粉降解所致。
烟叶在生长发育过程中通过光合作用产生大量的碳水化合物,再通过呼吸作用将这些碳水化合物转化为有机酸和其他中间产物,柠檬酸循环(TCA循环)是其中一条关键的代谢途径,是糖类物质代谢、脂类物质代谢和氨基酸代谢联系的枢纽[26]。本研究中,20 d vs 40 d组中的差异代谢物显著富集在TCA 循环通路上,说明呼吸作用在此阶段发生了显著变化,结合TCA 循环中间产物柠檬酸、酮戊二酸以及苹果酸在烟株打顶后20~40 d呈上调表达,可知在烟株打顶后40 d烟叶呼吸作用显著上调。本研究中还发现,烟叶中亚麻酸、棕榈酸和甘油酸等不饱和脂肪酸含量在成熟过程中均表现为下调变化,不饱和脂肪酸含量的下降对烤烟品质有促进作用[27],进一步印证了前人通过提高成熟度来提升烟叶品质的结论[28]。
氮素重新利用是植物成熟衰老过程中一个重要的生理活动,氨基酸是植物氮代谢的重要产物[29-30]。本研究中各成熟阶段的差异代谢物均富集到氨基酸类代谢通路中,主要有丙氨酸、天冬氨酸和谷氨酸代谢、氨基酰-tRNA生物合成、精氨酸和脯氨酸代谢等通路,表明氨基酸代谢在烟叶成熟衰老过程中具有重要作用。对烟叶化学成分含量的分析发现,在打顶后20~50 d,烟叶游离氨基酸和总氮含量逐渐下降,总植物碱逐渐积累,脯氨酸、半胱氨酸、苏氨酸、4-氨基丁酸等氨基酸类代谢物在成熟过程中呈下调表达,降烟碱则呈上调表达。烟叶游离氨基酸含量下降,一方面与氮素的转移再利用有关,另一方面可能是作为前体物参与了生物碱的合成。降烟碱由烟碱去甲基化形成,与打顶后20 d相比,在打顶后40 d和60 d,烟叶中降烟碱含量明显上调表达,可见烟叶中烟碱向降烟碱的转化主要发生在衰老叶片中[31-32]。在氮素充足的条件下,TCA 循环产物可以转化为天冬氨酸,天冬氨酸是合成生物碱的初始底物,因此在成熟过程中随着柠檬酸和苹果酸含量的上调,生物碱含量也逐渐增加[33]。
4 结论
①根据上部烟叶成熟过程中色素、内源激素、化学成分含量和代谢物的变化规律,将烟叶成熟过程分为3个阶段,即烟株打顶后20~30 d、40~50 d和60 d,其中打顶后40 d可能是上部烟叶成熟过程中生理功能由盛转衰的一个关键节点。②果糖、阿洛糖、4-氨基丁酸、棕榈酸、亚麻酸、甘油酸、苹果酸、奎尼酸、莨菪亭、肌醇等可能是上部烟叶成熟过程中关键的代谢物,主要参与了氨基酸代谢、糖代谢和脂肪酸代谢等生物过程。其中乙醛酸和二羧酸代谢,不饱和脂肪酸的生物合成,TCA 循环,丙氨酸、天冬氨酸和谷氨酸代谢等通路在上部烟叶成熟过程中起重要的调控作用。
